罗氏沼虾谷氨酸脱氢酶基因克隆及其在MrTV感染下的组织表达分析
郑群艳,潘晓艺,沈锦玉,,陈少波,3*,徐洋,许婷
罗氏沼虾谷氨酸脱氢酶基因克隆及其在MrTV感染下的组织表达分析
郑群艳1,潘晓艺2,沈锦玉1,2,陈少波1,3*,徐洋2,许婷21
(1.温州医科大学检验医学院-生命科学学院,浙江温州325035;2.浙江省淡水水产研究所,浙江省鱼类健康与营养重点实验室,浙江湖州313001;3.浙江省海洋水产养殖研究所,浙江温州325005)
本研究利用cDNA末端快速扩增技术克隆获得罗氏沼虾(Macrobrachium rosenbergii)谷氨酸脱氢酶(glutamate dehydrogenase,GDH)基因(MrGDH)的cDNA全长序列,对其进行生物信息学分析,并检测该基因在罗氏沼虾不同组织中的表达差异;同时,利用罗氏沼虾太湖病毒(Macrobrachium rosenbergii Taihu virus,MrTV)感染沼虾,研究感染前后沼虾鳃和肝胰腺MrGDH的转录特征。结果显示,MrGDH基因cDNA序列全长2 257 bp,拥有一个1 662 bp长的开放阅读框,合计编码氨基酸553个,合成的蛋白质分子质量约为61.37 kDa。MrGDH氨基酸序列与中国明对虾(Fenneropenaeus chinensis)、凡纳滨对虾(Litopenaeus vannamei)的同源性较高,达到92%,其二级结构和三维结构与黑腹果蝇(Drosophila melanogaster)以及家蚕(Bombyx mori)高度相似,说明MrGDH氨基酸序列比较保守。实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)结果显示,MrGDH基因在与机体运动和代谢有关的组织中表达量较高,其中在肌肉中表达量最高,而在血淋巴中最低。罗氏沼虾受MrTV病毒感染48 h,肝胰腺和鳃中MrGDH基因的表达在统计学上均极显著高于对照组(p<0.01);感染72 h,鳃中MrGDH基因表达显著高于对照组(p<0.05),肝胰腺中MrGDH基因表达极显著高于对照组(p<0.01):说明MrTV感染胁迫可以刺激罗氏沼虾MrGDH的表达上调。
罗氏沼虾;罗氏沼虾太湖病毒;谷氨酸脱氢酶;基因克隆;组织表达差异
谷氨酸脱氢酶(glutamate dehydrogenase,GDH)是一种结构保守的蛋白酶,主要有四聚体和六聚体2种形式,在动物、植物、微生物等生物体中广泛存在,主要催化α-酮戊二酸和谷氨酸之间的可逆反应,是谷氨酸生物合成中一种依赖辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)或烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)的关键酶;按依赖辅酶的类型可将谷氨酸脱氢酶分为专一利用NAD作为辅酶的GDH、专一利用NADP作为辅酶的GDH,以及能利用NAD和NADP作为辅酶的GDH 3种类型[1-2]。大多数微生物只具备1种GDH[1-4];高等植物的GDH一般以NAD为辅酶,对其体内氮代谢至关重要[2,5];动物能以NAD和NADP为辅酶,其中以NAD作辅酶时催化效率较高[2]。GDH催化的反应是动物获得能量腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的重要途径,也是α-酮酸类在体内转化的主要途径,充当着连接谷氨酸和三羧酸循环的桥梁,在甲壳类动物氨氮代谢过程中发挥着非常重要的作用[6-8]。
目前与甲壳类动物谷氨酸脱氢酶相关的报道较少。2009年,LI等[9]克隆了凡纳滨对虾(Litopenaeus vannamei)的GDH基因。2010年,熊泽泉[10]研究了5种十足目甲壳动物的GDH序列片段,发现GDH氨基酸序列十分保守,而在脊椎动物与无脊椎动物中存在差异。2012年,WANG等[11]克隆出了中华绒螯蟹(Eriocheir sinensis)的GDH基因,发现其对甲壳动物具有重要的渗透调节作用。2014年,李少飞[7]克隆出了中国明对虾(Fenneropenaeus chinensis)的GDH基因并对其进行了功能分析。2015年,刘胜男等[12]的研究表明,在氨氮胁迫下,三疣梭子蟹(Portunus trituberculatus)的鳃组织及肝胰腺中GDH基因表达都有不同程度的上调。2016年,周发林等[8]克隆了斑节对虾(Penaeus monodon)的GDH基因,并研究了该基因在氨氮胁迫下的时空表达情况;同年,LI等[13]发现凡纳滨对虾受白斑综合征病毒(white spot syndrome virus,WSSV)感染后,GDH的表达在一定时间里出现了上调,并通过将谷氨酸催化成α-酮戊二酸为三羧酸(tricarboxylic acid,TCA)循环提供能量来维持WSSV病毒复制。但迄今为止,尚未见有关罗氏沼虾谷氨酸脱氢酶(MrGDH)的报道。
罗氏沼虾(Macrobrachium rosenbergii)也被称为马来西亚大虾,属十足目长臂虾科,生长在淡水或咸淡水中,其个体大,食性广,肉质鲜嫩,营养价值高,是世界上养殖产量较高的虾类品种之一[14-15]。随着1980年后人工养殖的迅速发展,罗氏沼虾的养殖范围遍布我国大部分省市,为养殖业带来了较大的经济效益。随着罗氏沼虾养殖的逐渐扩大化,各种制约罗氏沼虾养殖业发展的问题纷至而来,除了受养殖品种本身的免疫防御及养殖环境的影响外,病原体也是一个非常重要的因素。由细菌或病毒引起的水产疾病普遍发病快、影响范围广、发病率高,是制约水产养殖业发展极为重要的原因之一。2010年被发现和命名的罗氏沼虾太湖病毒(Macrobrachium rosenbergii Taihu virus,MrTV)是双顺反子病毒科中一种新型的RNA病毒,其基因组为单一正链RNA,含2个开放阅读框(open reading frame,ORF),病毒粒子为二十面体对称结构,无囊膜,有单层衣壳;其敏感宿主主要是罗氏沼虾幼体,致死率达到80%~90%,严重时达95%以上[16-17]。本研究利用cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)技术获得了MrGDH基因的cDNA全长,从序列、结构及同源性等方面对其进行生物信息学分析,并利用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)技术测定该基因在罗氏沼虾各组织中的表达情况;此外,用MrTV感染罗氏沼虾,并检测MrGDH基因在不同组织的表达差异,旨在为甲壳类动物MrGDH的研究提供理论依据。
1 材料与方法
1.1 试验材料
MrTV阴性罗氏沼虾活体购自浙江省湖州市南太湖水产种业有限公司。选取7日龄罗氏沼虾幼体用于MrGDH基因克隆;选取体长(14±2)cm、体质量(24±2.1)g的罗氏沼虾成虾50只,用于MrGDH基因在MrTV病毒感染胁迫下的组织表达分析;MrTV阳性样品由浙江省淡水水产研究所鱼病研究室保存。
1.2 MrGDH基因的cDNA克隆
参考cDNA文库测序得到的EST序列,用Primer Premier 5.0设计引物,并由南京金斯瑞生物科技有限公司合成,序列见表1。采用TIANGEN总RNA提取试剂盒提取罗氏沼虾幼体总RNA,并利用变性琼脂糖凝胶电泳检测RNA的完整性,将RNA保存于-80℃备用。
以RNA为模板,GDH-Race-100R与GDH-332R引物用于5'端RACE PCR,GDH-Race-23F与GDH-36F用于3'端RACE PCR,具体步骤参照SMARTerTMRACE cDNA扩增试剂盒(Clontech公司,美国)说明书。其中RACE cDNA扩增试验重复3次,每次送测序的阳性克隆5个。以总RNA为模板,采用TIANGEN FastQuant cDNA第1链合成试剂盒合成cDNA,用于实时荧光定量PCR和已知片段的验证,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.3 MrGDH基因序列分析
在NCBI数据库中对MrGDH基因全长进行BLAST分析与氨基酸序列预测;用MEGA 6.0和ClustalX2对氨基酸序列进行多重比对[8],且将比对过的序列用GeneDoc进行编辑。蛋白理化性质预测在ExPASy中进行[8,10];在EMBL-EBI中分析MrGDH蛋白的结构域[7];蛋白信号肽、磷酸化位点以及位置预测均在生物序列分析中心(Center for Biological Sequence Analysis,CBS)[10,18]中进行。蛋白二级结构预测使用GOR IV[8,18]二级结构预测法;三维结构预测通过SWISS-MODEL[7,10,18]软件进行。除了选取BLAST比对结果中与MrGDH氨基酸序列同源性较高的序列之外,还检索了代表性物种的GDH氨基酸序列,用MEGA 6.0软件对这些氨基酸序列进行比对,构建GDH进化树,分析MrGDH的进化历程以及与其他物种的亲缘关系。
1.4 病毒感染
MrTV阳性样品加液氮研磨后,以1∶10的比例加入磷酸盐缓冲液(phosphate buffered solution,PBS)稀释,8 000 r/min离心30 min后,取上清液,经0.22 μm滤器过滤后采用蔗糖密度梯度离心法[4]进行纯化浓缩,制得MrTV病毒,用PBS稀释至初始体积,并于-80℃保存备用。罗氏沼虾病毒感染设为2组:MrTV病毒感染组(A1)和PBS注射对照组(A2)。采用尾部肌肉注射感染,每尾注射0.1 mL,于0、24、48、72、96 h分别对试验组和对照组进行取样并标记,每个样品混合了同组中同时间点5尾雄虾的同种组织,将样品进行MrTV病毒检测后于-80℃保存。
1.5 MrGDH基因表达分析
用qRT-PCR技术检测MrGDH基因在健康成虾的胃、心、肝胰腺、肠、附肢、鳃、肌肉、眼柄和血淋巴中的表达情况,以及受MrTV感染前后在肝胰腺和鳃中的表达情况。
所用引物为GDH Q99F/R,内参引物为MR-βactin-F/R(表1)。反应步骤如下:95℃变性15 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,40个循环;95 ℃ 1 min,60 ℃ 30 s,95 ℃ 30 s。用熔解曲线评判qRT-PCR中产物扩增的特异情况,采用2-ΔΔCT法计算各组织中MrGDH基因的相对表达量。利用SPSS 17.0软件中的单因素方差分析比较差异显著性。
2 结果与分析
2.1 MrGDH基因全长克隆
联合RT-PCR和RACE技术克隆获得MrGDH基因的cDNA全长并提交GenBank(序列号为KY349118),PCR产物和RACE产物的电泳结果见图1。序列分析表明,MrGDH基因cDNA全长为2 257 bp,开放阅读框长1 662 bp,编码553个氨基酸,5'端非编码区(untranslated regions,UTR)长53 bp,3'端非编码区长542 bp,含多聚体[poly(A)]尾。

图1 MrGDH基因的PCR和RACE电泳结果Fig.1 PCR and RACE electrophoresis results of MrGDH gene
2.2 MrGDH序列及理化性质分析

图2 MrGDH基因cDNA全序列及氨基酸序列Fig.2 cDNA and amino acid sequences of MrGDH gene
由图2可知,MrGDH基因共编码553个氨基酸。MrGDH蛋白分子质量约为61.37 kDa,理论等电点为6.51,含带正电荷残基(Asp+Glu)64个,带负电荷残基(Arg+Lys)69个,不稳定指数为28.22,属于稳定蛋白;脂溶指数为80.80,亲水性平均值为-0.307,推测该蛋白为亲水蛋白;SignalP 4.1 Server预测结果显示无信号肽,平均信号肽分值(D)为0.133,属于非分泌型蛋白;NetPhos 3.1 Server预测结果表明,MrGDH含蛋白磷酸化作用位点共53个,其中丝氨酸磷酸化作用位点26个,苏氨酸磷酸化作用位点16个,酪氨酸磷酸化作用位点11个。Interpro分析出第259个至549个氨基酸为MrGDH 4种氨基酸(Glu/Phe/Leu/Val)的脱氢酶结构域(图2中用灰色框标出),第171个至184个氨基酸为MrGDH 3种氨基酸(Leu/Phe/Val)的脱氢酶活性位点(VPFGGAKAGLKINP)(图3中第1和2个用红框标示序列),第393个至403个氨基酸为无脊椎动物的保守序列AKIIAE AANGP(图3中第3个用红框标示序列),第428个至433个氨基酸为真核生物GDH的高度保守序列(GGVTVS)(图3中第4和5个用红框标示序列)。
2.3 氨基酸序列同源性分析及系统进化树的构建
经BLAST比对发现,MrGDH氨基酸序列与其他甲壳类动物GDH氨基酸序列高度同源,同源性为74%~92%,其中与中国明对虾和凡纳滨对虾同源性最高,均达92%,其次是斑节对虾,同源性为91%,与拟穴青蟹(Scylla paramamosain)的同源性为90%。此外,与黑腹果蝇和家蚕的同源性分别达到79%和82%,与昆虫类如柑橘凤蝶(Papilio xuthus)、玉带凤蝶(Papilio polytes)以及金凤蝶(Papilio machaon)的线粒体GDH同源性为79%~80%。
所选GDH氨基酸序列经MEGA 6.0多重比对后,用邻接法构建系统进化树。结果(图4)显示,中华绒螯蟹与天津厚蟹(Helice tientsinensis)聚为类A,三疣梭子蟹和拟穴青蟹聚成类B,凡纳滨对虾和斑节对虾先聚在一起,然后与中国明对虾聚成类C,类A、类B、类C聚成类D,罗氏沼虾和类D聚成类E,家蚕和黑腹果蝇聚成类F,类E和类F聚成类G,类G与大型蚤(Daphnia magna)聚成类H。之后的亲缘关系从近到远依次是:脊椎动物、线虫、原生动物、古细菌、植物、原核细菌及真核细菌。这说明甲壳类与家蚕及果蝇的亲缘关系近,与植物、微生物等亲缘关系远。

图3 MrGDH氨基酸序列与其他物种GDH的氨基酸多重序列比对Fig.3 Multiple alignment of the predicted amino acid sequence of MrGDH with other eukaryote GDH amino acid sequences
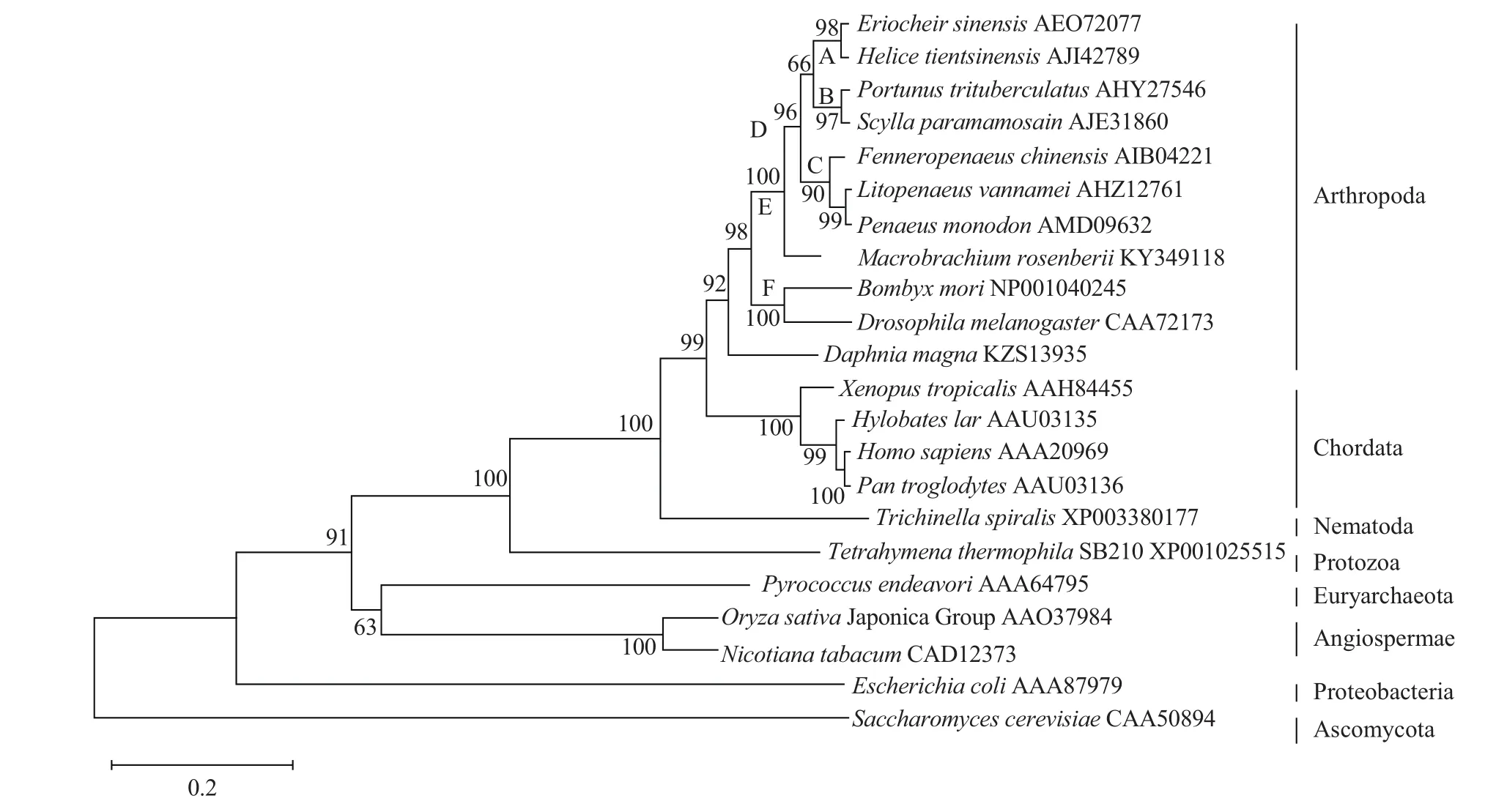
图4 用邻接法构建的GDH氨基酸序列系统进化树Fig.4 Phylogenetic tree of GDH amino acid sequences from different species based on neighbor-joining methool
2.4 MrGDH蛋白结构预测

图5 MrGDH蛋白、果蝇GDH蛋白以及家蚕GDH蛋白三维结构模型Fig.5 Three-dimensional ribbon structure of MrGDH protein,Drosophila melanogaster GDH and Bombyx mori GDH
α螺旋、延伸链和无规卷曲构成MrGDH蛋白的二级结构,占整条链的比例分别为34.00%、20.07%和45.93%。家蚕及黑腹果蝇的GDH蛋白二级结构也由α螺旋、延伸链和无规卷曲构成,其中家蚕GDH二级结构中α螺旋、延伸链和无规卷曲所占比例分别为32.49%、16.43%、51.08%,黑腹果蝇各部分所占比例分别为32.56%、19.75%、47.69%。3种生物GDH蛋白的三维结构都非常接近(图5)。
2.5 MrGDH基因在罗氏沼虾各组织中的表达分析
以MR-β-actin为内参基因,利用qRT-PCR对罗氏沼虾肌肉、附肢、肝胰腺、心、鳃、肠、眼柄、胃、血淋巴9个组织中MrGDH基因的表达量进行检测。结果(图6)显示:MrGDH基因在所检组织中均有表达;除肝胰腺与心、心与鳃、肠与眼柄、胃与血淋巴间差异无统计学意义(P>0.05)外,其他组织间的表达差异均有统计学意义(p<0.05);MrGDH基因在肌肉中的相对表达量最高,其后依次是附肢、肝胰腺、心、鳃、肠、眼柄、胃、血淋巴。

图6 MrGDH基因在罗氏沼虾各组织中的相对表达情况Fig.6 Relative expression level of MrGDH gene in different tissues of Macrobrachium rosenbergii
2.6 感染MrTV病毒前后MrGDH基因在肝胰腺和鳃中的表达分析
MrTV病毒检测[16-17]结果显示,除0 h样品外,MrTV病毒感染组(A1组)都为阳性,注射PBS的对照组(A2组)都为阴性。感染MrTV前后MrGDH基因在鳃和肝胰腺中的表达变化情况如图7、图8所示。在罗氏沼虾鳃组织中,感染0 h和24 h的A1组和A2组间在统计学上无显著差异(P>0.05);感染48 h时,A1组高于A2组,差异达极显著水平(p<0.01);感染72 h时,A1组高于A2组,差异显著(p<0.05);感染96 h时,A1组和A2组间无显著差异(P>0.05)。肝胰腺中MrGDH基因的表达变化情况与鳃类似:感染0 h和24 h的A1组和A2组间在统计学上无显著差异(P>0.05);感染48 h和72 h时,A1组高于A2组,差异达极显著水平(p<0.01);感染96 h时,A1组和A2组间无显著差异(P>0.05)。

图7 感染MrTV前后鳃中MrGDH基因在不同时间的相对表达量Fig.7 Relative expression level of MrGDH gene in gill before and after MrTV injection at different time
以上结果说明,在MrTV感染期间,罗氏沼虾鳃和肝胰腺中MrGDH基因的表达水平在24~48 h间有明显的上调,在72~96 h期间开始恢复,均呈现出一个明显的趋势,即低水平表达与对照组持平,再上调显著超过对照组,之后恢复到对照组水平。
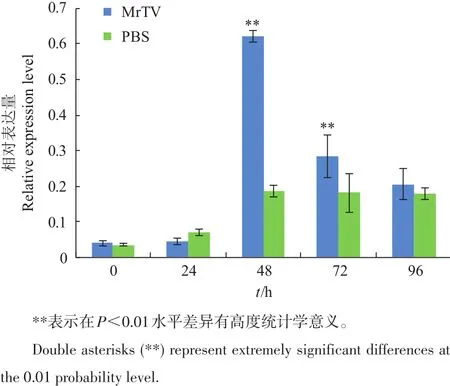
图8 感染MrTV前后肝胰腺中MrGDH基因在不同时间的相对表达量Fig.8 Relative expression level of MrGDH gene in hepatopancreas before and after MrTV injection at different time
3 讨论
某些生物的谷氨酸脱氢酶(GDH)氨基末端含线粒体定向运输的导肽序列[10,19-20],经TargetP 1.1 Server预测,MrGDH蛋白极有可能为线粒体转运蛋白(分值为0.615)。蛋白质磷酸化是蛋白质修饰中最普遍且最重要的一种方式,在细胞信号传递中占有重要地位,分析蛋白质磷酸化位点对全面了解蛋白质不可或缺。本研究发现MrGDH基因序列中存在一段保守序列AKIIAEAANGP,与脊椎动物中AKIIAEGANGP略有差异,与熊泽泉对十足目GDH的研究[10]一致。酿酒酵母不具备真核生物GDH的高度保守序列GGVTVS,说明该段序列在真核生物中并不都存在。
GDH是一种结构保守的蛋白酶,在生物体中广泛存在,对生物体氮代谢具有重要的作用[1,7-8],其催化的反应是获得能量ATP的重要途径。甘氨酸、谷氨酸、脯氨酸、丙氨酸和牛磺酸等游离氨基酸对大多数甲壳动物渗透压起着主要的调节作用,不同甲壳动物中起渗透调节的氨基酸种类虽不一定相同,但这些氨基酸的代谢均受GDH调控[10]。
肌肉支配着全身的运动,是虾体的主要构成部分,其对能量的需求远高于其他组织;附肢与虾在水中的运动有关,对能量的需求也很高;肝胰腺是甲壳类动物的主要消化腺,在脂类的储存、营养消化吸收和分泌中有重要的作用,也是甲壳动物氨氮解毒代谢及氨氮排泄场所[6,21];心脏的作用是推动血液流动,向各器官、各组织及各细胞提供养分和氧,并带走代谢终产物,维持细胞和机体正常的代谢和功能,激素和体内其他体液因子也需要通过血液的推动被运送至相应的靶细胞,来实现体液调节及维持内环境平衡;鳃是虾与外界进行气体交换的场所;肠与消化、吸收、排泄相关,等等。各组织功能的差异可能是导致MrGDH基因差异性表达的主要原因。研究表明,罗氏沼虾、斑节对虾、凡纳滨对虾及中国明对虾中GDH组织表达均在肌肉中最高[6-8]。
PBS注射组中MrGDH基因的表达在24~96 h时基本处于递增状态,可能是由室内养殖过程中水体环境发生改变造成的。生物体新陈代谢排泄出来的一些物质增加了水体中的渗透压,在渗透胁迫下,机体需要调动体内大量的营养物质,一方面提供足够的能量用于渗透调节,另一方面尽量争取更快的生长速度[21];当虾体内与外界环境渗透压达到平衡后,MrGDH的表达不再大幅度增加。在MrTV病毒感染组中,罗氏沼虾肝胰腺和鳃中MrGDH基因的表达均发生了一定的变化,其中感染48 h和72 h时的MrTV病毒感染组均高于PBS注射组,其他时间则2组差异不大。脂类储存、营养消化吸收和分泌、氨氮解毒及排泄都主要在肝胰腺中进行;鳃是虾最主要的离子转运器官,也是与外界进行气体交换的场所,起着连接体内和体外的桥梁作用,病毒也可通过鳃进入虾体内。LI等[13]研究发现,凡纳滨对虾受白斑综合征病毒(white spot syndrome virus,WSSV)感染后,GDH的表达在一定时间内出现了上调,它通过将谷氨酸催化成α-酮戊二酸,为TCA循环提供能量来维持WSSV复制。感染MrTV后的罗氏沼虾,很可能受病毒的影响,使体内谷氨酸转化成α-酮戊二酸的反应增加,为TCA循环补充能量维持病毒复制,从而使MrGDH基因表达上调。本研究对MrGDH的生物学特性进行了初步分析,为甲壳类MrGDH的研究奠定了基础。
[1] 丁诗华,杨志荣,唐亚雄,等.类产碱假单胞菌谷氨酸脱氢酶酶学性质的研究.四川大学学报(自然科学版),1999,36(2):354-358.DING S H,YANG Z R,TANG Y X,et al.Properties of glutamate dehydrogenase from Pseudomonas pseudoalcaligenes.Journal of Sichuan University(Natural Science Edition),1999,36(2):354-358.(in Chinese with English abstract)
[2] 邓玉.猪脑谷氨酸脱氢酶的分离纯化及性质和功能基团研究.重庆:西南大学,2012:1-8.DENG Y.Isolation,purification,some properties and modification of groups of glutamate dehydrogenase from porcine brain.Chongqing:Southwest University,2012:1-8.(in Chinese with English abstract)
[3] 王燕,宋香,杨平平,等.谷氨酸生产菌S9114中的谷氨酸脱氢酶的研究.生物工程学报,2003,19(6):725-729.WANG Y,SONG X,YANG P P,et al.Purification and characterization of glutamate dehydrogenase from Corynebacterium glutamicum S9114.Chinese Journal of Biotechnology,2003,19(6):725-729.(in Chinese with English abstract)
[4] 朱冰,俞冠翘,朱家璧,等.地衣芽孢杆菌谷氨酸脱氢酶基因的克隆和特性.中国科学(C辑),2000,30(4):401-411.ZHU B,YU G Q,ZHU J B,et al.Cloning and characterization of glutamate dehydrogenase gene from Bacilluslicheniformis.Science in China(Series C),2000,30(4):401-411.(in Chinese)
[5] ROBINSON S A,SLADE A P,FOX G G,et al.The role of glutamate dehydrogenase in plant nitrogen metabolism.Plant Physiology,1991,95(2):509-516.
[6] 穆小生.大菱鲆4种生物标志物基因的克隆、组织特异性表达研究及重组蛋白制备.山东,青岛:中国海洋大学,2013:16-18.MU X S.Gene cloning,specific expression in different tissues and recombinantprotein preparation of4 biomarkers in Scophthalmus maximus.Qingdao,Shandong:Ocean University of China,2013:16-18.(in Chinese with English abstract)
[7] 李少飞.中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用.辽宁,大连:大连海洋大学,2014:8-50.LI S F.cDNA cloning and expression analysis of the enzyme genes related to ammonia metabolism in Fenneropenaeus chinensis and study on effect of these enzymes in the detoxification of ammonia following ambient ammonia stresses.Dalian,Liaoning:Dalian Ocean University,2014:8-50.(in Chinese with English abstract)
[8] 周发林,陈劲松,黄建华,等.斑节对虾谷氨酸脱氢酶基因的克隆及氨氮胁迫对其时空表达的影响.中国水产科学,2016,23(6):1236-1246.ZHOU F L,CHEN J S,HUANG J H,et al.Molecular cloning and expression analysis of glutamate dehydrogenase(GDH)in Penaeus monodon under ammonia nitrogen stress.Journal of Fishery Sciences of China,2016,23(6):1236-1246.(in Chinese with English abstract)
[9] LI E,ARENA L,CHEN L Q,et al.Characterization and tissuespecific expression of the two glutamate dehydrogenase cDNAs in pacific white shrimp, Litopenaeus vannamei.Journal of Crustacean Biology,2009,29(3):379-386.
[10]熊泽泉.十足目(Crustacea:Decapoda)经济甲壳动物谷氨酸脱氢酶基因的研究.上海:华东师范大学,2010:6-45.XIONG Z Q.Study on glutamate dehydrogenase gene of the economic macro-decapods(Crustacean)species.Shanghai:East China Normal University,2010:6-45.(in Chinese with English abstract)
[11]WANG Y,LI E,YU N,et al.Characterization and expression of glutamate dehydrogenase in response to acute salinity stress in the Chinese mitten crab,Eriocheir sinensis.PLoS One,2012,7(5):e37316.
[12]刘胜男,潘鲁青,刘茂琪.氨氮胁迫对三疣梭子蟹解毒代谢关键基因表达的影响.海洋湖沼通报,2015(2):97-104.LIU S N,PAN L Q,LIU M Q.Effects of ammonia exposure on key detoxification metabolism associated genes expression in swimming crab Portunus trituberculatus.Transactions of Oceanology and Limnology,2015(2):97-104.(in Chinese with English abstract)
[13]LI C Y,WANG Y J,HUANG S W,et al.Replication of the shrimp virus WSSV depends on glutamate-driven anaplerosis.PLoS One,2016,11(1):e0146902.
[14]刘恩生,万全.罗氏沼虾的养殖现状与发展前景(综述).安徽农业大学学报,1997,24(2):189-192.LIU E S,WAN Q.Current situation and development prospect of Macrobrachium rosenbergii.JournalofAnhuiAgricultural University,1997,24(2):189-192.(in Chinese)
[15]朱其建,戴习林,邹卫丽,等.罗氏沼虾抗病选育群体的抗病性能及其遗传多样性分析.水产学报,2013,37(10):1468-1478.ZHU Q J,DAI X L,ZOU W L,et al.Disease resistance and genetic diversity analysis in selected populations of Macrobrachium rosenbergii.Journal of Fisheries of China,2013,37(10):1468-1478.(in Chinese with English abstract)
[16]潘晓艺,刘杜鹃,沈锦玉,等.罗氏沼虾野田村病毒和双顺反子病毒双重RT-PCR检测方法与序列分析.上海海洋大学学报,2012,21(6):996-1002.PAN X Y,LIU D J,SHEN J Y,et al.Duplex RT-PCR detection and sequences comparison of Macrobrachium rosenbergii nodavirus and Macrobrachium rosenbergii dicistrovirus.Journal of Shanghai Ocean University,2012,21(6):996-1002.(in Chinese with English abstract)
[17]PAN X Y,CAO Z,YUAN JF,etal.Isolationand characterization of a novel dicistrovirus associated with moralities ofthegreatfreshwaterprawn,Macrobrachium rosenbergii.International Journal of Molecular Sciences,2016,17(2):204.
[18] 陈湘瑜,徐日荣,林栩松,等.花生谷氨酸脱氢酶基因AhGDH1的克隆与生物信息学分析.福建农业学报,2016,31(3):217-224.CHEN X Y,XU R R,LIN X S,et al.Cloning and bioinformatic analysis of AhGDH1 gene from Arachis hypogaea L.Fujian Journal of Agricultural Sciences,2016,31(3):217-224.(in Chinese with English abstract)
[19]李二超.盐度对凡纳滨对虾的生理影响及其营养调节.上海:华东师范大学,2008:5-157.LI E C.Physiological effects of ambient salinity on Litopenaeus vannamei and nutrient modulation.Shanghai:East China Normal University,2008:5-157.(in Chinese with English abstract)
[20]SAKAKIBARA H,FUJII K,SUGIYAMA T.Isolation and characterization of a cDNA that encodes maize glutamate dehydrogenase.Plant and Cell Physiology,1995,36(5):789-797.
[21]LIMAMI A M,ROUILLON C,GLEVAREC G,et al.Genetic and physiological analysis of germination efficiency in maize in relation to nitrogen metabolism reveals the importance of cytosolic glutamine synthetase.Plant Physiology,2002,130(4):1860-1870.
Molecular cloning and tissue expression analysis of glutamate dehydrogenase gene from Macrobrachium rosenbergii under MrTV infection stress.Journal of Zhejiang University(Agric.&Life Sci.),2017,43(5):639-648
ZHENG Qunyan1,PAN Xiaoyi2,SHEN Jinyu1,2,CHEN Shaobo1,3*,XU Yang2,XU Ting2
(1.School of Laboratory Medicine and Life Sciences,Wenzhou Medical University,Wenzhou 325035,Zhejiang,China;2.Key Laboratory of Fish Health and Nutrition of Zhejiang Province,Zhejiang Institute of Freshwater Fisheries,Huzhou 313001,Zhejiang,China;3.Zhejiang Mariculture Research Institute,Wenzhou 325005,Zhejiang,China)
Macrobrachium rosenbergii;Macrobrachium rosenbergii Taihu virus;glutamate dehydrogenase;gene cloning;difference in tissue expression
Q 17
A
10.3785/j.issn.1008-9209.2017.04.171
Summary Macrobrachium rosenbergii is one of the major aquaculture shrimp,whose larva is the susceptible host of Macrobrachium rosenbergii Taihu virus(MrTV)which is one kind of novel RNA virus,and a member of Dicistroviridae owning a single positive strand with two open reading frames.Glutamate dehydrogenase(GDH)is a key enzyme in glutamate biosynthesis and plays an important role in organism’s metabolism.But there are still few reports aboutglutamate dehydrogenase in crustaceans,and almost no reports of M.rosenbergii glutamate dehydrogenase(MrGDH),as well as the interaction between MrGDH and MrTV.
国家自然科学基金(2013skj002);浙江省自然科学基金(LY12C19007);浙江省科技厅院所扶持专项(2017F30033);浙江省湖州市公益性技术应用研究项目(2015GZ09)。
*通信作者(Correspondingauthor):陈少波(http://orcid.org/0000-0001-6693-2335),Tel:+86-572-86699360,E-mail:chenshaobo@hotmail.com第一作者(First author):郑群艳(http://orcid.org/0000-0002-3687-192X),E-mail:zhengqunyan2010@126.com
2017-04-17;接受日期(Accepted):2017-09-06
In this study,the complete sequence of MrGDH gene was cloned by rapid amplification of cDNA ends(RACE)technology,and the expression of MrGDH gene in different tissues was studied by quantitative real-time polymerase chain reaction(qRTPCR).Then the transcriptional characteristics of MrGDH gene in the gill and hepatopancreas of M.rosenbergii were analyzed under MrTV infection(positive group),and the negative group was injected with phosphate buffered solution.
The results showed that the complete cDNA sequence of MrGDH gene was 2 257 bp in length with a 1 662 bp open reading frame(ORF)encoding 553 amino acids,which shared 92%homology with Fenneropenaeus chinensis GDH and Litopenaeus vannamei GDH.The protein molecular mass of MrGDH was approximately 61.37 kDa.Its secondary and threedimensional structures were extremely similar to Drosophila melanogaster GDH and Bombyx mori GDH.The MrGDH gene was expressed in all detected tissues of M.rosenbergii.After 48 h and 72 h of injection,the expression of MrGDH gene in hepatopancreas and gill of positive group was significantly higher than the negative group.
In summary,the MrGDH gene is conservative,and its expression distribution indicates that it’s highly expressed in the organisms extremely related to movement and metabolism,with the highest in muscle and the lowest in haemolymph.This difference may be caused by the diversity in energy demand of each organization.Overall,it is indicated that MrTV infection could stimulate the expression of MrGDH gene.

