蛋白激酶C激活对口腔鳞癌细胞上皮-间质转化的影响
陈钟 郑晓丹 徐勇
蛋白激酶C激活对口腔鳞癌细胞上皮-间质转化的影响
陈钟 郑晓丹 徐勇
目的利用舌癌细胞系HN12探索激活蛋白激酶C(protein kinase C,PKC)对口腔鳞癌细胞上皮-间质转化(epithe-lial-mesenchymal transition,EMT)的影响。方法采用质粒pCMV6-AC-GFP-P120ctn转染HN12细胞,使HN12过表达P120-连环蛋白(P120-catenin,P120ctn),再加入蛋白激酶C(protein kinase C,PKC)激活剂佛波酯(phorbol 12-myristate 13-acetate,PMA),采用实时荧光定量PCR、Western blot检测PMA处理前后 PKC、P120ctn、E-cad的mRNA和蛋白表达,通过Transwell细胞侵袭及细胞迁移试验等方法检测细胞的迁移和侵袭能力。结果当PKC被PMA活化时,细胞形态发生改变,细胞中P120ctn的表达显著降低,E-钙黏蛋白(E-cadherin,E-cad)也随之降低,间质标记蛋白N-钙黏蛋白(N-cadherin,N-cad)和波形蛋白(Vimentin,Vim)的mRNA和蛋白表达水平显著升高,肿瘤细胞的迁移和侵袭能力显著提高(P<0.05)。结论PKC可能通过磷酸化调节P120ctn的表达,参与细胞黏附的调控,促进EMT,在口腔鳞癌细胞的迁移和侵袭过程中发挥作用。
P120-连环蛋白(P120ctn); 蛋白激酶C(PKC); 上皮-间质转化(EMT); 口腔鳞状细胞癌(OSCC)
上皮-间质转化(epithelial-mesenchymal transition,EMT)是胚胎发育过程中一种基本的生理现象,以上皮细胞极性的丧失及运动能力增强为重要特征。近年来研究发现,EMT与肿瘤的侵袭、转移密切相关,在肿瘤的发展、迁移和耐药性形成等过程中发挥了重要的生物作用[1-2],在口腔鳞状细胞癌(oral squamous-cell cancer,OSCC)细胞系中多种EMT标记物的表达发生了上调或下调[3]。Wells等[4]发现EMT最重要的标志性变化是E-钙黏蛋白(E-cadherin,E-cad)的减少或丢失。我们之前的免疫组化试验发现E-cad在OSCC中的表达与蛋白激酶C(protein kinase C,PKC)和P120-连环蛋白(P120-cantenin,Pl20ctn)具有相关性,且与淋巴结的转移等恶性表型有关[5]。本试验以舌癌转移淋巴结细胞系HN12(具有极强的侵袭和转移的能力[6]为研究对象,探索PKC、Pl20ctn和E-cad在口腔鳞癌细胞系EMT中的作用机制。
1 材料与方法
1.1 主要试剂和仪器
鼠抗人P120ctn单克隆抗、鼠抗人E-cad单克隆抗体(Abcam,美国),兔抗人PKC单克隆抗体,pCMV6-AC-GFP- P120ctn(Origene,加拿大),X-tremeGene HP DNA 转染试剂(Roche,瑞士),佛波酯(Sigma,美国)。DMEM培养基、胎牛血清 (FBS)(Gibco,美国),TRIzol (Invitrogen,加拿大),逆转录试剂盒(TaKaRa,日本)。CO2培养箱(Thermal,美国)、倒置相差显微镜(Olympus,日本)、荧光PCR仪(Corbett美国)、Transwell小室(Corning,美国)。
1.2 基因转染及筛选
HN12细胞接种至6 孔板,每孔3×105个细胞/2 ml DMEM培养基常规培养24 h。用无血清培养基稀释质粒pCMV6-AC-GFP-P120ctn至1 μg/100 μl,取100 μl加入X-tremeGene HP DNA 转染试剂3 μl,15~25 ℃孵育30 min,将混合液加入每孔中。37 ℃孵育24 h后,改用含80 μg/ml G418的培养基培养。反复筛选,收集具有G418抗性的细胞克隆增殖,命名为HN12/P120ctn。
1.3 PMA激活试验
HN12/P120ctn细胞加入PKC激活剂佛波酯(phorbol 12-myristate 13-acetate,PMA),命名为HN12/P120ctn+PMA,使终浓度分别为0、25、50、100 ng/ml。观察0、24、48、72 h细胞迁移和侵袭的情况,筛选出最佳分析时间点和浓度点,并根据所选出的最佳分析时间点和浓度点,进行PKC、P120ctn、E-cad、N-cad、Vim mRNA和蛋白水平的检测。
1.4 实时荧光定量PCR
引物合成委托上海生工生物工程公司完成。用Trizol试剂提取各组细胞总RNA,进行cDNA合成,反应体系为Oligo dT primer(50 μmol/L)1 μl,dNTP Mixture 1 μl,Total RNA 5 μg,加入RNase free dH2O 补至10 μl,在PCR仪上进行以下条件的反转录:42 ℃,15 min,70 ℃ 30~60 min。-20 ℃保存。使用荧光PCR仪对HN4、HN12和HOK细胞中的P120ctn基因和E-cad基因进行定量检测,反应条件94 ℃、5 min,93 ℃预变性35 s,56 ℃变性30 s,71 ℃退火60 s,72 ℃延伸7 min,30 个循环。
1.5 Western blot
常规收获细胞,提取蛋白上样,加入琼脂糖凝胶电泳10 mA 2 h,根据Marker分子量截取目的条带,100 V衡压1 h,湿转到PVDF膜上, 5%的脱脂奶粉封闭后加入一抗4 ℃摇动孵育过夜,充分荡洗,HRP标记二抗室温孵育,洗膜曝光。
1.6 Transwell细胞侵袭及细胞迁移试验
迁移实验采用培养基和Transwell小室放在37 ℃温育。消化对数生长期的HN12/P120ctn和HN12/P120ctn+PMA细胞,加入无血清培养基计数,调整细胞浓度至2×105/ml,上室加入200 μl细胞悬液,下室加入800 μl含20%血清的培养,48 h后固定、染色,统计结果。侵袭实验在Transwell上室底部中央铺Matrigel胶,后续步骤同迁移实验。
1.7 统计学分析
2 结 果
2.1 HN12/P120ctn、HN12/P120ctn+PMA细胞形态的观察
HN12/P120ctn以多角形细胞为主,细胞汇聚成片,HN12/P120ctn+PMA细胞的表现则为:出现较多梭形细胞,细胞大小不等,形态不规则,分布较为分散(图 1)。
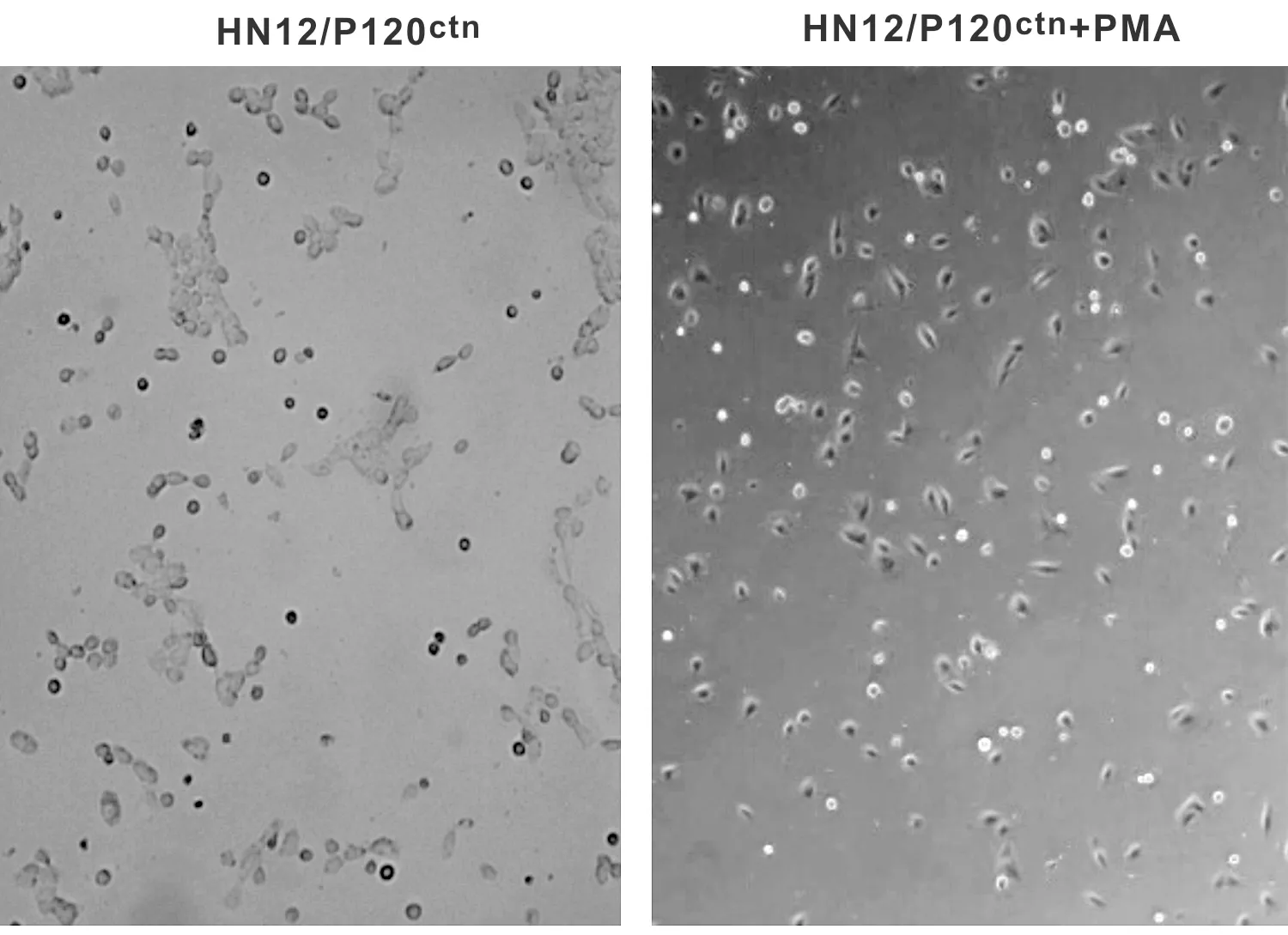
图 1 HN12/P120ctn和HN12/P120ctn+PMA处理后细胞形态
Fig 1 The cell morphology treated by HN12/P120ctnand HN12/P120ctn+PMA cell
2.2 PKC激活剂PMA对HN12/P120ctn细胞EMT的影响
用PMA处理HN12/P120ctn细胞后发现,随着PKC表达的显著降低,P120ctn、E-cad的mRNA(图 2)和蛋白(图 3)表达水平明显升高,而其他EMT标记物N-cad和Vim mRNA(图 4)和蛋白(图 5)表达水平显著降低。
2.3 PKC激活剂PMA对HN12/P120ctn细胞迁移和侵袭能力的影响
HN12/P120ctn细胞加入PMA,检测细胞迁移(图 6)和侵袭(图 7)能力的变化,Transwell细胞迁移实验结果显示,HN12/P120ctn+PMA细胞穿过Transwell小室微孔的数量显著高于HN12/P120ctn;侵袭实验结果显示,HN12/P120ctn+PMA显著低高于HN12/P120ctn,因此,PMA对HN12/P120ctn细胞迁移和侵袭能力存在促进作用(P<0.05)。
3 讨 论
PKC存在于细胞质内,是由钙活化的磷脂依赖性丝-苏氨酸蛋白激酶,被激活后与胞膜内壁结合作用于底物,能够使底物蛋白分子内丝氨酸/苏氨酸发生磷酸化。PKC与肿瘤的发生发展有着密切的关系,在OSCC细胞系TSCCA中,PKC的抑制剂staurosporine活化了细胞凋亡蛋白酶caspase-3[7],降低了细胞迁移和侵袭的能力;此外,Lai等[8]也发现活化PKC途径可以导致OSCC细胞迁移和侵袭,这些都提示PKC可能参与了OSCC的发生和发展。肝癌细胞系HepG2所处的酸性环境能够诱导黏附连接中P120ctn的表达下调和丝氨酸去磷酸化,PKCα and δ基因敲除能够阻断这一过程的发生,提示PKC被激活后可能可以作用于在细胞膜表达的P120ctn,使P120ctn丝氨酸/苏氨酸发生去磷酸化[9,10]。
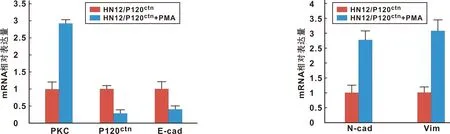
图 2 PKC mRNA、P120ctnmRNA和E-cad mRNA在HN12/P120ctn和HN12/P120ctn+PMA处理后的细胞中的表达 图 4 N-cad mRNA和Vim mRNA在HN12/P120ctn和HN12/P120ctn+PMA处理后的细胞中的表达
Fig 2 Expression of PKC mRNA, P120ctnmRNA and E-cad mRNA in HN12/P120ctnand HN12/P120ctn+PMA treated cells Fig 4 Expression of N-cad mRNA and Vim mRNA in HN12/P120ctnand HN12/P120ctn+PMA treated cells

图 3 PKC、P120ctn和E-cad蛋白在HN12/P120ctn和HN12/P120ctn+PMA处理后的细胞中的表达 图 5 N-cad和Vim蛋白在HN12/P120ctn和HN12/P120ctn+PMA处理后的细胞中的表达
Fig 3 Expression of PKC, P120ctnand E-cad protein in HN12/P120ctnand HN12/P120ctn+PMA treated cells Fig 5 Expression of N-cad and Vim protein in HN12/P120ctnand HN12/P120ctn+PMA treated cells
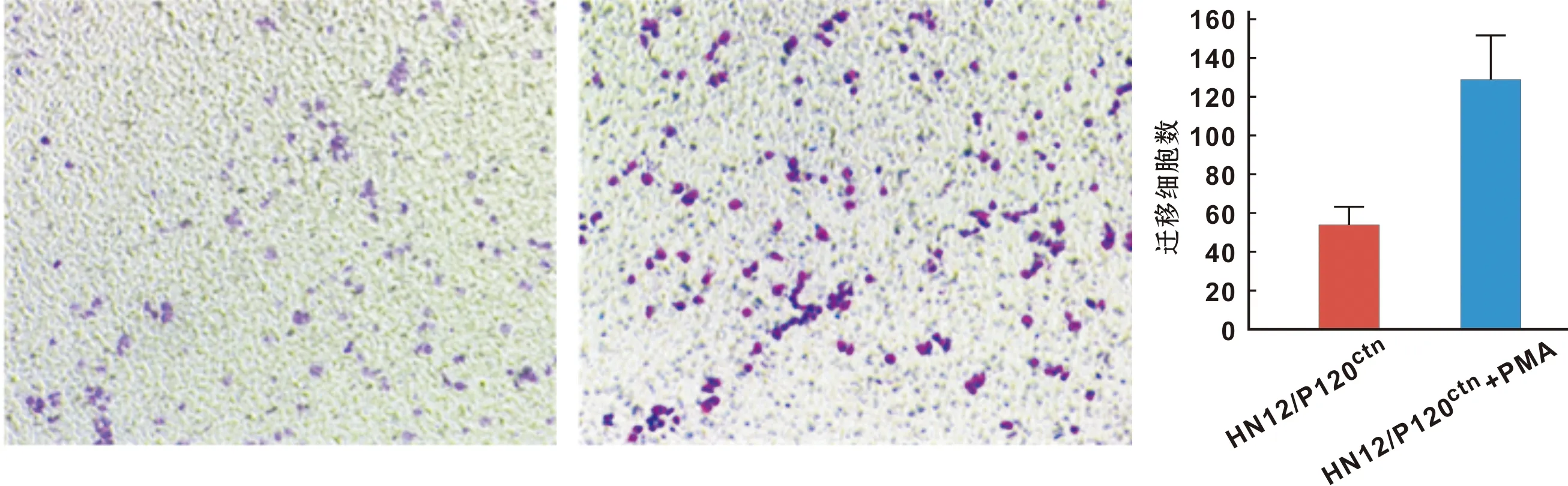
图 6 PMA对HN12/P120ctn细胞迁移能力的影响
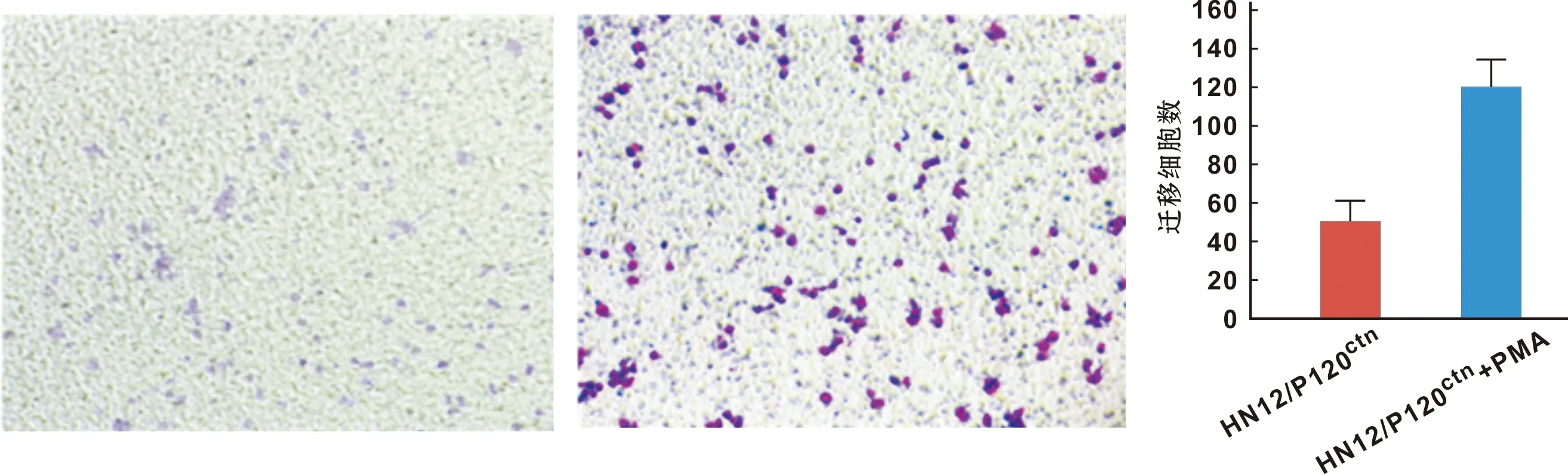
图 7 PMA对HN12/P120ctn细胞侵袭能力的影响
P120ctn是连环蛋白家族的新成员,连环蛋白(catenin,ctn)是一个有相似结构的胞内糖蛋白家族,能与E-cad构成连环蛋白-钙黏蛋白复合体(cadherin catenin complex,CCC),使E-cad被固定在细胞骨架上,与相邻细胞形成稳定的连接。P120ctn是唯一与E-cad胞内肽段近膜端(juxtamembrane domain,JMD)结合的连环蛋白,参与聚集和稳定细胞膜上的钙黏蛋白,调控钙黏蛋白介导的细胞间的黏附稳定[11,12]。P120ctn与E-cad结合的关键部位便是磷酸化位点,P120ctn的磷酸化可能调节了钙黏蛋白的结合和稳定性[13,14],从而影响CCC的稳定性,在磷酸化降低时,细胞黏附能力会发生异常。越来越多的证据表明,P120ctn的丝/苏氨酸磷酸化可能直接调节着P120ctn的功能[9],并且PKC可能是一个重要的信号媒介。我们的试验发现当PKC被PMA激活时,P120ctn高表达的HN12/P120ctn细胞中P120ctn和E-cad的表达随之降低,提示在OSCC中PKC可能通过磷酸化调节了P120ctn和E-cad的表达。
EMT是肿瘤细胞侵袭转移的主要因素之一,是指在某些特定的生理病理情况下,上皮细胞转化为间质细胞的现象,主要表现为上皮细胞极性丧失,细胞黏附减弱,转化为成纤维细胞样形态,运动能力增强。钙黏蛋白属于黏蛋白家族,与膜转移相关,是EMT的重要的分子生物学基础,是钙依赖的具有关键调节作用的细胞黏附分子[15]。E-cad是近年来研究较多的一种细胞黏附分子,它可能通过增强同型质细胞间的黏附,使肿瘤细胞之间连接紧密,难以脱离原发部位进入周围的组织或血管,从而抑制转移的发生。当E-cad缺失时单个肿瘤细胞通过以下2 种方式之一运动迁移:间充质样细胞运动(通过蛋白水解酶使肿瘤组织边缘的单个细胞发生定向运动)或阿米巴运动。后者通常表现为细胞极性缺失的非定向运动。与之相反,另一种钙黏蛋白,N-钙黏蛋白(N-cadherin,N-cad)在发生EMT时表达上调[16],N-cad可能促进了肿瘤细胞的运动和迁移,在三维环境中N-cad是调控细胞集体迁移的重要因素。波形蛋白(Vimentin,Vim)是EMT的另一个特征性标记蛋白,正常表达于各种细胞类型中,在各种肿瘤细胞系中高表达,包括前列腺癌、乳腺癌、子宫内膜癌、中枢神经系统肿瘤、恶性黑色素瘤和胃肠道肿瘤[17]。肿瘤蛋白质组学的研究发现与其他特异性蛋白改变包括能量代谢和信号传导以及细胞骨架构成和细胞运动一致,在肝内胆管癌[18]、SK-Hep-1肝癌细胞系[19]和胰腺导管癌[20]中Vim的表达水平与EMT的启动和高度恶性表型相关。Chaw[21]等对100 例口腔组织(包括正常组织、轻度异常增生、中重度异常增生和口腔鳞癌)的免疫组化研究表明,EMT标记物的表达趋势提示它们参与了口腔癌的发展,它们的异常表达是恶性转化的潜在标记物。
本试验发现当PKC被激活时,细胞形态发生改变,出现梭形细胞;除E-cad表达发生改变之外,其他EMT标记物N-cad和Vim的表达水平显著升高,同时HN12/P120ctn细胞的迁移和侵袭能力显著提高,提示在口腔鳞癌细胞系中PKC可能通过P120ctn参与了EMT,在肿瘤的迁移和侵袭中发挥了作用。这与前人在乳腺癌中的研究结果一致,在三阴乳腺癌中,P120ctn在S268丝氨酸位点的磷酸化调节依赖于PKC ε,在一个PKCε激活的模型中,抑制PKCε将阻断其向间质细胞表型的转化[22],从而抑制EMT的发生。
综上,我们推测,PKC可能通过磷酸化调节了P120ctn的表达,参与了细胞黏附的调控,促进了EMT,在口腔鳞癌细胞的迁移和侵袭过程中发挥了作用。
[1] Jiang F, Ma S, Xue Y, et al. LDH-A promotes malignant progression via activation of epithelial-to-mesenchymal transition and conferring stemness in muscle-invasive bladder cancer[J]. Biochem Bioph Res Commun, 2016, 469(4): 985-992.
[2] Lv JH, Wang F, Shen MH, et al. SATB1 expression is correlated with β-catenin associated epithelial-mesenchymal transition in colorectal cancer[J]. Cancer Biol Ther, 2016, 17(3): 254-261.
[3] Krisanaprakornkit S, Iamaroon A. Epithelial-mesenchymal transition in oral squamous cell carcinoma[J]. ISRN Oncol, 2012, 2012: 681469.
[4] Wells A, Yates C, Shepard CR. E-cadherin as an indicator of mesenchymal to epithelial reverting transitions during the metastatic seeding of disseminated carcinomas [J]. Clin Exp Metastasis, 2008, 25(6): 621-628.
[5] 陈钟, 董孟华, 邓锋. PKC、P120ctn和E-cad在口腔鳞癌中的表达[J]. 实用口腔医学杂志, 2014, 30(1): 61-65.
[6] Yeudall WA, Miyazaki H, Ensley JF, et al. Uncoupling of epidermal growth factor dependent proliferation and invasion in a model of squamous carcinoma progression [J]. Oral Oncol, 2005, 41(7): 698-708.
[7] Zhang YX, Yu SB, Ou-Yang JP, et al. Effect of protein kinase C alpha, caspase-3, and survivin on apoptosis of oral cancer cells induced by staurosporine 1 [J]. Acta Pharmacol Sin, 2005, 26(11): 1365-1372.
[8] Lai KC, Liu CJ, Chang KW, et al. Depleting IFIT2 mediates atypical PKC signaling to enhance the migration and metastatic activity of oral squamous cell carcinoma cells [J]. Oncogene, 2013, 32(32): 3686-3697.
[9] Xia X, Mariner DJ, Reynolds AB. Adhesion-associated and PKC-modulated changes in serine/threonine phosphorylation of p120-catenin [J]. Biochemistry, 2003, 42(30): 9195-9204.
[10]Chen Y, Kung HN, Chen CH, et al. Acidic extracellular pH induces p120-catenin-mediated disruption of adherens junctions via the Src kinase-PKCδ pathway [J]. FEBS Lett, 2011, 585(4): 705-710.
[11]Kourtidis A, Ngok SP, Anastasiadis PZ. p120 catenin: An essential regulator of cadherin stability, adhesion-induced signaling, and cancer progression [J]. Prog Mol Biol Transl Sci, 2013, 116: 409-432.
[12]Nanes BA, Chiasson-MacKenzie C, Lowery AM, et al. p120-catenin binding masks an endocytic signal conserved in classical cadherins [J]. J Cell Biol, 2012, 199(2): 365-380.
[13]Vandenbroucke St Amant, Emily E. The role of PKC alpha-mediated p120-catenin phosphorylation on endothelial permeability [D]. Chicago: University of Illinois at Chicago, 2013: 18-22.
[14]Espejo R, Jeng Y, Paulucci-Holthauzen A, et al. PTP-PEST targets a novel tyrosine site in p120 catenin to control epithelial cell motility and Rho GTPase activity [J]. J. Cell Sci, 2014,127(Pt3): 497-508.
[15]Xiong H, Hong J, Du W, et al. Roles of STAT3 and ZEB1 proteins in E-cadherin down-regulation and human colorectal cancer epithelial-mesenchymal transition [J]. J Biol Chem, 2012,287(8): 5819-5832.
[16]Shih W, Yamada S. N-cadherin as a key regulator of collective cell migration in a 3D environment [J]. Cell Adh Migr, 2012,6(6): 513-517.
[17]Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy [J]. Cell Mol Life Sci, 2011, 68(18): 3033-3046.
[18]Dos Santos A, Court M, Thiers V, et al. Identification of cellular targets in human intrahepatic cholangiocarcinoma using laser microdissection and accurate mass and time tag proteomics [J]. Mol Cell Proteomics, 2010, 9(9):1991-2004.
[19]Pan TL, Wang PW, Huang CC, et al. Network analysis and proteomic identification of vimentin as a key regulator associated with invasion and metastasis in human hepatocellular carcinoma cells [J]. J Proteomics, 2012, 75(15):4676-4692.
[20]Roy LD, Sahraei M, Subramani DB, et al. MUC1 enhances invasiveness of pancreatic cancer cells by inducing epithelial to mesenchymal transition [J]. Oncogene, 2011, 30(12):1449-1459.
[21]Chaw SY, Majeed AA, Dalley AJ, et al. Epithelial to mesenchymal transition(EMT) biomarkers-E-cadherin, beta-catenin, APC and Vimentin-in oral squamous cell carcinogenesis and transformation [J]. Oral Oncol, 2012, 48(10): 997-1006.
[22]Dann SG, Golas J, Miranda M, et al. p120 catenin is a key effector of a Ras-PKCε oncogenic signaling axis [J]. Oncogene, 2014, 33(11): 1385-1394.
TheeffectsofPKCactivationontheepithelial-mesenchymaltransitionoforalsquamouscellcancercells
CHENZhong,ZHENGXiaodan,XUYong.
361008,DepartmentofStomatology,XiamenMedicalCollege,China
Objective: To study the effects of activating protein kinase C(PKC)on oral squamous-cell cancer(OSCC) cell epithelial-mesenchymal transition(EMT).MethodsPlasmid pCMV6-AC-GFP-P120ctnwas used to transfect HN12 cells to make P120-catenin(120ctn) overexpress and thereafter PKC activator PMA(phorbol 12-myristate 13-acetate) was added to the culture. Real-time fluorescent quantitative PCR and Western blot were adopted to test mRNA and protein expression of PKC, P120ctn, E-cadherin(E-cad), N-cadherin(N-cad) and Vimentin(Vim). Transwell cell invasion and cell migration assay were used to test the invasion and migration capacity before and after the activation.ResultsWhen PKC was activated by PMA, the expression of P120ctnand E-cad were decreased, the cell morphology changed, mRNA and protein expression of mesenchymal marker protein N-cad and Vim increased significantly. Meanwhile, the migration and invasion capacity of the tumor cells increased significantly(P<0.05).ConclusionIn OSCC cells, PKC may be involved in promoting EMT and the metastasis and invasion by adjusting P120ctn/E-cad expression and cell adhesion.
P120-catenin(P120ctn);ProteinkinaseC(PKC);Epithelial-mesenchymaltransition(EMT);Oralsquamous-cellcancer(OSCC)
厦门医学院自然科学基金(编号: Z2013-02)
361008, 厦门医学院口腔医学系
陈钟 E-mail: 310571932@qq.com
R739.8
A
10.3969/j.issn.1001-3733.2017.05.022
(收稿: 2017-05-25 修回: 2017-07-18)

