1730例女性健康体检者高危型和低危型人乳头瘤病毒感染情况调查
连 菲,陈静娜,杨永泉,张莹莹,李 晓,张 蓉,刘娟子,黄秀娜,张志英,孙朝晖,李林海
1730例女性健康体检者高危型和低危型人乳头瘤病毒感染情况调查
连 菲,陈静娜,杨永泉,张莹莹,李 晓,张 蓉,刘娟子,黄秀娜,张志英,孙朝晖,李林海
目的通过对1730例健康体检女性的人乳头瘤病毒(human papillomavirus, HPV)感染情况进行分析,推测广州地区女性HPV感染状况。方法采用HPV核酸分型流式荧光杂交法,对来我院体检的1730例健康女性宫颈分泌物进行17种高危型HPV和10种低危型HPV核酸检测,并对不同年龄组的感染情况进行比较,总结该人群不同HPV型别及亚型感染率。结果高危型HPV感染率10.17%(176/1730),低危型HPV感染率为5.90% (102/1730)。各年龄段高危型HPV感染率最高的为>60岁年龄段,其次为<30岁年龄段。HPV感染模式最常见为高危型单一,最少见的感染模式为低危型多重合并高危型单一。高危型HPV感染率前8位依次为HPV53型、58型、52型、39型、16型、18型、51型、56型,低危型HPV感染率前4位依次为HPV43型、61型、81型、42型。结论 广州地区女性HPV感染率较高,并且以高危型HPV感染为主。定期进行HPV筛查,有利于预防和早期发现宫颈病变。
人乳头瘤病毒;高危型;低危型;广州
人乳头瘤病毒(human papillomavirus, HPV)是双链环状DNA病毒,具有嗜皮肤性和嗜黏膜性[1]。现已报道的HPV亚型约有200种,其中40余种HPV亚型与女性的生殖道感染相关[2-3]。HPV亚型可分为高危型和低危型,15种高危型HPV(16、18、31、 33、 35、39、 45、51、52、56、58、59、68、73、82型)和3种可能高危型HPV(26、53、 66型)的持续感染是引起子宫上皮内瘤变和宫颈癌的危险因素。12种低危型HPV(6、11、40、42、43、44、54、61、70、72、81、CP6108型)与尖锐湿疣、寻常疣及黏膜的乳头状瘤等良性病变密切相关[4-5]。本文对来我院体检的1730例健康女性宫颈分泌物中的17种高危型HPV亚型和10种低危型HPV亚型进行分析,以推测广州地区女性HPV感染情况。
1 对象与方法
1.1 对象 研究对象为2016年4月1日—2017年3月31日在解放军广州总医院进行健康体检的女性,共1730例,年龄17~77岁,平均为(42.62±9.81)岁,均进行宫颈分泌物HPV分型检测。
1.2 方法
1.2.1 标本采集 扩阴器充分暴露宫颈口,棉拭子擦去宫颈口分泌物,宫颈刷伸入宫颈口,紧贴宫颈口顺时针轻柔转动4~5周,抽出宫颈刷,置入装有细胞保存液的洗脱管,管口处沿刷柄折痕折断宫颈刷,宫颈刷头留在洗脱管中,旋紧管盖,做好样本标识,并保持洗脱管直立放置。
1.2.2 试剂与仪器 核酸提取试剂盒和HPV 核酸分型检测试剂盒(流式荧光杂交法)均购自上海透景生命科技股份有限公司,PCR扩增仪(美国ABI公司),多功能流式点阵仪(美国luminex200)。
1.2.3 检测原理 通过引物多重PCR扩增,流式荧光杂交分型检测的方法,同时检测27种HPV DNA。试剂盒设置了2类探针,28颗分类微球。其中,与HPV DNA杂交的探针包被在27个分类微球上,对应型别特异性探针的信号为阳性将被判定为该型别HPV阳性。质控微球是与人微球蛋白基因杂交的探针,它的结果提示取样、抽提、PCR扩增和杂交整个过程是否符合要求。检测时,首先PCR扩增待检测样品DNA,得到的PCR产物和微球上交联的探针根据碱基互补配对的原理杂交,加入荧光标记物,最后在多功能流式点阵仪上检测荧光信号。如果PCR产物和探针完全配对,则微球上相应探针捕获到标有生物素的PCR产物,加入标记了链霉亲和素的藻红蛋白后,形成微球-探针-PCR产物-生物素-链霉亲和素-藻红蛋白复合物,在多功能流式点阵仪上即可检测到分类微球的荧光信号。如果PCR产物与探针不配对,则分类微球的荧光信号为背景信号,所得到生物数据经分析后可直接判断结果。
1.2.4 HPV分型检测
1.2.4.1 样本及对照品反应模板制备 取200 μl的宫颈洗脱液加到1.5 ml的离心管中,14 000 rpm 离心3 min。吸弃上清,每管中加入200 μl 的核酸提取试剂。振荡混匀,于100 ℃金属浴中保温15 min后,14 000 rpm离心5 min。上清用于扩增反应。
1.2.4.2 PCR扩增 PCR反应混合液每份为10 μl预混液,5 μl引物,0.8 μl扩增酶。取 5 μl的样品加入到PCR反应液中,盖紧盖子后以2000 rpm的转速离心10 s,使反应液集中在PCR反应管的底部。将PCR反应管放入PCR仪,按照下列参数进行PCR扩增反应。并按照2个退火温度的热循环条件进行扩增反应:95 ℃ 5 min,1个循环;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,5 个循环;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 3 min,1 个循环。
1.2.4.3 杂交检测 微球杂交液试剂瓶倒置于漩涡仪上振荡30 s,然后再正立振荡30 s,使微球充分混悬在溶液中,并在每一个杂交孔中加入22 μl。每个样本吸取PCR扩增产物3 μl,依次加入到相应的杂交孔中,并抽吸几次加以混匀。剪取相应大小的透明封口膜,将微孔板覆盖封口。将杂交板置于金属恒温浴,把仪器的盖子压紧已经封口的杂交板,以防在高温变性和杂交时液体蒸发。变性和杂交过程运行程序为95 ℃ 5 min 变性,48 ℃ 30 min杂交,48 ℃15 min孵育;将透明封口膜重新粘好,继续在48 ℃下孵育15 min。将微孔杂交板快速转移至预热好的多功能流式点阵仪上进行检测和分析报告。
1.2.4.4 结果判定 如果阳性内对照微球蛋白的信号大于150,即代表整个实验成功。如果不符合前述条件,代表实验失败。如果有任何HPV型别特异性探针的信号大于150,即判断为该探针对应的型阳性。如果不符合前述条件的,即判断为阴性。
1.2.5 统计学处理 用SPSS 16.0软件进行统计分析。年龄呈正态分布,用x±s表示。各年龄组HPV感染率比较用R×Cχ2检验。P<0.050.05表示差异有统计学意义。
2 结 果
2.1 总体感染情况 1730例女性中,HPV阳性者278例,阳性率为16.07%,其中高危型HPV的阳性率为10.17%(176/1730),低危型HPV的阳性率为5.90%(102/1730)。
2.2 各年龄组HPV阳性率 将1730例健康体检女性按年龄段分为5个年龄组,40~49年龄组阳性率最低,为13.90%,60~77年龄组HPV 阳性率最高,为21.43%,但各年龄组间差异无统计学意义。见表1。
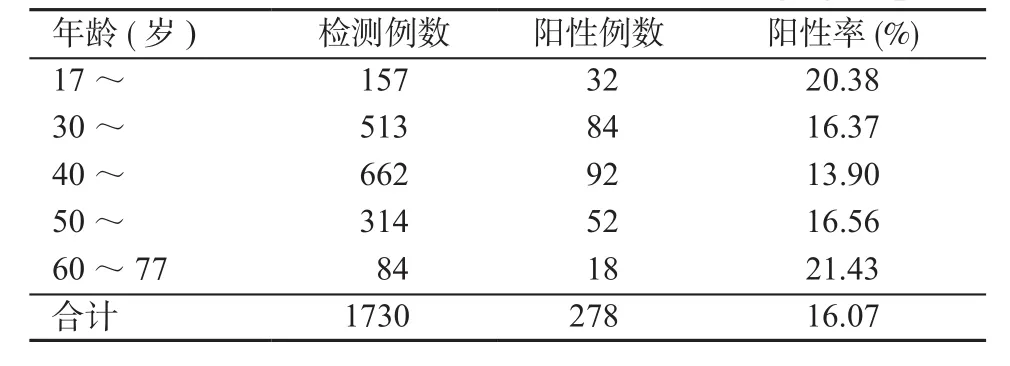
表1 各年龄组HPV阳性率Table 1 HPV infection rate in different age groups
2.3 各年龄组HPV感染模式构成比 各年龄组的HPV感染模式有7种,分别为低危型单一、低危型多重、高危型单一、高危型多重、低危型单一合并高危型单一、低危型多重合并高危型单一、低危型单一合并高危型多重。各年龄组常见的感染模式为高危型单一模式(56.47%)和低危型单一模式(24.82%),最少见的感染模式为低危型多重合并高危型单一模式。高危型单一模式主要分布在30~39年龄组,低危型单一模式主要分布在40~49年龄组。见表2。

表2 各年龄组HPV感染模式构成比 [例(%)]Table 2 Constituent ratio of HPV infection pattern in different age groups [cases(%)]
2.4 HPV各亚型阳性率 共检出16种高危型HPV和9种低危型HPV,未检出高危型HPV26和低危型HPV40。17种高危型阳性率从高到低依次为 HPV53(2.02%),HPV58(1.91%),HPV52(1.73%),HPV39(1.27%),HPV16(1.21%),HPV18(1.04%),HPV51(0.69%),HPV56(0.64%),HPV59(0.64%),HPV66(0.64%),HPV33(0.52%),HPV45(0.35%),HPV31(0.23%),HPV35(0.23%),HPV68(0.23%),HPV82(0.06%),HPV26(0)。10种低危型HPV阳性率从高到低依次为HPV43(2.20%),HPV61(0.92%),HPV81(0.92%),HPV42(0.69%),HPV55(0.69%),HPV6(0.35%),HPV44(0.29%),HPV11 (0.17%),HPV83(0.17%),HPV40(0)。见图1。
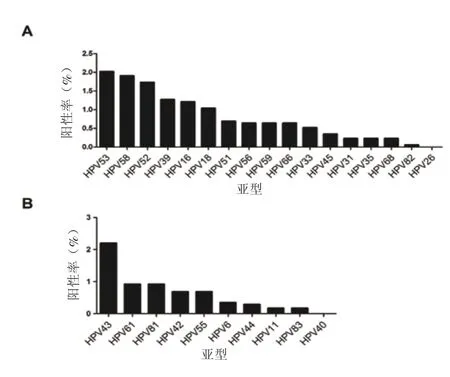
图1 HPV各亚型阳性率A.高危型;B.低危型Figure 1 HPV positive rate in different subtypes
3 讨 论
本研究通过对我院1730份健康体检女性宫颈分泌物中17种高危型HPV亚型和10种低危型HPV亚型进行分析,结果显示低危型HPV的阳性率为5.90%,高危型的阳性率为10.17%,以高危型感染为主。Zeng等[6]报道广东地区低危型HPV的阳性率为9.12%,高危型HPV的阳性率为27.01%。Tang等[7]报道重庆地区低危型HPV阳性率为2.90%,高危型HPV阳性率为30.90%。本研究与上述2个报道都是采用流式荧光杂交法进行标本检测,HPV感染率的差异可能是研究的人群和地区的差异导致的。
各年龄组的HPV感染率经统计分析差异无统计学意义,但从阳性率看,HPV的2个感染高峰出现在<30岁年龄组和>60岁年龄组,阳性率分别为20.38%和21.43%。30~60岁之间女性HPV感染率大约为16%。60岁以上女性HPV高感染率的原因可能是随着年龄的增长,体内针对HPV的特异性免疫能力下降以及绝经后激素水平的下降,最终导致潜伏在体内的HPV重新活化[7]。
本研究中各年龄层的HPV感染模式主要是单一高危型HPV感染和单一低危型HPV感染,多重高危型HPV的仅占很少一部分。Spinillo等[5]报道单一高危型HPV感染、单一高危型合并低危型HPV感染、多重低危型HPV感染不增加宫颈上皮不典型增生以及宫颈癌的风险。另外,多重高危型HPV感染与中度和重度的宫颈上皮不典型增生以及宫颈癌的发生发展密切相关[5]。
De等[4]报道全球38个地区宫颈癌患者最常见的8种HPV型别依次是HPV16型、18型、31型、33型、35型、45型、52型、58型。Muñoz等[2]报道全球9个地区最常见型别依次是HPV16型、18型、45型、31型、33型、52型、58型、35型。Zeng等[6]报道中国最常见的型别依次是HPV52型、16型、58型、56型、39型、18型、59型、68型。Zhang等[11]报道上海最常见的型别依次是HPV16型、58型、52型、51型、68型、18型、56型、33型。Xu等[12]报道台州最常见的型别依次是HPV52型、16型、58型、39型、18型、56型、51型、33型。本研究中最常见的8种高危型HPV依次是HPV53型、58型、52型、39型、16型、18型、51型、56型。目前上市的HPV疫苗有3种,分别是二价疫苗(HPV16/18),四价疫苗(HPV6/11/16/18),九价疫苗(HPV6/11/16/18/31/33/45/52/58)[13-14]。由于不同地区的高危型HPV亚型感染率存在差异,因此开发新的多价疫苗或通用疫苗才能够更好的预防HPV感染。大量的研究表明注射HPV疫苗可以降低由HPV持续感染引起的子宫上皮内瘤变和宫颈癌的发病率[15-18]。
综上,本研究分析了1730例健康体检女性17种高危型和10种低危型HPV的感染情况,为本地区的HPV的诊断和防治提供了一定的参考依据。广州地区女性HPV感染率较高,并且以高危型HPV感染为主,定期进行HPV筛查,有利于预防和早期发现宫颈上皮内瘤变和宫颈癌。
[1]Van Doorslaer K, Tan Q, Xirasagar S, et al. The papillomavirus episteme: a central resource for papillomavirus sequence data and analysis[J]. Nucleic Acids Res, 2012, 41(D1):D571-D578.
[2]Muñoz N, Bosch F X, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer[J].N Engl J Med, 2003, 348(6):518-527.
[3]Halec G, Alemany L, Lloveras B, et al. Pathogenic role of the eight probably/possibly carcinogenic HPV types 26, 53, 66, 67, 68, 70,73 and 82 in cervical cancer[J]. J Pathol, 2014, 234(4):441-451.
[4]de Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol, 2010,11(11):1048-1056.
[5]Spinillo A, Gardella B, Roccio M, et al. Multiple human papillomavirus infection with or without type 16 and risk of cervical intraepithelial neoplasia among women with cervical cytological abnormalities[J]. Cancer Causes Control, 2014, 25(12):1669-1676.
[6]Zeng Z, Yang H, Li Z, et al. Prevalence and genotype distribution of HPV infection in China: analysis of 51,345 HPV genotyping results from China's largest CAP certified laboratory[J]. J Cancer,2016, 7(9):1037-1043.
[7]Tang Y, Zheng L, Yang S, et al. Epidemiology and genotype distribution of human papillomavirus (HPV) in Southwest China: a cross-sectional five years study in non-vaccinated women[J].Virol J, 2017, 14(1):84.
[8]Burchell AN, Winer RL, de Sanjosé S, et al. Chapter 6:epidemiology and transmission dynamics of genital HPV infection[J]. Vaccine, 2006, 24(1):S52-S61.
[9]Crosbie EJ, Einstein MH, Franceschi S, et al. Human papillomavirus and cervical cancer[J]. Lancet, 2013, 382(9895):889-899.
[10]Halec G, Schmitt M, Dondog B, et al. Biological activity of probable/possible high-risk human papillomavirus types in cervical cancer[J]. Int J Cancer, 2013, 132(1):63.
[11]Zhang C, Zhang C, Huang J, et al. Prevalence and genotype distribution of human papillomavirus among females in the suburb of Shanghai, China[EB/OL]. J Med Virol, 2017. [2017-08-02]http://onlinelibrary.wiley.com/doi/10.1002/jmv.24899/abstract;jses sionid=237ABFDB946D596956E5CAEE3DD1DE55.f04t03.
[12]Xu HH, Lin A, Chen YH, et al. Prevalence characteristics of cervical human papillomavirus (HPV) genotypes in the Taizhou area, China: a cross-sectional study of 37 967 women from the general population[J]. BMJ Open, 2017, 7(6):e14135.
[13]Kornides ML, Calo WA, Heisler-Mackinnon JA, et al. U.S. primary care clinics' experiences during introduction of the 9-Valent HPV Vaccine[EB/OL]. J Community Health, 2017. [2017-08-02]https://link.springer.com/article/10.1007%2Fs10900-017-0420-x.[14]Garland SM, Steben M, Sings HL, et al. Natural history of genital warts: analysis of the placebo arm of 2 randomized phase III trials of a quadrivalent human papillomavirus (types 6, 11, 16, and 18)vaccine[J]. J Infect Dis, 2009, 199(6):805-814.
[15]Bruni L, Diaz M, Barrionuevo-Rosas L, et al. Global estimates of human papillomavirus vaccination coverage by region and income level: a pooled analysis[J]. Lancet Glob Health, 2016,4(7):e453-e463.
[16]Costa APF, Cobucci RNO, da Silva JM, et al. Safety of human papillomavirus 9-valent vaccine: a meta-analysis of randomized trials[J]. J Immunol Res, 2017, 2017:3736201.
[17]Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women[J]. N Engl J Med, 2015, 372(8):711-723.
[18]李硕,张云辉,王永怡,等. 2016年全球传染病热点回顾[J].传染病信息,2017,30(1):1-7.
Analysis of high-risk and low-risk human papillomavirus infection among 1730 women receiving healthy examination
L
I
AN Fei, CHEN Jing-na, YANG Yong-quan, ZHANG Ying-ying, LI Xiao, ZHANG Rong, LIU Juan-zi, HUANG Xiu-na,ZHANG Zhi-ying, SUN Zhao-hui, LI Lin-hai*
Department of Laboratory Medicine, Guangzhou General Hospital of PLA, 510010, China Department of Laboratory Medicine, The First Affiliated Hospital, Shantou University Medical College, 515041, China LIAN Fei and CHEN Jing-na are the first authors who contributed equally to the article
ObjectiveTo investigate the prevalence of human papillomavirus (HPV) infection among 1730 women receiveing healthy examination in our hospital, and speculate the prevalence of HPV infection among female population in Guangzhou.MethodsA total of 1730 woman who
healthy examination in our hospital underwent 17 high-risk HPV and 10 low-risk HPV genotype screening of cervical specimen using flow cytometry fluorescence hybridization method. Different HPV genotypes and subtype infection rate were summarized.ResultsThe infection rate of high-risk HPV was 10.17% (176/1730), and the infection rate of low-risk HPV was 5.90% (102/1730). The highest infection rate of high-risk HPV was > 60 years age group, followed by < 30 years age group. The most common HPV infection pattern was single high-risk HPV infection, while the least pattern was multiple low-risk merged single high-risk HPV infection. HPV type 53, 58, 52, 39, 16, 18, 51, 56 (in descending order of frequency) were 8 most common highrisk HPV types, while HPV type 43, 61, 81, 42 were 4 most common low-risk HPV types.ConclusionsHPV infection rate is high among females in Guangzhou, and high-risk HPV is the most common infection genotype. Regular HPV screening of cervical specimens is useful for prevention and early detection of cervical cancer.
human papillomavirus; high-risk; low-risk; Guangzhou
R373.9
A
1007-8134(2017)05-0286-04
10.3969/j.issn.1007-8134.2017.05.010
广州市产学协同创新重大专项(201604040003)
510010 ,解放军广州总医院检验科(连菲、杨永泉、张莹莹、李晓、张蓉、刘娟子、黄秀娜、张志英、孙朝晖、李林海);515041,汕头大学医学院第一附属医院检验科(陈静娜)前两位作者对本文有同等贡献,均为第一作者
李林海,E-mail: mature303@126.com
*Corresponding author, E-mail: mature303@126.com
(2017-09-02收稿 2017-10-17修回)
(本文编辑 张云辉)

