2,2′-二硝基-4,4′-联苯二甲酸构筑的四个稀土金属有机骨架
冯上发 何 鑫 秦 涛 张顺林 朱敦如*,,2
2,2′-二硝基-4,4′-联苯二甲酸构筑的四个稀土金属有机骨架
冯上发1何 鑫1秦 涛1张顺林1朱敦如*,1,2
(1南京工业大学化工学院,材料化学工程国家重点实验室,南京 210009)
(2南京大学配位化学国家重点实验室,南京 210023)
在溶剂热条件下,2,2′-二硝基-4,4′-联苯二甲酸(H2L)与 Ln(NO3)3·6H2O 反应,成功合成了 4 个稀土金属有机骨架(LOFs):[LnL1.5(DMA)]n(Ln=Eu (1),Gd (2),Tb (3),Dy (4),DMA=N,N-二甲基乙酰胺)。 采用元素分析、红外(IR)、热重(TGA)、单晶和粉末 X 射线衍射(XRD)对其结构进行了表征。晶体结构分析表明:LOFs 1~4均为单斜晶系、C2/c空间群,为异质同晶的双节点(3,8)-连接的三维(3D)拓扑结构。LOFs 1~4均具有高的热稳定性(分解温度Td>322℃),1显示铕的特征荧光光谱,而3仅显示配体的荧光发射。
稀土金属有机骨架;2,2′-二硝基-4,4′-联苯二甲酸;晶体结构;荧光
0 引 言
稀土金属配合物由于其自身的4f轨道的电子跃迁,可表现出独特的光学和磁学性质[1]。稀土金属离子由于具有高的配位数以及灵活多变的配位模式,也能构筑具有迷人拓扑结构的稀土金属有机骨架(lanthanide-organic frameworks,LOFs)材料。近十多年来,新型LOFs材料的设计与合成受到科研工作者越来越多的关注,因为LOFs材料在荧光、磁性、气体存储、离子交换以及质子导体等领域具有重要的应用价值[2-5]。迄今为止,已有大量不同类型的配体(如希夫碱、氨基酸以及吡啶羧酸等)被用于合成新的LOFs材料[6-9],而应用最广泛的一类有机配体是芳香多羧酸,因为芳香多羧酸具有丰富多变的配位方式,而稀土金属离子具有较强的氧亲合性[10]。其中对苯二甲酸[11]、均苯三甲酸[12]以及 4,4′-联苯二甲酸[13]等芳香多羧酸配体所合成的LOFs材料已有大量报道,而用官能团取代的芳香多羧酸构筑的3D LOFs研究得相对较少。
我们的兴趣是利用对称取代的联苯二甲酸作为配体来构筑结构新颖的LOFs(或MOFs)材料。我们前期的研究表明,利用此类配体不仅可构筑拓扑结构多样的MOFs材料,而且由于取代基的配位或空间填充效应,可得到热稳定性高的LOFs(MOFs)材料[14]。 例如由 2,2′-二甲氧基-4,4′-联苯二甲酸与Cd(Ⅱ)离子所构建的MOF材料,首次呈现3D/3D二重杂互穿的拓扑结构[15];而由该配体与稀土Eu(Ⅲ)、Gd(Ⅲ)、Dy(Ⅲ)离子所合成的LOF材料是一个新的双节点(3,20)-连接的3D拓扑结构,其次级建筑块(SBU)为新颖的俄罗斯套娃[Ln4@Ln4]结构[16]。 本文中我们采用硝基取代的联苯二甲酸:2,2′-二硝基-4,4′-联苯二甲酸(H2L)与 Ln(NO3)3·6H2O 通过溶剂热反应,合成了 4 个新的 3D LOFs:[LnL1.5(DMA)]n(Ln=Eu(1),Gd (2),Tb (3),Dy (4),测定了它们的晶体结构和热稳定性,并研究了LOFs 1和3的荧光性质。
1 实验部分
1.1 试剂和仪器
Ln(NO3)3·6H2O(Ln=Eu,Gd,Tb,Dy)、N,N-二甲基乙酰胺(DMA)均为市售分析纯试剂,未经进一步纯化。 2,2′-二硝基-4,4′-联苯二甲酸(H2L)配体根据文献合成[17]。LOFs材料的C,H和N元素分析是在Thermo Finnigan Flash 1112A型元素分析仪上测定;红外光谱(KBr压片)使用 VECTOR 22 Bruker型红外光谱仪在4 000~400 cm-1范围内测定;热重分析采用NETZSCH STA 449C型热重分析仪在N2气氛及升温速率为10℃·min-1的条件下测定;粉末XRD由Bruker D8 Advance型X射线衍射仪测定,采用 Cu靶 Kα(λ=0.154 06 nm)为辐射源,管电压 40 kV、管电流 40 mA,扫描范围为 5°~50°。 荧光采用Hitach F-700型荧光光谱仪测定。
1.2 LOFs 1~4 的合成
1.2.1 [EuL1.5(DMA)]n(1)的合成
将 Eu (NO3)3·6H2O (22.3 mg,0.05 mmol)和 H2L(24.9 mg,0.075 mmol)分别加入有聚四氟乙烯内胆的15 mL不锈钢反应釜中,再分别加入0.5 mL DMA和2 mL H2O。将其置于130℃的烘箱中反应48 h 后,冷却至室温(RT),过滤后得到 26.3 mg无色块状晶体1(基于Eu的产率为71.6%),红外光谱(KBr,cm-1):3 066(w),2 939(w),1 667(s),1 593(vs),1 529 (s),1 409 (vs),1 351 (s),788 (s)。 元素分析:C25H18EuN4O13,计算值(%):C,40.89;H,2.47;N,7.63;实验值(%):C,41.01;H,2.32;N,7.48。
1.2.2 [LnL1.5(DMA)]n(Ln=Gd (2),Tb (3),Dy(4)的合成
LOFs 2~4的合成方法与1类似,只是分别用Gd(NO3)3·6H2O、Tb(NO3)3·6H2O 和 Dy(NO3)3·6H2O 代替 Eu(NO3)3·6H2O。2 的产率为 61.9%, 红外光谱(KBr,cm-1):3 065(w),2 939(w),1 670(s),1 593(vs),1 529 (s),1 410 (vs),1 351 (s),788 (s)。 元素分析:C25H18GdN4O13,计算值(%):C,40.59;H,2.45;N,7.57;实验值 (%):C,40.82;H,2.32;N,7.44。 3 的产率为76.9%, 红外光谱 (KBr,cm-1):3 064 (w),2 935(w),1 671(m),1 593(s),1 528(s),1 409(vs),1 350(s),789(s)。元素分析:C25H18TbN4O13,计算值(%):C,40.50;H,2.45;N,7.56;实验值(%):C,40.72;H,2.33;N,7.34。4的产率为 68.5%, 红外光谱 (KBr,cm-1):3 064(w),2 938 (w),1 673 (s),1 593 (vs),1 528 (s),1 410 (vs),1 350(s),787(s)。 元 素 分析:C25H18DyN4O13,计算值(%):C,40.31;H,2.44;N,7.52;实验值(%):C,40.51;H,2.25;N,7.38。
1.3 LOFs 1~4的单晶结构测定
选取大小合适的LOFs 1~4的单晶置于Bruker Smart APEX Ⅱ CCD仪上,在296(2)K收集 X射线衍射数据。光源采用经过石墨单色化的Mo Kα射线(λ=0.071 073 nm)。以 ω-2θ扫描方式收集衍射点,全部强度数据经Ψ扫描进行经验吸收校正。晶体结构解析采用直接法。全部非氢原子经Fourier合成及差值电子密度函数修正,使用最小二乘法对坐标和各向异性温度因子进行修正。氢原子均通过理论加氢确定。在SHELXTL-97中完成所有的计算[18]。1~4的晶体学数据列于表1中,主要键长及键角列于表2。
CCDC:1549595,1; 1549593,2; 1549596,3;1549594,4。

表1 LOFs 1~4的晶体学数据Table 1 Crystallographic data of LOFs 1~4
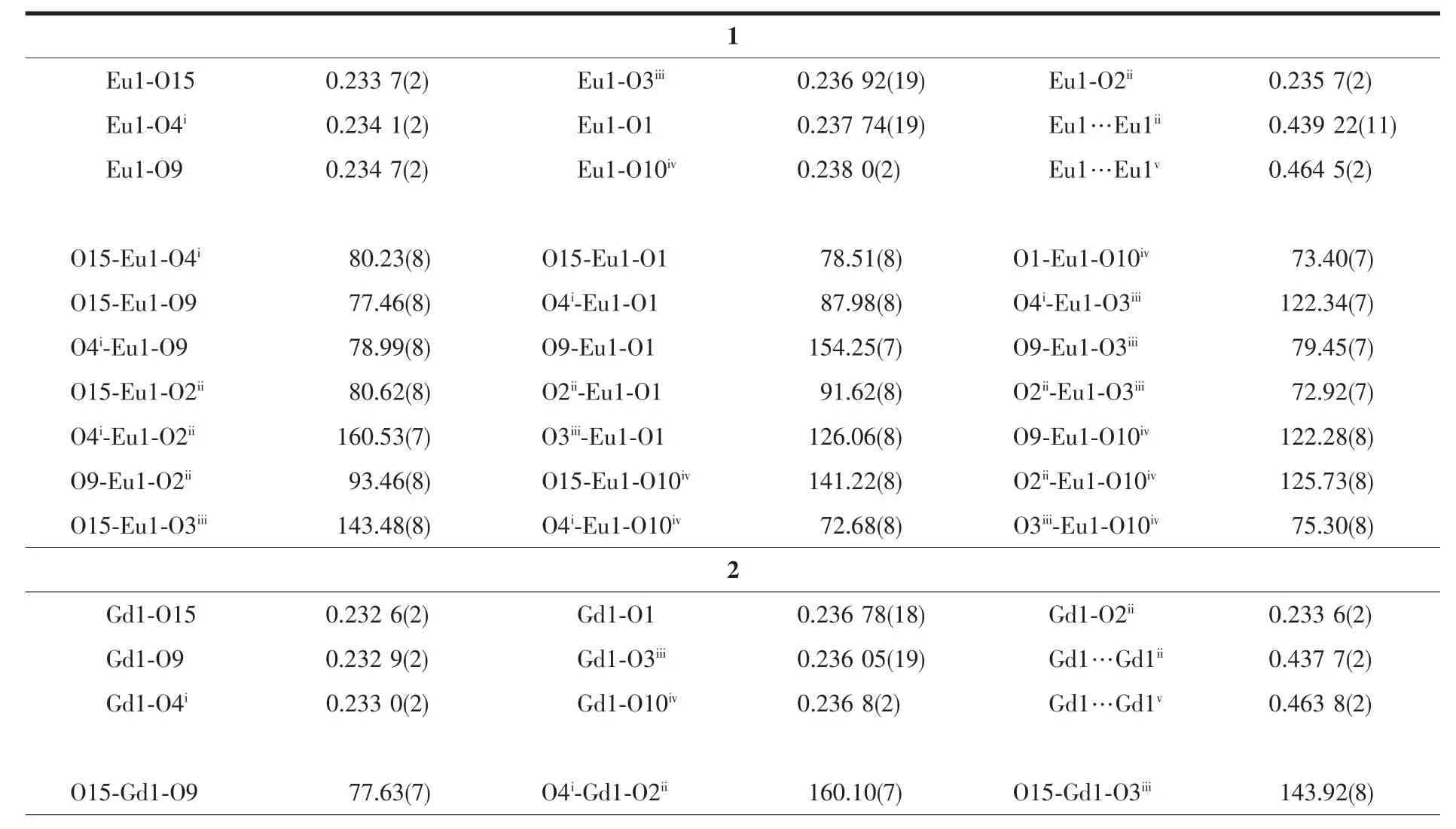
表2 LOFs 1~4 的主要键长(nm)和键角(°)Table 2 Selected bond lengths (nm)and angles (°)for LOFs 1~4

续表2
2 结果与讨论
2.1 LOFs 1~4的晶体结构描述
单晶结构分析表明:LOFs 1~4均结晶于单斜晶系,C2/c空间群。因为1~4是同构的,因此本文仅以1为例来分析其晶体结构。1的不对称单元由1个Eu(Ⅲ)离子、1.5个L2-配体和1个配位DMA分子所组成,其中1个硝基是无序的(N1,O5,O6的占有率为0.5)(图1a)。Eu(Ⅲ)离子为七配位的单帽三棱柱构型(图 1b),其面心的氧原子(O15)来自 DMA,其余 6个氧原子均来自6个不同L2-配体的羧基(图1c)。
如图2a所示,每个Eu1与2个相邻的铕离子(Eu1ii和Eu1v)分别以4个羧基和2个羧基桥连,形成1D的无机金 属离 子链[Eu1v(μ2-CO2)2Eu1(μ2-CO2)4Eu1ii]n,Eu1…Eu1ii和Eu1…Eu1v的距离分别为0.439 22(11)和 0.464 5(2)nm(表 2)。 1D 链之间由配体的联苯基团进一步连接形成3D的空间结构(图2b)。若将由4个羧基桥连的2个铕离子(Eu1和Eu1ii)视为一个八连接的金属节点(图3a),连接该金属节点的配体L2-看作一个三连接的节点(图3b),则1可简化为一个由双节点 (3,8)-连接的 3D 网络 (图 3c)。 根据TOPOS 软件[19]计算可知,其点阵符号为{42·5}2{44·56·610·75·82·9}。 Platon 计算表明,1 中不存在任何孔道,这是由于配体的紧密排列和硝基的空间填充效应所导致的。在1中桥连配体L2-存在2种配位模式:(1)顺,顺-双(二齿桥连)和(2)顺,反-双(二齿桥连)(图4),其中联苯环间的二面角分别为60.8°和87.9°。

图1 (a)LOF 1 的不对称单元;(b),(c):Eu(Ⅲ)的配位环境Fig.1 (a)Asymmetric unit for LOF 1;(b),(c):View of the coordination environments of Eu(Ⅲ) ions in 1
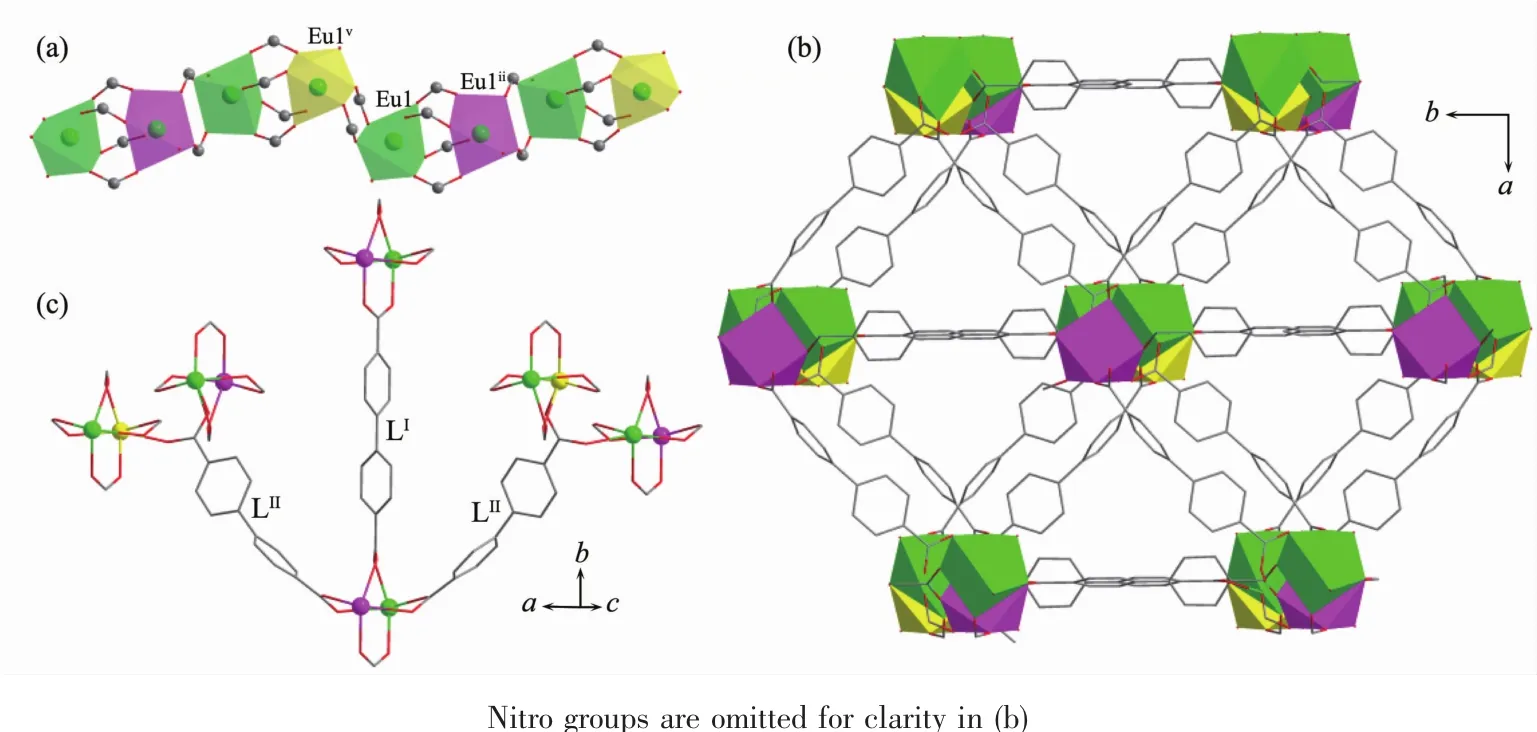
图2 (a)羧基桥连 Eu(Ⅲ)形成的 1D 无机金属链[Eu1v(μ2-CO2)2Eu1(μ2-CO2)4Eu1ii]n;(b)LOF 1 的 3D 骨架;(c)LOF 1 中配体 L2-的连接方式Fig.2 (a)One dimensional inorganic chain [Eu1v(μ2-CO2)2Eu1(μ2-CO2)4Eu1ii]nformed by the carboxyl groups and Eu(Ⅲ) ions;(b)Three dimensional framework of 1;(c)Two types of configurations of L2-ligands in 1
2.2 相纯度和热稳定性
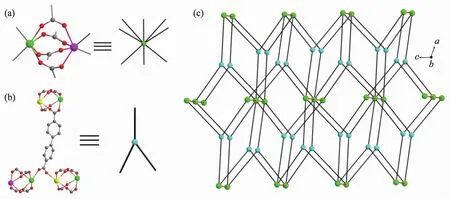
图3 (a)八连接的 Eu(Ⅲ)节点简化;(b)三连接的配体 L2-节点简化;(c)双节点(3,8)-连接的 3D 网络Fig.3 (a)Simplification of 8-connected Eu(Ⅲ) node;(b)Simplification of 3-connected ligand L2-node;(c)View of two-nodal(3,8)-connected 3D network in 1
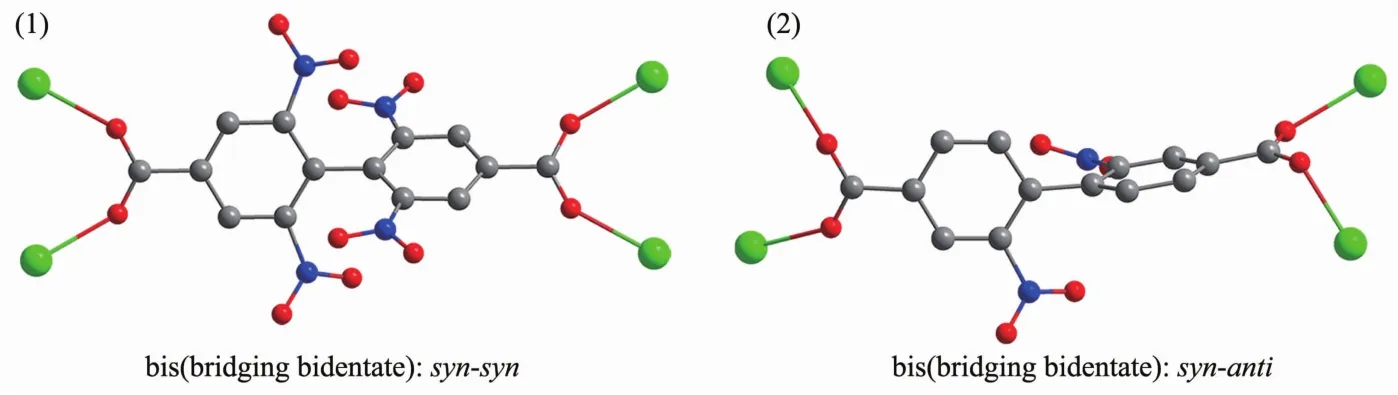
图4 LOF 1中配体L2-的两种配位模式Fig.4 Two types of coordination modes of ligand L2-in LOF 1
为了验证大量合成的LOFs 1~4的纯度,我们对其进行了粉末XRD表征。结果表明:粉末XRD图中的衍射峰位置与单晶结构模拟的结果完全一致,说明大量合成的LOFs 1~4均为纯相。

图5 LOFs 1~4的热重分析Fig.5 TGA curves of LOFs 1~4
热重分析(TGA)表明(图 5),因为结构中不含溶剂分子,LOFs 1~4均表现出类似的高热稳定性 (分解温度Td>322℃)。 以 1为例,在室温至 277°C,LOF 1几乎不失重,在277~329℃之内失重12.9%,归属为失去1个配位的DMA分子 (计算值为11.9%),继续升温,1的骨架开始坍塌。LOFs 2~4的热重分析详见表3。
2.3 LOFs 1和3的荧光性质
由于固有的4f轨道电子跃迁,镧系金属离子常发出独特的荧光,因此LOFs荧光材料能应用于化学传感、荧光检测、发光器件和生物医学成像等领域[20]。在室温下测定了LOFs 1和3以及自由配体H2L的固态荧光发射光谱。在465 nm的光激发下,LOF 1呈现出Eu(Ⅲ)离子的特征荧光发射光谱 (图6)。说明在光致发光过程中,1中的L2-配体已将能量传递到Eu(Ⅲ)离子中心,成功发挥了天线作用。1的发射光谱由 Eu(Ⅲ)离子的5D0→7Fj(j=0~4)的电子跃迁产生,其中太弱的5D0→7F0荧光发射峰观察不到,最强的5D0→7F2的荧光发射分裂成2个峰 (614和621 nm),其余的3个发射峰592、652和704 nm分别对应于5D0→7F1,7F3和7F4电子跃迁[14e,21]。 由于具有良好的热稳定性 (Td>329℃),LOF 1是一种潜在的红光发射材料。如图7所示,在368 nm的光激发下,自由配体H2L在496 nm处出现最大荧光发射峰。而在351 nm的光激发下,LOF 3在450 nm处出现最大荧光发射峰,此时并未观察到Tb(Ⅲ)离子的特征荧光发射,说明3中的L2-配体并不能发挥天线作 用[21]。

表3 LOFs 1~4的热重分析Table 3 TGA for LOFs 1~4
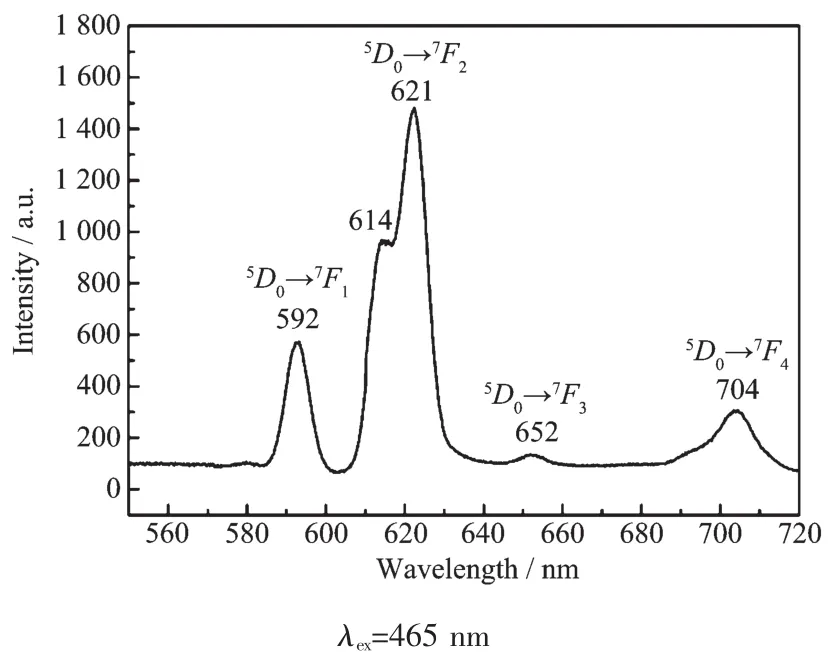
图6 LOF 1的固态荧光发射光谱Fig.6 Photoluminescence emission spectrum of 1

图7 自由配体H2L和LOF 3的固态荧光发射光谱Fig.7 Photoluminescence emission spectra of free ligand H2L and LOF 3
3 结 论
通过使用 2,2′-二硝基-4,4′-联苯二甲酸为配体,成功合成了4个新的稀土金属有机骨架。LOFs 1~4具有双节点(3,8)-连接的3D网络结构并表现出高热稳定性。LOF 1在室温激发状态下发射Eu(Ⅲ)离子的特征荧光,而LOF 3仅发射配体的荧光。
[1](a)Roy S,Chakraborty A,Maji T K.Coord.Chem.Rev.,2014,273-274:139-164(b)Fordham S,Wang X,Bosch M,et al.Struct.Bond.,2015,163:1-27
[2](a)Zhen M,Tan H,Xie Z,et al.ACS Appl.Mater.Interfaces,2013,5:1078-1083(b)Li H Y,Xu H,Zang S Q,et al.Chem.Commun.,2016,52:525-528(c)Zhou Y,Yan B.Chem.Commun.,2016,52:2265-2268(d)Colodrero R M P,Papathanasiou K E,Stavgianoudaki N,et al.Chem.Mater.,2012,24:3780-3792(e)Cui Y,Xu H,Yue Y,et al.J.Am.Chem.Soc.,2012,134:3979-3982
[3] (a)Cui P P,Zhang X D,Zhao Y,et al.Dalton Trans.,2016,45:2591-2597(b)Lin Z J,Yang Z,Liu T F,et al.Inorg.Chem.,2012,51:1813-1820(c)He Y P,Tan Y X,Zhang J.Inorg.Chem.,2013,52:12758-12762(d)Li G P,Liu G,Li Y Z,et al.Inorg.Chem.,2016,55:3952-3959
[4](a)Wang S,Cao T,Yan H,et al.Inorg.Chem.,2016,55:5139-5151(b)Zhao J,He X,Zhang Y,et al.Cryst.Growth Des.,2017,17:5524-5532(c)Seth S,Savitha G,Moorthy J N.J.Mater.Chem.A,2015,3:22915-22922(d)Han Y H,Tian C B,Lin P,et al.J.Mater.Chem.A,2015,3:24525-24531(e)Dang S,Ma E,Sun Z M,et al.J.Mater.Chem.,2012,22:16920-16926
[5] (a)Wang C,Li L,Bell J G,et al.Chem.Mater.,2015,27:1502-1516(b)Jiang H L,Tsumori N,Xu Q.Inorg.Chem.,2010,49:10001-10006(c)Wang X,Qin T,Bao S S,et al.J.Mater.Chem.A,2016,4:16484-16489
[6] (a)Tehrani A A,Ghasempour H,Morsali A,et al.Cryst.Growth Des.,2015,15:5543-5547(b)Herbst A,Khutia A,Janiak C.Inorg.Chem.,2014,53:7319-7333(c)Xi F G,Liu H,Yang N N,et al.Inorg.Chem.,2016,55:4701-4703
[7] (a)Kathalikkattil A C,Roshan R,Tharun J,et al.Chem.Commun.,2016,52:280-283(b)Sartor M,Stein T,Hoffmann F,et al.Chem.Mater.,2016,28:519-528(c)Dong L,Chu W,Zhu Q,et al.Cryst.Growth Des.,2011,11:93-99
[8](a)Park I H,Lee S S.CrystEngComm,2011,13:6520-6525(b)Li W X,Zheng Y S,Sun X J,et al.J.Fluoresc.,2010,20:235-241
[9] (a)Liu Y,Zhang Y,Hu G H,et al.Chem.Eur.J.,2015,21:10391-10399(b)Bag P P,Wang X S,Cao R.Dalton Trans.,2015,44:11954-11962(c)Tong Y,Han X,Huang C,et al.Dalton Trans.,2016,45:3702-3705(d)Liu T F,Zhang W,Sun W H,et al.Inorg.Chem.,2011,50:5242-5248
[10](a)Guo H,Zhu Y,Qiu S,et al.Adv.Mater.,2010,22:4190-4192(b)Li Z,Zhu G,Guo X,et al.Inorg.Chem.,2007,46:5174-5178(c)Tang Q,Liu S,Liu Y,et al.Inorg.Chem.,2013,52:2799-2801
[11](a)Wei Y,Sa R,Li Q,et al.Dalton Trans.,2015,44:3067-3074(b)Geranmayeh S,Mohammadnezhad F,Abbasi A.J.Inorg.Organomet.Polym.,2016,26:109-116(c)Hao J N,Yan B.J.Mater.Chem.C,2014,2:6758-6764
[12](a)Mu W,Huang X,Zhong R,et al.CrystEngComm,2015,17:1637-1645(b)Han Y F,Zhou X H,Zheng Y X,et al.CrystEngComm,2008,10:1237-1242
[13](a)You L,Zong W,Xiong G,et al.Appl.Catal.A,2016,511:1-10(b)Liu K,Zhou J M,Li H M,et al.Cryst.Growth Des.,2014,14:6409-6420(c)Lin X M,Ding Y J,Liang S M,et al.CrystEngComm,2015,17:3800-3808(d)Fang M,Li J J,Shi P F,et al.Dalton Trans.,2013,42:6553-6563
[14](a)Wang X Z,Zhu D R,Xu Y,et al.Cryst.Growth Des.,2010,10:887-894(b)Gao T,Wang X Z,Gu H X,et al.CrystEngComm,2012,14:5905-5913(c)Zhang H J,Wang X Z,Zhu D R,et al.CrystEngComm,2011,13:2586-2592(d)XU Heng(徐恒),GONG Jun(龚军),MA Jun-Han(麻钧涵),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(10):2229-2235(e)Liu X,Wang X,Gao T,et al.CrystEngComm,2014,16:2779-2787(f)Wang X,Zhao J,Zhao Y,et al.Dalton Trans.,2015,44:9281-9288
[15](a)Xu H,Bao W,Xu Y,et al.CrystEngComm,2012,14:5720-5722(b)Luo R,Xu H,Gu H X,et al.CrystEngComm,2014,16:784-796
[16]Zhao J,Wang X,Zhao J,et al.CrystEngComm,2016,18:863-867
[17]Qin T,Gong J,Ma J,et al.Chem.Commun.,2014,50:15886-15889
[18]Sheldrick G M.Acta Crystallogr.,Sect.A:Found.Crystallogr.,2008,A64:112-122
[19]Blatov V A.IUCr CompComm Newsletter,2006,7:4-38
[20]Cui Y,Chen B,Qian G.Coord.Chem.Rev.,2013,273-274:76-86
[21]LI Jia-Jia(李佳佳),SONG Shuang(宋爽),MA Dou(马豆),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(4):717-724
Four Lanthanide-Organic Frameworks Built from 2,2′-Dinitro-4,4′-biphenyldicarboxylic Acid
FENG Shang-Fa1HE Xin1QIN Tao1ZHANG Shun-Lin1ZHU Dun-Ru*,1,2
(1College of Chemical Engineering,State Key Laboratory of Material-Oriented Chemical Engineering,Nanjing Tech University,Nanjing 210009,China)
(2State Key Laboratory of Coordination Chemistry,Nanjing University,Nanjing 210023,China)
Four lanthanide-organic frameworks (LOFs),[LnL1.5(DMA)]n(Ln=Eu (1),Gd (2),Tb (3),Dy (4);H2L=2,2′-dinitro-4,4′-biphenyldicarboxylic acid,DMA=N,N-dimethylacetylamide),have been prepared by the solvothermal reaction of H2L and Ln(NO3)3·6H2O.Their structures have been characterized by elemental analyses,IR,TGA,single-crystal and powder X-ray diffraction (XRD)studies.Crystal structure analyses show that LOFs 1~4 crystallize in the monoclinic system with C2/c space group.LOFs 1~4 are isomorphous and possess a binodal(3,8)-connected three-dimensional(3D)topology network.All the LOFs exhibit high thermal stabilities (Td>322 ℃).Furthermore,1 displays characteristic luminescence of Eu(Ⅲ) ion while 3 only shows the emission peak of the L2-ligand.CCDC:1549595,1;1549593,2;1549596,3;1549594,4.
lanthanide-organic frameworks;2,2′-dinitro-4,4′-biphenyldicarboxylic acid;crystal structure;luminescence
O614.33+8;O614.33+9;O614.341;O614.342
A
1001-4861(2017)11-2095-08
10.11862/CJIC.2017.241
2017-06-06。收修改稿日期:2017-09-05。
国家自然科学基金(No.21476115)和南京大学配位化学国家重点实验室开放课题资助项目。
*通信联系人。E-mail:zhudr@njtech.edu.cn;会员登记号:S060015982P。

