酶法制备富硒糙米抗氧化肽的研究
赵 爽 ,刘昆仑 *,陈复生
(河南工业大学 1.谷物资源转化与利用省级重点实验室;2.粮油食品学院,河南 郑州 450001)
酶法制备富硒糙米抗氧化肽的研究
赵 爽1,2,刘昆仑1,2*,陈复生2
(河南工业大学 1.谷物资源转化与利用省级重点实验室;2.粮油食品学院,河南 郑州 450001)
采用酶法制备富硒糙米抗氧化肽,研究了酶种类、酶解时间、酶解温度、底物浓度、pH和加酶量对酶解产物抗氧化活性的影响。结果表明,碱性蛋白酶较适宜制备富硒糙米抗氧化肽。在单因素的基础上,以总抗氧化能力为指标,采用响应面法优化了富硒糙米抗氧化肽的最佳制备工艺,其条件为:底物浓度3%,pH 8.0,酶解时间2.0 h,温度50℃,加酶量7 550 U/g。该条件下制备的抗氧化肽的总抗氧化能力为(16.16±0.22)μmol/g。抗氧化肽在食品特别是功能性食品中的应用,对于保持食品品质、提高机体抗氧化机能具有积极作用。
富硒糙米;抗氧化肽;响应面法;酶解
0 引言
食品中的氧化反应会使食品变色、营养成分损失,甚至会产生不良风味和有害物质[1]。此外,过量的自由基会破坏机体内的生物大分子如DNA、蛋白质、脂质等,导致其结构和功能的氧化损伤,并引发癌症、心血管疾病等[2-3]。为了预防食品变质和疾病发生,抑制食品中自由基的产生显得尤为重要。人工合成的抗氧化剂如丁基羟基茴香醚(BHA)、2,6-二叔丁基对甲酚(BHT)等虽能有效抑制食品中的氧化反应,但具有潜在风险,在食品中的应用受到严格限制[4]。因此,天然来源的抗氧化剂引起了国内外学者的极大关注。食源性抗氧化肽具有安全有效、分子质量低、易吸收等优点,还具有特殊的营养和功能特性。近年来,以动植物蛋白为原料制备高活性的抗氧化肽成为研究热点[5-8]。
硒是人体所必需的微量元素,具有抗氧化、抗癌、抗病毒等多种特性[9]。硒以硒代半胱氨酸(SeCys)及硒代甲硫氨酸(SeMet)的形式位于多种硒酶的活性中心,调节硒酶清除机体内的过氧化物,抵抗机体内的氧化损伤。长期以来,对硒的抗氧化作用研究多集中于硒酶和硒蛋白。但是硒酶和硒蛋白结构复杂,易受加工贮藏环境影响而变性失活。已有研究证实,硒蛋白的水解产物,小分子的富硒肽具有一定的抗氧化活性[10-11]。
作者从富硒糙米中提取硒蛋白,通过酶解制备富硒抗氧化肽,以总抗氧化能力为指标,采用响应面法分析各因素对富硒抗氧化肽活性的影响,建立最佳制备工艺,为富硒抗氧化肽在食品、医药领域的应用提供参考。
1 材料与方法
1.1 材料与试剂
水稻(隆粳968):安徽隆平高科种业有限公司;碱性蛋白酶(189.57 U/mg)、中性蛋白酶(107.39 U/mg)、胃蛋白酶(28.63 U/mg)、风味蛋白酶(21.55 U/mg):上海源叶生物科技有限公司;总抗氧化能力测试盒:南京建成生物工程研究所;其他试剂均为分析纯。
1.2 方法
1.2.1 富硒糙米的制备
参照Liu等[12]的方法制得,富硒糙米硒含量为6.26 μg/g 。
1.2.2 硒蛋白的提取
根据Yue等[13]报道的方法提取富硒糙米硒蛋白。富硒糙米粉碎后过 100目筛,正己烷(W/V=1∶3)振荡脱脂7 h,通风橱过夜使溶剂挥发。称取脱脂富硒糙米粉45 g, 用蒸馏水 (W/V=1∶3) 浸泡12 h,搅拌成悬浮液后加入0.1 mol/L NaOH溶液(W悬浮液:VNaOH溶液=1∶3)。 将悬浮液在 45 ℃下搅拌2 h,4 000 r/min离心30 min,取上清液,用 0.1 mol/L HCl调pH值至5.5,4 000 r/min离心20 min,沉淀洗涤两次后将pH调至7.0,冷冻干燥备用。
1.2.3 富硒糙米蛋白的酶解工艺
富硒糙米蛋白(控制一定的底物浓度)→调节pH→搅拌(37℃,15 min)→加酶(控制一定的时间和温度)→灭酶(90℃,10 min)→离心(8 000 r/min,15 min)→收集上清液(测定抗氧化活性及水解度)→冷冻干燥。
1.2.4 水解度(DH)测定
茚三酮比色法[14]。将酶解液稀释一定倍数后,8 000 r/min离心 15 min,取上清液2 mL,加入 pH 8.04的磷酸盐缓冲液0.5 mL和2%(W/V)的茚三酮溶液0.5 mL,摇匀,沸水浴15 min后,立即冷却至室温,定容至25 mL,摇匀,静置15 min后在波长570 nm处进行比色,以试剂空白为参比溶液。

1.2.5 总抗氧化能力(Trolox value)测定
根据总抗氧化能力(Trolox value)试剂盒(ABTS快速法)的方法测定。将酶解液稀释一定倍数后,8 000 r/min 离心 15 min,依次加入 10 μL 待测样品,20 μL过氧化物酶应用液和170 μL ABTS工作液于96孔板中,室温下反应6 min,在波长405 nm处用酶标仪读取各孔OD值,以蒸馏水为空白对照,Trolox作为标准品。

式中:Trolox value为样品的总抗氧化能力(μmol/g);cTrolox为样品相当于Trolox的浓度(mmol/mL),将OD值代入Trolox标准曲线得出;m为糙米蛋白的质量(g);V为反应液的总体积;n为稀释倍数。
1.2.6 单因素试验
胃蛋白酶、中性蛋白酶、碱性蛋白酶和风味酶4种酶对富硒糙米蛋白的酶解条件如表1所示,以水解度和总抗氧化能力为评价指标,筛选出最佳蛋白酶。
利用筛选出的蛋白酶水解富硒糙米蛋白,考察底物质量浓度 (1、3、5、7、9 g/100 mL)、pH(7.0、7.5、8.0、8.5、9.0)、温度(30、40、45、50、60 ℃)和加酶量(4 000、8 000、12 000、16 000、20 000 U/g)对水解度及抗氧化活性的影响。

表1 不同蛋白酶的水解条件Table 1 Hydrolysis conditions of different proteases
1.2.7 响应面试验设计
在单因素试验的基础上,以时间(A)、温度(B)和加酶量(C)为自变量,总抗氧化能力(Y)为响应值,设计了三因素三水平的响应面试验,因素水平编码见表2。

表2 因素水平编码Table 2 Code and level of factors chosen
1.2.8 数据处理
采用SPSS Statistics(V.21)进行单因素方差分析,Design Expert(V.8.0.6)软件进行响应面分析。试验重复3次。
2 结果与讨论
2.1 单因素试验
2.1.1 蛋白酶种类对富硒糙米抗氧化肽活性的影响
多肽的氨基酸种类与其活性密切相关,不同种类蛋白酶的作用位点具有差异性,因此需要筛选合适的蛋白酶进行酶解。选择碱性蛋白酶、中性蛋白酶、胃蛋白酶和风味酶对糙米硒蛋白进行酶解,4种蛋白酶的水解度和抗氧化活性与时间的变化关系如图1所示。风味酶的水解能力强于碱性蛋白酶和中性蛋白酶,胃蛋白酶水解能力较弱(图1A)。这主要是由于风味酶既是内切酶又是外切酶,水解产物中含有较多游离氨基酸,因此其水解度最高[15]。碱性蛋白酶水解产物的抗氧化活性略高于中性蛋白酶和风味蛋白酶,胃蛋白酶水解产物的抗氧化活性远低于其他3种酶。综合考虑糙米硒蛋白酶解产物的水解度和抗氧化活性,碱性蛋白酶最适宜制备抗氧化活性肽,胃蛋白酶不适宜用于水解糙米硒蛋白。由图1B可知,碱性蛋白酶水解产物的抗氧化活性随水解时间的增加呈现先升高后降低的趋势,其抗氧化活性在1.5 h时最高。

图1 蛋白酶种类对富硒糙米蛋白水解度及产物抗氧化活性的影响Fig.1 Effect of enzyme species on DH and antioxidant activity of hydrolysates of Se-enriched brown rice protein
2.1.2 底物浓度对富硒糙米抗氧化肽活性的影响
在pH为8.0、温度为45℃、加酶量为12 000 U/g、酶解时间2.0 h的条件下,考察底物浓度对糙米硒蛋白水解产物的抗氧化活性和水解度的影响,结果见图2。当底物浓度为3%时,糙米硒蛋白酶解产物的抗氧化活性和水解度均达到最大值,分别为14.42 μmol/g和11.55%。当蛋白浓度较低时,底物能与蛋白酶充分接触,增加底物浓度能促进多肽的生成,当底物浓度达到饱和点后,继续增加底物浓度会抑制蛋白酶的酶解效率,因此最适底物浓度为3%。张杨等[16]对蒲公英籽蛋白进行酶解时发现,随底物浓度的增加,酶解物的抗氧化能力和水解度呈现先增大后基本不变甚至下降的趋势。
2.1.3 pH值对富硒糙米抗氧化肽活性的影响
在底物浓度为5%、温度为45℃、加酶量为12 000 U/g、酶解时间2.0 h的条件下,考察pH值对糙米硒蛋白酶水解产物的抗氧化活性和水解度的影响,结果见图3。pH值会影响蛋白酶和底物蛋白的解离状态,从而影响蛋白酶与底物的结合[16]。当pH值为8.0时,碱性蛋白酶水解产物的抗氧化活性最强,水解度也最高。

图2 底物浓度对富硒糙米蛋白水解产物抗氧化活性的影响Fig.2 Effect of substrate concentration on antioxidant activity of hydrolysates of Se-enriched brown rice protein

图3 pH值对富硒糙米蛋白水解产物抗氧化活性的影响Fig.3 Effect of pH on antioxidant activity of hydrolysates of Se-enriched brown rice protein
2.1.4 加酶量对富硒糙米抗氧化肽活性的影响
在底物浓度为5%、pH值为8.0、酶解温度为45℃、酶解时间为2.0 h的条件下,考察加酶量对糙米硒蛋白酶水解产物的抗氧化活性和水解度的影响。由图4可知,当加酶量小于8 000 U/g时,糙米硒蛋白水解产物的抗氧化活性和水解度均随加酶量的增加呈显著增加的趋势。当加酶量大于8 000 U/g时,虽然水解度仍显著增加,但是抗氧化活性趋于稳定。且当加酶量大于16 000 U/g时,抗氧化活性略有下降。这是由于加酶量过高时,会导致糙米硒蛋白过度水解,抗氧化肽结构被破坏,抗氧化活性降低。因此,确定最适加酶量为4 000~8 000 U/g。
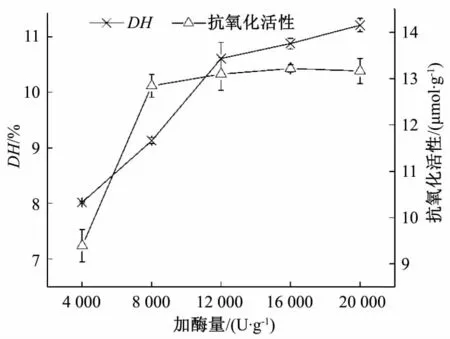
图4 加酶量对富硒糙米蛋白水解产物抗氧化活性的影响Fig.4 Effect of enzyme dosage on antioxidant activity of hydrolysates of Se-enriched brown rice protein
2.1.5 温度对富硒糙米抗氧化肽活性的影响
在底物浓度为 5%、pH值为 8.0、加酶量为12 000 U/g、,酶解时间为2 h的条件下,考察酶解温度对糙米硒蛋白酶水解产物的抗氧化活性和水解度的影响。由图5可知,酶解产物的抗氧化活性和水解度随温度的增加呈先升高后降低的趋势。在一定的温度范围内,蛋白酶的活性会随温度的升高而增加,因此水解度会呈现增强的趋势。但是当温度过高时,蛋白酶会变性失活,使酶解能力降低。当酶解温度为45℃时,糙米硒蛋白酶解产物的抗氧化活性最强,且水解度也达到最大值。张辉等[17]认为蛋白酶有一定的酶解温度范围,当温度超过蛋白酶的最适范围时,会影响酶解反应,不利于多肽生成,从而降低酶解物的抗氧化能力。

图5 温度对富硒糙米蛋白水解产物抗氧化活性的影响Fig.5 Effect of hydrolysis temperature on antioxidant activity of hydrolysates of Se-enriched brown rice protein
2.2 响应面试验
综合单因素的试验结果,选择碱性蛋白酶水解糙米硒蛋白,固定底物浓度为3%、pH值为8.0,选择酶解时间、酶解温度和加酶量为考察因素,根据Box-Behnken原理进行响应面试验,结果如表3所示。采用 Design-Expert(V.8.0.6)软件对试验结果进行多元回归拟合,得到回归方程为:
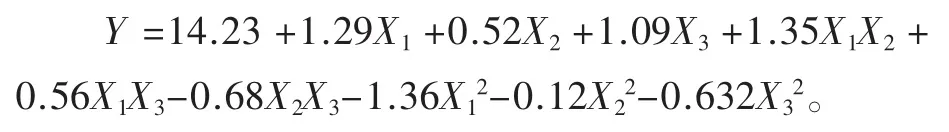
由表4可知,回归模型极显著(P=0.003 3),失拟项不显著(P=0.720 3),说明该模型的拟合度好,可靠性高;模型的决定系数R2=0.967 5,调整性决定系数R2Adj=0.909 1,表明抗氧化能力由该模型解释的可能性为90.91%,该方程能够较好地预测酶解条件对多肽抗氧化能力的影响。此外,F检验可反映各因子的贡献率,F值越大,表明对试验结果的影响越显著,由此可知,各因素对多肽抗氧化活性的影响顺序为:时间>加酶量>温度。
图6能够直观地反映各因素对抗氧化能力的影响。图6A为加酶量为零水平时,酶解时间(X1)和酶解温度(X2)的交互作用,响应曲面沿X1轴的坡度明显高于X2,说明时间的变化对抗氧化活性的影响强于温度的变化。等高线呈椭圆形说明时间与温度的交互作用非常显著。图6B是酶解温度为零水平时,酶解时间(X1)和加酶量(X3)的交互作用,随着加酶量的增加抗氧化活性先增加后趋于平缓。图 6C是酶解温度(X2)和加酶量(X3)的交互作用,响应曲面沿X3轴的坡度明显高于X1,说明时间的变化对抗氧化活性的影响更显著。
经计算得出最佳试验条件为:酶解时间2.0 h,酶解温度50℃,加酶量7 547.17 U/g。根据实际操作条件,将最佳试验条件设定为底物浓度3%、pH值 8.0、酶解时间2 h、酶解温度50℃、加酶量 7 550 U/g。在此条件下,糙米硒蛋白酶解液的抗氧化能力为 (16.16±0.22) μmol/g, 与预测值 16.27 μmol/g的相对误差为0.69%,说明通过响应面法优化得到最佳酶解条件可靠。
2.3 富硒糙米抗氧化肽与非富硒糙米抗氧化肽的活性比较
在最佳酶解条件:底物浓度3%、pH值8.0、酶解时间2 h、酶解温度50℃、加酶量7 550 U/g下对同品种的非富硒糙米蛋白进行酶解,并测定其抗氧化活性为(12.63±0.39) μmol/g,低于该条件下富硒糙米蛋白酶解产物的抗氧化活性,说明硒可以提高糙米蛋白酶解产物的抗氧化能力。Liu等[10]从富硒糙米中分离纯化出一种富硒肽(SeMet-Pro-Ser),具有较强的清除能力。但是糙米蛋白酶解产物中硒的抗氧化作用途径还有待进一步研究。

表3 响应面优化试验设计及结果Table 3 Respond surface experimental design and results

表4 回归方程各项方差分析Table 4 ANOVA analysis of regression equation

图6 因素交互作用对富硒糙米蛋白水解产物抗氧化活性的影响Fig.6 Effect of factors interaction on antioxidant activity of hydrolysates of Se-enriched brown rice protein
3 结论
本试验采用胃蛋白酶、中性蛋白酶、碱性蛋白酶和风味酶水解糙米硒蛋白,并测定酶解液的抗氧化活性,研究发现碱性蛋白酶水解产物的抗氧化活性略高于中性蛋白酶和风味酶,胃蛋白酶水解产物的抗氧化活性最差。在单因素的基础上采用响应面法对酶解时间、酶解温度和加酶量3个因素进行优化,得到的模型可靠,拟合度良好。各因素对糙米硒蛋白酶解液抗氧化活性影响的主次顺序为:时间>加酶量>温度。最适酶解条件为底物浓度3%、pH 8.0、时间2.0 h、温度50℃、加酶量7 550 U/g。该条件下所得酶解液的抗氧化能力为(16.16±0.22) μmol/g,与预测值相近,该模型能够用于预测糙米硒蛋白酶解液的抗氧化活性。富硒糙米蛋白酶解产物具有显著的抗氧化活性,可用于食品、医药等领域,为消费者提供新型食疗保健产品。
[1]ZHANG J,ZHANG H,WANG L,et al.Isolation and identification of antioxidative peptides from rice endosperm protein enzymatic hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS/MS[J].Food Chemistry,2010,119(1):226-234.
[2]赵谋明,任娇艳.食源性生物活性肽结构特征与生理活性的研究现状与趋势[J].中国食品学报,2011,11(9):69-81.
[3]WATTANASIRITHAM L,THEERAKULKAIT C,WICKRAMASEKARA S,et al.Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J].Food Chemistry,2016,192:156-162.
[4]AGRAWAL H,JOSHI R,GUPTA M.Isolation,purification and characterization of antioxidative peptide of pearl millet(Pennisetum glaucum)protein hydrolysate [J].Food Chemistry,2016,204:365-372.
[5]NAJAFIAN L,BABJI A S.Production of bioactive peptides using enzymatic hydrolysis and identification antioxidative peptides from patin(Pangasius sutchi) sarcoplasmic protein hydolysate [J].Journal of Functional Foods,2014,9(1):280 289.
[6]李艳红,刘坚,张涛,等.酶解鹰嘴豆蛋白制备抗氧化肽工艺优化研究[J].农业工程学报,2008,24(1):268-273.
[7]WANG L,HUANG J,CHEN Y,et al.Identification and characterization ofantioxidant peptides from enzymatic hydrolysates of duck meat[J].Journal of Agricultural and Food Chemistry,2015,63(13):3437-3444.
[8]JANGHL,LICEAGAAM,YOONKY.Purification,characterization and stability of an antioxidant peptide derived from sandfish(Arctoscopus japonicus)protein hydrolysates[J].Journal of Functional Foods,2016,20:433-442.
[9]STEINBRENNER H,SPECKMANN B,KLOTZL O.Selenoproteins:Antioxidant selenoenzymes and beyond [J].Archives of Biochemistry&Biophysics,2016,595:113-119.
[10]LIU K,ZHAO Y,CHEN F,et al.Purification and identification of Secontaining antioxidative peptides from enzymatic hydrolysates of Seenriched brown rice protein [J].Food Chemistry,2015,187:424-430.
[11] 刘大川,周俊梅,张寒俊.富硒菜籽蛋白肽的制备工艺研究[J].中国粮油学报,2006,21(3):245-249.
[12]LIU K,CHEN F,YAN Z,etal.Selenium accumulation in protein fractions during germination of Se-enriched brown rice and molecular weights distribution of Se-containing proteins [J].Food Chemistry,2011,127(4):1526-1531.
[13] YUE L,FANG L,LUO C,et al.Functional properties of the Maillard reaction products of rice protein with sugar[J].Food Chemistry,2009,117(1):69-74.
[14] 郭兴凤.蛋白质水解度的测定[J].中国油脂,2000(6):176-177.
[15] LIN Z,YIJUN Z,CHUQIAO X,et al.Mechanism of the discrepancy in the enzymatic hydrolysis efficiency between defatted peanut flour and peanut protein isolate by Flavorzyme[J].Food Chemistry,2015,168:100-106.
[16] 张杨,胡磊,汪少芸,等.响应面优化酶解法制备蒲公英籽蛋白抗氧化肽工艺[J].食品工业科技,2016,37(5):258-262.
[17] 张辉.超声辅助酶解制备麦麸抗氧化肽工艺的研究[J].食品科技,2016(1):219-224.
PREPARATION OF ANTIOXIDANT PEPTIDES FROM SE-ENRICHED BROW RICE BY ENZYMATIC HYDROLYSIS
ZHAO Shuang1,2,LIU Kunlun1,2,CHEN Fusheng2
(1.The Key Lab of Conversion and Utilization of Grain Resource of Henan Province;2.College of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
Antioxidant peptides from Se-enriched brown rice were prepared by enzymatic hydrolysis method.Effects of six factors including enzyme species,hydrolysis time,hydrolysis temperature,substrate concentration,pH and enzyme dosage on the antioxidant activities of hydrolysates of Se-enriched brown rice protein were studied in this work. Response surface methodology was used to optimize the enzymolysis conditions with the total antioxidant capacity (Trolox valve)as evaluation index,based on the results of the single factor experiments.The results showed that alkaline protease was suitable for producing antioxidant peptides from Se-enriched brown rice. The optimal enzymolysis conditions were as follows: substrate concentration of 3% ,pH value of 8.0,enzymolysis temperature of 50 ℃,enzymolysis time of 2.0 h and enzyme dosage of 7 550 U/g protein,under which the Trolox valve was up to (16.16±0.22) μmol/g. The application of antioxidant peptides in the food industry especially in functional food plays a positive role to keep the food quality and improve the antioxidation function of the organism.
Se-enriched brown rice; antioxidant peptides; response surface methodology; enzymolysis
TS201.2 文献标志码:B
1673-2383(2017)05-0005-06
http://kns.cnki.net/kcms/detail/41.1378.N.20171030.0936.004.html
网络出版时间:2017-10-30 9:36:32
2017-02-13
国家自然科学基金项目(31601417;U1404333);河南省科技攻关计划项目(162102110059);河南省省属高校基本科研业务费专项(2014YWQQ03)
赵爽(1991—),女,河南确山人,硕士研究生,研究方向为植物蛋白资源开发与利用。
*通信作者

