羊耳菊水提物对肺炎克雷伯菌所致重症肺炎大鼠的抗炎效果及机制
李凤玲
(平顶山市中医医院,平顶山,467000)
羊耳菊水提物对肺炎克雷伯菌所致重症肺炎大鼠的抗炎效果及机制
李凤玲
(平顶山市中医医院,平顶山,467000)
目的:探讨羊耳菊水提物对肺炎克雷伯菌所致重症肺炎大鼠的抗炎效果及机制。方法:采用肺炎克雷伯菌诱导大鼠重症肺炎模型,羊耳菊水提物(6,12和24 g/kg体重)灌胃治疗,地塞米松(1.04 mg/kg体重)为阳性对照,6 d后测定支气管肺泡灌洗液中白细胞和中性粒细胞以及肺组织TNF-α,IL-1β,IL-6水平及MPO的活性,Western-blot法检测肺组织NF-κBp65、p-p38MAPK蛋白水平。结果:不同剂量羊耳水提物能改善动脉血气指标,减少白细胞及中性粒细胞的水平,降低肺组织TNF-α、IL-1β、IL-6、MPO水平及NF-κBp65、p-p38MAPK蛋白水平。结论:羊耳菊水提物能通过阻断p38MAPK和NF-κBp65信号通路改善肺炎克雷伯菌所致大鼠重症肺炎的炎性反应,可成为一种天然有效的抗炎药物。
肺炎;肺炎克雷伯菌;羊耳菊;核因子-κBp65;p-p38MAPK
羊耳菊Inulacappa(Buch.-Ham.)DC.为菊科旋覆花属植物[1-2],主要分布在我国四川、云南、贵州、广西、广东、江西、湖南等省份,全草用药,含有丰富的黄酮类和萜类化合物,以及大量的咖啡酰基奎宁酸物质[3-4],具有较好的抗菌、消炎和镇痛作用[5],但具体机制还不太明确。本研究采用羊耳菊水提物治疗肺炎克雷伯菌所致大鼠重症肺炎,探讨其抗炎效果及机制,为羊耳菊的开发提供科学依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD雄性大鼠,体重(200±25)g,由河南实验动物中心提供,许可证号:SCXK(豫)2010-0002,分笼饲养,饲料充足饮水不限,室温20~25 ℃,适应环境5 d后用于实验。
1.1.2 药物 羊耳菊全草采自怀化市康龙自然保护区,经漯河医专第二附属医院主任药师鉴定为菊科旋覆花属植物,植物材料进行挑选、洗净在60 ℃温度下烘干,粉碎过60目筛备用。肺炎克雷伯菌临床株由漯河医专分子生物学实验室提供,分离于慢性支气管炎急性发作患者的痰液。接种前生理盐水稀释至适当浓度(相当于1.2×10 CFU/mL)。
1.1.3 试剂与仪器 TNF-α,IL-1β,IL-6试剂盒(R&D,美国),MPO检测试剂盒(南京建成生物有限公司),抗体NF-κBp65、p-p38MAPK、β-actin(美国Sigma公司)。血气分析仪(美国NOVA STPM3血气分析仪);T-1800血球分析仪(日本东亚公司);EXL800型酶标仪(BioTek,美国)。
1.2 方法
1.2.1 羊耳菊水提物的制备 准确称取干燥粉羊耳菊3 kg,按照固液1∶10的比例加入水浸泡24 h后,加热回流提取2 h,提取2次,多层纱布趁热过滤,上清液合并,并浓缩至含生药3 g/mL,4 ℃冷藏保存,使用前稀释成不同浓度。
1.2.2 给药剂量 采用最大耐受剂量法,预实验对大鼠进行急性经口毒性试验,经测得最大耐受量96 g/kg,用其1/4、1/8、1/16给药。地塞米松:60 kg体重成人日用量l0 mg,每千克体重用量为10/60=0.166 7 mg/kg。大鼠用量为0.166 7×6.25=1.04 mg/kg。
1.2.3 分组与模型制备 60只SD大鼠随机分成6组,每组10只,即:正常组、模型组、地塞米松组(1.04 mg/kg)、羊耳菊水提物组(6、12、24 g/kg),所有大鼠经麻醉后,颈部消毒、备皮无菌操作,暴露大鼠上段气管,正常组大鼠采用1 mL注射器经气管滴入生理盐水0.3 mL,其余滴入菌液0.3 mL,接种后立即竖立大鼠固定台.使大鼠保持直立位约20 s,以保证接种菌液因重力作用而入肺。当大鼠出现反应迟钝、呆滞、呼吸急促,并伴有严重的低氧血症,SaO2<90%或动脉氧分压≤8 kPa确诊为重症肺炎[8]。对照组和模型组每天给予生理盐水20 mL/kg灌胃1次,地塞米松组和羊耳菊水提物组按照20 mL/kg体重灌胃1次,连续6 d。
1.2.4 肺炎大鼠血气分析 全自动血气分析仪检测血液中的动脉血二氧化碳分压(PaCO2)、二氧化碳含量(CO2)、动脉氧分压(PaO2)、动脉血氧饱和度(SaO2)。
1.2.5 苏木精-伊红(HE)染色观察肺组织病理学变化 取大鼠左肺上叶,4 ℃生理盐水冲洗,滤纸拭干,10%中性甲醛溶液固定,石蜡包埋,常规切片,HE染色,光学显微镜下观察肝组织切片的病理变化。
1.2.6 支气管肺泡灌洗液中白细胞及中性粒细胞检测 第6天给药24 h后,戊巴比妥钠50 mg/kg,ip麻醉。扎紧左主支气管,输液管套管插入主支气管3~4 cm并固定,注入生理盐水10 mL于肺腔,连续翻动右肺组织,抽回再灌注3次,抽出灌洗液。共灌洗3次,收集总灌洗液,计数白细胞和中性粒细胞。
1.2.7 肺组织部分生化指标的测定 取左肺下叶200 mg冰浴匀浆制成10%溶液,4 ℃、3 000 r/min离心10 min,取上清液。酶联免疫吸附法测定TNF-α,IL-1β,IL-6水平。按试剂盒说明书测定方法测定MPO活性。
1.2.8 Western-blot检测肺组织NF-κBp65、p-p38MAPK蛋白水平 常规方法提取肺组织总蛋白,考马斯亮蓝法测定总蛋白的量。加样行10%SDS聚丙烯酰氨凝胶电泳,PVDF膜转膜2 h,5%山羊血清(PBS稀释)封闭,加入1∶500稀释(1% BSA-PBS稀释)的NF-κBp65、p-p38MAPK一抗,1∶500稀释的β-actin,4 ℃孵育过夜,加入辣根过氧化物酶标记二抗(1∶3 000)和β-actin二抗(1∶5 000)及DAB显色试剂盒。行ECL反应,显色。Tannon凝胶成像系统拍照,GIS凝胶成像分析软件分析,以同一泳道NF-κBp65、p-p38MAPK和β-actin条带灰度值比反映蛋白表达水平。

2 结果
2.1 羊耳菊水提物对肺炎大鼠血气指标的影响 与正常组比较,模型组大鼠的PaCO2值明显高于正常组(P<0.01),而PaCO2浓度,PaO2值和SaO2的水平明显低于正常组(P<0.01)。与模型组大鼠比较,羊耳菊水提物中高剂量组PaCO2水平明显降低(P<0.05),CO2、PaO2和SaO2水平明显增加(P<0.05)。见表1。
2.2 肺组织病理学变化 正常组大鼠肺组织无异常发生,结构清晰,无炎性反应和浸润的发生。模型组肺泡壁加厚,并伴有大量的中性粒细胞,肺泡间质出现水肿和肺泡壁间质浸润。地塞米松组和羊耳菊水提物组浸润明显减轻,部分出现少量的中性粒细胞、淋巴细胞以及脱落坏死的上皮细胞。见图1。

图1 大鼠肺组织病理学变化(×200)
2.3 羊耳菊水提物对肺炎大鼠支气管肺泡灌洗液中白细胞和中性粒细胞及肺组织MPO活性的影响
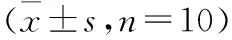
表1 羊耳菊水提物对肺炎大鼠血气分析的变化
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
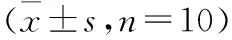
表2 羊耳菊水提物对肺炎大鼠各组外周血的白细胞和中性粒细胞变化
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
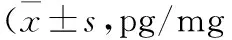
表3 羊耳菊水提物对肺炎大鼠TNF-α,IL-1β和IL-6的影响蛋白,n=10)
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
与正常组比较,模型组大鼠支气管肺泡灌洗液中中性粒细胞、白细胞水平和肺组织中的MPO活性明显增加,差异有统计学意义(P<0.01),与模型组比较,地塞米松组和羊耳菊水提物不同剂量组的大鼠的支气管肺泡灌洗液中的白细胞和中性粒细胞及肺组织中的MPO明显下降,差异有统计学意义(P<0.05)。见表2。
2.4 羊耳菊水提物对肺炎大鼠肺组织TNF-α,IL-1β,IL-6的影响 与正常组比较,模型组大鼠中肺组织的TNF-α,IL-1β,IL-6水平明显增加,差异均有统计学意义(P<0.01)。与模型组比较,地塞米松和羊耳菊水提物中高剂量组大鼠肺组织的TNF-α,IL-1β,IL-6水平明显下降,差异均有统计学意义(P<0.05)。见表3。
2.5 羊耳菊水提物对肺炎大鼠肺组织NF-κBp65、p-p38MAPK蛋白水平的影响 与正常组比较,模型组织NF-κBp65、p-p38MAPK蛋白水平明显升高,差异有统计学意义(P<0.01)。与模型组比较,地塞米松组和羊耳菊水提物不同剂量组均能明显降低NF-κBp65、p-p38MAPK蛋白水平,差异均有统计学意义(P<0.01)。见图2、表4。

图2 羊耳菊水提物对肺炎大鼠肺组织NF-κBp65、p-p38MAPK蛋白水平的影响

组别NF-κBp65p-p38MAPK正常组0.58±0.120.55±0.07模型组1.13±0.14**0.97±0.12**地塞米松组(1.04mg/kg)0.63±0.06△△0.61±0.09△△羊耳菊水提物(6g/kg)0.91±0.03△0.85±0.05△羊耳菊水提物(12g/kg)0.82±0.05△△0.74±0.05△羊耳菊水提物(24g/kg)0.71±0.08△△0.65±0.07△△
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
3 讨论
重症肺炎是呼吸科临床常见的疾病,已经严重威胁人类的健康,每年大发病率达到1.2%,正确的制备肺炎模型对该病的发病机制和临床研究有重要意义。本研究采用从肺炎患者的唾液中分离得到的肺炎克雷伯菌临床株经培养后建立大鼠急性重症肺炎模型,大鼠的临床表现与重症肺炎患者在呼吸系统的临床表现相符[6]。血气分析中某些因子水平通常作为肺炎程度的评价体系最重要的因素,SaO2<90%或动脉氧分压<8 kPa基本可以确定为重症肺炎[7],本实验制备大鼠肺炎不经过任何治疗6 d后发现大鼠的SaO2仅有(58.48±7.87)%,而PaO2仅有(4.75±0.75)kPa,说明肺炎克雷伯菌诱导大鼠肺炎完全有可能恶化为重症肺炎,而且术后处死的模型组大鼠白细胞计数、中性粒细胞计数及肺组织中的MPO活性明显增加较为明显,通过病理组织学观察显示,模型组肺泡壁加厚,并伴有大量的中性粒细胞,肺泡间质出现水肿和肺泡壁间质浸润。我们认为达到预定诊断标准的大鼠发病症状与临床上重症肺炎患者的发病情况比较类似,可以认为该方法成功建立了重症肺炎大鼠模型。
TNF-α作为一种具有多种生物学效应的细胞因子,在各种疾病的发展中有着重要的特殊地位[8],主要由激活的单核-巨噬细胞分泌,参与炎性反应和免疫应答,一定量的TNF-α对机体具有抗感染和增强免疫力等作用,但大量的TNF-α持续释放会诱导中性粒细胞局部侵润,引起局部炎性反应,使机体器官甚至多系统受损,TNF-α作为早期启动炎性反应递质连锁反应的因子,可激活其他体内炎性反应因子IL-1β,IL-6等的释放。TNF-α,IL-1β和IL-6等大量炎性反应因子的大量释放还诱导T细胞、B细胞、NK细胞核单核细胞等使其功能活性增强,加强感染症状,使得外周血液中的白细胞和中性粒细胞的大量产生。通过羊耳菊水提物治疗发现,不同剂量羊耳菊水提物能有效抑制TNF-α,IL-1β和IL-6的释放和组织白细胞和中性粒细胞的大量产生,并且促使炎性反应减退从而达到治疗肺炎的效果,并呈现剂量依赖性[9-12]。而且本研究中利用羊耳菊水提物不同剂量治疗6 d后,发现羊耳菊水提物能明显改善血流动力学和血气分析中的因子水平,这也进一步说明羊耳菊水提物治疗急性肺损伤效果明显。
研究显示,炎性反应递质的表达和MAPKs与NF-κB信号级联途径密切相关。NF-κB为一种能与基因的启动子或增强子特异性结合并启动转录的一组转录调节因子,多数为p50和p65组成的同源或异源二聚体,调控细胞的炎性反应因子基因的表达,其活性受到IKB的抑制。而MAPKs信号通路的ERK、JNK和p38MAPK等家族成员均可调控炎性反应水平,通过作用于各自不同的底物,调控TNF-α,IL-1β和IL-6等细胞因子的表达。研究显示,MAPKs与NF-κB信号通路中家族成员异常表达与基因表达层面发生变异存在一定的联系,而炎性反应因子的旁分泌同样是其诱发的因素之一[13]。研究表明,通过诱导炎性反应因子自分泌可激活MAPKs与NF-κB信号通路中家族成员的表达,而MAPKs与NF-κB信号通路中家族成员的激活反过来更刺激了炎性反应因子的产生及分泌,形成了一条MAPKs与NF-κB信号正反馈持续激活的环路[14]。因此,MAPKs与NF-κB信号通路的阻断能有效的缓解急性肺损伤。本实验结果显示,羊耳菊水提物能有效的降低NF-κBp65、p-p38MAPK蛋白水平,并呈现剂量依赖性。MAPKs信号通路中,p38MAPK水平与NF-κB的激活关系非常密切,其中p38MAPK的表达水平下降,NF-κB的活性也会受到一定程度的影响。因此,MAPKs与NF-κB信号级联途径都是急性肺损伤中抗炎的重要环节,为阻断炎性反应的重要靶点。
总之,羊耳菊水提物对肺炎克雷伯菌所致大鼠重症肺炎抗炎效果明显,能有效的改善肺功能。其中p38MAPK和NF-κBp65信号通路是羊耳菊水提物抗炎作用的主要靶点,可以为羊耳菊的开发提供新的研究路径。
[1]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1977:698.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:627.
[3]中国科学院《中国植物志》编写委员会.中国植物志(第75卷)[M].北京:科技出版社,1979:271.
[4]关焕玉,兰燕宇,廖尚高,等.羊耳菊中咖啡酰基奎宁酸类化学成分研究[J].天然产物研究与开发,2014,26(12):1948-1952.2014,26(12):1948-1952.
[5]莫佳佳,徐慕蝶,杨丹丹,等.侗族药羊耳菊醇提物抗炎镇痛作用的实验研究[J].中国实验方剂学杂志,2012,18(21):258-260.
[6]陈业民,黄文杰,李胜利,等.肺炎克雷伯菌致大鼠重症肺炎模型的建立[J].第一军医大学学报,2005,25(12):1498-1502.
[7]卢伟波,赵子文,钟维农,等.肺炎克雷伯杆菌致大鼠重症肺炎模型的改良与评估[J].中国病理生理杂志,2013,29(3):571-576.
[8]Petronilho F,deSouza B,Vuolo F,et al.Protective effect of gastrin-releasing peptide receptor antagonist in carrageenan-induced pleural inflammation in rats[J].Inamm Res,2010,59(9):783-789.
[9]孙雪东,董金芳,陆地,等.支气管肺泡灌洗液中的炎症因子在呼吸机相关性肺炎患者中的动态变化[J].中华医院感染学杂志,2010,20(15):2189-2191.
[10]王开富,萧伟,王振中,等.热毒宁注射液的解热抗炎作用及其机制[J].中国医院药学杂志,2013,33(23):1918-1922.
[11]Li JL,Ng LG.Peeking into the secret life of neutrophils[J].Immunol Res,2012,53(1-3):168-181.
[12]白静慧,朱相宇,郑丽媛,槲皮素对脓毒症急性肺损伤大鼠肺组织NF-κB表达的影响[J].解剖科学进展,2014,20(1):31-34.
[13]张利鹏,赵焱,刘国娟,等.乌司他丁通过干预p38MAPK/ERK信号通路减轻脓毒症性肺损伤[J].中国药理学通报,2016,32(9):1311-1316.
[14]刘丹丹,曹纲,张琦,等.三叶青黄酮经p38MAPK和NF-κB途径抑制老年小鼠急性肺损伤[J].中国药理学通报,2015,31(12):1725-1730.
Anti-inflammatoryEffectofInulaCappaAqueousExtractonKlebsiellaPneumoniae-inducedSeverePneumoniainRats
Li Fengling
(ChineseMedicineHospital,Pingdingshan467000,China)
Objective:To observe anti-inflammatory effect of Inula cappa aqueous extract on Klebsiella pneumoniae-induced severe pneumonia in rats.MethodsKlebsiella pneumoniae was used to induce ultrasonic severe pneumonia model in rats.Different doses of Inula Cappa aqueous extract (6,12 and 24 g/kg BW) were orally given,and take dexamethasone (1.04 mg/kg weight) as the comparison drug to conduct blood gas analysis,including peripheral white blood cells,neutrophils,TNF-alpha,IL-1 beta,IL-6,LDH and MPO activity in lung tissue.ResultsDifferent doses of Inula Cappa aqueous extract can improve the arterial blood gas index,reduce the content of white blood cells and neutrophils,decrease the content of TNF-α,IL-1β,IL-6,MPO and level of NF-KBp65 and p-p38MAPK.ConclusionInula Cappa aqueous extract can improve inflammation of severe pneumonia induced by Klebsiella pneumoniae by blocking p38 MAPK and NF-KBp65 signaling pathways.It can be taken as a natural and effective anti-inflammatory drug.
Inula Cappa; Klebsiella; Pneumonia; Extract; NF-KBp65; p-p38MAPK
李凤玲(1969.08—),女,本科,副主任中药师,研究方向:中药药理,E-mail:314692241@qq.com
R284;R256.4
A
10.3969/j.issn.1673-7202.2017.10.041
(2016-11-23收稿 责任编辑:杨觉雄)

