离子抑制色谱法测定伊班膦酸钠原料药中的有关物质
李欣,陈红,张亿(成都市食品药品检验研究院,成都610045)
离子抑制色谱法测定伊班膦酸钠原料药中的有关物质
李欣*,陈红#,张亿(成都市食品药品检验研究院,成都610045)
目的:采用离子抑制色谱法测定伊班膦酸钠原料药中的有关物质。方法:色谱柱为Dionex IonPac AS11-HC,流动相为氢氧化钾溶液(梯度洗脱),流速为1.1 mL/min,柱温为45℃,进样量为20 μL,检测器为抑制型电导检测器,检测器温度为35℃。结果:亚磷酸盐、杂质Ⅰ、磷酸盐检测质量浓度线性范围分别为3.08~30.83 μg/mL(r=0.999 9)、2.84~28.43 μg/mL(r=0.999 1)、2.95~29.52 μg/mL(r=0.999 9);定量限分别为2.47、56.7、3.31 ng,检测限分别为0.75、17.2、1.0 ng;精密度、稳定性、重复性试验的RSD<4.0%;加样回收率分别为101.49%~103.57%(RSD=0.7%,n=9)、100.00%~104.85%(RSD=1.8%,n=9)、101.35%~104.08%(RSD=0.9%,n=9)。结论:该方法简便、准确、灵敏,适用于测定伊班膦酸钠原料药中的有关物质。
离子抑制色谱法;伊班膦酸钠;有关物质;亚磷酸盐;杂质Ⅰ;磷酸盐
伊班膦酸钠是新一代双膦酸盐类药物,化学名为3-(N-甲基-N-戊基)胺基-1-羟基丙烷-1,1-双磷酸单钠盐一水合物,临床主要用于治疗伴有或不伴有骨转移的恶性肿瘤引起的高钙血症和绝经后妇女的骨质疏松症[1-3]。《中国药典》《欧洲药典》《美国药典》均未收载伊班膦酸钠。该药在我国现有质量标准为国家药品标准WS1-(X-250)-2003Z,其中有关物质检查项下采用剩余滴定法测定亚磷酸盐,采用比色法测定游离磷酸盐[4];也有报道采用比色分析法、高效液相色谱-示差折光检测法等测定伊班膦酸钠原料药中的有关物质[5-7],但是上述各方法均专属性较差、操作费力,且易受辅料干扰,步骤烦琐。鉴于此,笔者采用离子抑制色谱法建立了测定伊班膦酸钠原料药中有关物质的方法,以期为完善该原料药的质量标准提供参考。
1 材料
1.1 仪器
ICS-3000型离子色谱仪,包括自再生抑制器、淋洗液发生器、电导检测器(美国Dionex公司);CAP225D型电子天平(瑞士Mettler-Toledo公司);Milli2Q型去离子水发生器(美国Millipore公司)。
1.2 药品与试剂
伊班膦酸钠原料药(A厂,批号:101011517、102011517、010614);伊班膦酸钠对照品(批号:58113,纯度:99.84%)、杂质Ⅰ对照品(批号:IBD.01.01,纯度:99.7%)均购自波兰Pharmaceutical Works POLPHARMA S.A.公司;磷酸氢二钠对照品(德国Merck公司,批号:F1696586,纯度:99.5%);亚磷酸对照品(德国Sigma-Aldrich公司,批号:MKBS4781V,纯度:100.0%);氢氧化钾为分析纯,水为去离子水。
2 方法与结果
2.1 色谱条件
色谱柱:Dionex IonPac AS11-HC(250 mm×4.0 mm,9µm);流动相:氢氧化钾溶液,梯度洗脱(洗脱程序见表1);流速:1.1 mL/min;柱温:45℃;进样量:20 μL;检测器:抑制型电导检测器;检测器温度:35℃;检测方式:抑制电导检测;抑制器:Dionex ASRS 4-mm;抑制电流:109 mA;自动进样器温度:25℃。
2.2 溶液的制备
2.2.1 混合对照品溶液精密称取磷酸氢二钠对照品46.20 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,得磷酸盐对照品贮备液;精密称取亚磷酸对照品32.76 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,得亚磷酸盐对照品贮备液;精密称取伊班膦酸钠对照品31.98 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,得伊班膦酸对照品贮备液。分别精密量取上述单一对照品贮备液各2 mL,置于同一50 mL量瓶中,加水定容,摇匀,得混合对照品贮备液。精密称取杂质Ⅰ对照品11.88 mg,置于100 mL量瓶中,加水溶解并定容,摇匀,得杂质Ⅰ对照品贮备液。分别精密量取上述混合对照品贮备液和杂质Ⅰ对照品贮备液各3 mL,置于同一25 mL量瓶中,加水定容,摇匀,即得。

表1 梯度洗脱程序Tab 1 Gradient elution procedure
2.2.2 供试品溶液取样品适量,加水溶解,制成每1 mL中约含伊班膦酸10 mg的供试品溶液。
2.2.3 空白对照溶液取去离子水作为空白对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液、空白对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,各成分均能达到基线分离,分离度均>2.1;理论板数以伊班膦酸峰计为6 836,保留时间为48 min。结果表明,其他成分对测定不干扰。
2.4 破坏性试验
(1)酸破坏样品溶液:取样品(批号:101011517)100 mg,置于10 mL量瓶中,加1.0 mol/L盐酸溶液1.0 mL,水浴(37℃)1 h,放至室温,加1.0 mol/L氢氧化钠溶液调节至中性,加水定容,摇匀,即得。(2)碱破坏样品溶液:取样品(批号:101011517)100 mg,置于10 mL量瓶中,加1.0 mol/L氢氧化钠溶液1.0 mL,水浴(37℃)1 h,放至室温,加1.0 mol/L盐酸溶液调节至中性,加水定容,摇匀,即得。(3)氧化破坏样品溶液:取样品(批号:101011517)100 mg,置于10 mL量瓶中,加30%过氧化氢溶液1.0 mL,水浴(37℃)1 h,放至室温,加水定容,摇匀,即得。(4)高温破坏样品溶液:取样品(批号:101011517)100 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,水浴(100℃)2 h,放至室温,即得。(5)光照破坏样品溶液:取样品(批号:101011517)100 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,置于4 500 lx强光下照射48 h,即得。分别取上述各破坏样品溶液适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图2。由图2可知,破坏性试验分解产生的杂质均能与主成分峰完全分离,互不干扰,说明本方法专属性好,能够满足测定要求。
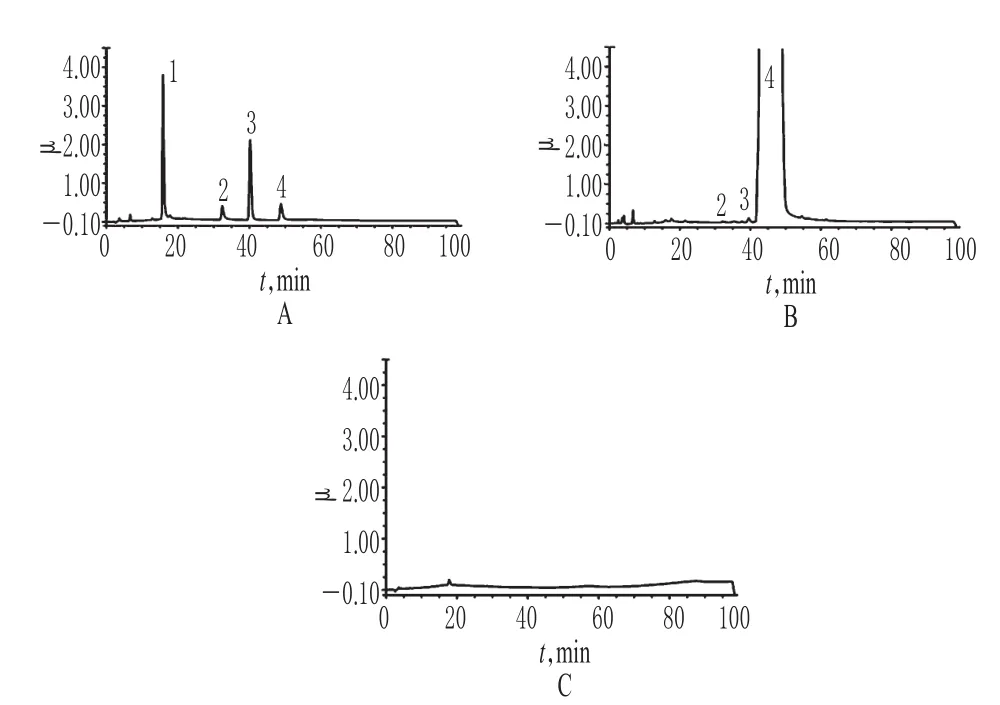
图1 系统适用性试验离子抑制色谱图Fig 1 Ion suppression chromatograms of system suit ability test
2.5 线性关系考察
分别精密量取“2.2.1”项下混合对照品溶液0.6、2.1、3.0、4.0、6.0 mL,置于25 mL量瓶中,加水定容,摇匀,即得系列混合对照品溶液。取上述系列混合对照品溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。以待测有关物质质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得亚磷酸盐回归方程为y=0.102 9x-0.048 2(r=0.999 9)、杂质Ⅰ回归方程为y=0.028 7x-0.075 4(r=0.999 1)、磷酸盐回归方程为y=0.089 5x-0.000 8(r=0.999 9)。结果表明,亚磷酸盐、杂质Ⅰ、磷酸盐检测质量浓度线性范围分别为3.08~30.83、2.84~28.43、2.95~29.52 μg/mL。
2.6 定量限(LOQ)与检测限(LOD)考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得LOQ;当信噪比为3∶1时,得LOD。结果,亚磷酸盐、杂质Ⅰ、磷酸盐的LOQ分别为2.47、56.7、3.31 ng,LOD分别为0.75、17.2、1.0 ng。
2.7 精密度试验
取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,亚磷酸盐、杂质Ⅰ、磷酸盐峰面积的RSD分别为0.5%、3.6%、0.3%(n=6),表明仪器精密度良好。
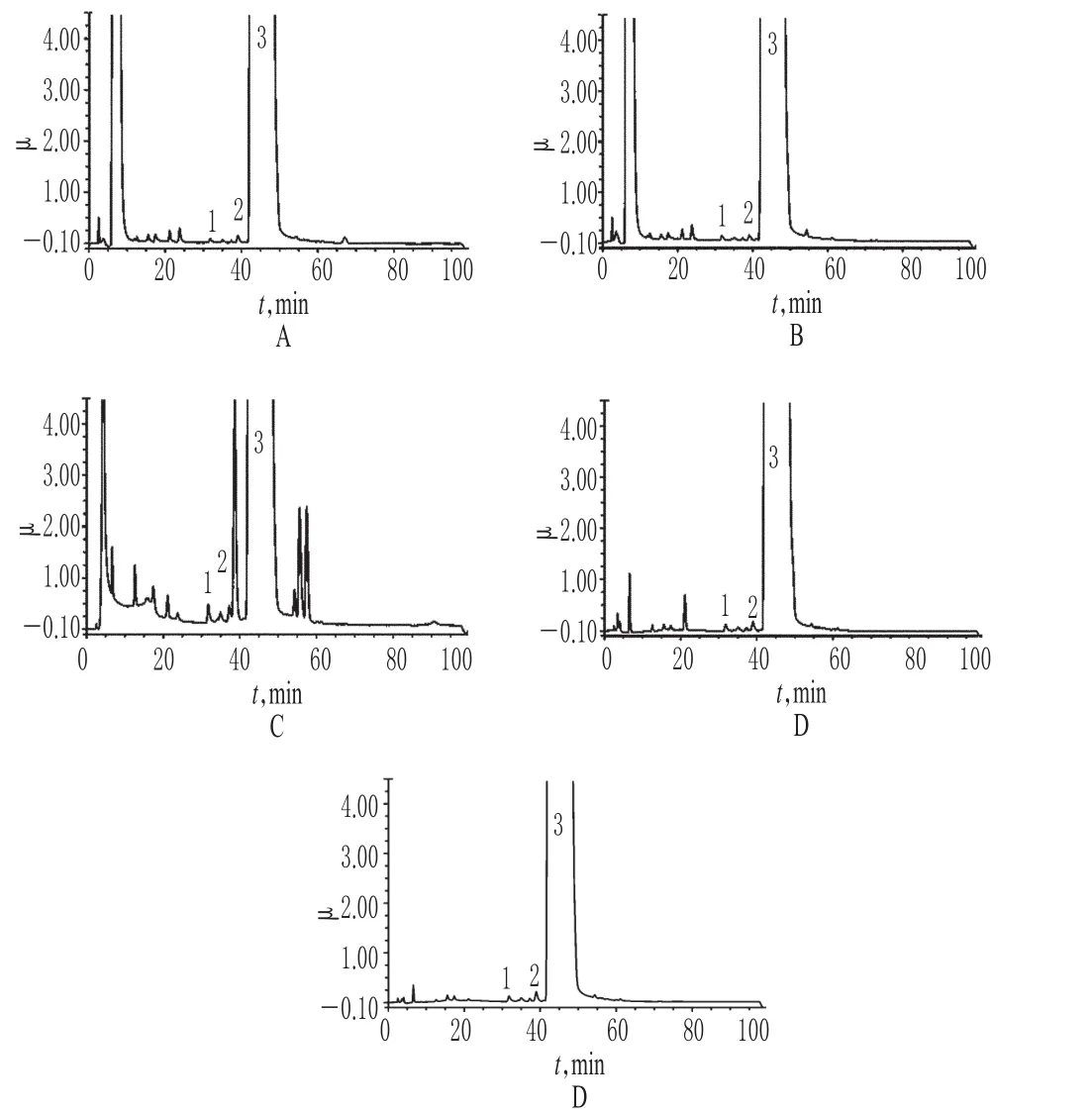
图2 破坏性试验离子抑制色谱图Fig 2 Ion suppression chromatograms of destructive test
2.8 稳定性试验
取样品(批号:101011517)适量,按“2.2.2”项下方法制备供试品溶液,分别于室温下放置0、2、10、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,亚磷酸盐未检出,只检出杂质Ⅰ和磷酸盐,其峰面积的RSD分别为2.7%、1.1%(n=5),表明供试品溶液在室温下放置24 h内稳定性良好。
2.9 重复性试验
取样品(批号:101011517)适量,共6份,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进行测定,记录峰面积。结果,亚磷酸盐未检出,杂质Ⅰ和磷酸盐峰面积的RSD均为0.06%(n=6),表明本方法重复性良好。
2.10 加样回收率试验
取样品(批号:101011517)适量,共9份,分别加入低、中、高质量的待测有关物质对照品,各置于10 mL量瓶中,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.11 样品有关物质测定
取3批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按外标法计算有关物质的量,结果见表3(注:“-”表示未检出)。

表2 加样回收率试验结果(n=9)Tab 2 Results of recovery tests(n=9)
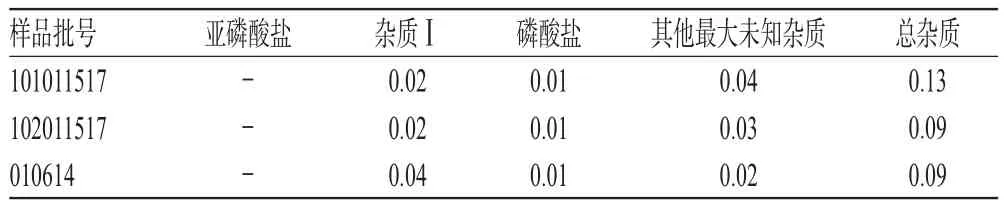
表3 样品有关物质测定结果(n=3,%)Tab 3 Results of determination related substance of samples(n=3,%)
3 讨论
3.1 梯度洗脱方式的选择
由于伊班膦酸钠原料药中存在较多的阴离子,故采用梯度洗脱的方式[8-10],即改变流动相中氢氧化钾溶液的浓度,使各杂质之间、杂质与主成分之间分离度均能达到要求;且在预试验中发现,当氢氧化钾溶液的浓度梯度在45 min内由初始的10 mmol/L增加至30 mmol/L时,亚磷酸盐、杂质Ⅰ、磷酸盐与主成分峰之间能够达到分离要求,各阴离子峰之间均无干扰。
3.2 检测方式的选择
由于亚磷酸盐、杂质Ⅰ和磷酸盐均无强紫外吸收[11],其本身也无电化学活性,故选择电导检测方式。该检测方式具有灵敏度高、选择性好、线性范围宽等优点。本试验以氢氧化钾溶液为流动相,采用阴离子交换-抑制电导方式进行检测,不仅可以得到很低的背景电导,提高检测灵敏度,而且样品前处理简单,只需溶解稀释即可进样分析[12-15]。
3.3 杂质Ⅰ的计算及系统适用性溶液的制备
由于杂质Ⅰ对照品不易得,在计算时可采取加校正因子的主成分自身对照法,以节约检验成本,同时使该检验方法具有普遍适用性。所以本试验只用少量杂质Ⅰ对照品制备混合对照品溶液。又由于混合对照品溶液中已含有主成分,因此本试验不单独制备系统适用性溶液。
综上所述,本方法简便、准确、灵敏,适用于测定伊班膦酸钠原料药中的有关物质。
[1] 关素梅,张勇.负荷量伊班膦酸钠治疗肺癌骨转移的临床观察[J].中国药房,2011,22(4):338-339.
[2] 包丽华,林华,李永军,等.伊班膦酸钠和阿仑膦酸钠对绝经后骨质疏松的干预研究[J].中国骨质疏松杂志,2011,17(3):232-235.
[3] 李谢,易超,徐琳,等.伊班膦酸钠合成工艺的改进[J].安徽医药,2012,16(8):1074-1075.
[4] 国家药典委员会.国家药品标准WS1-(X-250)-2003Z[S].2004.
[5] 谭芳,万昆.伊班膦酸钠注射液含量及游离磷酸盐测定方法探讨[J].华西药学杂志,2014,29(4):419-420.
[6] 郭跃龙,韩继永,端亮,等.钼蓝比色法测定伊班膦酸钠注射液中的游离磷酸盐[J].江汉大学学报(自然科学版),2011,39(4):28-30.
[7] 安静,张俊贞,卢彦芳,等.伊班膦酸钠注射液的流动注射化学发光法测定[J].中国医药工业杂志,2012,43(2):123-125.
[8] 张元,李伟青,周伟娥,等.离子色谱法同时测定丹参注射剂中6种无机阴离子[J].中国实验方剂学杂志,2015,21(17):24-27.
[9] 刘静,李静,聂黎行,等.离子色谱法同时测定注射用丹参(冻干)中有机酸和无机阴离子[J].药物分析杂志,2012,32(10):1774-1777.
[10] 刘颖,张克星,兰静,等.离子色谱法测定甲磺酸伊马替尼中甲磺酸[J].现代药物与临床,2012,27(4):378-379.
[11] 马郑,唐玮,董建峰,等.离子色谱法测定伊班膦酸钠注射液中的亚磷酸根和磷酸根的含量[J].沈阳药科大学学报,2013,30(6):446-449.
[12] 熊婧,吴建敏,岳志华,等.离子色谱法测定依替膦酸二钠及其片剂的含量及有关物质[J].药物分析杂志,2012,32(2):310-313.
[13] 王菲菲,张聿梅,马双成,等.高效薄层色谱、柱前衍生-超高效液相色谱和离子色谱分析疏血通注射液中游离氨基酸的比较[J].药学学报,2016,51(3):439-443.
[14] 白海娇.离子色谱法测定复方氨基酸注射液(20AA)中醋酸根[J].现代药物与临床,2014,29(5):494-496.
[15] 王丽兰,廖淑君.高效液相色谱法测定血液透析液中醋酸根离子含量[J].国际检验医学杂志,2013,34(5):589-591.
Determination of Related Substances in Ibandronate Sodium Raw Materials by Ion Suppression Chromatography
LI Xin,CHEN Hong,ZHANG Yi(Chengdu Institute for Food and Drug Control,Chengdu 610045,China)
OBJECTIVE:To adopt ion suppression chromatography to determine related substance in ibandronate sodium raw materials.METHODS:The separation was performed on a Dionex IonPac AS11-HC column with mobile phase consisted of potassium hydroxide(gradient elution)at the flow rate of 1.1 mL/min.The column temperature was set at 45℃,and sample size was20 μL.Suppressed conductivity detector was adopted with temperature of 35℃.RESULTS:The linear ranges of phosphite,impurityⅠand phosphate were 3.08-30.83 μg/mL(r=0.999 9),2.84-28.43 μg/mL(r=0.999 1),2.95-29.52 μg/mL(r=0.999 9),respectively.The limits of quantitation were 2.47,56.7,3.31 ng,and the limits of detection were 0.75,17.2,1.0 ng.RSDs of precision,stability and reproducibility tests were all lower than 4.0%.The recoveries were 101.49%-103.57%(RSD=0.7%,n=9),100.00%-104.85%(RSD=1.8%,n=9),101.35%-104.08%(RSD=0.9%,n=9),respectively.CONCLUSIONS:The method is simple,accurate and sensitive,and is suitable for the determination of related substance in ibandronate sodium raw materials.
Ion suppression chromatography;Ibandronate sodium;Related substance;Phosphite;ImpurityⅠ;Phosphate
R927
A
1001-0408(2017)30-4288-04
DOI10.6039/j.issn.1001-0408.2017.30.30
*主管药师。研究方向:药物分析及质量控制。电话:028-85362213。E-mail:474519950@qq.com
#通信作者:主任药师,硕士。研究方向:药物分析及质量控制。E-mail:redchen333@sohu.com
2017-03-28
2017-05-08)
(编辑:刘柳)

