脑蛋白水解物辅助治疗急性脑梗死疗效与安全性的系统评价Δ
唐榕,陈沛然,肖利洪,张世洪,勾忠平,李梅,冯萍#(.四川大学华西公共卫生学院,成都6004;.四川大学华西医院神经内科,成都6004;.四川大学华西医院国家药物临床试验机构,成都6004)
脑蛋白水解物辅助治疗急性脑梗死疗效与安全性的系统评价Δ
唐榕1*,陈沛然1,肖利洪1,张世洪2,勾忠平3,李梅3,冯萍3#(1.四川大学华西公共卫生学院,成都610041;2.四川大学华西医院神经内科,成都610041;3.四川大学华西医院国家药物临床试验机构,成都610041)
目的:系统评价脑蛋白水解物辅助治疗急性脑梗死的疗效与安全性,为临床提供循证参考。方法:计算机检索SCI、Cochrane图书馆、EMBase、PubMed、中国期刊全文数据库(CJFD)、中文科技期刊数据库(VIP)、万方数据库,收集脑蛋白水解物联合常规方案(试验组)对比单纯常规方案或联合安慰剂(对照组)治疗急性脑梗死的随机对照试验(RCT),提取资料并按照Cochrane系统评价员手册5.1.0评价质量后,采用Rev Man 5.2统计软件对数据进行Meta分析。结果:最终纳入20项RCT,包括3 313例患者。Meta分析结果显示,试验组患者美国国立卫生研究院卒中量表(NIHSS)评分[MD=-1.77,95%CI(-2.33,-1.21),P<0.001]、有效率[OR=2.85,95%CI(1.75,4.63),P<0.001]、Barthel指数(BI)评分[MD=7.30,95%CI(3.48,11.13),P<0.001]显著高于对照组,差异均有统计学意义;两组患者致残率[OR=0.46,95%CI(0.20,1.03),P=0.06]、死亡率[OR=0.79,95%CI(0.52,1.19),P=0.25]、不良反应发生率[OR=1.04,95%CI(0.85,1.27),P=0.72]和严重不良反应发生率[OR=0.01,95%CI(-0.02,0.04),P=0.51]比较,差异均无统计学意义。结论:脑蛋白水解物辅助治疗急性脑梗死疗效较好,可以显著改善患者神经功能缺损状态和生活质量,且不增加不良反应的发生。
脑蛋白水解物;急性脑梗死;随机对照试验;系统评价;疗效;安全性
急性脑梗死是指因脑部血液循环障碍,缺血、缺氧所致的局限性脑组织缺血性坏死或软化,是成人最常见的致残性疾病。有资料显示,急性脑梗死后3个月的死亡/残疾率约为34.5%~37.1%[1]。目前,急性脑梗死的常规治疗为在一般处理的基础上,改善患者脑循环、保护脑神经(称为特异性治疗)[1]。由于脑组织对缺血、缺氧非常敏感,急性的脑局部缺血在发生8~10 min内脑神经元即开始发生不可逆的坏死,周边形成半暗带[2],并且随着时间的推移,坏死灶还将不断蔓延扩大。此时若及时溶栓,恢复脑血流灌注,改善脑循环,则半暗带组织可以一定程度逆转并恢复功能。但是在实际临床中,大多数入院的患者已经过了最佳的溶栓时间窗(发病<6 h),而此时保护缺血损伤组织中仍有活力的神经元,延缓坏死区域的蔓延成为临床治疗的关键。
脑蛋白水解物为多肽类神经营养药物,是脑蛋白经水解提取的游离氨基酸及低分子肽的混合注射液,可通过血脑屏障进入神经细胞,并影响其呼吸链,尤其对于受损的神经元,具有调节代谢、增加蛋白质合成、促进生长和修复的功能,从而可保护神经元免受各种缺血和神经毒素的损害。
目前,国内已有多篇文献报道了脑蛋白水解物治疗急性脑梗死的疗效和安全性,但各研究样本量较小,所得结论参考价值有限,且目前尚未见相关系统评价的报道,虽然国外1篇综述研究纳入了1项多中心随机对照试验(RCT),但仅对死亡率及不良反应进行了评价[3]。因此,本研究采用Meta分析的方法系统评价了脑蛋白水解物辅助治疗急性脑梗死的疗效与安全性,以期为临床提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型国内外公开发表的RCT,无论是否采用盲法、是否发表;语种限制为中文和英文。
1.1.2 研究对象符合第4届全国脑血管病学术会议“关于缺血性脑血管疾病诊断标准”[4]的急性脑梗死患者,均经头颅CT或磁共振成像(MRI)检查证实,患者年龄、种族、性别不限。
1.1.3 干预措施试验组患者给予脑蛋白水解物联合常规方案治疗,对照组患者单纯给予常规方案或联合安慰剂治疗。常规方案治疗定义为除神经营养药物之外的药物和非药物治疗,包括改善脑循环治疗(如必要时溶栓、抗血小板聚集、抗凝等)及对症治疗(如降颅压、脱水、降糖、降血压、降血脂等)。常规治疗方案均符合2014年版《中国急性缺血性脑卒中诊治指南》中所述的治疗原则。
1.1.4 结局指标疗效指标包括:①美国国立卫生研究院卒中量表(NIHSS)评分、②有效率(Response rate)、③Barthel指数(BI)评分、④致残率、⑤死亡率;安全性指标包括:⑥不良反应发生率、⑦严重不良反应发生率。其中,①②③⑥为主要指标,④⑤⑦为次要指标。NIHSS评分及BI评分的变化值采用两种衡量方式:①用Cochrane系统评价员手册推荐的计算方式,使用文献中给出的治疗前后数据计算得出;②直接纳入文献中已知的变化值。致残率采用改良Rankin量表评定,Rankin量表评级≥2级者定义为残疾。
1.1.5 排除标准①经CT或者MRI检查证实为脑出血、脑动脉瘤、脑肿瘤者;②同时使用其他神经保护剂者(如小牛血去蛋白提取物、依达拉奉、胞磷胆碱等);③研究中没有对以上任一结局指标进行评估者。
1.2 检索策略
计算机检索SCI、Cochrane图书馆、PubMed、EMBase、中国期刊全文数据库(CJFD)、中文科技期刊数据库(VIP)、万方数据库,检索时限均为各数据库建库起至2016年7月。中文检索式:“脑蛋白水解物”或“脑活素”或“施普善”或“丽珠赛乐”或“脑组织注射液”或“脑多肽”或“元活苏”或“赛若素”或“脑复素”或“氨基酸/低分子肽”或“奥利达”或“必奥星”或“必瑞克”或“活血素”并“急性脑梗死”或“急性缺血性脑卒中”并“随机对照试验”;英文检索式:“Cerebrolysin”or“Cerebrotein hydrolysate”or“Cerebrolysintides”or“Amino acid/low-molecularpep”and“Acute cerebral infarction”or“Acute ischemic stroke”and“Randomized controlled trial”。
1.3 文献筛选
文献检索结果以数据库的形式保存,然后剔除重复的报道(限定作者、年份及题目相同),并由两位互相独立的研究人员根据“1.1”项下所述纳入与排除标准,对初筛所得文献的标题、摘要和全文进行独立的阅读、评估和筛选,剔除不符合标准的研究。而后再进行交叉核对,意见不一致时通过讨论或征求第三方意见解决。
1.4 质量评价及资料提取
根据Cochrane系统评价员手册5.1.0推荐的质量评价方法评价纳入研究的质量,主要包括以下6个方面:随机序列产生、分配隐藏、盲法、不完整资料偏倚、选择性报道及其他可能偏倚。
1.5 统计学方法
采用Rev Man 5.2统计软件进行Meta分析。首先对纳入研究进行异质性分析,根据I2值及P值来判断异质性大小。若I2<50%,P>0.10,说明各研究间无统计学异质性,采用固定效应模型分析;反之,说明各研究间有统计学异质性,则首先分析异质性来源并作相应处理,若仍找不到异质性来源,且效应指标只有统计学异质性而无临床异质性,则采用随机效应模型分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索及筛选结果
按照检索策略共检索到原始文献1 303篇,去除重复文献423篇,阅读题目、摘要或全文后,排除综述、动物实验、治疗疾病为非目标疾病、试验组联合其他药物治疗、明显伪造抄袭、结局指标不能合并等不符合要求的文献860篇,最终纳入20篇文献[5-24]。文献筛选流程及结果见图1。
2.2 纳入研究基本信息
总计3 313例患者纳入本次系统评价。各研究样本量为40~1 069例,疗程为10~28 d,脑蛋白水解物剂量为30~50 mL,qd,或者120~122 mg,qd,溶剂均为0.9%氯化钠注射液。
2.3 纳入研究质量评价结果
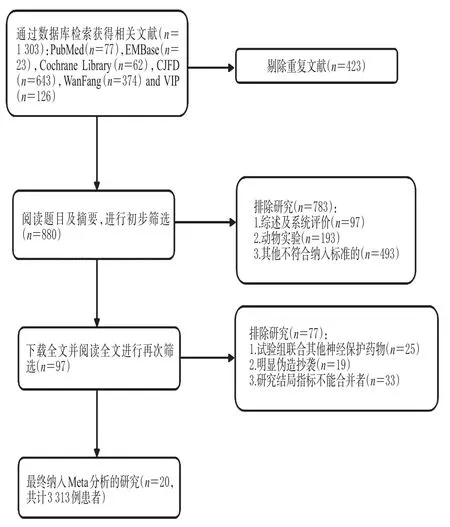
图1 文献筛选流程及结果Fig 1 Literature screening process and results
所有研究均为平行设计的RCT,其中9项研究报道了随机序列的产生[5-7,12,15,18,20-22],6项研究报道了分配隐藏[5-6,13,15,22,24],11项研究报道了盲法(包括单盲及双盲)[5-6,9,13-16,20-22,24],2项研究为开放性研究[18,23]。所有研究均描述了两组患者基线具有相似性,但均未描述不完整资料偏倚、选择性报道及其他可能偏倚。纳入研究偏倚风险见图2、图3。
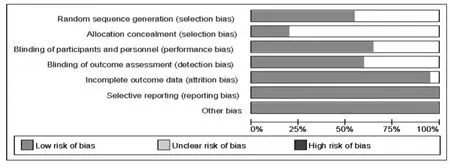
图2 偏移风险条形图Fig 2 Bias risk bar chart
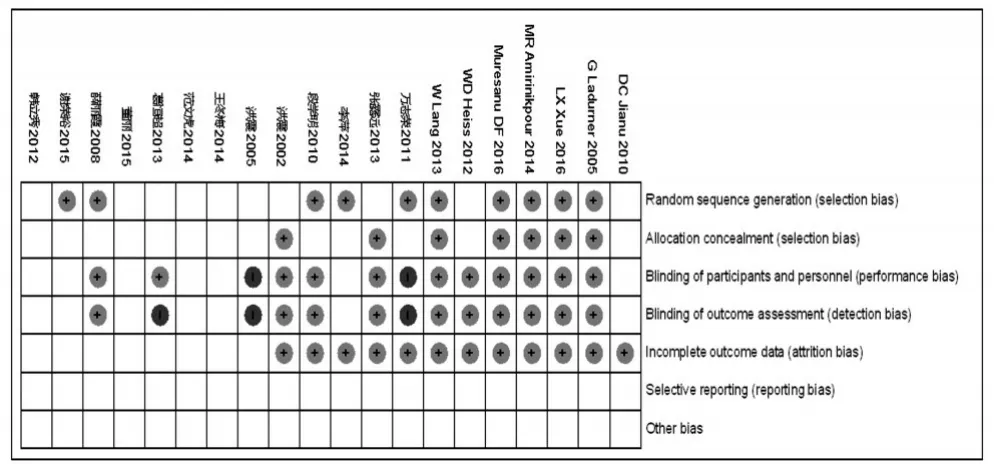
图3 偏移风险图Fig 3 Bias risk chart
2.4 Meta分析结果
2.4.1 NIHSS评分13项研究报道了NIHSS评分,合计1 231例患者[5,7-9,11,13-14,16-18,20-21,23]。各研究间有统计学异质性(P<0.001,I2=90%),采用随机效应模型进行分析,详见图4。Meta分析结果显示,试验组患者NIHSS评分显著高于对照组,差异有统计学意义[MD=-1.77,95%CI(-2.33,-1.21),P<0.001]。
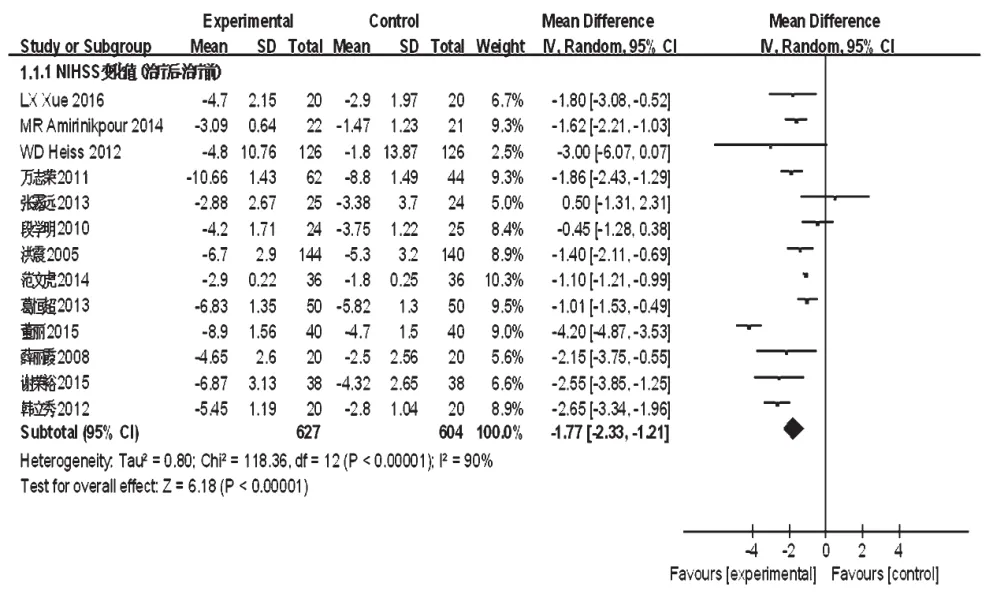
图4 两组患者NIHSS评分的Meta分析森林图Fig 4 Forest plot of Meta-analysis of NIHSS score in 2 groups
2.4.2 有效率治疗效果参照纳入文献[7-8,10-11,14,21]拟定的共同标准进行判定,分为基本痊愈、显著进步、进步、无变化、恶化。有效率=(基本痊愈例数+显著进步例数+进步例数)/总例数×100%。6项研究报道了有效率,合计432例患者[7-8,10-11,14,21]。各研究间无统计学异质性(P=0.73,I2=0),采用固定效应模型进行分析,详见图5。Meta分析结果显示,试验组患者有效率显著高于对照组,差异有统计学意义[OR=2.85,95%CI(1.75,4.63),P<0.001]。
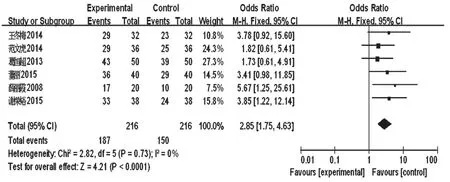
图5 两组患者有效率的Meta分析森林图Fig 5 Forest plot of Meta-analysis of response rate in 2 groups
2.4.3 BI评分5项研究报道了BI评分,合计309例患者[5,8,13-14,21]。各研究间有统计学异质性(P=0.001,I2=78%),采用随机效应模型进行分析,详见图6。Meta分析结果显示,试验组患者BI评分显著高于对照组,差异有统计学意义[MD=7.30,95%CI(3.48,11.13),P<0.001]。
2.4.4 不良反应发生率12项研究报道了不良反应发生率[6,8,10,13,15-16,18-22,24],合计2 475例患者。各研究间无统计学异质性(P=0.47,I2=0),采用固定效应模型进行分析,详见图7。Meta分析结果显示,两组患者不良反应发生率比较,差异无统计学意义[OR=1.04,95%CI(0.85,1.27),P=0.72]。2.4.5次要指标致残率、死亡率和严重不良反应发生率等次要指标的Meta分析结果见表1。由表1可知,两组患者致残率、死亡率和严重不良反应发生率比较,差异均无统计学意义。
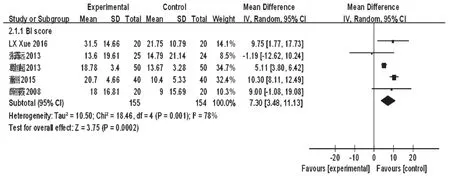
图6 两组患者BI评分的Meta分析森林图Fig 6 Forest plot of Meta-analysis of BI score in 2 groups

图7 两组患者不良反应发生率的Meta分析森林图Fig 7 Forest plot of Meta-analysis of the Adverse effect in 2 groups
2.5 敏感性分析和发表偏倚评价
敏感性分析将固定效应模型与随机效应模型互换,结果均未发生明显变化,说明本研究结果较为稳定。对主要结局指标NIHSS评分进行倒漏斗图分析,详见图8。由图8可知,倒漏斗图显示不完全对称,提示可能存在发表偏倚。
3 讨论
脑蛋白水解物是由多种游离氨基酸和小分子肽组成,其特点为组分中无蛋白质、脂肪及其他抗原性物质,容易透过血-脑屏障,主要通过促进神经细胞的代谢及调节功能来发挥神经保护作用。目前,国内外众多文献关于脑蛋白水解物辅助治疗急性脑梗死的疗效及安全性尚有争论。有综述指出,由于脑蛋白水解物组早期死亡率、随访期末死亡率及全因死亡率与对照组比较均没有显著性差异[3],故没有足够的证据证明脑蛋白水解物辅助治疗急性脑梗死可以提高疗效。但近期的1项国内RCT以NIHSS评分、BI评分及死亡率为主要评价指标进行观察,结果提示脑蛋白水解物辅助治疗急性脑梗死安全有效[5]。国外1项近期的RCT以手臂动作调查测试(Action research arm test,ARAT)评分、改良的Rankin量表评分、死亡率及不良反应发生率等为主要评价指标进行观察,结果提示脑蛋白水解物对急性脑梗死患者早期康复具有良好的效益-风险比[6]。因此,本研究结合国内外的RCT结果,对脑蛋白水解物辅助治疗急性脑梗死的疗效与安全性进行系统评价。

表1 次要指标的Meta分析结果Tab 1 Result of Meta-analysis of secondary indexes
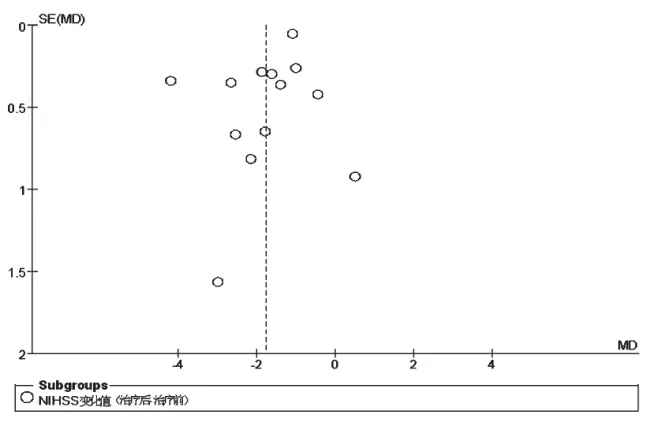
图8 NIHSS评分的倒漏斗图Fig 8 Inverted funnel plot of NIHSS score
本次Meta分析结果显示,在疗效方面,试验组患者NIHSS评分、有效率及BI评分均显著优于对照组,差异均有统计学意义;而两组患者致残率、死亡率比较,差异均无统计学意义。这提示从神经功能缺损状态和日常生活能力这两方面上来说,脑蛋白水解物辅助治疗急性脑梗死的疗效较好,但是其在降低致残率、死亡率等方面效果不显著。安全性方面,试验组患者不良反应发生率和严重不良反应发生率与对照组比较,差异均无统计学意义。这提示脑蛋白水解物辅助治疗急性脑梗死不增加不良反应的发生。
总体上来说,脑蛋白水解物辅助治疗急性脑梗死是有优势的,尤其表现在神经功能缺损状态及日常生活能力的改善方面,这与大部分纳入文献结果一致。但是在对致残率的评估中,此次Meta分析得到了“两组比较差异无统计学意义”的结果(如表1所示)。这表明联用脑蛋白水解物在降低致残率方面没有优势,推测可能与纳入的研究仅4项,样本量较小有关。此外,在死亡率评估方面,本次结果与Ziganshina LE等[3]研究结果一致,提示联用脑蛋白水解物在降低急性脑梗死患者死亡率方面没有优势。但是,由于本研究纳入的是全因死亡率,而非病死率,而老年人常合并其他疾病,如果在某些研究中这些疾病的基线不能严格保持一致,将很有可能影响到结局指标的准确性。
本系统评价纳入的研究均为RCT,大多数研究在研究设计、实施方面均较好,整体偏倚风险较小。但由于纳入研究的数量偏少,因此有可能在评估某些重要的结局指标(如致残率、死亡率等)时存在一定的偏差。有研究将资料进行了亚组分析,结果显示在基线NIHSS评分>12分的亚组中,脑蛋白水解物组患者的90 d生存率相比对照组显示出了显著的优越性(P<0.05)[16]。然而,在本次Meta分析中,符合此条件的研究较少,故未对急性脑梗死的严重程度进行分级。另外,有研究指出,在治疗重症急性脑梗死患者时,与安慰剂组相比,脑蛋白水解物组患者运动功能(使用MRI监测大脑运动神经网络)有明显的改善[25]。还有研究表明,脑蛋白水解物可以改善急性脑梗死患者大脑中动脉的血流状况[9]。这提示在以后的临床研究过程中,可以考虑对疾病程度进行分级,将以上指标纳入观察,开展多中心、大样本、严格设计和实施的RCT,以此深入探索脑蛋白水解物用于急性脑梗死治疗的作用。
综上所述,脑蛋白水解物辅助治疗急性脑梗死疗效较好,可以显著改善患者神经功能缺损状态和生活质量,且安全性亦较好。
[1] 中华医学会神经病学分会.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[2] Tottene A,Volsen S,Pietrobon D.Subunits form the pore of three cerebellar R-type calciumchannels with different pharmacological and permeation properties[J].J Neurosci,2000,20(1):171-178.
[3] Ziganshina LE,Abakumova T.Cerebrolysin for acute ischaemic stroke:review[J].Cochrane Database of Systematic Reviews,2015(6):1-31.
[4] 中华神经科学会.各类脑血管病诊断要点[J].中华神经科杂志,1996,29(6):379.
[5] Xue LX,Zhang T,Zhao YW,et al.Efficacy and safety comparison of DL-3-n-butylphthalide and cerebrolysin:effects on neurological and behavioral outcomes in acute ischemic stroke[J].Exp Ther Med,2016,11(5):2015-2020.
[6] Muresanu DF,Heiss WD,Hoemberg V,et al.Cerebrolysin and recovery after stroke:CARS[J].Stroke,2016,47(1):151-159.
[7] 谢荣裕.脑蛋白水解物治疗急性脑梗死疗效观察[J].现代中西医结合杂志,2015,24(34):3841-3843.
[8] 董丽.脑活素与血栓通联合治疗急性脑梗死40例临床疗效观察[J].世界临床医学,2015,9(6):129-130.
[9] Amirinikpour MR,Nazarbaghi S,Ahmadisalmasi B,et al.Cerebrolysin effects on neurological outcomes and cerebral blood flow in acute ischemic stroke[J].Neuropsychiatr Dis Treat,2014,3(10):2299-2306.
[10] 王冬梅.使用血栓通分别联合脑蛋白水解物与奥拉西坦治疗急性脑梗死的疗效对比[J].当代医药论丛,2014,12(17):276-277.
[11] 范文虎.灯盏花素联合脑蛋白水解物治疗急性脑梗死的临床观察[J].云南中医中药杂志,2014,35(4):30-31.
[12] 李萍.脑蛋白水解物注射液治疗卒中后认知功能障碍的随机对照研究[J].中风与神经疾病杂志,2014,31(3):259-262.
[13] 张露远.脑蛋白水解物治疗急性缺血性脑卒中的疗效及安全性观察[J].中华脑科疾病与康复杂志,2013,3(4):228-231.
[14] 葛恒超.红花黄色素联合脑蛋白水解物治疗急性脑梗死疗效观察及对血液流变学的影响[J].中国基层医药,2013,20(23):3571-3573.
[15] Lang W,Stadler CH,Poljakovic Z,et al.A prospective,randomized,placebo controlled,double-blind trial about safety and efficacy of combined treatment with alteplase(rt-PA)and cerebrolysin in acute ischaemic hemispheric stroke[J].Int J Stroke,2013,8(2):95-104.
[16] Heiss WD,Brainin M,Bornstein NM,et al.Cerebrolysin in patients with acute ischemic stroke in Asia:results of a double-blind,placebo-controlled randomized trial[J].Stroke,2012,43(3):630-636.
[17] 韩立秀.施普善治疗急性脑梗死的磁共振波谱成像评价[J].中国实用神经疾病杂志,2012,15(6):3-5.
[18] 万志荣.施普善(脑活素)对急性缺血性卒中的临床疗效研究[J].中华神经学杂志,2011,10(11):1181-1183.
[19] Jianu DC,Muresanu DF,Bajenaru O,et al.Cerebrolysin adjuvant treatment in Broca’s aphasics following first acute ischemic stroke of the left middle cerebral artery[J].J Med Life,2010,3(3):297-307.
[20] 段学明.施普善治疗急性脑梗死疗效的初步观察[D].大连:大连医科大学,2010.
[21] 薛丽霞,施普善治疗急性缺血性脑卒中的随机双盲对照研究[D].上海:上海交通大学,2008.
[22] Ladurner G,Kalvach P,Moessler H.Neuroprotective treatment with Cerebrolysin in patients with acute stroke:a randomised controlled trial[J].J Neural Transm cvienna,2005,112(3):415-428.
[23] 洪震.施普善在缺血性脑卒中急性期的临床疗效研究[J].中华老年心脑血管病杂志,2005,7(5):331-333.
[24] 洪震.施普善治疗缺血性卒中后早期恢复期疗效再评价[J].中国新药与临床杂志,2002,21(3):133-136.
[25] Chang WH,Park CH,Kim DY,et al.Cerebrolysin combined with rehabilitation promotes motor recovery in patients with severe motor impairment after stroke[J].BMC Neurology,2016,16(31):1-11.
Efficacy and Safety of Cerebrolysin in Adjuvant Treatment of Acute Cerebral Infarction:A Systematic Review
TANG Rong1,CHEN Peiran1,XIAO Lihong1,ZHANG Shihong2,GOU Zhongping3,LI Mei3,FENG Ping3(1.West China School of Public Health,Sichuan University,Chengdu 610041,China;2.Dept.of Neurology,West China Hospital,Sichuan University,Chengdu 610041,China;3.National Institution of Drug Clinical Trial,West China Hospital,Sichuan University,Chengdu 610041,China)
OBJECTIVE:To evaluate the efficacy and safety of cerebrolysin in adjuvant treatmenut of acute cerebral infarction systematically,and to provide evidence-based reference in clinic.METHODS:Retrieved from SCI,Cochrane Library,EMBase,PubMed,CJFD,VIP and Wanfang Database,RCTs about cerebrolysin combined with routine plan(trial group)vs.routine plan alone or combined with placebo(control group)in adjuvant treatment of acute cerebral infarction were collected.After data extraction and quality evaluation by using Cochrane systematic review manual 5.1.0,Meta-analysis was conducted by using Rev Man 5.2 statistical software.RESULTS:A total of 20 RCTs were included,involving 3 313 patients.Meta-analysis showed that NIHSS score[MD=-1.77,95%CI(-2.33,-1.21),P<0.001],response rate[OR=2.85,95%CI(1.75,4.63),P<0.001]and Barthel index(BI)score[MD=7.30,95%CI(3.48,11.13),P<0.001]in trial group were significantly higher than control group,with statistical significance.There was no statistical significance in disability rate[OR=0.46,95%CI(0.20,1.03),P=0.06],mortality[OR=0.79,95%CI(0.52,1.19),P=0.25],the incidence of ADR[OR=1.04,95%CI(0.85,1.27),P=0.72]or the incidence of severe ADR[OR=0.01,95%CI(-0.02,0.04),P=0.51]between 2 groups.CONCLUSIONS:Cerebrolysin is good for adjanctive therapy of acute cerebral infarction,can significantly improve neurologic impairment and life quality and dosen’t increase the incidence of ADR.
Cerebrolysin;Acute cerebral infarction;RCT;Systematic review;Therapeutic efficacy;Safety
R971
A
1001-0408(2017)30-4233-05
DOI10.6039/j.issn.1001-0408.2017.30.16
四川省科技支撑计划项目(No.2013SZ0003)
*硕士研究生。研究方向:统计学方法在临床研究中的应用。电话:028-86590459。E-mail:270749397@qq.com
#通信作者:教授,博士。研究方向:药物器械临床评价。电话:028-85423583。E-mail:617130961@qq.com
2016-11-25
2017-07-30)
(编辑:申琳琳)

