百草枯通过激活线粒体凋亡通路诱导人肺Ⅱ型上皮样A549细胞凋亡
孙大壮,王蕊,宋春青,许勇民,董雪松
(中国医科大学附属第一医院急诊科,沈阳 110001)
· 论著 ·
百草枯通过激活线粒体凋亡通路诱导人肺Ⅱ型上皮样A549细胞凋亡
孙大壮,王蕊,宋春青,许勇民,董雪松
(中国医科大学附属第一医院急诊科,沈阳 110001)
目的探讨百草枯(PQ)诱导人肺Ⅱ型上皮样A549细胞凋亡过程中线粒体凋亡通路的发生机制。方法体外培养A549细胞,对照组加入RPMI 1640培养液,实验组加入不同浓度的PQ(50、100、150和200 μ mol/L),2组细胞继续培养24和48 h。MTT法检测细胞活性;Hoechst 33258染色法观察细胞核的形态;流式细胞术检测细胞凋亡率以及线粒体膜电位;分光光度法检测caspase-3和caspase-9的活化程度;Western blotting检测线粒体凋亡相关蛋白Bcl-2、Bcl-xL、Bax和Bak的表达。结果MTT结果显示,PQ对A549细胞具有显著的生长抑制作用。Hoechst染色显示,不同浓度的PQ作用于A549细胞24和48 h后,可发现细胞凋亡的特征性改变,如细胞核固缩、核碎裂、凋亡小体形成,并且细胞的凋亡程度随着PQ浓度的增大和作用时间的延长而加重。细胞凋亡率升高也证实了这一结果。线粒体膜电位出现不同程度的降低;caspase-3和caspase-9活性不同程度的增加;抗凋亡蛋白Bcl-2、Bcl-xL的表达量降低;促凋亡蛋白Bax、Bak的表达量升高。以上结果均呈时间与浓度依赖性。结论PQ通过激活线粒体凋亡通路诱导A549细胞凋亡。
百草枯;肺泡上皮细胞;线粒体;凋亡
百草枯(paraquat,PQ)化学名称为1,1’-二甲基-4,4’-联吡啶阳离子盐,在过去几十年中PQ是全世界使用非常广泛的一种季胺类高效能除草剂。最近十余年里,服用PQ自杀或PQ意外中毒的发生率在亚洲特别是中国呈增加的趋势,且死亡率居高不下[1-2]。PQ经皮肤、呼吸道和消化道均可吸收。进入体内的PQ可迅速分布至各个器官,从而引起机体多器官功能损害,其中肺组织是PQ中毒的主要靶器官[3],急性PQ中毒导致患者出现肺水肿、肺泡出血、肺泡上皮间质炎症和损伤[4-5]。中毒患者早期往往死于急性呼吸窘迫综合征,存活患者逐渐发展为肺纤维化,最终死于呼吸衰竭。尽管到目前为止,已有很多PQ导致肺损伤及肺间质纤维化的研究,但发病机制仍不十分明确[6]。PQ的细胞毒性是通过损伤线粒体来实现的[7-8],但是PQ导致线粒体功能障碍的确切机制并不清楚。已有研究表明,肺泡上皮细胞凋亡是肺纤维化的起始机制[9]。因此,本研究的目的是探讨PQ诱导人肺Ⅱ型上皮样A549细胞凋亡机制,检测细胞线粒体凋亡通路的作用及意义,为临床治疗PQ中毒提供理论依据。
1 材料与方法
1.1 材料
人肺癌A549细胞株由中国医科大学实验中心提供。胎牛血清(美国Gemini公司),RPMI 1640培养基(美国HyClone公司),PQ、胰蛋白酶、MTT、DMSO、罗丹明123(美国Sigma公司),Hoechst染色试剂盒、ECL发光液和细胞裂解液(碧云天生物技术研究所),caspase活性检测试剂盒(南京凯基生物技术有限公司),细胞凋亡检测试剂盒(日本DOJINDO公司),Bcl-2、Bcl-xL、Bax、Bak、β-actin、HRP标记的山羊抗兔IgG抗体、HRP标记的山羊抗鼠IgG抗体(美国Proteintech Group公司)。
1.2 方法
1.2.1 细胞培养及分组:在含10%胎牛血清的RPMI 1640培养液中培养细胞,培养条件为含5% CO2的37 ℃培养箱。对照组加入RPMI 1640培养液继续培养24和48 h。实验组加入不同浓度的PQ(分别为50、100、150和200 μ mol/L)继续培养24和48 h。
1.2.2 细胞活性检测:以1×105/mL的密度种植在96孔板内,每孔100 μ L,培养24 h后,实验组加入不同浓度的PQ,同时对照组加入等量的培养液,每个浓度设6个平行孔,继续培养24和48 h。孵育完成后,每孔加入5 mg/mL的MTT 20 μ L混匀,在37 ℃、5% CO2条件下培养4 h,吸干每孔内的上清,每孔加入DMSO 150 μ L震荡,使沉淀充分溶解。酶标仪570 nm测定吸光度值。
1.2.3 Hoechst 33258染色:按实验分组处理细胞并继续培养24和48 h后,吸干培养液,加入固定液,固定10 min,吸出固定液PBS洗3次,然后加入Hoechst染液5 min,吸出染液后PBS洗3次,滴一滴抗荧光淬灭液,荧光显微镜观察细胞核的形态。
1.2.4 细胞凋亡率检测:细胞于6孔板内贴壁后,按实验分组处理细胞并继续培养24和48 h。孵育完成后,使用不含EDTA的胰蛋白酶收集2组细胞,1 000 r/min离心5 min,PBS洗涤,加入5 μ L的Annexin V-FITC和5 μ L 碘化丙啶室温避光孵育15 min,流式细胞仪检测。
1.2.5 线粒体膜电位检测:细胞按处理因素孵育完成后,每孔加入含有1 μ mol/L罗丹明的培养液,避光室温孵育30 min。使用不含EDTA的胰蛋白酶收集细胞,PBS洗涤,流式细胞仪检测线粒体膜电位。
1.2.6 caspases活性检测:各组细胞处理结束后,收集各组细胞,PBS洗涤,加入裂解缓冲液,待细胞裂解完全,10 000 r/min离心1 min收集上清,使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白浓度定为3 μ g/μ L,吸取50 μ L细胞裂解产物加入50 μ L的2×缓冲液与5 μ L caspase反应底物37 ℃避光孵育4 h。酶标仪405 nm测定吸光度值。
1.2.7 Western blotting 检测Bcl-2、Bcl-xL、Bax和Bak蛋白的表达:收集各组细胞并提取蛋白,通过BCA试剂盒测定各组蛋白浓度。样品经12% SDS-PAGE电泳分离,湿电转移至PVDF膜上,膜在室温下用5%脱脂奶粉封闭2 h,加入TBST稀释的Bcl-2、Bcl-xL、Bax、Bak和β-actin抗体,4 ℃过夜,洗膜后加入TBST稀释的二抗,室温2 h。用ECL显色,最后进行显影,定影。采用Image J图像分析软件进行灰度分析。
1.3 统计学分析
应用SPSS 20.0统计软件进行分析,数据均采用x-±s表示,组间比较采用单因素方差分析,方差齐时组间两两比较采用Dunnett t检验,方差不齐时用Dunnett T3检验。P < 0.05为差异有统计学意义。
2 结果
2.1 PQ对A549细胞活性的影响
不同浓度的PQ作用24 h后,与对照组相比,PQ浓度分别为50、100、150和200 μ mol/L的实验组A549细胞活性分别降至98.25%±0.52%、49.57%±2.74%、41.57%±2.21% 和36.68%±1.61%;相同处理条件48 h后,与对照组相比,PQ浓度分别为50、100、150和200 μ mol/L的实验 组A549细 胞 活性 分 别降 至95.89%±3.68%、38.23%±3.17%、18.33%±4.84%和10.30%±2.68%。PQ的半数抑制浓度在24和48 h时分别为131.92和 96.96 μ mol/L。见图1。
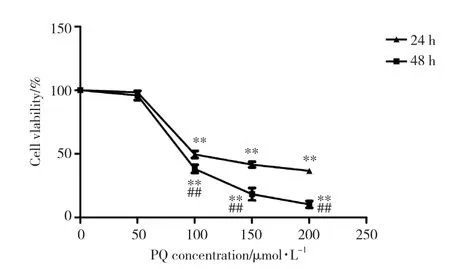
图1 不同浓度的PQ处理A549细胞24和48 h后对细胞活性的影响Fig.1 Effect of different concentrations of PQ on cell viability of A549 cells after 24 and 48 h
2.2 Hoechst染色检测细胞凋亡形态
PQ作用于A549细胞后细胞形态发生改变。Hoechst染色发现,与对照组相比,随着PQ浓度的增加和作用时间的延长,视野中凋亡的A549细胞数目越来越多。凋亡的A549细胞可清晰地看见核固缩、核碎裂和凋亡小体形成。见图2。
2.3 流式细胞术检测细胞凋亡率
不同浓度的PQ作用A549细胞24 h后,对照组细胞的凋亡率为3.80%±0.50%,PQ浓度分别为50、100、150和200 μ mol/L的实验组细胞的凋亡率分别为4.94%±1.20%、6.01%±0.78%、7.22%±1.50%和7.64%±1.23%。相同处理条件48 h后,对照组细胞的凋亡率为 3.85%±0.60%,PQ浓度分别为50、100、150和200 μ mol/L的实验组细胞的凋亡率分别为5.40%±1.30%、10.48%±2.10%、56.64% ±3.20%和77.43%±4.00%。与对照组相比,PQ处理A549细胞后,细胞凋亡率随着PQ浓度的增加和作用时间的延长逐渐升高。

图2 不同浓度的PQ处理A549细胞24和48 h后对细胞形态的影响Fig.2 Effect of different concentrations of PQ on morphological changes in A549 cells after 24 and 48 h

图3 不同浓度的PQ处理A549细胞24和48 h后对细胞凋亡率的影响Fig.3 Effect of different concentrations of PQ on apoptosis of A549 cells after 24 and 48 h
2.4 罗丹明123染色检测线粒体膜电位变化
不同浓度的PQ作用24 h后,对照组A549细胞荧光强度降低的比例为4.90%±0.80%,PQ浓度分别为50、100、150和200 μ mol/L的实验组A549细胞荧光强度降低的比例分别为6.20%±1.29%、7.30%±1.52%、9.00%±1.00%和13.10%±1.50%。相同处理条件48 h后,对照组A549细胞荧光强度降低的比例为4.90%±1.00%,PQ浓度分别为50、100、150和200 μ mol/L的实验组A549细胞荧光强度降低的比例分别为7.30%±1.05%、30.10%±2.15%、57.00%±2.95%和69.00%±4.00%。与对照组相比,实验组A549细胞随着PQ浓度的增加和作用时间的延长荧光强度逐渐降低,表明线粒体膜电位逐渐降低。见图4。
2.5 分光光度法测定caspase-3和caspase-9活性
不同浓度的PQ作用24 h后,PQ浓度分别为50、100、150和200 μ mol/L的 实 验 组A549细 胞caspase-3活性与对照组相比分别增加2.30%±2.11%、18.40%±5.05%、22.50%±3.61%和35.60%±6.12%,caspase-9活性与对照组相比分别增加1.00%±2.01%、16.20%±1.60%、20.20%±3.59%和 30.30%±7.11%;相同处理条件48 h后,PQ浓度分别为50、100、150和200 μ mol/L的 实 验 组A549细 胞caspase-3活 性 与 对照组相比分别增加4.50%±2.50%、55.60%±4.52%、65.30%±7.60%和 80.10%±5.30%,caspase-9活性与对照组相比分别增加 3.50%±2.51%、 50.20%±4.62%、68.50%±7.59%和 75.20%±5.63%。结果表明, caspase-3和caspase-9的活性随着PQ浓度的增加和作用时间的延长逐渐升高。见图5。
2.6 Western blotting检测Bcl-2家族蛋白的表达
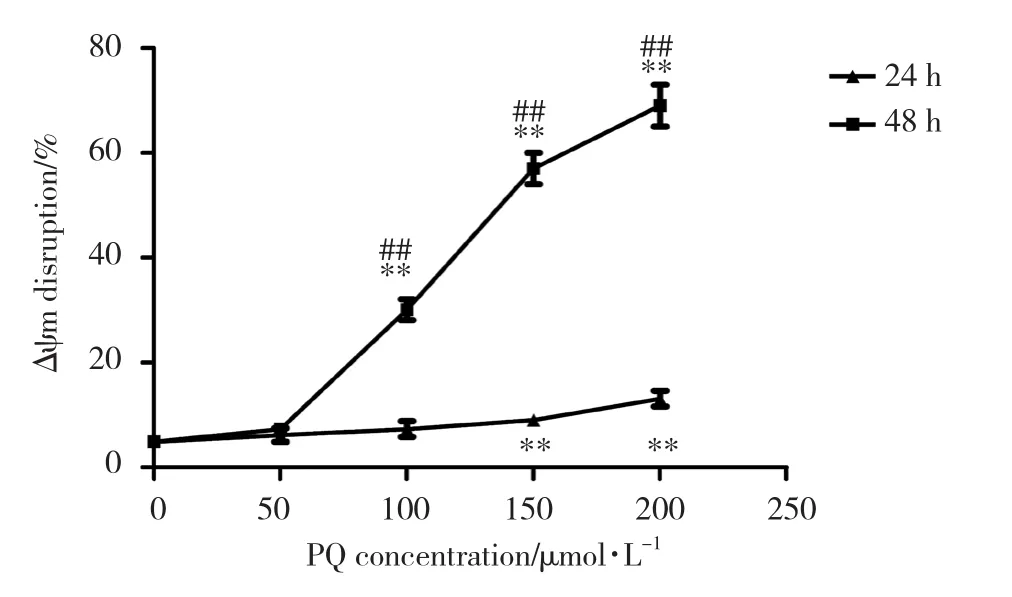
图4 不同浓度的PQ处理A549细胞24和48 h后对线粒体膜电位的影响Fig.4 Effect of different concentrations of PQ on mitochondrial transmembrane potential in A549 cells after 24 and 48 h
Western blotting结果显示,不同浓度的PQ作用24和48 h后,与对照组相比,PQ浓度分别为50、100、150和200 μ mol/L的实验组A549细胞随着PQ浓度的增加和作用时间的延长促凋亡蛋白Bax、Bak的表达明显增加,同时抗凋亡蛋白Bcl-2、Bcl-xL的表达明显减少。见图6。
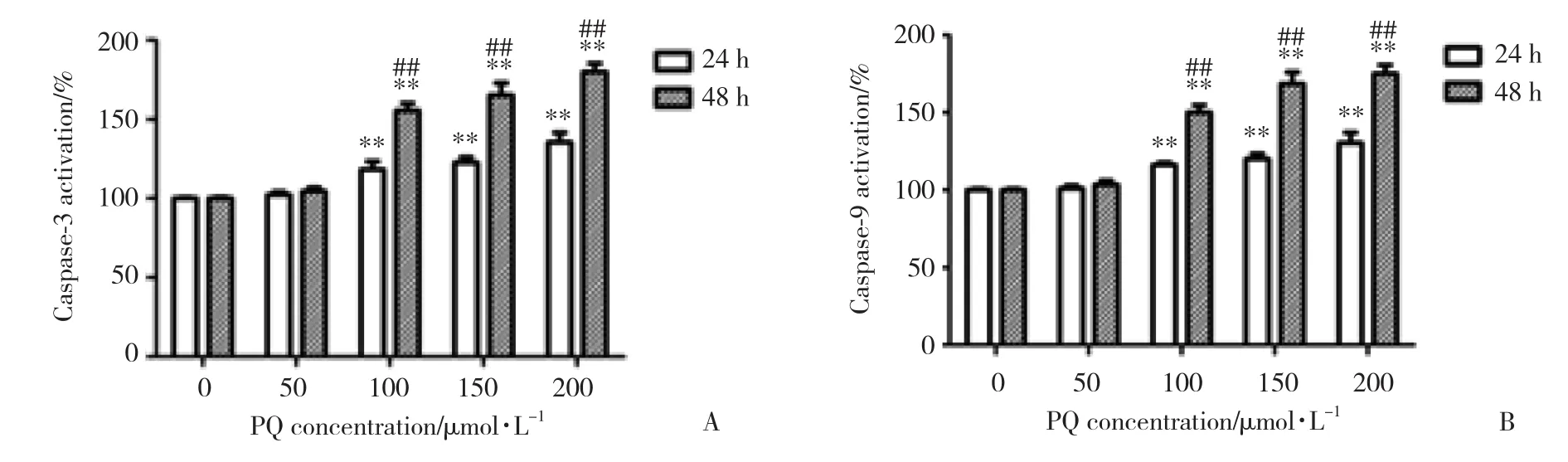
图5 不同浓度的PQ处理A549细胞24和48 h后对caspase-3和caspase-9活性的影响Fig.5 Effect of different concentrations of PQ on activities of caspase-3 and caspase-9 in A549 cells after 24 and 48 h
3 讨论
肺脏是PQ作用的主要靶器官。摄入体内的PQ在肺组织中的浓度是血浆中浓度的6~10倍,并且在血浆中PQ浓度下降时,仍可在肺内维持[3]。由于PQ可与胺类物质竞争多胺转运/摄取系统,经Ⅰ、Ⅱ型肺泡上皮细胞和Clara细胞摄取,造成广泛的肺损伤,最终发展为不可逆的肺纤维化。肺纤维化是以成纤维细胞增殖及大量细胞外基质聚集并伴炎症损伤、组织结构破坏为特征的一大类肺疾病的终末期改变,也就是正常的肺泡组织被损坏后经过异常修复导致结构异常(疤痕形成)。研究[10]表明凋亡在肺纤维化的进程中起重要的作用,而且线粒体功能损伤在调控肺泡上皮细胞凋亡的过程中非常重要[11]。因此,研究线粒体在PQ诱导的肺泡上皮细胞损伤中的作用机制具有重要意义,有助于阐明PQ导致肺损伤的发病机制,为临床诊治提供理论基础和指导。
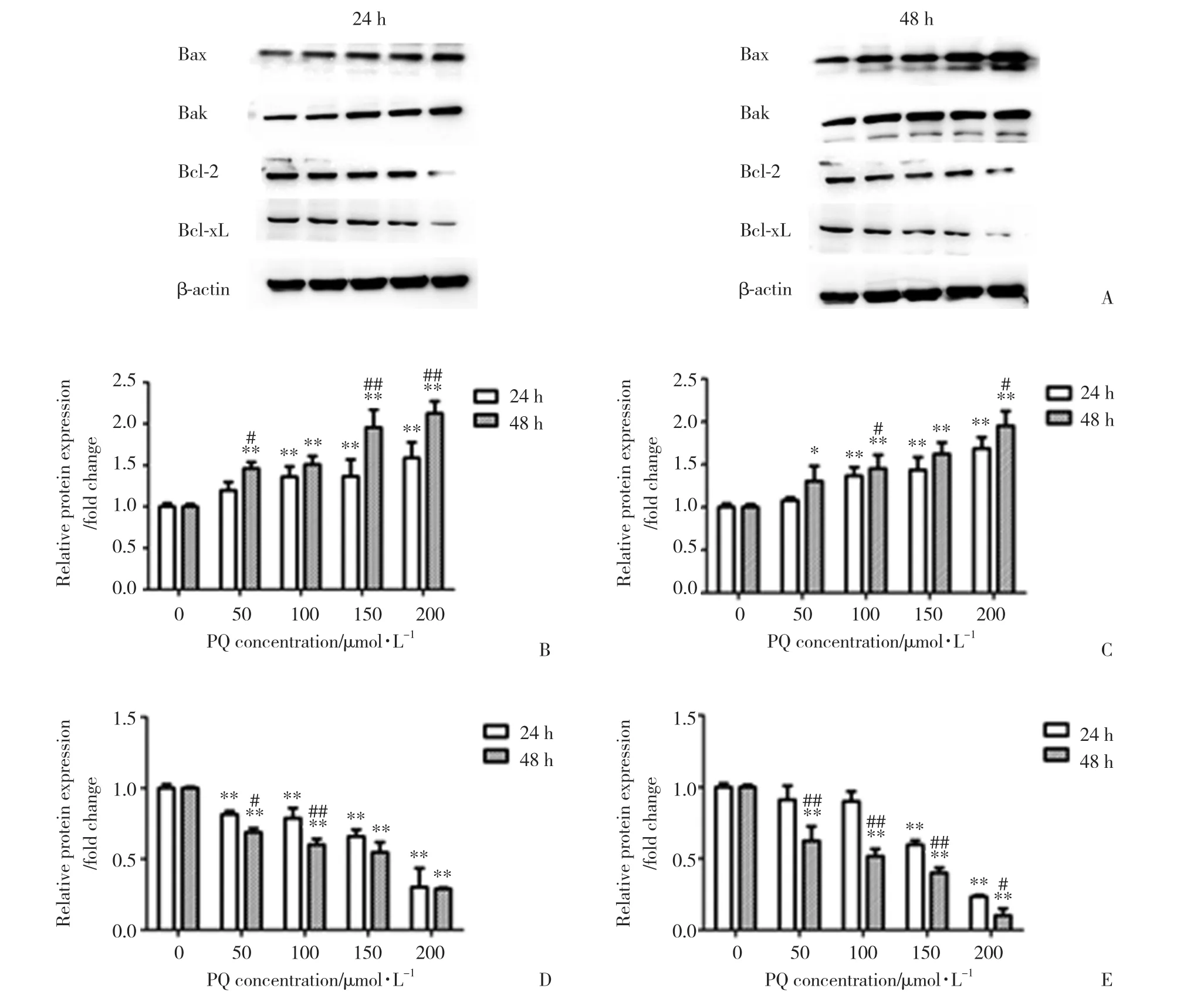
图6 不同浓度的PQ处理A549细胞24和48 h后对Bcl-2家族蛋白表达的影响Fig.6 Effect of different concentrations of PQ on expression of Bcl-2 family proteins in A549 cells after 24 and 48 h
近期有国外文献[12-13]报道,PQ在肺泡上皮细胞积累并对其造成损伤,进而干扰抗氧化系统,产生的活性氧导致氧化应激对肺泡上皮细胞造成损伤,在PQ诱导的肺泡上皮细胞损伤中起关键作用。国内有文献报道,PQ引起大鼠肺组织Bcl-2/Bax基因的不均衡表达[14],上调大鼠肺组织线粒体VDAC及caspase-3、caspase-8、caspase-9的表达[15]。以上研究结果提示,PQ诱导的肺泡上皮细胞损伤可能通过线粒体凋亡通路。因此,本研究通过MTT、凋亡检测、线粒体膜电位检测、caspases活性检测和Western blotting一系列方法,研究PQ诱导肺上皮细胞损伤的潜在机制。
MTT是一种常用的实验方法,用来研究药物对细胞增殖的影响。本研究中MTT结果表明,PQ对A549细胞具有显著的生长抑制作用,并呈明显的剂量和时间依赖性。Hoechst染色后荧光显微镜观察细胞核的形态以及Annexin V/碘化丙啶染色后流式细胞仪检测,是证明药物是否诱导细胞发生凋亡的常用手段。结果表明,实验组的A549细胞出现核固缩、核碎裂和凋亡小体形成,并且凋亡率与对照组相比显著升高,表明PQ抑制细胞增殖与凋亡相关。
凋亡是细胞程序性死亡过程,对维持细胞的内稳态有重要的监管作用。细胞的凋亡受许多内在和外在因素的影响,特别是caspase[16]和Bcl-2蛋白家族[17]。本研究结果表明,实验组caspases-3和caspases-9的活性明显高于对照组并呈明显的剂量和时间依赖性。同时随着PQ浓度的增加和作用时间的延长,Bax和Bak蛋白的表达逐渐增加,而Bcl-2和Bcl-xL蛋白的表达逐渐减少。线粒体是能量代谢的中心,其功能障碍可直接诱导细胞凋亡,因此线粒体介导的凋亡被视为主要的凋亡通路[18]。其中线粒体跨膜电位的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。线粒体膜电位去极化诱导一些促凋亡因子包括细胞色素C从线粒体中释放出来,激活caspase-9和caspase-3,最终导致细胞凋亡[19]。本研究结果显示,实验组线粒体膜电位与对照组相比明显降低,并呈时间和浓度依赖性,表明PQ诱导肺上皮样A549细胞凋亡可能通过线粒体凋亡途径。
综上所述,本研究以A549细胞作为人肺泡Ⅱ型上皮细胞模型来评估PQ诱导的细胞凋亡,证明PQ诱导A549细胞凋亡通过线粒体凋亡通路,为新药的研发提供了实验和理论依据。
[1] GIL HW,HONG JR,JANG SH,et al. Diagnostic and therapeutic approach for acute paraquat intoxication[ J]. Korean Med Sci,2014,29(11):1441-1449. DOI:10.3346/jkms.2014.29.11.1441.
[2] 张宝兰,姚朗,欧艺. 1991-2008年我国百草枯中毒文献分析[J]. 中 国 急 救 医 学,2010,30(2):139-141. DIO:10.3969/j.issn.1002-1949.2010.02.013.
[3] DINIS-OLIVEIRA RJ,DUARTE JA,S NCHEZ-NAVARRO A,et al. Paraquat poisonings:mechanisms of lung toxicity,clinical features and treatment[ J]. Crit Rev Toxicol,2008,38(1):13-71.
[4] VENKATESAN N. Pulmonary protective effects of curcumin against paraquat toxicity[ J]. Life Sci,2000,66(2):PL21-PL28.
[5] TOMITA M,OKUYAMA T,KATSUYAMA H,et al. Mouse model of paraquat-poisoned lungs and its gene expression profile[ J]. Toxicology,2007,231(2/3):200-209. DOI:10.1016/j.tox.2006.12.005.
[6] MITSOPOULOS P,SUNTRES ZE. Cytotoxicity and gene array analysis of alveolar epithelial A549 cells exposed to paraquat[ J].Chem Biol Interact,2010,188(3):427-436. DOI:10.1016/j.cbi.2010.09.022.
[7] HIRAI K,WITSCHI H,CT MG. Mitochondrial injury of pulmonary alveolar epithelial cells in acute paraquat intoxication[ J]. Exp Mol Pathol,1985,43(2):242-252.
[8] HE Y,ZOU L,ZHOU Y,et al. Adiponectin ameliorates the apoptotic effects of paraquat on alveolar type Ⅱ cells via improvements in mitochondrial function[ J]. Mol Med Rep,2016,14(1):746-752. DOI:10.3892/mmr.2016.5328.
[9] UHAL BD. Epithelial apoptosis in the initiation of lung fibrosis[ J]. Eur Respir J Suppl,2003,44:7s-9s. DOI:10.1183/09031936.03.00000303.
[10] KUWANO K,HAGIMOTO N,NAKANISHI Y. The role of apoptosis in pulmonary fibrosis[ J]. Histol Histopathol,2004,19(3):867-881. DOI:10.14670/HH-19.867.
[11] KIM SJ,CHERESH P,JABLONSKI RP,et al. The role of mitochondrial DNA in mediating alveolar epithelial cell apoptosis and pulmonary fibrosis[ J]. Int J Mol Sci,2015,16(9):21486-21519. DOI:10.3390/ijms160921486.
[12] LIU S,LIU K,SUN Q,et al. Consumption of hydrogen water reduces paraquat-induced acute lung injury in rats[ J]. J Biomed Biotechnol,2011,2011:305086. DOI:10.1155/2011/305086.
[13] PARK HK,KIM SJ,KWON DY,et al. Protective effect of quercetin against paraquat-induced lung injury in rats[ J]. Life Sci,2010,87(5/6):181-186. DOI:10.1016/j.lfs.2010.06.011.
[14] 王晔. Bcl-2/Bax在百草枯中毒鼠肺组织中的表达及三七总皂苷的保护作用[J]. 中国急救医学,2012,32(8):714-717. DOI:10.3969/j.issn.1002-1949.2012.08.011.
[15] 赖登攀,夏金明,王建峰,等. 百草枯中毒大鼠肺组织线粒体中电压依赖性阴离子通路及caspase-3、8、9的变化[J]. 中华劳动卫生职业病杂志,2015,33(5):363-365. DOI:10.3760/cma.j.issn.1001-9391.2015.05.014.
[16] FADEEL B,ORRENIUS S. Apoptosis:a basic biological phenomenon with wide-ranging implications in human disease[ J]. J Intern Med,2005,258(6):479-517. DOI:10.1111/j.1365-2796.2005.01570.x.
[17] MARTINOU JC,YOULE RJ. Mitochondria in apoptosis:Bcl-2 family members and mitochondrial dynamics[ J]. Dev Cell,2011,21(1):92-101. DOI:10.1016/j.devcel.2011.06.017.
[18] PENG W,WU JG,JIANG YB,et al. Antitumor activity of 4-O-(2″-O-acetyl-6″-O-p-coumaroyl-β-D-glucopyranosyl)-p-coumaric acid against lung cancers via mitochondrial-mediated apoptosis[ J]. Chem Biol Inter,2015,233:8-13. DOI:10.1016/j.cbi.2015.03.014.
[19] ORRENIUS S. Mitochondrial regulation of apoptotic cell death[ J].Toxicol Lett,2004,149(1/3):19-23.
(编辑 陈 姜)
Mitochondria-mediated Apoptosis in Human Lung Type Ⅱ Alveolar Epithelial-like A549 Cells by Paraquat
SUN Dazhuang,WANG Rui,SONG Chunqing,XU Yongmin,DONG Xuesong
(Department of Emergency,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the apoptosis mechanism induced by paraquat (PQ) in human typeⅡalveolar epithelial-like A549 cells.MethodsA549 cells were cultured in vitro. The cells in the experimental group were exposed to various concentrations of PQ (50,100,150,and 200 μ mol/L),while those in the control group were cultured in RPMI 1640 medium. After treatment for 24 and 48 h,the cell survival rate was assessed by MTT assay. Morphological changes in the nuclei were observed by Hoechst 33258 fluorescence staining.Cellular apoptosis and mitochondrial transmembrane potential were assayed by flow cytometry. The activities of caspase-3 and caspase-9 were assayed by spectrophotometry. Western blotting was used to analyze the expression of proteins in the Bcl-2 family,such as Bcl-2,Bcl-xL,Bax,and Bak.ResultsPQ exhibited significant anti-proliferative activity in A549 cells. PQ-treated A549 cells were subjected to Hoechst 33258 staining. The hallmarks of apoptosis were detected,and the degree of apoptosis increased. Mitochondrial membrane potential was decreased,the levels of active caspase-3 and caspase-9 increased,the expression of Bcl-2 and Bcl-xL was decreased,and the expression of Bax and Bak was increased. These effects occurred in concentration- and time-dependent manners.ConclusionPQ efficiently induced intracellular apoptosis through the mitochondrial pathway in A549 cells.
paraquat; alveolar epithelial cells; mitochondria; apoptosis
R595.4
A
0258-4646(2017)11-0961-06
10.12007/j.issn.0258-4646.2017.11.001
国家自然科学基金(81471851);辽宁省博士启动基金(20141033)
孙大壮(1991 -),男,硕士研究生.
董雪松,E-mail:dongxues@163.com
2017-04-14
网络出版时间:

