无机固体电解质Li7La3Zr2O12的研究进展
查文平,李君阳,阳敦杰,沈 强,陈 斐
(武汉理工大学 材料复合新技术国家重点实验室,湖北 武汉 430070)
特约专栏
2017-04-09
国家自然科学基金资助项目(51202171, 51472188)
查文平,女,1995年生,硕士研究生
陈 斐,男,1981年生,教授,博士生导师,Email:chenfei027@gmail.com
10.7502/j.issn.1674-3962.2017.10.03
无机固体电解质Li7La3Zr2O12的研究进展
查文平,李君阳,阳敦杰,沈 强,陈 斐
(武汉理工大学 材料复合新技术国家重点实验室,湖北 武汉 430070)
目前,采用固体电解质代替传统电解液发展新型全固态锂离子电池,已成为解决电池安全问题、提高电池储能密度的一项重要的技术方法。固体电解质材料作为全固态锂电池的核心,它的性能很大程度上决定了电池的各项性能指标。迄今被研究过的无机固体电解质材料有很多,包括NASICON型、LISICON型、钙钛矿型和石榴石型等晶态固体电解质,和氧化物及硫化物等玻璃态固体电解质,其中石榴石型结构的Li7La3Zr2O12材料具有优异的综合电化学性能,使其更具实际应用潜力和研究价值。实验与理论计算结果表明该材料具有较高的锂离子电导率(10-4~10-3S·cm-1),能与负极金属锂及大部分正极材料稳定接触,电化学窗口高达6 V。根据近年来国内外在该类材料上的研究现状,主要从Li7La3Zr2O12的晶体结构特征、制备方法及掺杂改性等方面进行了详细介绍,最后阐述了Li7La3Zr2O12固态电解质材料在全固态锂电池中的发展前景及面临的挑战。
Li7La3Zr2O12;石榴石结构;无机固态电解质;掺杂改性;锂离子电池
1 前 言
与其它种类的电池相比,可充放锂离子电池具有更高的输出电压和能量储存密度,同时也更环保,被广泛应用在便携式电子装备和电子交通工具中[1,2]。但目前商用锂离子电池普遍采用液态电解质。液态电解质虽然具有较高的锂离子电导率,但其存在易泄露、易腐蚀、高温易分解等缺点使其存在自燃或爆炸等安全隐患,同时容易与电极发生反应产生锂枝晶,更限制了其在化学储能领域的大规模应用[3,4]。与使用液体电解质的锂离子电池相比,全固态电池(如图 1 所示)的构造简单、体积小,可获得大电压单体电池模块,且热稳定性和安全性好,能量密度和功率密度高。因此,采用固体电解质代替传统电解液,开发高安全性、高能量密度及宽温度使用范围的全固态锂离子电池具有十分重要的意义[5]。
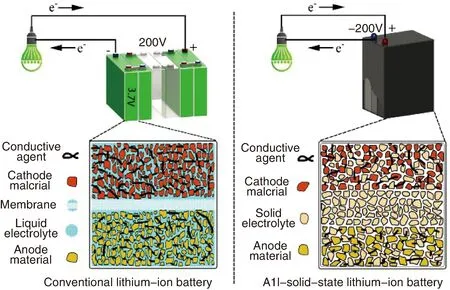
图1 传统锂离子电池与全固态锂离子电池的对比图Fig.1 Comparison of traditional lithium ion battery and all-solid-state lithium ion battery
固体电解质材料是全固态电池的核心部件,在正负极间起着运输离子的作用,其性能很大程度上决定了电池的功率密度、循环稳定性、安全性能、高低温性能以及使用寿命[6]。应用于全固态电池中的固态电解质材料应需具备如下特点:①高的离子电导率;②良好的化学稳定性;③对锂具有良好的电化学稳定性[7]。目前被广泛研究的无机固态电解质主要有NASICON型、LISICON型、钙钛矿型、石榴石型、LIPON和硫化物体系等[8],但这些无机固态电解质都只具备其中部分特点,无法兼顾所有特点。例如,NASICON型[9]固态电解质和钙钛矿型[10]固态电解质的室温离子电导率可以达到10-3S·cm-1,但是体系中的Ti4+在与金属锂接触的过程中易被还原成Ti3+,使电解质材料不稳定;LISICON型[11]固态电解质与金属锂以及空气中的二氧化碳易发生反应,且相对较低的离子电导率还会随应用时间的增加而降低;LIPON[12]固态电解质的室温离子电导率只有10-6S·cm-1,并且难以与电极材料形成复合电极,当前只能用于薄膜电池;硫化物玻璃[13]固态电解质具备较好的热稳定性以及很高的离子电导率(~10-2S·cm-1),但硫化物易吸水释放H2S气体,这是个亟待解决的问题。具有石榴石型结构的LixLa3M2O12(M = Te, Nb, Zr),实验[14]和第一性原理模拟[15]都表明该材料具有较高的离子导电率、优良的稳定性能和电化学性能,与金属锂接触稳定,电化学窗口高达6 V,扩大了正负极材料的选择范围。尤其是当M离子全部被Zr填充时所制备的Li7La3Zr2O12(简称LLZO)[16]室温离子电导率最高可达3.0×10-4S·cm-1,激活能仅为0.3 eV。综合比较,Li7La3Zr2O12固态电解质的优点使其在未来的全固态锂电池领域中拥有广阔的应用前景和研究价值。
2 LLZO的晶体结构及锂离子迁移通道
Li7La3Zr2O12的母体材料是通式为A3B2C3O12的石榴石矿物,其骨架结构为[A3B2O12]3-,LLZO中的La3+和Zr4+分别占据石榴石结构中的A位(24c)和B位(16a),锂离子占据C位,为提高载流子浓度,最初的石榴石中A、B位的元素分别用价态更低的元素取代形成目前研究的石榴石结构Li7La3Zr2O12。根据电价守恒原则,石榴石结构中的锂离子浓度会得到提升。LLZO的晶体结构较为复杂,如图2所示,LLZO骨架结构由[LaO8]十二面体和[ZrO6]八面体以共棱的形式相互连接,这种连接方式不紧密,结构中存在大量空隙位置,锂离子在这些间隙位置中分布。按照对称性可以将锂离子分为两种,一种是占据在24d位置的Li1,与周围4个O构成[LiO4]四面体;另一种是占据96h位置的Li2,与周围6个O构成[LiO6]八面体。一个锂四面体连接四个锂八面体,一个锂八面体连接两个四面体,两种锂离子随机分布,相互连接,构成锂离子传输的三维网络状结构。


图2 (a)立方相LLZO的晶体结构:骨架结构及锂离子在其中的分布;(b)立方相LLZO中锂离子传输通道Fig.2 Crystal structure and lithium ion transport channel of cubic phase LLZO

图3 LLZO中锂离子迁移通道的环状结构:(a)立方相 LLZO;(b)四方相 LLZO[17]Fig.3 Loop structures of lithium ion migration pathway in cubic LLZO (a) and tetragonal LLZO (b)[17]
Li1(24d)和Li2(96h)位置,其中24d为四面体中心位置,96h为八面体中对称的两个偏心位置,相邻两个96h位置距离过于接近,由于电荷相互排斥,相邻的两个96h位置不能被同时占据;另外,由对称性可知单个LLZO 晶胞存在24个Li1位置和96个Li2位置,但由于电荷排斥,96个Li2位置不能同时被占据,其中有48个Li2位置未被占据。单个晶胞中存在8个Li7La3Zr2O12,即56个锂离子,56个锂离子随机分布在72个位置,将产生高达1015种不同锂离子空间排布的LLZO结构。随机分布与有序化排列之间的巨大差别是立方相与四方相电化学性能巨大差异的关键影响因素—立方相LLZO的离子电导率(10-4S·cm-1)比四方相(10-6S·cm-1)高两个数量级。Meier等[20]利用多种计算方法,从理论上揭示了立方相与四方相中锂离子迁移的不同方式。结果显示,由于四方相中锂离子呈高度有序化排布,锂离子的迁移表现出多个离子同步迁移的特性,迁移激活能约为0.4 eV,因此离子迁移困难;立方相中锂离子位置被部分占据,晶体中存在着大量随机分布的锂离子空位,锂离子表现出单个跃迁特性,迁移激活能约为0.1~0.3 eV,迁移较容易;因此立方相LLZO晶体的离子导电性能高于四方相LLZO。由于四方相与立方相离子电导率的差异,研究者们更倾向于制备得到离子电导率较高的立方相LLZO。
3 LLZO的制备方法
制备LLZO的主要方法有传统固相反应法、溶胶凝胶法以及场辅助烧结法[21-23]。其他制备方法还有共沉淀法[23,24]、静电纺丝[25]、喷雾热解合成[26, 27]等。
3.1 高温固相反应法
2007年,Murugan等[16]采用传统固相烧结方法,在1230 ℃下高温烧结36 h,首次制备了石榴石型结构的Li7La3Zr2O12,其离子电导率高达3×10-4S·cm-1。自此以后,该材料开始得到广泛研究,目前大量工作已被报道。高温固相反应法具有产量大、制备工艺简单等优点,是迄今为止制备LLZO最常用的方法。为得到性能更加优异的LLZO,研究者们通过调控原材料种类、锂含量、工艺参数(烧结温度、压力、时间等)得到离子电导率更高、结构更稳定的LLZO电解质材料。Allen等[28]以Li2CO3、La(OH)3、ZrO2为原料,在1000 ℃下高温煅烧3 h,得到了离子电导率为3.7×10-4S·cm-1的LLZO,其致密度高达98%,活化能降至0.30 eV; Lee等[29]以LiOH、La2O3、ZrO2为原料,高能球磨12 h后,1125 ℃下高温煅烧20 h,得到室温离子电导率高达4.9×10-4S·cm-1的LLZO。在降低固相烧结温度方面,近期Hu Z L等[30]于900 ℃下煅烧12 h得到Al稳定的LLZO;Kumar等[31]则通过选取高活性锂源降低烧结温度:将溶解在乙醇溶液中的CH3COOLi加入到预先混合均匀的La(OH)3,ZrO2和1wt%的AlOOH中,球磨后在750 ℃下保温3 h即得到LLZO,大大降低了固相烧结的温度和时间,美中不足的是以上方法得到的LLZO离子电导率并没有提高。文献中已报道的立方相LLZO的固相反应合成法总结,如表1所示。

表1 文献中已报道的立方相LLZO的固相反应合成法
3.2 溶胶凝胶法
固相合成方法的烧结温度一般在1000 ℃以上,且晶粒尺寸偏大,一般为10~100 mm[28-36]。为降低烧结温度,得到粒径更小、分布更均匀的LLZO粉体,通常采用溶胶凝胶法。溶胶凝胶法可使各组分在液相中混合均匀、相互反应,得到颗粒均匀的前驱体粉末后,在相对较低的温度下烧结即可制备出纳米尺寸晶格的LLZO粉末[37]。这对于无机固体电解质的制备与性能优化大有裨益。Xie等[38]和Kokal等[39]采用溶胶凝胶法在750 ℃的低温下成功合成了纯立方相的LLZO纳米粉末,但其室温离子电导率只有10-6S·cm-1。Sakamoto等[40]以LiNO3、La(NO3)3·6H2O和Zr(OH7C3)4为原料,乙酸为螯合剂,采用超临界干燥技术干燥湿凝胶,低温预处理后在1000 ℃下烧结4 h,得到致密度达96%,而晶粒尺寸只有260 nm的纳米立方相LLZO,晶粒尺寸降低了几十倍,同时也获得了较高的室温离子电导率(4×10-4S·cm-1)。近年来采用溶胶凝胶法制备LLZO的报道如表2所示。

表2 文献中已报道的溶胶凝胶法制备立方相LLZO
3.3 场辅助烧结法
场辅助烧结法是除了传统的固相反应法和溶胶凝胶法之外制备LLZO的另一种常用方法。采用传统固相反应法制备LLZO时,虽然制备工艺较为简单,但前驱体粉需在较高温度下进行长时间的烧结,能耗较高。长时间高温烧结易造成锂元素的挥发,且易产生La2Zr2O7、La2O3等杂相,这些杂相会使材料的电化学性能恶化[16]。溶胶凝胶法的缺点则是制备过程相对复杂,需经历凝胶的凝胶化、陈化、干燥、预处理等过程,周期相对较长,且原料多采用无机盐类和醇盐,价格普遍较为昂贵[40],大大增加了制备LLZO的成本。随着研究的深入,除了离子电导率,能耗、制备周期、成本等工业化生产因素也逐渐被纳入LLZO制备的考虑范围。
场辅助烧结技术(FAST)是一种新型快速烧结制备LLZO的技术,将原料粉末装入石墨等材质制成的模具内,在加热加压的同时通入脉冲电流,利用原料粉体间的电火花放电除去颗粒表面的杂质并活化表面,从而促进烧结,有利于原料粉体在相对较低的温度下实现快速致密化[48,49]。Zhang等[21]采用场辅助烧结技术首次在1100 ℃烧结温度条件下制备了致密度高达99.8%的LLZO陶瓷块体,烧结时间仅为10 min,室温离子电导率高达5.7×10-4S·cm-1,是目前同种材料的最高值。为提高实验室的生产规模,Botros等[22]将喷雾热解法(NSP)和场辅助烧结相结合,将场辅助烧结的烧结温度降低到950 ℃,同时使LLZO的晶粒尺寸减小,室温离子电导率为3.3×10-4S·cm-1。Zhang等[23]则通过共沉淀法制备得到纳米核-壳结构的前躯体粉,再通过场辅助烧结技术将烧结温度降低到了900 ℃,最后得到了粒径为1~3 mm的高致密度(96.5%)的LLZO,室温离子电导率为3.32×10-4S·cm-1。致密度和相的纯度是影响离子电导率的两个重要因素,不同的制备方法,会对致密度和相的纯度造成不同的影响。由于场辅助烧结法的烧结时间非常短,可以有效地减少由于烧结温度过高、烧结时间过长而导致的锂元素损失,同时该方法在烧结过程中可以对粉体施加单轴的压力,能够有效提高材料的致密度,所以场辅助烧结法特别适合用来快速制备高纯度、高致密度的LLZO电解质材料。
3.4 其他制备方法
除上述提到的方法外,目前已经研究过的LLZO新型制备方法还有共沉淀法、静电纺丝、喷雾热解合成等,但是这些方法目前还未发展成熟,无法满足LLZO的大规模商业生产。因此,科研工作者仍在致力于开发各种新型、高效、节能的制备方法,在降低成本、烧结温度,缩短周期的同时,也能兼顾LLZO的电化学性能。
4 LLZO的掺杂改性
立方相LLZO的离子电导率比四方相高两个数量级,但高温下纯立方相LLZO结构很不稳定,容易转变为四方相[50, 51]。因此,除探索合理的制备方法外,如何稳定立方相晶格来提高其室温离子电导率是LLZO成为固态电解质在锂离子电池中运用的另一研究重点。元素掺杂是稳定立方相晶格,提高离子电导率最有效的方法之一。元素掺杂一方面可以利用电价守恒控制LLZO固态电解质中的锂离子浓度,有效提高结构中的锂空位浓度,增加锂离子排列的无序度,达到稳定立方相、优化离子电导率的目的;另一方面还可以对骨架结构进行调控,利用离子半径不等的元素对骨架结构进行掺杂或者替换,以使晶胞中的锂离子通道大小适宜锂离子的迁移[52]。针对LLZO中Li, La和Zr位置进行掺杂取代的研究情况如表 3 所示。

表3 LLZO的掺杂、制备及其对应的离子电导率
4.1 Li位掺杂
LLZO中锂离子的浓度及排列顺序对离子电导率有着至关重要的影响。Rangasamy等[77]实验发现用0.2~0.24 mol的Al(0.4~0.48个锂空位)取代单位结构的LLZO,可以稳定立方相晶格,且其离子电导率比不含Al的LLZO更高,这种现象很快就被其他研究Al掺杂LLZO的研究者证实[78, 79]。随后,Bernstein等[80]结合密度泛函理论和分子动力学计算证明了在LLZO结构单元中引入0.4~0.5浓度范围的锂空位,更有利于离子电导率的提高。Zhang[18]等制备了锂离子浓度从5.47 mol到7.37 mol依次变化的LLZO陶瓷片,利用核磁共振测试方法,研究了锂离子浓度与离子电导率的关系, 发现锂离子浓度超过7后,XRD峰变宽,开始由立方相向四方相转变,这是由于锂离子浓度增高后,浓度高度有序化排列的结果;锂离子浓度为6.35mol时离子电导率最高,说明对于LLZO而言适当降低锂离子浓度(或增加锂空位浓度)有利于离子电导率的提升。因此,采用非等价阳离子如Al[21, 81],Ga[55-58],Fe[53, 54]等取代Li位,利用超价的额外正电荷来促进锂空位的形成,成为提高LLZO离子导电率的一个研究热点。Bernuy等[59]在O2气氛条件下烧结得到致密的LLZO陶瓷片,室温离子电导率高达1.3×10-3S·cm-1,并采用固态核磁共振(MAS-NMR)测试了Ga在晶体结构中的位置及其对Li分布和离子迁移率的影响。MAS-NMR结果显示Ga占据四面体位置,可以促进锂在可占据位置上的随机分布,从而促进导电性的增加。Rettenwander等[53, 54,56]进行了一系列Li位掺杂实验,在LLZO原料中加入Ga2O3、Fe2O3和Al2O3,得到单元素或多元素掺杂的立方相LLZO,其中Ga和Al共同掺杂的LLZO,其室温离子电导率高达1.32×10-3S·cm-1。
4.2 La位掺杂
目前,LLZO掺杂改性主要集中在Li位和Zr位,较少针对La位,因为La位对LLZO的整个晶体结构影响较大,且决定了锂离子传输的瓶颈尺寸[82],故很难找到合适的掺杂离子。研究表明[61], 采用碱土金属(Ca,Sr,Ba)对La位进行取代,能够有效增加LLZO结构中的Li2位置上锂含量,同时减少Li1位置上的锂含量。Li2位置的锂离子要比Li1位置的更容易迁移[83],因而碱土金属掺杂对锂离子电导率的提高具有积极作用。Dumon等[61]通过传统固相合成法制备得到了室温离子电导率高达4.95×10-4S·cm-1的Sr掺杂立方相LLZO,而未掺杂的LLZO的室温电导率只有2.1×10-4S·cm-1。这表明碱土金属取代La位确实能够有效稳定LLZO的立方相晶格,同时提高其离子传导性能并降低晶界电阻。Dumon还指出由于Sr与La的离子半径大小最接近,掺杂后对结构和离子传输通道的影响更小,因而更适合锂离子的迁移,且掺杂后的LLZO离子电导率更高。除采用二价碱土金属对La位进行掺杂以外,还可以采用高价元素取代La元素,如Ce4+,高价元素掺杂可适当降低锂离子浓度,有利于离子电导率的提升。Rangasamy等[62]采用传统固相烧结法研究了不同掺杂含量(0 石榴石型无机固体电解质Li7La3Zr2O12(LLZO)室温下具有较高的离子电导率(10-4~10-3S·cm-1)和较低的电子电导率(<10-11S·cm-1),同时还具有与锂负极接触稳定、电化学稳定性和热稳定性良好、电化学窗口宽、无毒且成本低等优点,在未来的全固态锂离子电池的运用和发展中具有较高的研究价值和较好的实际应用前景。但其锂离子电导率相比于传统的液态有机电解液仍低了两个数量级,且目前大多数的制备方法都无法完全满足LLZO大规模生产的需求,这些因素均阻碍了LLZO的商业化生产和运用。因此,如何在减少制备成本、降低烧结温度、缩短合成周期的同时,提高LLZO锂离子电导率仍是LLZO无机电解质材料未来的研究方向和重点。 References [1] Bruce P G, Freunberger S A, Hardwick L J,etal.NatureMaterials[J], 2012, 11(2). [2] Dunn B, Tarascon J M.Science[J], 2011, 334(6058): 928-935. [3] Deviannapoorani C, Dhivya L, Ramakumar S,etal.JournalofSol-GelScienceandTechnology[J], 2012, 64(2): 510-514. [4] Tsai C L, Roddatis V, Vinod C C,etal.AcsAppliedMaterials&Interfaces[J], 2016, 8(16). [5] Kamaya N, Homma K, Yamakawa Y,etal.NatureMaterials[J], 2011, 10(9): 682-686. [6] Verma P, Maire P, Novák P.ElectrochimicaActa[J], 2010, 55(22): 6332-6341. [7] Cao C, Li Z, Wang X L,etal.FrontiersinEnergyResearch[J], 2014, 2: 1-10. [8] Knauth P.SolidStateIonics[J], 2009, 180(14-16): 911-916. [9] Arbi K, Lazarraga M G, Chehimi D B H,etal.Cheminform[J], 2004, 35(15): 1173-1181. [10] Stramare S, Thangadurai V, Weppner W.Cheminform[J], 2003, 34(52): 3974-3990. [11] Thangadurai V, Weppner W.Ionics[J], 2006, 12(1): 81-92. [12] Kozen A C, Pearse A J, Lin C F,etal.ChemistryofMaterials[J], 2015, 27(15). [13] Saienga J, Martin S W.JournalofNon-CrystallineSolids[J], 2008, 354(14): 1475-1486. [14] Thangadurai V, Kaack H, Weppner W J F.Cheminform[J], 2003, 34(27):437-440. [15] Nakayama M, Kotobuki M, Munakata H,etal.PhysicalChemistryChemicalPhysicsPccp[J], 2012, 14(28): 10008. [16] Murugan R, Thangadurai V, Weppner W.AngewandteChemieInternationalEdition[J], 2007, 46(41): 7778-81. [17] Awaka J, Takashima A, Kataoka K,etal.Cheminform[J], 2011, 42(18):60-62. [18] Zhang Y, Chen F, Tu R,etal.SolidStateIonics[J], 2015, 284: 53-60. [19] Awaka J, Kijima N, Hayakawa H,etal.JournalofSolidStateChemistry[J], 2009, 182(8): 2046-2052. [20] Meier K, Laino T, Curioni A.JournalofPhysicalChemistryC[J], 2014, 118(13): 6668-6679. [21] Zhang Y, Chen F, Rong T,etal.JournalofPowerSources[J], 2014, 268(3): 960-964. [22] Botros M, Djenadic R, Clemens O,etal.JournalofPowerSources[J], 2016, 309: 108-115. [23] Zhang Y, Cai J, Chen F,etal.JournalofAlloys&Compounds[J], 2015, 644:793-798. [24] Shao C, Liu H, Yu Z,etal.SolidStateIonics[J], 2016, 287: 13-16. [25] Yang T, Gordon Z D, Li Y,etal.JournalofPhysicalChemistryC[J], 2015, 119(27): 14947-14953. [26] Djenadic R, Botros M, Benel C,etal.SolidStateIonics[J], 2014, 263(10):49-56. [27] Lei C, Cheng H W, Jarry A,etal.AcsAppliedMaterials&Interfaces[J], 2015, 7(32):17649. [28] Allen J L, Wolfenstine J, Rangasamy E,etal.JournalofPowerSources[J], 2012, 206(1):315-319. [29] Lee J M, Kim T, Baek S W,etal.SolidStateIonics[J], 2014, 258(5): 13-17. [30] Hu Z, Liu H, Ruan H,etal.CeramicsInternational[J], 2016, 42(10): 12156-12160. [31] Kumar P J, Nishimura K, Senna M,etal.RscAdvances[J], 2016, 6(67). [32] Kotobuki M, Kanamura K, Sato Y,etal.JournalofPowerSources[J], 2011, 196(18): 7750-7754. [33] Buschmann H, Dölle J, Berendts S,etal.PhysicalChemistryChemicalPhysicsPccp[J], 2011, 13(43): 19378-92. [34] Rangasamy E, Wolfenstine J, Allen J,etal.JournalofPowerSources[J], 2013, 230(230): 261-266. [35] Chen R J, Huang M, Huang W Z,etal.SolidStateIonics[J], 2014, 265(6):7-12. [36] Cheng L, Park J S, Hou H,etal.JournalofMaterialsChemistry[J], 2013, 2(1): 172. [37] Yoo A R, Yoon S A, Kim Y S,etal.JournalofNanoscienceandNanotechnology[J],2016,16(11): 11662-8. [38] Xie H, Li Y, Goodenough J B.MaterialsResearchBulletin[J], 2012, 47(5): 1229-1232. [39] Kokal I, Somer M, Notten P H L,etal.SolidStateIonics[J], 2011, 185(1): 42-46. [40] Sakamoto J, Rangasamy E, Kim H,etal.Nanotechnology[J], 2013, 24(42):424005. [41] Shimonishi Y, Toda A, Tao Z,etal.SolidStateIonics[J], 2011, 183(1):48-53. [42] Jin Y, Mcginn P J.JournalofPowerSources[J], 2011, 196(20): 8683-8687. [43] Li Y, Han J T, Wang C A,etal.JournalofPowerSources[J], 2012, 209(4): 278-281. [44] Raskovalov A A, Il'Ina E A, Antonov B D.JournalofPowerSources[J], 2013, 238: 48-52. [45] Takano R, Tadanaga K, Hayashi A,etal.SolidStateIonics[J], 2014, 255(2): 104-107. [46] Rosenkiewitz N, Schuhmacher J, Bockmeyer M,etal.JournalofPowerSources[J], 2015, 278:104-108. [47] Lee C H, Park G J, Choi J H,etal.MaterialsResearchBulletin[J], 2016, 83: 309-315. [48] Takeuchi T, Kageyama H, Nakanishi K,etal.JournaloftheElectrochemicalSociety[J], 2010, 157(11): A1196. [49] Groza, She Jianfang(佘建芳).RefractoryMetalsandHardMaterialsAbroad(国外难熔金属与硬质材料)[J], 2001(1):18-20. [50] Wang X P, Xia Y, Hu J,etal.SolidStateIonics[J], 2013, 253(12):137-142. [51] Wolfenstine J, Ratchford J, Rangasamy E,etal.MaterialsChemistry&Physics[J], 2012, 134(2-3): 571-575. [52] Miara L J, Ong S P, Mo Y,etal.ChemistryofMaterials[J], 2013, 25(15): 3048-3055. [53] Rettenwander D, Geiger C A, Amthauer G.InorganicChemistry[J], 2013, 52(14): 8005-9. [54] Rettenwander D, Geiger C A, Tribus M,etal.JournalofSolidStateChemistry[J], 2015, 119: 266-271. [55] Howard M A, Clemens O, Kendrick E,etal.DaltonTransactions[J], 2012, 41(39): 12048-12053. [56] Wolfenstine J, Ratchford J, Rangasamy E,etal.MaterialsChemistry&Physics[J], 2012, 134(2-3): 571-575. [57] Wagner R, Redhammer G, Rettenwander D,etal.ChemistryofMaterials[J], 2016, 47(23): 1861-1871. [58] Bernuy-Lopez C, Manalastas W J, Miguel L D A J,etal.ChemMater[J], 2014, 26: 3610-3617. [59] Sun J, Zhao N, Li Y,etal.ScientificReports[J], 2017, 7:41217. [60] Rettenwander D, Redhammer G, Preishuber-Pflügl F,etal.ChemistryofMaterials[J], 2016, 28(7): 2384-2392. [61] Wu J F, Wei K P, Peterson V K,etal.AcsAppliedMaterials&Interfaces[J], 2017,9(14): 12461. [62] Dumon A, Huang M, Shen Y,etal.SolidStateIonics[J], 2013, 243(28): 36-41. [63] Rangasamy E, Wolfenstine J, Allen J,etal.JournalofPowerSources[J], 2013, 230(230): 261-266. [64] Baek S W, Lee J M, Kim T Y,etal.JournalofPowerSources[J], 2014, 249: 197-206. [65] Sun J, Zhao N, Li Y,etal.ScientificReports[J], 2017, 7: 41217. [66] Janani N, Ramakumar S, Kannan S,etal.JournaloftheAmericanCeramicSociety[J], 2015, 98(7): 2039-2046. [67] Buschmann H, Berendts S, Mogwitz B,etal.JournalofPowerSources[J], 2012, 206: 236-244. [68] Hayamizu K, Matsuda Y, Matsui M,etal.SolidStateNuclearMagneticResonance[J], 2015, 70:21-27. [69] Wei X, Huang M, Yang S,etal.ElectrochimicaActa[J], 2014, 115(3): 581-586. [70] Rettenwander D, Welzl A, Cheng L,etal.InorganicChemistry[J], 2015, 54(21): 10440-9. [71] Li Y, Wang Z, Cao Y,etal.ElectrochimicaActa[J], 2015, 180: 37-42. [72] Ramakumar S, Satyanarayana L, Manorama S V,etal.PhysicalChemistryChemicalPhysicsPccp[J], 2013, 15(27): 11327. [73] Cao Z Z, Ren W, Liu J R,etal.JInorgMater[J], 2014, 29: 220. [74] Ohta S, Kobayashi T, Asaoka T.JournalofPowerSources[J], 2011, 196(6): 3342-3345. [75] Liu C, Rui K, Shen C,etal.JournalofPowerSources[J], 2015, 282: 286-293. [76] Murugan R, Ramakumar S, Janani N.ElectrochemistryCommunications[J], 2011, 13(12): 1373-1375. [77] Hitz G T, Wachsman E D, Thangadurai V.JournaloftheElectrochemicalSociety[J], 2013, 160(8): A1248-A1255. [78] Rangasamy E, Wolfenstine J, Sakamoto J.SolidStateIonics[J], 2011, 206(1): 6. [79] Wolfenstine J, Sakamoto J, Allen J L.JournalofMaterialsScience[J], 2012, 47(10): 4428-4431. [80] Düvel A, Kuhn A, Robben L,etal.JournalofPhysicalChemistryC[J], 2012, 116(29): 15192. [81] Bernstein N, Johannes M D, Hoang K.PhysRevLett[J], 2012, 109(20): 1-8. [82] Geiger C A, Alekseev E, Lazic B,etal.InorganicChemistry[J], 2011, 50(3): 1089-1097. [83] Narayanan S, Ramezanipour F, Thangadurai V.JournalofPhysicalChemistryC[J], 2012, 116(38): 20154-20162. [84] Murugan R, Thangadurai V, Weppner W.AngewandteChemie[J], 2007, 34(27): 437-440. [85] Logéat A, Köhler T, Eisele U,etal.SolidStateIonics[J], 2012, 206(3): 33-38. Research Advance of Inorganic Solid Electrolyte Li7La3Zr2O12 ZHA Wenping, LI Junyang, YANG Dunjie, SHEN Qiang, CHEN Fei (State Key Lab of Advanced Technology for Materials Synthesis and Processing, Wuhan University of Technology, Wuhan 430070, China) At present, replacing traditional electrolytes with solid electrolytes to develop new all-solid-state lithium ion batteries has become an important technical method to solve the battery safety problems and improve the battery energy density. As the core material of all-solid-state lithium ion batteries, the performance of the solid electrolyte largely determines the performance of the battery. So far, many inorganic solid electrolyte materials have been studied, including crystalline solid electrolyte such as NASICON-type, LISICON-type, perovskite-type, and garnet-type and other glassy solid electrolyte such as oxide and sulfide. Among them, the garnet-type Li7La3Zr2O12has excellent comprehensively electrochemical performance, which promises it a more practical application potential and more research value. Experiments and theoretical calculations show that this material has a high lithium ion conductivity (10-4~10-3S·cm-1), and can contact with the negative metal lithium and most of the cathode material in a more stable state, and its electrochemical window is as wide as 6V. In this paper, we will introduce the crystal structure, preparation method and doping modification of Li7La3Zr2O12in detail basing on the research status at home and abroad in recent years, and then expound the development prospects and challenges of Li7La3Zr2O12as a solid electrolyte applying in all-solid-state lithium ion batteries. Li7La3Zr2O12; garnet-type; inorganic solid electrolyte; doping modification; lithium ion batteries TQ131.11 A 1674-3962(2017)10-0700-08 (编辑 盖少飞 吴 琛)4.3 Zr位掺杂

5 结 语

