水东湾海域浮游植物潮汐分布特征及其与环境因子的关系
施玉珍,张才学,张际标,陈春亮,赵利容,孙省利
广东海洋大学海洋资源与环境监测中心, 湛江 524088
水东湾海域浮游植物潮汐分布特征及其与环境因子的关系
施玉珍,张才学,张际标,陈春亮,赵利容,孙省利*
广东海洋大学海洋资源与环境监测中心, 湛江 524088
2014年秋、冬两季,每个季节在大潮期和小潮期对水东湾海域浮游植物群落结构和环境因子进行了调查,共鉴定出4门57属134种。其中硅藻门42属106种,占浮游植物种类数的79.1%;甲藻门13属26种,占浮游植物种类数的19.4%;蓝藻门1属1种,占浮游植物种类数的0.8%;针胞藻纲1属1种,占浮游植物种类数的0.8%。优势种 15 种,主要为尖布纹藻Gyrosigmaaluminatum、圆海链藻Thalassiosirarotula、中肋骨条藻Skeletonemacostatum、丹麦细柱藻Leptocylindrusdanicus和舟形鞍链藻Campylosiracymbelliformis等。4个航次共有种类数在18—40种,Jaccard种类相似性指数范围在0.200—0.404,多样性指数和均匀度平均值分别为2.60和0.60。秋季大、小潮期多样性指数差异较显著(P<0.05),冬季细胞丰度、多样性指数和均匀度大、小潮期均无明显差异。浮游植物细胞丰度变化范围为0.95×104个/L—28.0×104个/L,平均为6.86×104个/L,平均丰度冬季小潮期(9.46×104个/L)>秋季小潮期(7.56×104个/L)>冬季大潮期(5.97×104个/L)>秋季大潮期(4.44×104个/L)。主成分分析(PCA)表明:盐度和营养盐可能是影响水东湾海域生态环境的主导因子。对水东湾海域浮游植物群落结构与主要环境因子进行Spearman相关性分析,细胞丰度与盐度在秋季大、小潮期为负相关,在冬季大、小潮期呈显著正相关;与无机氮和磷酸盐在冬季大、小潮期呈极显著负相关,在秋季大、小潮期均无相关性。冬季小潮期水温与多样性指数、均匀度和细胞丰度均呈正相关;从测定结果来看浮游植物细胞丰度、多样性指数和均匀度与叶绿素a含量均无统计学意义上的相关性。
浮游植物;群落结构;多样性;环境因子;水东湾
浮游植物是海洋生态系统中重要的生产者,在海洋食物链中起着重要作用,其生长繁殖通常受栖息环境的直接影响[1],不同海域由于生态环境的不同其浮游植物群落也有较大差别。水东湾位于广东省茂名市电白县境内,是一个大型沙坝围抱的半封闭泻湖湾,内宽口窄,纳潮水域32 km2。湾内大部分水深小于2.5 m,湾口内水深5—9 m。连接泻湖与外海的潮汐通道,长约12.7 km,宽500—800 m,水深5—15 m,潮汐受外海潮波控制,属于不正规半日潮[2-3]。影响本岸段的主要动力因素是潮汐和波浪。
水东湾既是天然良港也是渔业生产的重要基地,目前湾内建有3千t级至3万t级的各类码头8个,年吞吐量达1732万t。已开发的海水养殖面积达1500 hm2。由于陆源物质的输入及养殖活动的影响,水东湾淤积严重,水域生态环境遭受严重污染。本文对2014年秋、冬两季不同潮期水东湾浮游植物的种类组成、数量分布及其与环境因子的关系进行了分析探讨,以期阐明该海域浮游植物物种潮汐分布特点及环境影响因素,其结果可为水东湾生态环境的保护与管理提供参考依据。
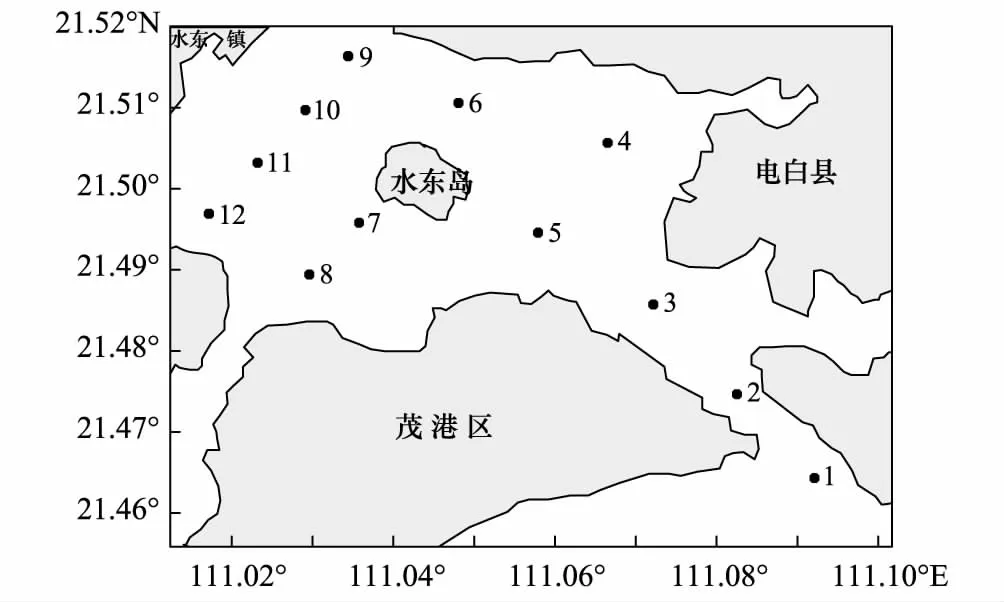
图1 水东湾采样站位Fig.1 Sampling stations in Shuidong Bay
1 材料与方法
1.1 样品采集与分析
于2014年9月(秋季)和2014年12月(冬季)两个季节,每个季节在大潮和小潮分别对水东湾海域的浮游植物和环境因子进行了共4个航次的调查,根据水东湾的地形地貌共布设了12个调查站位(图1),1—3站位位于潮汐通道也是港口航运区,8号站位靠近勤海码头,12号站位靠近海洋保护区。
浮游植物定性样品用浅水Ⅲ型浮游生物网自底至表垂直拖网采集,定量样品用采水器采集1L表层水样于聚乙烯瓶,加入5%福尔马林溶液固定,在实验室浓缩至50 mL,于显微镜下进行定性和定量分析。叶绿素a样品采集表、底层(离底部0.5 m)水样 500 mL,用(9+1)丙酮溶液萃取紫外-可见分光光度法测定[4]。其它主要相关环境因子的测试方法如下:水温用水温计、盐度采用Orion130A盐度计,亚硝酸盐采用盐酸萘乙二胺分光光度法、硝酸盐采用锌镉还原法、铵氮采用次溴酸盐氧化法、活性磷酸盐采用磷钼蓝分光光度法。每批样品测试时,采用国家环境保护部标准样品研究所的标准溶液做加标回收率实验,以保证测试结果的准确性。无机氮含量为亚硝酸盐、硝酸盐和铵氮测试结果之和[5]。
1.2 数据处理和统计分析
多样性指数[6]
式中,s为物种数,Pi为第i种在全部采样中的比例(Pi=ni/N),ni为第i种的个体数,N为所有种的个体总数。
均匀度[6]
J=H′/log2S
式中,H′为前式的多样性指数值,S为样品中总种类数。
优势度[6]
Y=(ni/N)·fi
式中,ni为某海岸带第i种的总个体数;N为某海岸带所有物种的总个体数,fi为第i种在某海岸带采样点出现的频率,以Y>0.02 作为优势种。
Jaccard 相似系数[7]
P=c·(a+b-c)-1
式中,a、b为两不同季节浮游植物种类数,c为两不同季节的共有种类数。
统计分析采用 SPSS软件(Statistical Program for Social Sciences) 17.0完成,等值线图采用Golden Software Surfer 8.0软件生成。
2 结果
2.1 浮游植物种类组成
水东湾海域浮游植物种类较多,4次调查共鉴定出4门57属134种(含变种、变型),其中硅藻门42属106种,占浮游植物种类数的79.1%;甲藻门13属26种,占浮游植物种类数的19.4%;蓝藻门1属1种,占浮游植物种类数的0.8 %;针胞藻纲1属1种,占浮游植物种类数的0.8 %。种类数以冬季大潮最多,达73种,冬季小潮次之,为67种,秋季大潮57种,秋季小潮42种(表1)。

表1 水东湾浮游植物种类组成和丰度的季节变化/(×104 个/L)
在硅藻门中圆筛藻属种类最多共12种,其次为盒形藻属、菱形藻属、斜纹藻属和根管藻属各7种;角毛藻属和直链藻属各6种;在甲藻门中原甲藻属种类最多,为6种,其次为角藻属和原多甲藻属,均为3种。4个航次调查均出现的广布种共有11种,其中硅藻10种,甲藻1种。共有种类数在18—40种,Jaccard种类相似性指数范围在0.200—0.404(表2)。冬季大、小潮期相似性指数最高为0.404;秋、冬两季大潮期相似性指数次之为0.358,其他季节间的种类相似性指数均较低;秋季大、小潮期相似性指数较低为0.289,秋季浮游植物的群落结构差异性较大,更替明显。
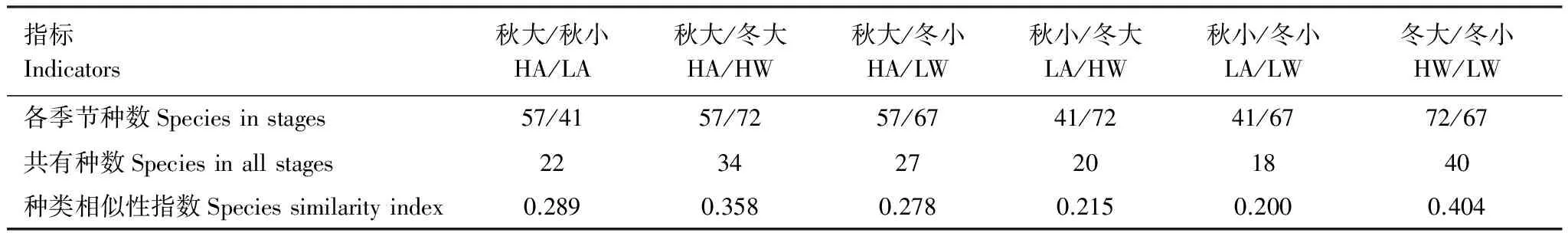
表2 2014水东湾季节间浮游植物种类相似性指数
HA: high tides in autumn; LA: low tides in autumn; HW: high tides in winter; LW: low tides in winter
水东湾海域浮游植物细胞丰度变化范围为47.75×104—83.7×104个/L,平均为63.24×104个/L。4个潮期浮游植物共有种类主要为硅藻,细胞数量硅藻占比均在95%以上;4个潮期共有种类还有甲藻,冬季大潮期最高占比3.91%,秋季小潮期最低为1.60%;其他门类的种类则很少,仅在冬季小潮期发现蓝藻门1种,秋季大潮期和冬季大、小潮期各发现针胞藻纲1种。
2.2 浮游植物的优势种群
本次调查共采到15种优势种,其中秋季大潮6种,秋季小潮7种,冬季大潮6种,冬季小潮8种(表3)。水东湾浮游植物群落是一个以硅藻为主导型的群落结构。优势种类主要为广温、广盐沿岸性种类,4个调查航次均为优势种的为温带沿岸性优势种圆海链藻;3个航次均为优势种的种类有2种,分别为广温广盐沿岸性优势种丹麦细柱藻和广温广盐广布优势种中肋骨条藻。优势度最高的是秋季大潮期的尖布纹藻,其优势度为0.532,占细胞总量的60.8%;其次是冬季大潮期的广温种舟形鞍链藻,优势度为0.414,占细胞总量的41.4%;秋季小潮期的第一优势种为中肋骨条藻,优势度大于0.1的还有圆海链藻和丹麦细柱藻,三者优势度均在0.14以上,它们共占细胞总量的57.9%;冬季大潮期的主要优势种为舟形鞍链藻,优势度为0.414,占了细胞总量的41.36%;冬季小潮期的主要优势种为舟形鞍链藻、圆海链藻、范氏瘤足斜斑藻和大洋脆杆藻,其优势度分别为0.234、0.223、0.093和0.090,占细胞总量分别为23.35%、22.34%、14.87%和10.33%。

表3 水东湾浮游植物的优势种
2.3 浮游植物多样性指数、均匀度和叶绿素a浓度的季节变化
水东湾浮游植物各航次多样性指数和均匀度都较低,多样性指数变化范围在2.07—2.98,平均为2.60;均匀度变化范围在0.52—0.65,平均为0.60。各航次多样性指数冬季小潮>秋季小潮>冬季大潮>秋季大潮;均匀度的排序为冬季小潮、秋季小潮>冬季大潮>秋季大潮。叶绿素a浓度冬季小潮最高,秋季小潮次之,秋季大潮期最低(表4)。应用方差分析t检验对水东湾海域秋季大、小潮期及冬季大、小潮期多样性指数和均匀度进行差异性分析,秋季大、小潮期多样性指数差异较显著,差异显著水平达0.029(P<0.05),其它P值均大于0.05,大、小潮期无明显差异。

表4 水东湾各季节浮游植物的多样性、均匀度和叶绿素 a 浓度
2.4 浮游植物丰度的平面分布和季节变化
水东湾海域各站位浮游植物细胞丰度变化范围为0.95×104个—28.0×104个/L,平均为6.86×104个/L,最大值出现在冬季小潮期的1号站位,为28.0×104个/L,最小值出现在冬季大潮期的12号站位,为0.95×104个/L,相差约30倍。4个航次的平均值1号站位最高,为15.19×104个/L,6号站位最低,为4.03×104个/L。平均丰度冬季小潮期(9.46×104个/L)>秋季小潮期(7.56×104个/L)>冬季大潮期(5.97×104个/L)>秋季大潮期(4.44×104个/L)。方差分析t检验表明秋、冬两季大小潮期的浮游植物细胞丰度P值均大于0.05,大、小潮期无明显差异性。
水东湾海域浮游植物细胞丰度的平面分布如图所示(图2),秋季大潮期浮游植物细胞丰度变化由西岸到东岸呈减小的趋势,水东岛以西等值线密集,浮游植物丰度变化较大,水东岛以东等值线稀疏丰度变化较小。秋季小潮期靠近水东镇附近的10号站位浮游植物细胞丰度较高,10号站位往外丰度呈减小趋势,该区域等值线密集,说明浮游植物细胞丰度变化幅度比较大。冬季大潮期和冬季小潮期分布规律较一致,均呈由湾里向湾口逐渐增大的趋势,与潮流方向相一致;湾内区域等值线稀疏,湾口附近等值线比较密集,说明湾内浮游植物细胞丰度变化比较小,而湾口区域丰度变化比较大。

图2 水东湾浮游植物丰度的平面分布和季节变化/(×104个/L)Fig.2 Horizontal distribution and seasonal changes of zooplankton in Shuidong Bay
3 讨论
3.1 水东湾海域浮游植物的群落特征
水东湾海域各季节浮游植物种类组成以硅藻为主,甲藻次之,从种类和数量来看硅藻类都占有绝对优势,属于硅藻型浮游植物群落。秋季大潮期以半咸水温带种尖布纹藻为主要优势种,尖布纹藻占细胞总量的60.8%,主要分布在水东岛以北海域,8—12号站位尖布纹藻平均丰度达12.1×104个/L。秋季小潮期的优势种主要以广温、广盐的近岸暖水种中肋骨条藻、圆海链藻和丹麦细柱藻等为主。秋季大、小潮期水东湾的生物群落由以尖布纹藻为主的羽纹硅藻类演替为以中肋骨条藻、圆海链藻和丹麦细柱藻等为主的中心硅藻类。冬季大、小潮期的第一优势种均为舟形鞍链藻,但冬季大潮期舟形鞍链藻占绝对优势,优势度达0.414,占细胞总量的41.4%,冬季小潮期的主要优势种除舟形鞍链藻外,还有圆海链藻、范氏瘤足斜斑藻和大洋脆杆藻等。从以上结果来看秋季大潮期尖布纹藻为绝对优势种,冬季大潮期舟形鞍链藻为主要优势种,尖布纹藻和舟形鞍链藻均为羽纹硅藻,偏向于底栖分布,在大潮期它们成为绝对优势种的主要原因可能与水东湾海域的生态环境及潮滩特征有关。水东湾为泻湖湾,湾内水深较浅大部分小于2.5 m,而且湾内滩涂宽阔,滩涂面积达2607 km2,滩涂年均生物量为335.39 g/m2,浅海底栖年均生物量为165.51 g/m2,栖息密度150个/m2[8]。另外水东湾北部区域有大片红树林,红树林面积近2000 hm2,在大潮期由于受潮汐和波浪影响,湾内表底水体混合作用加强,水深变浅,使偏向于底栖生活的硅藻更多地混入浮游群落中,在适宜的环境条件,这些藻类的生长竞争优势得到充分的体现而大量繁殖,从而抑制了其他种类的生存空间,物种多样性降低,成为优势种群。而小潮期湾内水体交换平缓,外来海水的涌入会加强,底栖硅藻的混入减弱,其优势度也相应下降。秋季和冬季优势种由尖布纹藻演替为舟形鞍链藻,从本文3.3节的讨论看,受沿岸河流影响比较大,流入水东湾的河流主要有旦场河、寨头河、南海河等,经水东镇、陈村镇等进入水东湾,秋季丰水期,河流的输入量增大,半咸水沿岸种尖布纹藻生长竞争优势增强,湾内靠近西北岸细胞丰度较大而湾口较小(图2)。冬季枯水期,径流减少,舟形鞍链藻等成为优势种,湾口细胞丰度较大而湾内较小。总体来看由于水东湾海域水浅、受潮汐和波浪影响大,浮游植物群落结构稳定性较差,容易受外界因素的影响,不同季节和不同潮期优势种更替较明显。
秋季大潮期和冬季大、小潮期各发现针胞藻纲1种。针胞藻纲中许多种类为有害赤潮原因种,已在世界各海区引起赤潮并造成养殖鱼类的大量死亡[9- 11]。本次在水东湾检出的为针胞藻类的海洋卡盾藻(Chattonella marina),国内卡盾藻赤潮首次于1991年春在南海大鹏湾发生[12],2000年卡盾藻在南海大亚湾海域大量出现,且于2003年夏在大亚湾发生赤潮,海洋卡盾藻已成为我国南方重要的有害赤潮原因种[13]。由于卡盾藻没有细胞壁,只要周围溶液的渗透压稍有变化,细胞立即崩解,本次采样中采用了常规固定剂福尔马林给精确分析造成了影响,虽然检出的卡盾藻数量极低,但在采样的三个潮期都有出现需引起重视。卡盾藻是一种沿岸性鞭毛藻类,在其生活史的某一时期会形成休眠孢囊,卡盾藻孢囊形成后,需要一段时间的强制性休眠时期,方可成熟萌发。日本沿海种类需在11℃下强制性休眠4个月以上才能成熟,15—18℃只有少数孢囊能成熟,20℃以上则不能成熟。成熟后的孢囊如遇到合适的环境条件,即可萌发形成游动细胞释放至水体中[13]。水东湾处于亚热带海域,大部分季节水温都在20℃以上,最低水温达16℃,水东湾海域的温度不能满足卡盾藻孢囊成熟条件。水东湾由于陆源物质的输入及养殖活动的影响,水域生态环境污染严重,水体处于富营养化状态。但到目前为止尚未发现有关水东湾海域针胞藻藻华发生的报道,由此作者认为,水东湾海域卡盾藻种源可能是通过船舶压舱水等途径偶然带来的已经休眠成熟了的孢囊,而不是来源于本地。卡盾藻作为沿岸水域重要的有害藻华种类,今后仍需加强针胞藻等赤潮物种的监测。
与南海其他海湾相比较(表5),水东湾海域浮游植物平均细胞丰度为6.86×104个/L,比流沙湾高大约2倍,与徐闻珊瑚区较接近,比其他海域拓林湾、大亚湾、深圳湾、湛江港、北部湾都要低得多。多样性指数除了比粤西海域、徐闻珊瑚区和北部湾低之外,比拓林湾、大亚湾、深圳湾都要高。与其出口外毗邻海域放鸡岛相比,冯波等2003年对放鸡岛海域浮游植物进行了四季调查,共鉴定出浮游植物57种,大多数属浮游硅藻,全年优势种主要为角毛藻属、丹麦细柱藻、脆根管藻和尖刺菱形藻,浮游植物丰度放鸡岛是水东湾的7倍,而多样性水东湾要高于放鸡岛。水东湾海域和放鸡岛海域在浮游植物的种类、丰度和多样性上均存在明显差异。水东湾内由于港口运输、养殖、及沿岸流等的影响,水质通透性较差,影响生物体的光合作用,造成湾内生物量较低。

表5 2014水东湾浮游植物群落结构和其他海湾的比较
3.2 水东湾海域浮游植物时空分布的影响因素
浮游植物的生长繁殖与光照、温度、盐度、营养盐(图3—图6)和摄食压力等密切相关。水东湾海域浮游植物细胞丰度总体来看冬季大于秋季,小潮期大于大潮期。这与徐闻珊瑚礁区[19]和北海近岸水域浮游植物冬季出现丰度高峰相一致[21]。造成水东湾海域秋季浮游植物丰度较小的原因,一方面主要是水温的影响,水东湾的浮游植物群落以硅藻为主,硅藻适于生长在低温、低盐和高氮磷比的环境中,硅藻随温度的波动较大,在18℃和21.5℃左右出现极大值[23]。水东湾海域秋季水温在25℃左右,冬季水温在19℃左右,冬季水温更利于硅藻类的生长。另一方面水东湾是天然渔港,养殖优质鱼、虾、贝类等,已开发的海水养殖面积达1400 hm2,目前有网箱近1万个,秋季为养殖中后期,水产品对浮游植物摄食量增大,尤其是滤食性贝类养殖产生的摄食压力是水东湾海域秋季浮游植物丰度相对较低的重要原因[24- 25]。
冬季小潮期浮游植物丰度出现高峰值可能主要与营养盐结构有关,海水中的营养盐结构对浮游植物的生长至关重要,浮游植物对环境中营养盐的吸收有一个特定的比例和浓度极限[26- 27],Nelson等[28]利用浮游植物生长动力学得出浮游植物生长所能利用营养盐的最低阈值,即营养盐的绝对限制标准,海水中若某一元素含量低于阈值(CDIN=1μmol/L;CP=0.1μmol/L;CSi=2μmol/L),则判定该元素为唯一的限制因子。Justic等[29]根据Si/N/P比值提出营养盐的相对限制标准;Dortch and Whitledge[30]结合营养盐的绝对和相对限制标准提出了一套营养盐的限制标准,若DIN≤1μmol/L,N/P<10则无机氮为限制因子;若P≤0.2 μmol/L,N/P>30,则磷酸盐为限制因子。从水东湾水质分析结果来看(表6),4个航次水东湾海域水质营养盐结构主要为低氮高磷,无机氮及磷酸盐含量均远高于Nelson等[28]所提出的浮游植物生长所能利用营养盐的最低阈值,水东湾的N、P含量是丰富的。但秋季大、小潮期N/P比均小于10,而冬季小潮期N/P营养盐结构更接近Redfield比值[31],有利于浮游植物的生长。
E: Eutrophication index; DIN: Dissolved inorganic nitrogen
秋季水东湾海域浮游植物细胞丰度的平面分布呈由湾内到湾口减小的趋势,秋季是粤西地区的丰水期,受沿岸流的影响,一些广温、广盐的沿岸种如尖布纹藻、中肋骨条藻、丹麦细柱藻、尖刺拟菱形藻等成为优势种,大潮期优势种尖布纹藻占了细胞总量的60.8%。小潮期中肋骨条藻、丹麦细柱藻等占细胞总量的40%以上,这些耐盐种一般在近海及河口的冲淡水区域大量出现[32- 33],测试结果表明1—6号站位的盐度在30以上,而6—12号站位盐度在30以下(图4),湾口较高的盐度(>30) 不利于近岸低盐种的生长繁殖[34],浮游植物生物量减少。因此,湾内浮游植物细胞丰度较高而湾口较低。
冬季大、小两个潮期平面分布则呈由湾内到湾口增大的趋势。该季节一方面水温较低在18℃左右(图3)。在此水温下,暖水性及种类会停止生长繁殖,暖温性种类则大量繁殖,成为优势种群,水温和光照成了该季节限制浮游植物生长的主要影响因素[35]。由于水东湾为泻湖型海湾,湾口区域航道较深,海水交换量大,水体比较清洁,透光性较好。湾内水动力条件较差,水体交换差,造成水体浑浊度较高,光照条件相对较弱。这可能是冬季浮游植物丰度湾口比湾内高的主要原因。

图3 调查海区表层水温的平面分布和季节变化 Fig.3 Horizontal distribution and seasonal changes of surface water temperature in investigated area

图4 调查海区表层盐度的平面分布和季节变化 Fig.4 Horizontal distribution and seasonal changes of surface salinity in investigated area
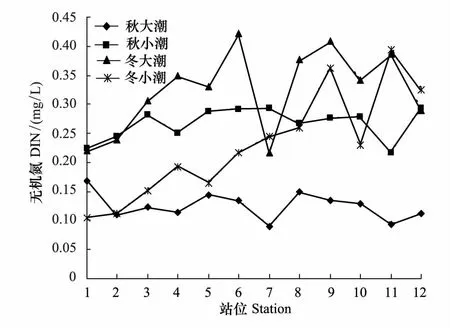
图5 调查海区无机氮含量的平面分布和季节变化 Fig.5 Horizontal distribution and seasonal changes of surface DIN in investigated area in
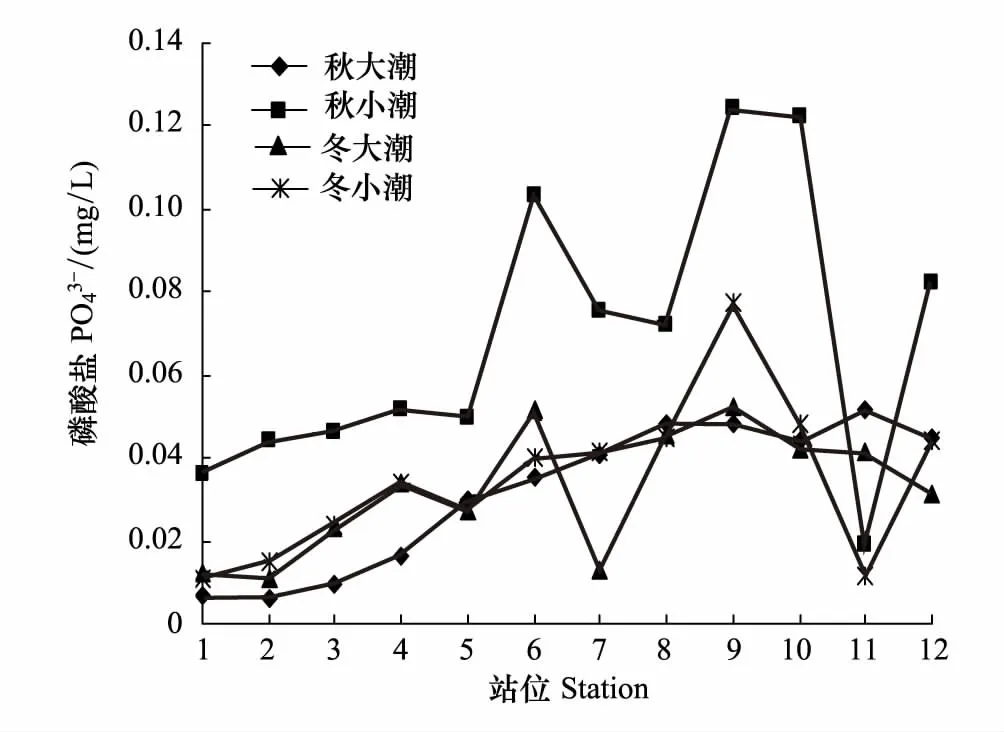
图6 调查海区表层磷酸盐的平面分布和季节变化 Fig.6 Horizontal distribution and seasonal changes Surface phosphate in nvestigated area
3.3 环境因子对水东湾海域浮游植物群落结构的影响
为更好反映影响水东湾海域生态环境的主导因子,对各季节水温、盐度、pH值、COD、亚硝酸盐、硝酸盐、氨氮、磷酸盐、无机氮、氮磷比、叶绿素a等11项环境因子进行了主成分分析。冬季小潮期特征值大于1的主成分因子有两个,其累积方差贡献为82.6%。其它3个潮期特征值大于1的主成分因子均为3个,其累积方差贡献均在79%以上。
对各季节因子荷载率(表7)进行分析可以看出,4个潮期第1主成分均包含了盐度,盐度的荷载率绝对值均较大,4个潮期第1主成分还主要包含了磷酸盐、无机氮等表征营养盐含量的因子。除此之外第1主成分因子荷载率较大的秋季为pH值,冬季为温度。4个季节第2主成分在叶绿素a、COD上有较高的荷载率,反映了水东湾海域浮游植物和有机物的污染状况。第2、3主成分因子和第1主成分因子相比重要性较低。因此,盐度和营养盐可能是影响水东湾海域生态环境的主导因子,而秋季pH值影响较大,冬季受温度的影响较大。

表7 水环境因子旋转后的因子荷载率
进一步对水东湾海域浮游植物群落结构与主要环境因子进行Spearman相关性分析(表8),结果表明,细胞丰度与盐度在秋季大、小潮期为负相关,冬季大、小潮期呈显著正相关。秋季为粤西地区丰水期,在秋季沿岸流作用下,海域盐度降低,更利于低盐沿岸种的繁殖,秋季大潮期半咸水种尖布纹藻成为绝对优势种,小潮期也主要为中肋骨条藻、丹麦细柱藻等沿岸种。而冬季的优势种为舟形鞍链藻、圆海链藻等海洋性种群,因此与盐度呈极显著正相关。冬季小潮期水温与多样性指数和均匀度呈正相关,与细胞丰度为极显著正相关。水温是冬季影响浮游植物种类组成及细胞丰度的关键因子[36]。冬季小潮期水温较低,各测试站位平均水温为18.7℃,温度是该季节一些浮游植物种类能否生存的敏感因素,温度过低使得一些暖水性生物停止生长繁殖,生物多样性和均匀度减小[37],随着温度升高一些耐温性海洋生物则大量繁殖,表明水温的升高有利于浮游植物的生长,这与国内外大量相关研究报结果类似[38]。细胞丰度与无机氮和磷酸盐在秋季大、小潮期均无相关性,在冬季大、小潮期均呈极显著负相关。秋季由于陆源输入及水产养殖的影响,一些沿岸性物种短时期内大量繁殖,而秋季也是水产养殖的中后期,对浮游植物的摄食量增大,导致营养盐结构比例失调(表6)。冬季小潮期由于N/P比接近16,更有利于浮游植物的生长繁殖,浮游植物细胞丰度较高,浮游植物丰度高的站位消耗的营养盐越多,浮游植物细胞丰度与营养盐呈极显著负相关。浮游植物细胞丰度、多样性指数和均匀度与叶绿素a含量均无统计学意义上的相关性。叶绿素a与浮游植物丰度通常有良好的线性关系,但这种线性相关特征只有在浮游植物丰度较高时才较为明显[39],水温、盐度、营养盐及浮游动物摄食等均会影响其关联性[40]。水东湾海域浮游植物群落在大小潮期间优势种急剧演替,由羽纹硅藻转为中心硅藻,周转速率快,羽纹硅藻是初级生产力的重要贡献者,尤其是在河口和近岸水域微小型硅藻是很多经济动物幼体的优质饵料生物。过于密集的网箱鱼排设施也会对光照产生较强的遮挡作用,并对浮游植物光合作用形成负面影响,网箱渔排养殖区叶绿素a浓度普遍低于其他调查站点[41]。另外羽纹硅藻的色素体为黄绿色或黄褐色,主要含有叶绿素a和c(没有叶绿素b)、日胡萝卜素、岩藻黄素和硅甲藻黄素[42],与中心硅藻的叶绿素有差异。可能浮游植物群落在急剧的演替过程中造成了不同站位浮游植物分布的种类和密度的不均匀,使得浮游植物群落特征与叶绿素a含量无统计学意义上的线性关系。另外由于本文用浅水Ⅲ型生物网采样,网孔径较大,使得链状硅藻更容易被浮游植物网采集到,而非链状的微藻则极易透过采集网的网孔,造成非链状微藻比例较少,由于采集网选择性的问题,也会导致统计关系方面的偏差。
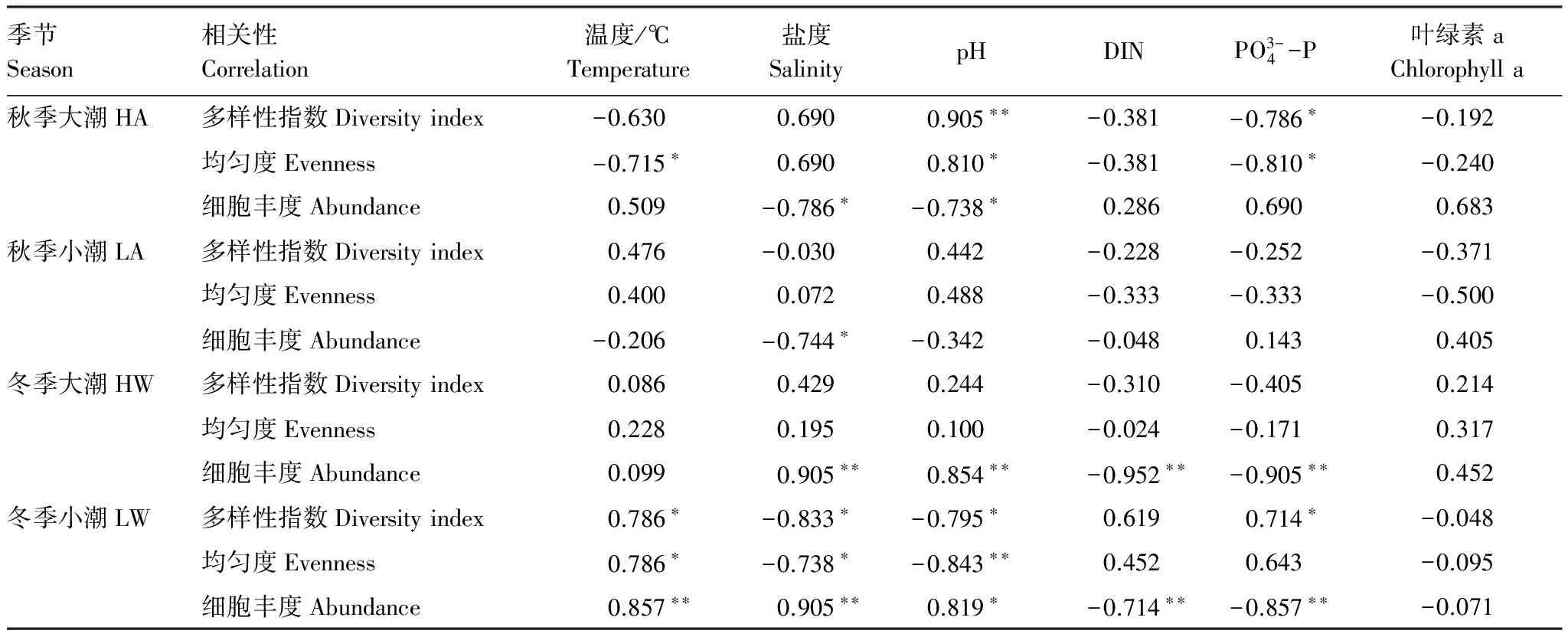
表8 水东湾浮游植物群落结构和环境因子的Spearman相关性
*显著水准为0.05(两尾)时相关显著;**显著水准为0.01(两尾)时相关显著
[1] Lalli C M, Parsons T R. Biological Oceanography: An Introduction. New York: Pergamon Press, 1993.
[2] 应秩甫. 水东潮汐通道和沿岸泥沙输移. 热带海洋, 1988, 7(4): 55- 61.
[3] 李春初, 应秩甫, 杨干然, 罗章仁. 粤西水东湾潮汐通道——落潮三角洲的动力地貌过程. 海洋工程, 1990, 8(2): 78- 88.
[4] 中华人民共和国国家标准. GB 17378.7- 2007 海洋监测规范 第7部分: 近海污染生态调查和生物监测. 北京: 中国标准出版社, 2008: 84- 85.
[5] 中华人民共和国国家标准. GB 17378.4- 2007 海洋监测规范 第4部分: 海水分析. 北京: 中国标准出版社, 2008: 57- 121.
[6] 沈国英, 施并章. 海洋生态学(第二版). 北京: 科学出版社, 2002: 158- 163.
[7] Jaccard P. Nouvelles recherches sur la distribution florale. Bulletin de la Societe Vaudoise Des Sciences Naturelles, 1908, 44: 223- 270.
[8] 林东年. 水东湾网箱养殖区水域环境状况评价. 水土保持研究, 2005, 12(4): 258- 260.
[9] Reguera B, Blanco J, Fernánde M, Wyatt T. Harmful Algae: Poceedings of the Ⅷ International Conference on Harmful Algae, Vigo Spain. International Oceanographic Commission of UNESCO, 1998: 93- 103.
[10] Tiffany M A, Barlow S B, Matey V E. Chattonella marina (Raphidophyceae) a potentially toxic alga in the Salton Sea California. Hydrobiology, 2001, 466(1/3): 187- 194.
[11] Anderson D M, Cembella A D, Hallegraeff G M. Physiological Ecology of Harmful Algal Bloom Berlin: Springer-Verlag, 1998: 95- 112.
[12] 齐雨藻, 黄长江. 南海大鹏湾海洋卡盾藻赤潮发生的环境背景. 海洋与湖沼, 1997, 28(4): 337- 342.
[13] 王朝晖, 齐雨藻, 陈菊芳, 徐宁. 大亚湾春季卡盾藻种群动态及其赤潮成因分析. 水生生物学报, 2006, 30(4): 394- 398.
[14] 周凯, 黄长江, 姜胜, 黄文魁, 董巧香. 2000—2001年柘林湾浮游植物群落结构及数量变动的周年调查. 生态学报, 2002, 22(5): 688- 698.
[15] 张玉宇, 吕颂辉, 齐雨藻. 2003—2004年大亚湾澳头养殖区水域浮游植物群落结构及数量变动特征. 海洋环境科学, 2008, 27(2): 131- 134.
[16] 张才学, 周凯, 孙省利, 肖燕冰, 陈春亮, 张际标, 张瑜斌. 深圳湾浮游植物的季节变化. 生态环境学报, 2010, 19(10): 2445- 2451.
[17] 蔡文贵, 李纯厚, 贾晓平, 高东阳. 粤西海域浮游植物种类的动态变化及多样性. 海洋环境科学, 2003, 22(4): 34- 37.
[18] 吕颂辉, 齐雨藻, 钱宏林, 梁松. 湛江港浮游植物与赤潮植物的初步研究. 海洋与湖沼, 1994, 25(2): 190- 196.
[19] 张才学, 孙省利, 谢伟良, 谢少英, 詹冬玲, 张瑜斌, 张际标, 陈春亮. 徐闻珊瑚礁区浮游植物的季节变化. 海洋与湖沼, 2009, 40(2): 159- 165.
[20] 张才学, 陈慧妍, 孙省利, 张瑜斌, 张际标, 陈春亮. 流沙湾海草床海域浮游植物的时空分布及其影响因素. 生态学报, 2012, 32(5): 1527- 1537.
[21] 周茜茜, 陈长平, 梁君荣, 骆巧琦, 高亚辉. 北部湾2006年夏季网采浮游植物种类组成与数量分布 //胡建宇, 杨圣云. 北部湾海洋科学研究论文集(第一辑). 北京: 海洋出版社, 2008: 171- 179.
[22] 冯波, 陈俊辉, 卢伙胜. 茂名市大放鸡岛海域浮游植物群落的季节变化. 海洋渔业, 2008, 30(1): 67- 73.
[23] 肖武鹏, 柳欣, 黄邦钦. 春季东海近岸表层浮游植物群落结构及其与环境因子的关系. 海洋学研究, 2013, 31(3): 76- 82.
[24] Macisaac H J, Sprules G, Johannson O E, Leach J H. Filtering impacts of larval and sessile zebra mussels (Dreissenapolymorpha) in western Lake Erie. Oecologia, 1992, 92(1): 30- 39.
[25] 韦蔓新, 何本茂. 钦州湾近20a来水环境指标的变化趋势. 浮游植物生物量的分布及其影响因素. 海洋环境科学, 2009, 28(4): 403- 409.
[26] 沈志良. 胶州湾营养盐结构的长期变化及其对生态环境的影响. 海洋与湖沼, 2002, 33(3): 232- 331.
[27] Song X X, Yu Z M, Yin K D, Qian P Y. Temporal and spatial distribution of nutrients and chlain the coastal area of Hong Kong. Oceanologia et Limnologia Sinica, 2013, 44(4): 846- 852.
[28] Nelson D M, Brzezinski M A. Kinetics of silicic acid uptake by natural diatom assemblages in two Gulf Stream warm-core rings. Marine Ecology Progress Series, 1990, 62(3): 283- 292.
[30] Dortch Q, Whitledge T E. Does nitrogen or silicon limit phytoplankton production in the Mississippi River plume and nearby regions. Continental Shelf Research, 1992, 12(11): 1293- 1309.
[31] Redfield A C. The biological control of chemical factors in the environment. American Scientist, 1958, 46(3): 205- 221.
[32] 顾新根, 袁骐, 杨焦文, 华棣. 长江口羽状锋海区浮游植物的生态研究. 中国水产科学, 1995, 2(1): 1- 15.
[33] 栾青杉, 孙军, 宋书群, 沈志良. 2004年秋季长江口及其邻近水域浮游植物群集. 海洋科学进展, 2008, 26(3): 364- 371.
[34] 朱根海, 宁修仁, 蔡昱明, 刘子琳, 刘诚刚. 南海浮游植物种类组成和丰度分布的研究. 海洋学报, 2003, 25(S2): 8- 23.
[35] Riegman R, Noordeloos A A M. Size-fractionated uptake of nitrogenous nutrients and carbon by phytoplankton in the North Sea during summer 1994. Marine Ecology Progress Series, 1998, 173: 95- 106.
[36] Liu C W, Lin K H, Kuo Y M. Application of factor analysis in the assessment of groundwater quality in a black foot disease area in Taiwan. Science of the Total Environment, 2003, 313(1/3): 77- 89.
[37] Sayeswara H A, Goudar M A, Manjunatha R. Water quality evaluation and phytoplankton diversity of hosahalli pond, Shivamogga, Karnataka (INDIA). International Journal of Chemical Sciences, 2011, 9: 805- 815.
[38] Mwaura F, Mavuti K M, Wamicha W N. Biodiversity characteristics of small high-altitude tropical man-made reservoirs in the Eastern Rift Valley, Kenya. Lakes and Reservoirs: Research and Management, 2002, 7(1): 1- 12.
[39] Tilzer M M. Secchi disk: chlorophyll relationships in a lake with highly variable phytoplankton biomass. Hydrobiologia, 1988, 162(2): 163- 171.
[40] 王雨, 林茂, 陈兴群, 林更铭. 海南西部近岸浮游植物的周年变化及主要关联因素. 水生生物学报, 2012, 36(4): 724- 734.
[41] 高亚辉, 梁君荣, 陈长平, 李雪松, 彭兴跃, 刘广发. 海洋硅藻多样性与生态作用研究. 厦门大学学报: 自然科学版, 2011, 50(2): 455- 464.
[42] 杜桂森. 羽纹硅藻类的细胞构造和繁殖. 生物学通报, 1991, (11): 6- 8.
EffectoftidalchangesandmajorenvironmentalfactorsonthedistributionofphytoplanktoninShuidongBay
SHI Yuzhen, ZHANG Caixue, ZHANG Jibiao, CHEN Chunliang, ZHAO Lirong, SUN Xingli*
MonitoringCenterofMarineResourcesandEnvironment,GuangdongOceanUniversity,Zhanjiang524088,China
Phytoplankton is the most important primary producer in marine ecosystems. Its growth and reproduction are affected by the biological characteristics of the different speciesas well as by environmental factors. Owing to the inflow of land-sourced material and mariculture activities, Maoming (Guangdong province), Shuidong Bay, a natural harbor and an important fishery production center, has become heavily polluted.In order to reveal the effect of tidal changes and major environmental factors on the distribution of phytoplankton in Shuidong Bay, the structure of the phytoplankton community and environmental factors were investigated during both high and low tides during the autumn and winter in 2014. As a result, 4 phyla, 57 genera and 134 species of phytoplankton were identified, including 42 genera and 106 species of diatoms, 13 genera and 26 species of dinoflagellates, and 1 species of cyanobacteria, accounted for 79.1%, 19.4% and 0.8% of the phytoplankton respectively. There were 15 dominant species, the major ones wereGyrosigmaaluminatum,Thalassiosirarotula,Skeletonemacostatum,Leptocylindrusdanicus, andCampylosiracymbelliformis.18—40 species were identified at each sampling, and the Jaccard species similarity index ranged from 0.200—0.404, with a diversity index and average uniformity of 2.60 and 0.60respectively.The diversity index, cell abundance, and evenness of the phytoplankton sampled during the high and low tides were significantly different (P<0.05) in the autumn but were not significantly different during the other seasons. Cell abundance, which ranged from 0.95×104to 28.0×104cells/L (mean=6.86×104cells/L), varied by season and tide: winter low tides (9.46×104cells/L) > autumn low tides (7.56×104cells/L) > winter high tides (5.97×104cells/L) > autumn high tides (4.44×104cells/L). Principal component analysis indicated that both salinity and nutrient content were likely the dominant environmental factors affecting the phytoplankton in Shuidong Bay. Meanwhile, correlation analysis indicated that cell abundance was negatively and positively correlated with salinity during the high and low tides of autumn and winter respectively, and negatively correlated with inorganic nitrogen and phosphate during the both the low and high tides of winter. In addition, water temperature was positively correlated with the diversity index, evenness, and cell abundance of phytoplankton sampled during the low tides of winter. However, none of the parameters was correlated with the content of chlorophyll a.
Phytoplankton; Community structure; Shannon-Weaver index; environmental factors; Shuidong Bay
2015年海洋公益性科研专项(20155027);广东省科技计划资助项目(2013B021600015)
2016- 06- 29; < class="emphasis_bold">网络出版日期
日期:2017- 04- 25
*通讯作者Corresponding author.E-mail: xinglsun@ 126.com
10.5846/stxb201606291286
施玉珍,张才学,张际标,陈春亮,赵利容,孙省利.水东湾海域浮游植物潮汐分布特征及其与环境因子的关系.生态学报,2017,37(18):5981- 5992.
Shi Y Z, Zhang C X, Zhang J B, Chen C L, Zhao L R, Sun X L.Effect of tidal changes and major environmental factors on the distribution of phytoplankton in Shuidong Bay.Acta Ecologica Sinica,2017,37(18):5981- 5992.

