“百草霜”对大刺鳅生长及其酶活性的影响
张 坤,樊海平,袁 帅,薛凌展,林 煜,钟全福,秦志清,胡 兵,张蕉南
(1福建天马科技股份集团有限公司,福州350308;2福建省特种水产配合饲料重点实验室,福州350308;3福建省淡水水产研究所,福州350002;4福建农林大学,福州350002)
“百草霜”对大刺鳅生长及其酶活性的影响
张 坤1,2,樊海平3,袁 帅4,薛凌展3,林 煜3,钟全福3,秦志清3,胡 兵1,2,张蕉南1,2
(1福建天马科技股份集团有限公司,福州350308;2福建省特种水产配合饲料重点实验室,福州350308;3福建省淡水水产研究所,福州350002;4福建农林大学,福州350002)
研究旨在考察饲料中添加不同水平的“百草霜”对大刺鳅生长、消化酶及非特异免疫活性的影响。将野生大刺鳅子一代(Mastacembelus aculeatus)幼鱼随机分成4组,每组3个平行,其中1组为饲喂鳗鲡配合饲料的对照组,另外3组分别为饲喂添加0.1%、0.5%、1.0%“百草霜”鳗鲡配合饲料的试验组,水温26~28℃,溶解氧5.0~6.0 mg/L,pH 6.5~7.5,饲养周期为56天。结果表明:与对照组相比,添加0.5%“百草霜”对大刺鳅增重率和特定生长率分别提高了24.76%和16.18%(P<0.05),而0.1%组饲料系数降低了30.23%(P<0.05)。添加“百草霜”未影响大刺鳅成活率(P>0.05)。胃蛋白酶在0.5%组最高(P<0.05);肠道及肝脏淀粉酶活力随着“百草霜”浓度的增大均呈先上升后下降的趋势,其中0.1%组效果最好,与对照组差异显著(P<0.05)。非特异性免疫指标的测定结果显示:添加0.1%和0.5%的大刺鳅肠道超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)的活性显著高于对照组(P<0.05),而肝脏过氧化氢酶活性在0.1%组达到最大(P<0.05),各组肝脏SOD、AKP、ACP与对照组无显著差异(P>0.05)。上述研究表明,饲料中添加剂量为0.1%~0.5%的“百草霜”能显著提高大刺鳅酶活性,满足生长需求。
大刺鳅;百草霜;消化酶;非特异免疫活性
0 引言
百草霜又称植物炭黑,为多种植物经部分或完全炭化活化而成,是一种具有特定物理化学性质的吸附剂,表现为比表面积大,吸附能力以及离子交换能力强等特点[1]。百草霜性温味辛,具有温胃消积、收敛止血等作用[2]。因其发达的孔隙结构有利于吸附有害菌以及霉菌毒素等,从而起到改善动物肠道菌群稳定,促进机体生长的目的[3]。目前已有研究表明百草霜对畜禽类的生长、疾病防治具一定作用[4-5],但作为饲料添加剂针对水产动物的影响研究尚未见报道。
大刺鳅(Mastacembelus aculeatus)属鲈形目刺鳅科,为底栖鱼类,主要分布在中国南方河流及湖泊中[6]。由于过度捕捞及环境污染等因素的影响,野生大刺鳅种质资源日益枯竭,福建省已将其列入重点保护的野生水生动物之一。目前针对大刺鳅的研究主要集中在形态学、分类学、苗种繁育和理化特征等方面[7]。初庆柱等[8]通过组织学研究表明大刺鳅消化系统区别于草食性鱼类,表现为食道短、胃发达、肠道短而直,该结构特点制约了大刺鳅的消化能力。由于目前尚未针对大刺鳅食性及生理结构研制的专用人工配合饲料,养殖生产中以鳗鲡配合饲料投喂,但发现转食鳗鲡配合饲料后,大刺鳅极易出现消化不良而发生肠炎病,特别是苗种培育阶段,肠炎病频繁发生,严重影响了苗种培育的成活率。
本试验以白头翁碳、艾叶碳、马齿苋碳复合制剂“百草霜”为添加剂,以“天马牌”鳗鲡配合饲料为饵料,考察添加不同剂量“百草霜”对大刺鳅生长性能、消化酶及免疫功能的影响,旨在为安全有效防控大刺鳅肠炎及该制剂于水产养殖中的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验用大刺鳅 顺昌县兆兴鱼种养殖有限公司利用野生大刺鳅繁育的子一代苗种,健康、活力良好,抽样检查无寄生虫,平均体重和体长分别为(11.28±2.21)g和(15.68±0.910)cm,暂养于直径1.5 m的玻璃纤维桶中,每天投喂鳗鱼配合饲料1次,投喂量为鱼体重的2%~2.5%,上午和下午各换水1次,每次换水量40%左右,暂养2周,稳定摄食后用于试验。试验于2016年7—9月进行。
1.1.2 百草霜 由福建省顺昌碳娃娃生物科技有限公司提供,主要成分为百草霜,白头翁碳、马齿苋碳和鱼腥草碳等≥90%,植物有机破壁微量营养素≥5%,主要功能为吸附病菌及有毒有害物质,由机体排出体外,改善水产动物胃肠道功能、增加消化力和免疫力、提高饲料转化率等。
1.1.3 试验饲料 鳗鲡配合饲料由福建天马科技股份集团有限公司提供,主要营养成分见表1。百草霜的添加量分别为干饲料重量的0.1%、0.5%和1.0%,先将百草霜用水制成悬浊液,然后按照鳗鱼饲料搅拌加工方法,水量为饲料干重1.6倍,将饲料混合成面团状,现制现用。
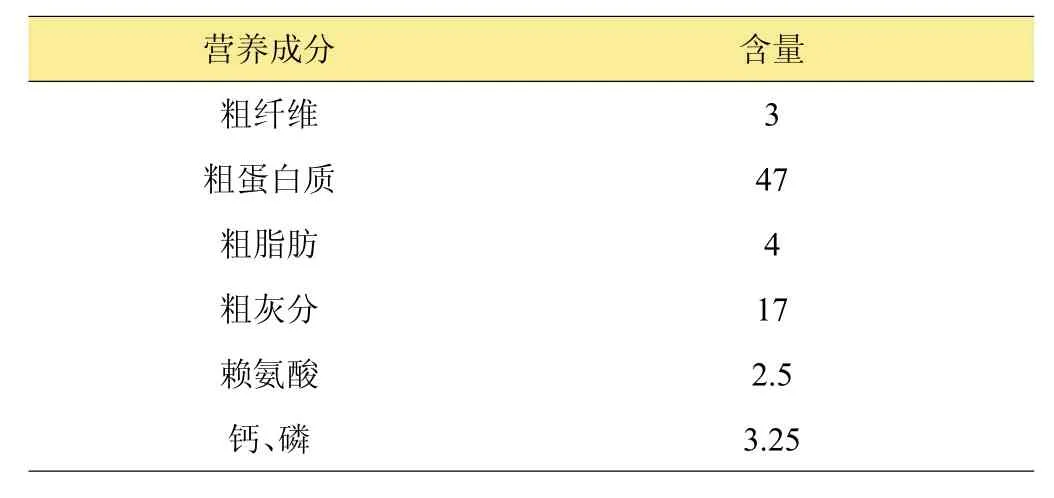
表1 鳗鲡配合饲料主要营养成分%
1.1.4 酶检测试剂 胃蛋白酶(PG)、淀粉酶(AMS)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)试剂盒,均购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 分组设计 3组为分别饲喂添加不同水平百草霜的鳗鲡配合饲料试验组,另1组为饲喂未添加百草霜的鳗鲡配合饲料对照组,每组设3个平行,每个平行放养试验用大刺鳅20尾。
1.2.2 试验条件 试验于150 L玻璃缸中放水135 L,水温保持在26~28℃之间,溶解氧5.0~6.0 mg/L,pH 6.5~7.5。每天7:00投喂一次,投饵量为鱼体总重的2%~2.5%,并分别于9:00及16:00进行虹吸排污和换水,日换水量80%。每隔10天,每缸抽取3尾大刺鳅,称体重后调整饲料量。每日记录饲料摄食量和死亡鱼尾数,试验连续8周。
1.2.3 样品采集与处理 试验第56天,逐尾称重鱼体重量,每组随机取9尾鱼(每个平行3尾),分别取肝脏、胃和肠道于预冷生理盐水中冲洗,滤纸吸干后加入9倍体积(V/W)的预冷生理盐水,冰水浴中匀浆制成10%组织液,3000 r/min离心10 min,取上清于-80℃保持备用,供组织相关酶活力测定。
1.2.4 生长指标测定 增重率(WGR,%)、特定生长率(SGR,%)、饲料系数(FCR)和存活率(SR,%)按照公式(1)~(4)计算。

式中:Wt为试验结束时鱼体质量(g),W0为试验开始时鱼体质量(g),t为饲喂天数(d),F为饲料摄食量(g),m0为试验初始尾数(ind.),mt为试验末尾数(ind.)。
1.2.5 酶指标测定 按照试剂盒说明书。
1.2.6 数据处理 试验数据采用SPSS 17.0软件进行Duncan法多重比较,P<0.05表示各组间差异显著。
2 结果与分析
2.1 百草霜对大刺鳅生长性能的影响
百草霜添加量为0.1%和0.5%试验组的增重率、特定生长率均明显提高,饲料系数明显降低(P<0.05)。0.5%组大刺鳅增重率和特定生长率较对照组分别提高24.76%和16.18%,为各组的最大值;0.1%组饲料系数较对照组降低了30.23%,为各组最小值。1.0%组的增重率和特定生长率与对照组差异不显著(P>0.05),但饲料系数降低了8.53%,与对照组显著差异(P<0.05)。各组试验期间存活率均为100%,详细情况见表2。
2.2 百草霜对大刺鳅消化酶活性的影响
2.2.1 百草霜对大刺鳅胃蛋白酶活性的影响 胃蛋白酶活性随着百草霜添加量的提高呈先上升后下降的趋势。添加量为0.5%组较对照组显著提高91.0%(P<0.05);0.1%组较对照组提高71.31%(P<0.05);1.0%组与对照组差异不显著(P>0.05),详细结果见图1。
2.2.2 百草霜对大刺鳅淀粉酶活性的影响 肠道及肝脏淀粉酶活性较对照组均有一定提高,且随百草霜添加量的提高呈先上升后下降的趋势。其中添加量0.1%组肠道及肝脏淀粉酶活性较对照组分别提高了104.03%、48.07%,与对照组显著差异(P<0.05)。0.5%组肠道淀粉酶活性显著高于对照组(P<0.05),而其余组淀粉酶活性与对照组差异不显著(P>0.05),详细结果见图2。
2.3 百草霜对大刺鳅非特异免疫活活性的影响
2.3.1 百草霜对大刺鳅总超氧化物歧化酶(T-SOD)的影响 百草霜对大刺鳅总超氧化物歧化酶(T-SOD)的影响结果如图3所示,大刺鳅肠道SOD活性随百草霜浓度增大呈现先上升后下降的趋势,其中0.1%、0.5%组SOD活力显著高于对照组,较对照组分别提高了29.69%、42.70%(P<0.05),而1.0%组肠道SOD活力与对照组无显著差异(P<0.05)。大刺鳅肝脏SOD活力随百草霜添加量增大呈现先上升后下降的趋势,其中0.1%和0.5%添加组SOD活力高于对照组,但无显著差异(P>0.05)。

表2 百草霜对大刺鳅生长性能的影响
2.3.2 百草霜对大刺鳅过氧化氢酶(CAT)的影响 百草霜对大刺鳅过氧化氢酶(CAT)的影响结果如图4所示,各试验组过氧化氢酶活力均高于对照组。大刺鳅肠道及肝脏过氧化氢酶含量随百草霜浓度增大呈现先上升后下降的趋势,其中肠道CAT活力在0.5%组达到最大,较对照组显著提高了61.87%(P<0.05);而肝脏的CAT活力在0.1%组达到最大,较对照组显著提高了54.93%。
2.3.3 百草霜对大刺鳅酸性磷酸酶(ACP)的影响 百草霜对大刺鳅ACP的影响结果如图5所示。大刺鳅肠道及肝脏ACP含量均随百草霜浓度增大呈现先上升后下降的趋势,其中试验组肠道ACP活性均高于对照组,于0.1%添加组达到最大,较对照组显著提高29.54%(P<0.05);而0.1%和0.5%组的肝脏ACP活性高于对照组,但差异不显著(P>0.05)。
2.3.4 百草霜对大刺鳅碱性磷酸酶(AKP)的影响 百草霜对大刺鳅AKP的影响结果如图6所示,3组“百草霜”添加量均能提高大刺鳅肠道AKP活性,随着添加浓度的提高AKP活性呈现先升后降的趋势,于0.1%组达到最大值,较对照组提高116.85%,且与对照组显著差异(P<0.05)。而百草霜对肝脏AKP活性未有显著影响,仅0.1%组略高于对照组(P>0.05)。
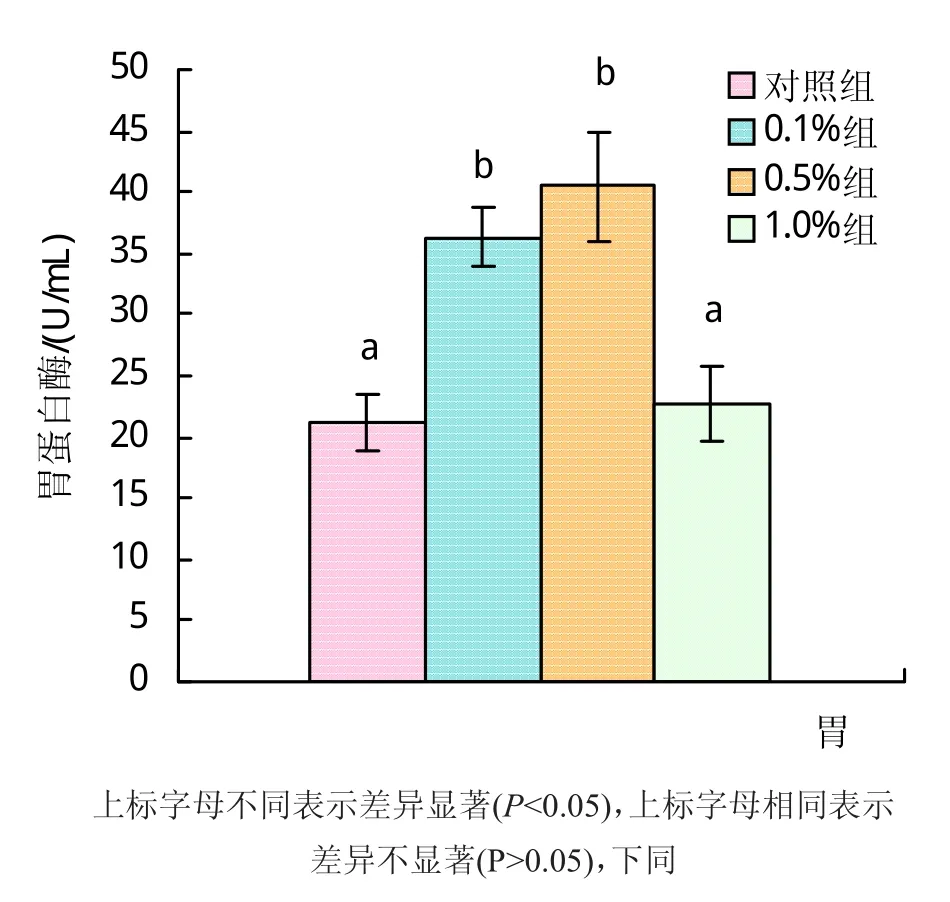
图1 百草霜对大刺鳅胃蛋白酶活力的影响

图2 百草霜对大刺鳅肠道及肝脏淀粉酶活力的影响

图3 百草霜对大刺鳅肠道及肝脏超氧化物歧化酶活力的影响

图4 百草霜对大刺鳅肠道及肝脏过氧化氢酶活力的影响
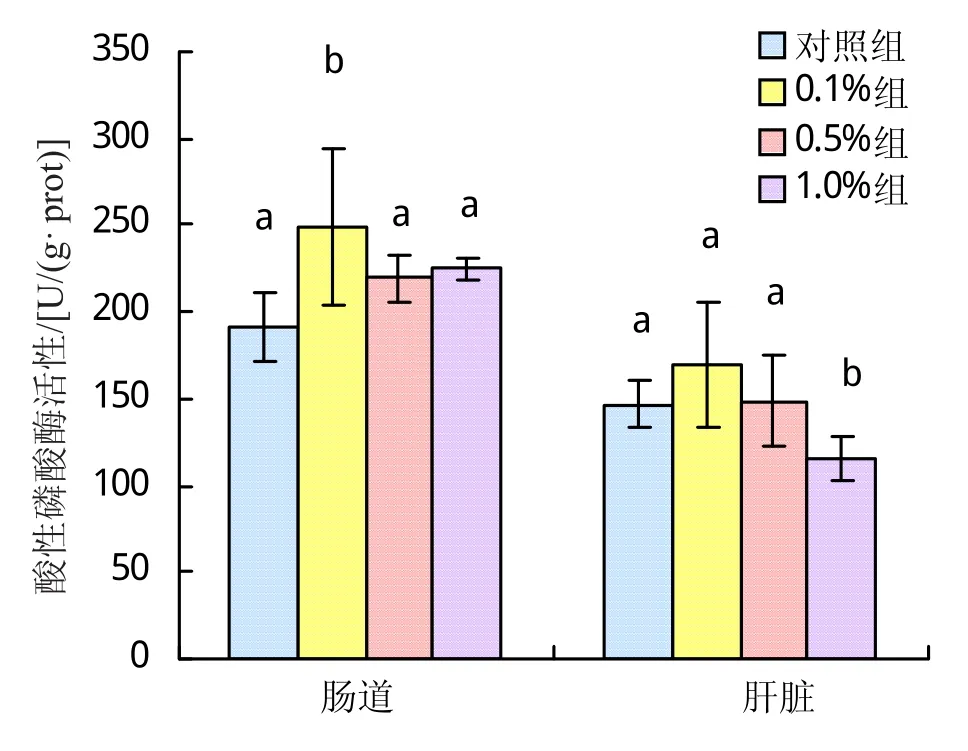
图6 百草霜对大刺鳅肠道及肝脏碱性磷酸酶活力的影响

图5 百草霜对大刺鳅肠道及肝脏酸性磷酸酶活力的影响
3 结论
在大刺鳅养殖过程中,肠炎病时有发生。肠炎又分为急性肠炎与慢性肠炎,其中急性肠炎常伴随细菌感染而导致较高的致死率,引起养殖鱼类急剧大量死亡。而慢性肠炎具有条件致病性、致死率低、持续时间长等特点,导致鱼类生长缓慢,饲料系数增加。当外界环境恶化或鱼体免疫力弱时,慢性肠炎会转为急性肠炎,造成养殖业严重损失,因此正视肠炎,做好预防工作并及早治疗,有利于降低养殖风险。本试验结果表明,“百草霜”能显著提高大刺鳅生长性能及酶活性,通过促进消化酶的分泌,提高机体非特异免疫活力,从而增强鱼体消化吸收能力,达到有效预防肠炎及其他细菌性疾病的目的。从效果来看,“百草霜”在大刺鳅饲料中的最适添加量为0.1%~0.5%。
4 讨论
4.1 “百草霜”对大刺鳅生长性能及消化酶活力的影响
鱼类肠道菌群作为细菌的资源库含有多种不同特性的细菌,其中部分细菌能分泌各种活性物质满足机体生长需求。消化道菌群的数量及组成对鱼体消化、免疫能力、抗外来菌群及寄生虫等起着决定作用[9]。目前众多研究表明优良的肠道菌群结构对机体生长具有促进作用:孙盛明等[10]通过在饲料中添加枯草芽孢杆菌改善团头鲂肠道内微生物平衡,从而达到刺激鱼体免疫,促进生长的目的;郭军等[11]发现在饲料中添加具独特吸附性的沸石,能有效维护鱼虾肠道健康,提高肠道的消化吸收功能,促进机体生长;肖曼等[12]研究不同水平酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响,结果显示酵母培养物通过促进有益菌生长、抑制有害菌增殖,进而提高生长性能。本试验结果表明,在基础饲料中添加0.1%、0.5%“百草霜”能显著提高大刺鳅增重率和特定增长率,降低饲料系数。这是由于商品“百草霜”以白头翁、马齿苋、鱼腥草、艾叶等天然植物为原料,经碳化活化后制得,其中有效组分为碳元素。因其比表面积大、空隙结构发达而具有优良的吸附性能。通过第三方检测表明“百草霜”碘吸附值≥600,对霉毒素、大肠杆菌、沙门氏菌等有害菌的吸附率均超过95%,通过改善肠道菌群,促进肠绒毛膜发育,提高消化吸收能力,从而促进养殖动物生长性能的提高。
消化酶是消化系统和消化腺分泌的具有消化作用的酶类。鱼体消化酶主要包括蛋白质分解酶、脂肪分解酶和糖类分解酶,其中主要糖类分解酶为淀粉酶。蛋白酶主要由胃和胰腺分泌,糖类分解酶主要分布在消化道中,且在消化道不同部位的活力不同[13]。消化酶活性是反映鱼类消化机能的重要生理指标,其含量的高低决定鱼类对营养物质的消化吸收能力,进而决定了鱼类生长发育的速度。本试验结果表明,饲料中添加“百草霜”后,大刺鳅的胃蛋白酶及肠道、肝脏淀粉酶活性均有所提高,其中添加量为0.5%时,胃蛋白酶活性显著高于对照组(P<0.05);添加量为0.1%时,肠道及肝脏淀粉酶显著高于对照组(P<0.05)。一般认为,活性炭对消化酶有以下作用。一是活性炭的静电作用及离子交换性能可改变胃肠道离子组成包括微量元素,这些微量元素有催酶和促酶作用[14-15];二是为消化酶提供适宜的pH值,消化酶活性受消化道pH值的影响很大,而活性炭对酸碱度的缓冲作用使消化酶具有更高的稳定性;另外,消化酶活性的提高还与活性炭巨大的表面积以及发达的内部微孔结构有关。由于微孔尺寸小,具有大量可供与食糜有效接触的界面,从而改善了消化道食糜的物理和化学特性,以利于消化酶与食糜的充分混合,使单位面积内消化酶有效接触底物的概率增加,从而反馈性刺激消化酶的分泌。
4.2 “百草霜”对大刺鳅非特异性免疫的影响
鱼类的免疫系统包括特异性及非特异性免疫,相较于哺乳动物,其特异性系统机制不完善。因此在抵御病害的入侵过程中,非特异性免疫发挥着更重要作用。超氧化酶歧化物(T-SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)可作为非特异性免疫功能强弱的评价指标,反映出机体的抗逆能力。其中T-SOD与CAT为主要的抗氧化酶,存在于体液及细胞内。前者通过与体内O2-发生歧化反应,达到消除自由基作用从而保护机体细胞免受损伤,后者通过促进H2O2分解,阻止羟基自由基形成,从而避免细胞遭受H2O2侵蚀,二者含量直接反映机体消除自由基的能力,关系着机体抗氧化能力的强弱。AKP及ACP是重要的生物体内功能调节酶。AKP通过催化磷酸单酯及基团的水解、转移,达到对钙质吸收、磷酸钙沉淀等作用,其含量大小关系到DNA、蛋白质及脂的代谢。ACP作为溶酶体标志酶,在细菌等异物的消化降解及转化能量、信号传导等方面发挥重要作用[16-18]。本试验结果表明饲料中添加“百草霜”可以提高大刺鳅肠道及肝脏中非特异免疫酶活性。其中添加量为0.5%时,大刺鳅肠道SOD、CAT活性最高,而二者在肝脏中的活性于0.1%组达到最大,添加量为0.1%时,肠道ACP及AKP活性均显著高于对照组,而肝脏中活性虽高于对照组,但差异不显著。笔者认为,“百草霜”对大刺鳅非特异性免疫的提高作用其机理主要是通过改善微生态环境以调节鱼体生理状态,进而影响了机体的免疫机能。正常菌群与宿主免疫系统之间的关系十分复杂,Wostmann[19]认为当无菌动物的肠道内缺乏细菌时,肠道形态被破坏导致免疫系统发育不良。其免疫细胞的结构较正常动物相比,表现为集合淋巴结发育不良,肠系膜淋巴结缺乏生发中心和浆细胞,细胞内的杀死致病菌的能力下降。而当无菌动物转变为常规的喂养或喂食益生菌后,它们的肠道的形态和免疫系统迅速发展,并开始产生大量的不同的抗体表型。这表明细菌可刺激肠道免疫系统的发展,与免疫系统相互协作进而影响机体免疫能力。另外由结果可知,随着“百草霜”添加量的增大,大刺鳅肠道及肝脏中4种非特异免疫酶活性均呈现先升高后下降的趋势,这表明持续投喂添加“百草霜”的鳗鲡配合饲料可能造成鱼体产生负反馈,导致肝脏过度负荷而受损,造成副作用,产生免疫疲劳。
[1]薛志成.良药百草霜[J].动物科学与动物医学,2003,20(1):591-592.
[2]吴一飞,倪士峰,杨波,等.中药百草霜的药学研究概况[J].海峡药学,2010,22(3):83-84.
[3]万怡灶,王玉林,周福刚,等.温廷益载银活性碳纤维对大肠杆菌吸附作用的研究[J].环境科学学报,1999,19(3):328-331.
[4]鲁必均,李金容,蒋蜀刚.百草霜在畜禽疾病防控中的应用[J].中国畜牧兽医文摘,2016,32(11):234.
[5]王笃兰.用百草霜巧治畜禽疾病[J].兽药与饲料添加剂,2007,4:26.
[6]Yang L P,Zhou W.A Review of the genusMastacembelus(Perciformes,Mastacembeloidae)in China a with descriptions of two new species and one new record[J].Acta Zootaxonomica Sinica,2011,36(2):325-331.
[7]刘霆,李建光,贺兵,等.大刺鳅的性腺调查和怀卵量比较分析[J].淡水渔业,2005,35(5):28-30.
[8]初庆柱,陈刚,张健东,等.大刺鳅消化系统的组织学研究[J].淡水渔业,2003,39(2):14-18.
[9]李莉.草鱼肠道菌群的变化和免疫机能的关系[D].武汉:华中农业大学,2003.
[10]孙盛明,苏艳莉,张武肖,等.饲料中添加枯草芽孢杆菌对团头鲂幼鱼生长性能、肝脏抗氧化指标、肠道菌群结构和抗病力的影响[J].动物营养学报,2016,28(2):507-514.
[11]郭军,刘铁钢,赵全东.沸石在水产中的应用[J].黑龙江水产,2012(5):19-21.
[12]肖曼,高振华,李兴华,等.酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响[J].动物营养学报,2013,25(7):1624-1631.
[13]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996.
[14]庚莉萍,白杉.开发矿物饲料添加剂十分必要[J].矿业快报,2004,3:30.
[15]Chingombe P,Saha B,Wskeman R J.Surface modification and characterization of a coal-based activated carbon[J].Carbon,2005(43):3132-3143.
[16]Irwin F.Biological Effects of the Superoxide Radical[J].Archibes of Biochemistry and Biophysis,1986,247:1-11.
[17]Frank V B,Eva V,James F,et al.The role of active oxygen species in plant signal transduction[J].Plant Science,2001,161:405-414.
[18]Cohn Z A.The activation of mononuclear phagocytes:fact,fancy and future[J].Journal of Immunology,1978,121(3):813-816.
[19]Wostmann B. Immunology, including radiobiology and transplantation[A].Wostmann B S.Germffee and gnotobiotic animal models[M].Boca Raton.F L:CRC Press,1996,101-112
Feeding Vegetable Carbon Black Affecting Growth Performance and Enzyme Activities in Mastacembelus aculeatus
Zhang Kun1,2,Fan Haiping3,Yuan Shuai4,Xue Lingzhan3,Lin Yu3,Zhong Quanfu3,Qin Zhiqing3,Hu Bing1,2,Zhang Jiaonan1,2
(1Fujian Tianma Science and Technology Group Co.,Ltd,Fuzhou 350308,Fujian,China;2Fujian Key Laboratory of Special Aquatic Formula Feed,Fuzhou 350308,Fujian,China;3Freshwater Fisheries Research Institute of Fujian Province,Fuzhou 350002,Fujian,China;4Fujian Agriculture and Forestry University,Fuzhou 350002,Fujian,China)
We aim to analyze the effects of vegetable carbon black at different levels on growth performance,digestive enzymes and non-specific immune activities of wild F1juvenile Mastacembelus aculeatus.A basal diet without adding vegetable carbon black and three test diets containing 0.1%,0.5%and 1.0%vegetable carbon black were prepared to feed four groups of M.aculeatus in triplicate respectively.The feeding experiment was conducted in 12 tank systems(150 L each)at a controlled water temperature of 26-28℃,dissolved oxygen of 5.0-6.0 mg/L and pH 6.5-7.5 for eight weeks.The results showed that compared with thecontrol group,the weight gain rate and specific growth rate of 0.5%vegetable carbon black group significantly increased by 24.76%and 16.18%respectively(P<0.05),and feed conversion rate of 0.1%vegetable carbon black group significantly reduced by 30.23%(P<0.05).Survival rate was not affected by vegetable carbon black(P>0.05).The activity of pepsin was the highest in the group of 0.5%vegetable carbon black(P<0.05).The activities of amylase in both intestine and liver first increased and then decreased with the increase of vegetable carbon black,with the highest value in the group of 0.1%vegetable carbon black(P<0.05).In the respect of non-specific immunity,the addition of 0.1%and 0.5%vegetable carbon black in diet had significant effect on activities of SOD,CAT,ACP,AKP in intestine(P<0.05).And the CAT activity in liver was the highest in the group of 0.1%vegetable carbon black(P<0.05).But SOD,AKP,ACP activities in liver were no affected in all the tested groups(P>0.05).It can be concluded that the growth performance and the activities of enzymes inM.aculeatuscould be improved by adding 0.1%-0.5%vegetable carbon black.
Mastacembelus aculeatus;Vegetable Carbon Black;Digestive Enzymes;Non-specific Immunity
S963.73
A论文编号:cjas16120017
福建省农业生物资源保存中心项目“福建省大刺鳅种质资源保护与开发应用”(FJZZZY-1501);福建省公益类科研院所基本科研专项“大刺鳅养殖主要病害调查与防控技术研究”(2016R1002-1);福建省属公益类科研院所基本科研专项“大刺鳅苗种批量人工培育技术研究”(2015R1002-1);福建省公益类科研院所基本科研专项“大刺鳅配合饲料的研制”(2017R1002-2);福建省省属公益类科研院所基本科研专项“大刺鳅循环水生态养殖技术研究”(2017R1002-1)。
张坤,男,1990年出生,硕士,研究方向:水产病害防治技术。通信地址:350308福建省福清市上迳镇排边工业园、福建天马科技集团股份有限公司,Tel:0591-85628337,E-mail:249916058@qq.com。
樊海平,男,1967年出生,硕士,研究员,主要从事水产养殖动物病害研究。通信地址:350002福州市西洪路555号福建省淡水水产研究所,Tel:0591-83732003,E-mail:fanhaiping16@163.com。
2016-12-18,
2017-05-02。

