二氢睾酮诱导小鼠雄激素性脱毛的机制研究
林蕾 杨梦洁 吴骁 王少敏 倪曙民 叶孟 高晶
二氢睾酮诱导小鼠雄激素性脱毛的机制研究
林蕾 杨梦洁 吴骁 王少敏 倪曙民 叶孟 高晶
目的 通过建立二氢睾酮(DHT)诱导的雄激素性脱毛(AGA)小鼠模型,研究DHT导致AGA发生、发展的相关分子机制。方法 采用DHT浓度梯度法对112只正常适龄雌性小鼠进行皮下给药,并通过人工脱毛使小鼠毛发生长周期同步化。通过HE染色观察DHT处理后不同时期小鼠毛囊形态结构及毛囊数目的改变,以确定AGA小鼠模型的建立。采用RT-PCR法对影响不同时期毛囊循环再生的相关信号分子的mRNA表达水平进行分析并比较。结果 不同浓度DHT处理后的小鼠在毛发生长不同阶段均表现出典型的毛囊小型化和毛发稀疏。在整个毛发生长周期中雄激素受体(AR)的mRNA表达水平几乎都呈上升趋势,而在第40、48天呈下降趋势。通过对毛囊干细胞表面标志物的mRNA表达水平分析发现,富含亮氨酸重复序列的G蛋白偶联受体5(Lgr5)的mRNA表达水平在毛发生长期-休止期VI期之间呈下降趋势,而CD34的mRNA表达水平无明显变化。外源性增加DHT剂量,细胞内AR的mRNA表达水平也相应增加,促毛发生长因子如成纤维细胞生长因子受体(FGFR)、人胰岛素样生长因子结合蛋白-5(IGF-BP5)、Ptch1及Wnt信号相关蛋白的mRNA表达水平降低。结论 DHT处理后可成功诱导AGA小鼠模型。DHT能够活化真皮乳头细胞中的AR受体,与毛囊上皮细胞相互作用,对促毛发生长因子FGFR、IGF-BP5、Ptch1及Wnt信号相关蛋白的表达产生抑制作用。
二氢睾酮 雄激素受体 脱毛 模型 信号通路
1 材料和方法
1.1 实验动物、分组及建模 SPF级C57BL/6雌性小鼠112只,5~6周龄,体重18~22g,购于江苏常州卡文斯实验动物有限公司[清洁级,编号:SCXK(苏)2016-0010],饲养于宁波大学实验动物中心。饲养条件:25°C室温,相对湿度 50%~70%,12h(7:00~19:00)明和 12h(19:00~7:00)暗条件下,每笼4只,不限饮食和水。根据预实验结果,采用随机数字表法将小鼠分为4组:对照组(玉米油给药),实验1组(DHT 5mg/kg给药),实验2组(DHT 7.5mg/kg给药)和实验3组(DHT 10mg/kg给药),每组28只。DHT购于美国Sigma公司(批号521-18-6),玉米油购置中国阿拉丁公司(批号8001-30-7),浓度均配制为10mg/ml。分别每日于小鼠背部皮下注射给药,给药5d后对小鼠进行脱毛处理,脱毛处理后的小鼠继续每日皮下给药至指定天数,拍照记录小鼠毛发生长状况;至指定天数后对小鼠进行颈椎脱臼处死,以小鼠给药点为中心剪取1cm3的全皮组织。组织样品分成两部分,一部分用包埋剂包埋冻存于-80°C,用于组织切片;另一部份用RNA样品保存液处理后冻存于-80°C用于RT-PCR检测。
1.2 小鼠毛囊形态结构观察 将附有组织的载玻片至于-20°C冷甲醇溶液中固定30min。用双蒸水(ddH2O)洗去载玻片上残余的OCT,浸泡于苏木素溶液中染色10min,ddH2O除去组织周围残余的染液,浸入1%氯化氢-乙醇分化液中分化15s,水洗后再浸入1%氨水中30s返蓝,水洗并在伊红染液中染色30s。水洗后进行乙醇浓度梯度脱水,然后置于二甲苯中进行透明处理30 min,用中性树胶进行封片,晾干后在光学显微镜下观察毛囊形态结构,并拍照记录。
1.3 mRNA表达水平检测 采用RT-PCR法。(1)小鼠毛囊中已知AGA突变基因的mRNA表达水平,包括DHT 代谢的关键酶[5α-还原酶Ⅰ型(5alpha1)和 5α-还原酶Ⅱ型(5alpha2)]、AR;(2)小鼠皮肤中毛囊干细胞(HF-SC)活性标记物角蛋白K15、富含亮氨酸重复序列的G蛋白偶联受体5(Lgr5)、CD34的mRNA表达水平;(3)小鼠毛囊中毛发生长相关因子如表皮生长因子受体(EGFR)、成纤维细胞生长因子受体(FGFR)、人胰岛素样生长因子结合蛋白-5(IGF-BP5)、血小板衍生因子α(PDGFRα)、Ptch1、转化生长因子 β(TGF-β)、血管内皮生长因子受体(VEGFR)、Wnt信号相关蛋白的mRNA表达水平;(4)小鼠毛囊中细胞外基质(ECM)相关因子如层黏连蛋白 α1、α3和 α5(LMα1、LMα3和 LMα5)、胶原 α6(Collagen α6)、粘连蛋白(Fibronectin)、巢蛋白 1和2(Nidogen1和Nidogen2)的mRNA表达水平。利用引物设计软件Primer Premier5.0进行引物设计,引物均由英潍捷基(上海)贸易有限公司合成。利用逆转录PCR将提取的总RNA以Oligo(dT)18为引物,反转录合成cDNA,用于后续实验,所记录的电泳图用Image J软件进行灰度值分析,读取每个样品基因的灰度值,并计算其相对含量。
1.4 统计学处理 应用SPSS 18.0统计软件;计量数据
2 结果
2.1 各AGA模型组小鼠毛发的变化 实验组小鼠毛发生长速度较对照组缓慢,且实验1组和实验2组小鼠毛发表型与AGA患者类似。在脱毛后的第1个毛发生长周期(第0~40天)中,早期(第0~8天)实验组小鼠和对照组间比较没有差异,皮肤中没有黑色素的积累;第10天实验3组和对照组小鼠背部皮肤开始变黑,而实验1组和实验2组小鼠在第10天之后开始逐渐变黑;在第25天,对照组小鼠脱毛部位毛发已经完全长出,而实验组小鼠部分皮肤直至第1个毛发生长周期结束也没有长出毛发,见图1。在脱毛后的第2个毛发生长周期(第40~65天)中,实验1组和实验2组部分小鼠在脱毛后的第1个毛发生长周期中未长出毛发的部位开始逐渐长出毛发,皮肤变黑,但毛发生长很快就结束,皮肤又开始变白;实验组3组与对照组比较无明显差异,见图2。
2.2 各AGA模型组小鼠不同时期毛囊形态结构比较见图3。
由图3可见,第12、65天对照组小鼠皮肤中含有完整、成熟的毛囊结构,其球状部位向下延伸至皮下,毛囊处于毛发生长初期Ⅵ期;而实验组小鼠毛囊均处于真皮层中,毛囊球状结构均呈萎缩状态,处于毛发生长终期与毛发生长初期V期之间。而在第48、52天,对照组与实验3组小鼠皮肤中都含有完整、成熟的毛囊结构,其球状部位向下延伸至皮下,处于毛发生长初期Ⅵ期;而实验1组和实验2组小鼠皮肤中没有完整的毛囊结构,毛囊球状结构萎缩并位于真皮层中。
2.3 各AGA模型组小鼠不同时期皮肤中毛囊数目比较 见图4。
由图4可见,不同时期各组小鼠皮肤中毛囊数目比较均有统计学差异(均P<0.05);实验 1、2、3组小鼠毛囊数目均少于对照组(均P<0.05)。
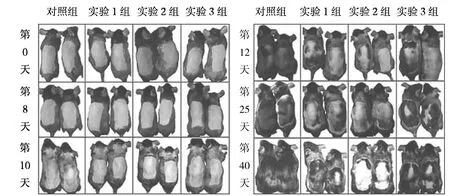
图1 各组小鼠第1个毛发生长周期的毛发表型
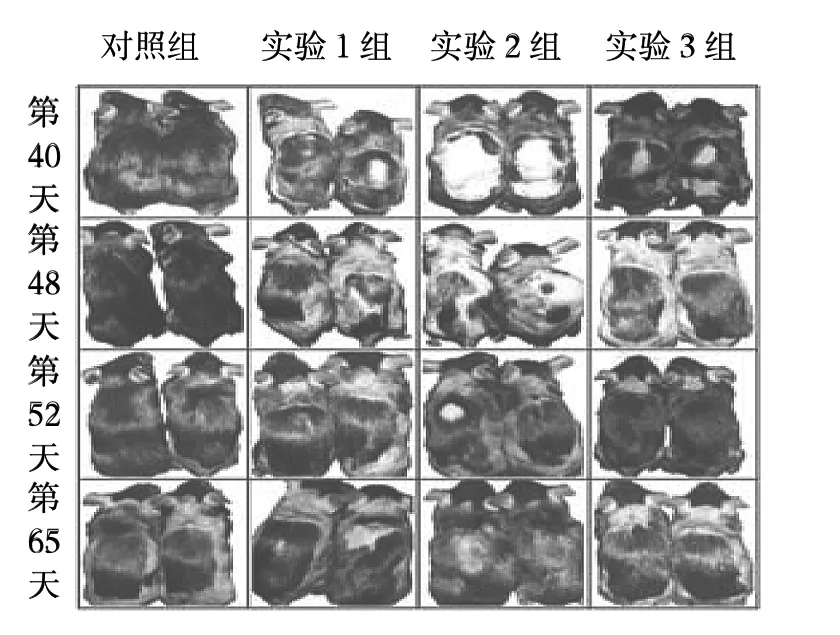
图2 各组小鼠第2个毛发生长周期的毛发表型
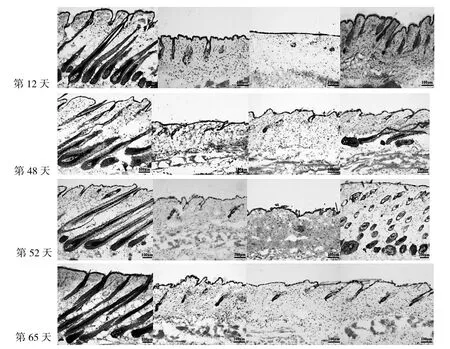
图3 各AGA组小鼠不同时期毛囊形态结构比较(HE染色,×10)
2.4 实验1组与对照组小鼠毛囊中不同时期AGA突变基因的mRNA表达水平比较 见图5。
由图5可见,第12、25、52、65天实验1组小鼠毛囊中AR的mRNA表达水平均高于对照组(均P<0.05),而第40、48天两组小鼠毛囊中AR的mRNA表达水平与对照组比较均无统计学差异(均PP>0.05)。第12、48、52、65天实验1组小鼠毛囊中5alpha2的mRNA表达水平均低于对照组(均P<0.05),而第25、40天组小鼠毛囊中5alpha2的mRNA表达水平与对照组比较均无统计学差异(均 P >0.05)。第 12、25、40、48、52、65天实验1组小鼠毛囊中5alpha1的mRNA表达水平比较均无统计学差异(均PP>0.05)。
2.5 实验1组与对照组小鼠毛囊中不同时期HF-SC活性标记物mRNA表达水平比较 见图6。
由图6可见,第12、65天实验1组小鼠毛囊中K15的的mRNA表达水平均低于对照组(均P<0.05),第25、40、48、52天实验1组小鼠毛囊中K15的mRNA表达水平与对照组比较均无统计学差异(均PP>0.05)。第12、48、52和65天实验1组小鼠毛囊中Lgr5的mRNA表达水平均低于对照组(均P<0.05),而第25、40天实验1组小鼠毛囊中Lgr5的mRNA表达水平与对照组比较均无统计学差异(均 P >0.05)。第 12、25、40、48、52、65天实验1组小鼠毛囊中CD34的mRNA表达水平与对照组比较均无统计学差异(均PP>0.05)。
2.6 实验1组与对照组AGA小鼠毛囊中不同时期毛发生长相关因子的mRNA表达水平比较 见图7。
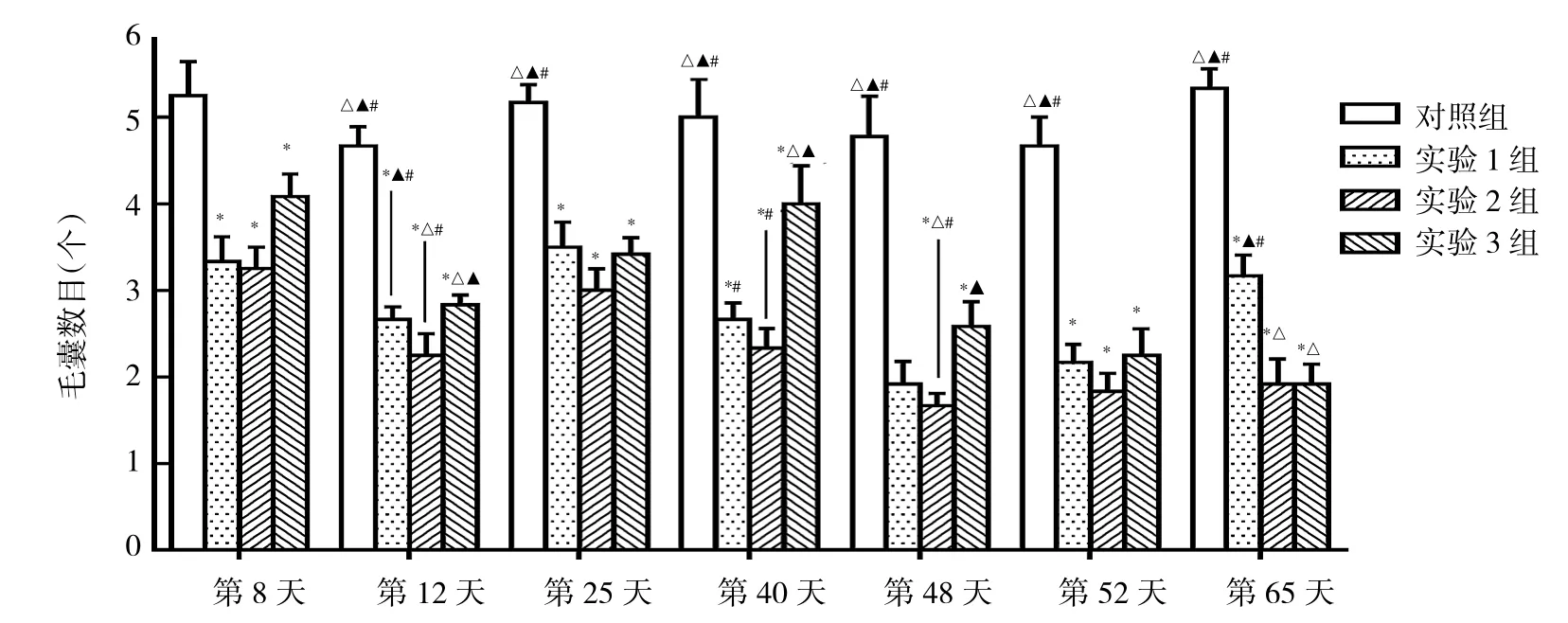
图4 各AGA组小鼠不同时期皮肤中毛囊数目比较(与对照组比较,*P<0.05;与实验1组比较,△P<0.05;与实验2组比较,▲P<0.05;与实验3组比较,#P<0.05)
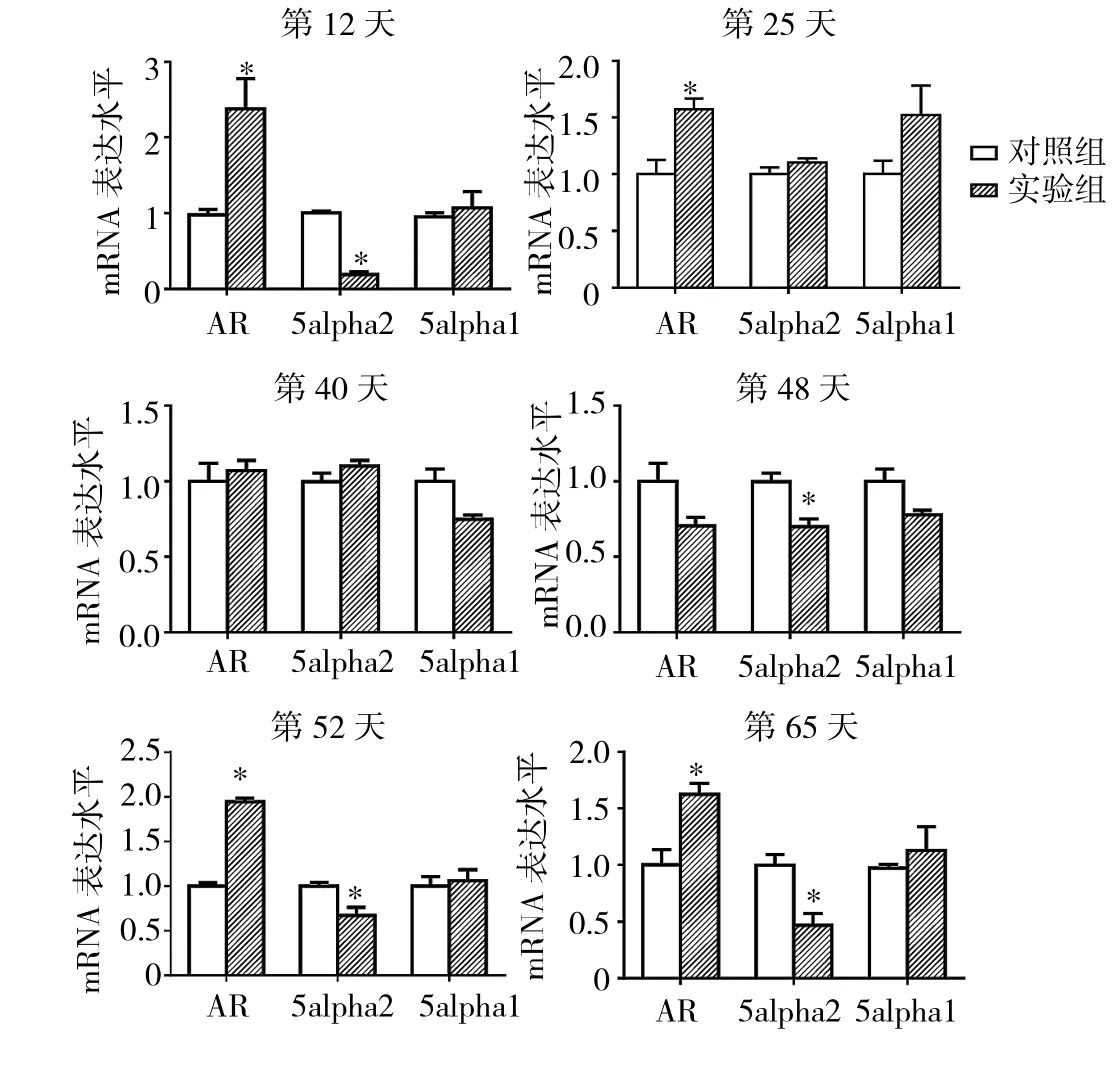
图5 实验1组与对照组小鼠毛囊中不同时期AGA突变基因的mRNA表达水平比较(与对照组比较,*P<0.05)
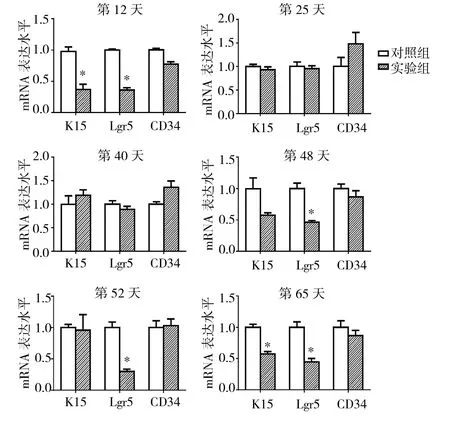
图6 实验1组与对照组小鼠毛囊中不同时期HF-SC活性标记物mRNA表达水平比较(与对照组比较,*P<0.05)
由图7可见,第12、48、52天实验1组小鼠毛囊中FGFR、IGF-BP5、Ptch1及Wnt的mRNA表达水平均低于对照组(均P<0.05)。第12、25天实验1组小鼠毛囊中TGF-β的mRNA表达水平均低于对照组(均P<0.05)。第40、48天实验1组小鼠毛囊中PDGFRα的mRNA表达水平均低于对照组(均P<0.05)。
2.7 实验1组与对照组AGA小鼠毛囊中不同时期ECM相关蛋白的mRNA表达水平比较 见图8。
由图8可见,第12、48、52天实验1组小鼠毛囊中LMα5的mRNA表达水平均低于对照组(均P<0.05),而第12、52天LMα3的mRNA表达水平均高于对照组(均P<0.05),但其他ECM相关蛋白LMα1、Collagen α6、Fibronectin、Nidogen1和 Nidogen2的 mRNA 表达水平与对照组比较均无统计学差异(均PP>0.05)。
3 讨论
非瘢痕性脱发是影响人们日常生活的最常见秃发类型,AGA作为非瘢痕性脱发的主要类型给患者带来诸多负面影响,越来越多的患者渴望得到积极、有效的治疗。由于缺少有效、相应的动物AGA模型,对AGA发生、发展的具体分子生物学机制的研究受到很大限制[4]。
本研究应用不同浓度的DHT处理小鼠,根据脱毛后小鼠毛发的生长周期,分别于生长期 Ⅵ-1(Ⅰ)、生长期 Ⅵ-2(Ⅰ)、休止期(Ⅰ)、生长期 Ⅰ(Ⅱ)、生长期Ⅵ-1(Ⅱ)、和生长期 Ⅵ-2(Ⅱ)和休止期(Ⅱ)[5-6]7个阶段即脱毛后的第 8、12、25、40、48、52、65 天对小鼠进行取样。Inui等[7]所阐述AGA的病理变化特征为毛发生长期缩短,毛囊变短、变细,色素减少,直至最初的大末端毛囊变成小毫毛毛囊且无色素沉着[8]。HE染色观察发现不同浓度DHT处理后的小鼠在毛发生长不同阶段无论是在毛发表型、毛囊结构,还是在毛囊数目上都与正常小鼠之间存在明显变化。即DHT处理后小鼠毛囊分布不均且在大多数时期成萎缩状态,尤其是实验2组和实验3组小鼠,小鼠毛囊数目呈周期性的渐进性降低,且均表现为休止期数目少于生长期Ⅵ期。这些现象与AGA患者表现相一致,表明在本研究中不同浓度的DHT均成功的诱导出AGA小鼠。
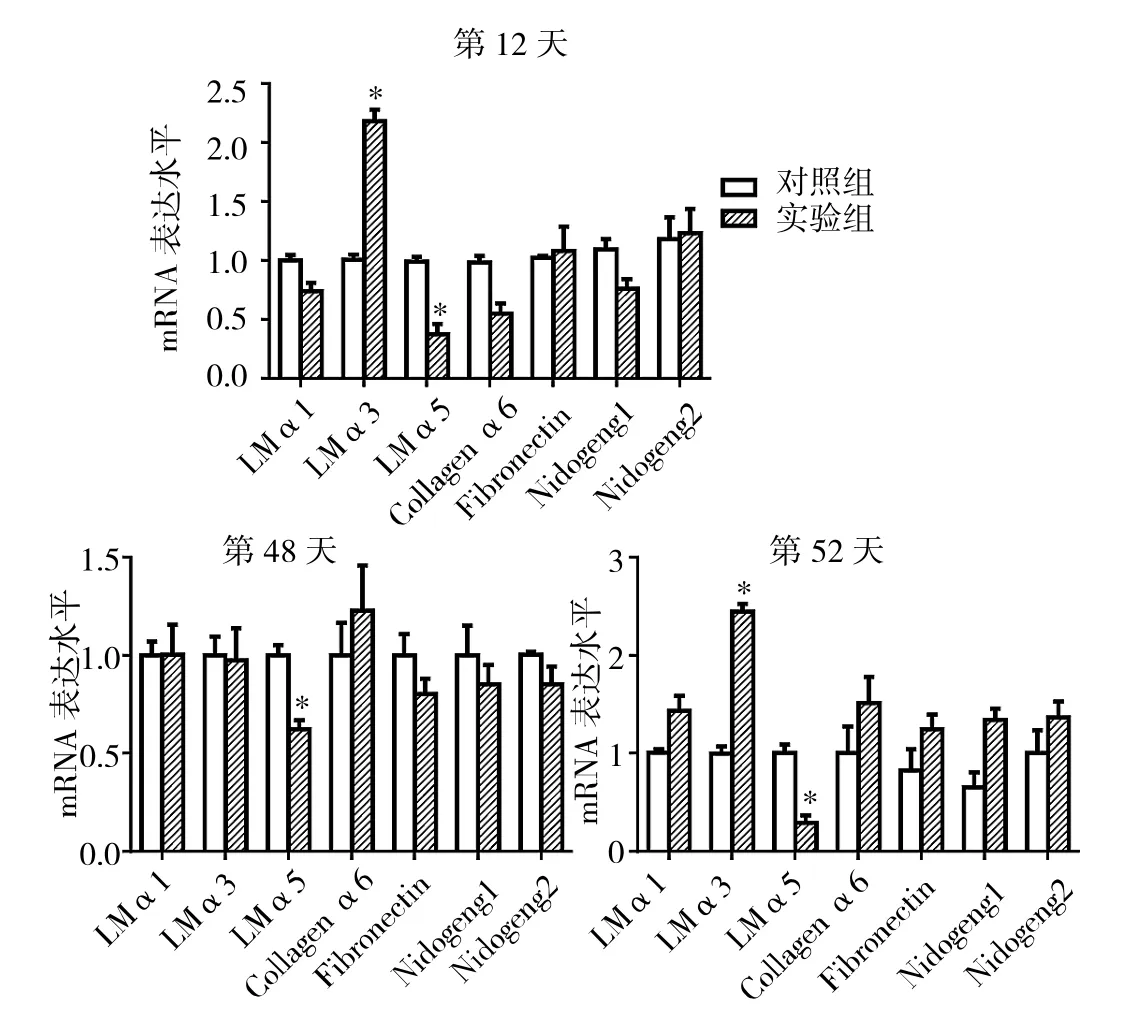
图8 实验1组与对照组AGA小鼠毛囊中不同时期ECM相关蛋白的mRNA表达水平比较(与对照组比较,*P<0.05)
对AGA小鼠进行HF-SC活性标记物的mRNA表达水平分析,发现Lgr5的表达水平在休止期与生长期Ⅵ-1期之间呈下降趋势,而CD34的表达水平无明显变化。这表明DHT主要是通过抑制生长期Ⅰ与生长期Ⅵ-1期之间HF-SC的活化所产生的作用于毛发的生长周期。
进一步对已知AGA突变基因的检测发现,当外源增加DHT含量,AR含量也相应增加,但在第40、48天小鼠AR含量并没有增加,甚至呈下降趋势。其原因可能是AR主要由真皮乳头细胞合成,在第40、48天小鼠毛囊处于休止期-生长期Ⅰ期之间,真皮乳头细胞数目减少,因而AR水平与对照组相比没有增加。这不仅进一步说明经DHT处理的小鼠为AGA小鼠模型,而且提示,DHT在皮肤中发挥作用主要是通过与真皮乳头细胞中的AR相结合。然而,在对实验1组小鼠不同时期毛发生长相关因子进行分析时,发现PDGFRα的表达水平与对照组相比在第12、25、52天没有明显降低,而在第40、48天明显降低。Gao等[9]研究通过对laminin-511突变型小鼠毛囊胚胎发育在第16.5天表现出障碍、毛囊结构消失的表型现象进行分子信号学分析,证明了由毛囊基底层上皮细胞分泌的laminin-511与其在间充质细胞膜上的受体integrin β亚基结合,促进初级绒毛的形成,进而激活Shh蛋白下游信号分子的活性;上皮细胞分泌的PDGF与间充质细胞膜上PDGF受体PDGFRα结合,在两条通路的共同作用下,刺激间充质细胞分泌Noggin因子,去除对毛囊生成的抑制效应。由此表明,在皮肤细胞中可能还存在其他DHT信号通路,当AR含量高时,DHT与AR相互作用,抑制促毛发生长因子FGFR、IGF-BP5、Ptch1以及Wnt信号的表达,对毛囊的形成与发育产生抑制作用,毛囊生长迟缓;而当真皮乳头细胞数目减少,AR含量降低时,DHT可能作用于另一信号通路,进而下调PDGFRα,维持对毛囊的抑制作用,使毛囊处于休止期。
本研究发现,当DHT水平一定,AR活性越高,细胞内5alpha2的水平降低。Inui等[7]研究显示,无论是在男性还是女性AGA患者中,头顶部毛囊中的5alpha活性较枕部毛囊中的明显偏高。在正常机体,5alpha活性与DHT之间可能存在反馈调节作用,当外源增加DHT含量时,对5alpha的表达产生抑制,以在一定程度上维持皮肤中DHT的相对稳定;而AGA患者中这种反馈调节作用可能受到阻碍。
综上所述,本研究通过不同浓度DHT处理成功诱导了AGA小鼠模型,为今后进一步研究AGA的发病机制以及AGA中不同毛发生长周期中细胞的分子变化提供了理想的动物模型。同时本研究证实了DHT能够活化真皮乳头细胞中的AR受体,与毛囊上皮细胞相互作用,对促毛发生长因子FGFR、IGF-BP5、Ptch1及Wnt信号的表达产生抑制,但其具体机制仍需进一步研究。
[1] Piraccini B M,Alessandrini A.Androgenetic alopecia[J].G Ital DermatolVenereol,2014,149(1):15-24.
[2] Wang T L,Zhou C,Shen Y W,et al.Prevalence of androgenetic alopecia in China:a community-based study in six cities[J].Br J Dermatol,2010,162(4):843-847.
[3] Ramot Y,Zlotogorski A.Molecular genetics of alopecias[J].Curr ProblDermatol,2015,47:87-96.
[4] Dainichi T,Kabashima K.Alopecia areata:What's new in epidemiology,pathogenesis,diagnosis,and therapeutic options?[J].J DermatolSci,2016,1811(16):30841-30846.
[5] Huh S H,Narhi K,Lindfors P H,et al.Fgf20 governs formation of primary and secondary dermal condensations in developing hair follicles[J].Genes Dev,2013,27(4):450-458.
[6] Waghmare S K,Bansal R,Lee J,et al.Quantitative proliferation dynamics and random chromosome segregation of hair follicle stem cells[J].EMBO J,2008,27(9):1309-1320.
[7] Inui S,Itami S.Androgen actions on the human hair follicle:perspectives[J].Exp Dermatol,2013,22(3):168-171.
[8] WolffH.Diagnosis and therapy ofhair loss[J].MMWFortschr Med,2013,155(3):53-58.
[9] Gao J,DeRouen MC,Chen C H,et al.Laminin-511 is an epithelial message promoting dermal papilla development and function during early hair morphogenesis[J].Genes Dev,2008,22(15):2111-2124.
Mechanism of androgenetic alopecia in mouse model
LIN Lei,YANG Mengjie,WU Xiao,et al.Ningbo College of Health
Sciences,Ningbo 315020,China
Objective To explore the mechanism of androgenetic alopecia(AGA)in mouse model.Methods AGA model was induced by subcutaneous injection of dehydrotestosterone (DHT)with concentration gradient method in 112 female mice.Hair depilation method was used to synchronize the initial stage of hair growth cycle of injected mice.The morphology and number of follicle were observed by H.E staining,and the mRNA expressions of signaling molecules in hair follicles were detected by RT-PCR. Results The follicular miniaturization and hair thinning were observed in mice treated with different concentration of DHT throughout the hair cycle.RT-PCR results showed the expression of androgen receptor(AR)was increased in whole hair cycle,but decreased at d40 and d48.The mRNA expression of stem cell marker Leucine-rich repeat-containing G-protein coupled receptor 5(Lgr5)was decreased during telogen and anagen VI phases,while the expression of CD34 had no significant changes.The expressions of FGFR,IGF-BP5,Ptch1 and Wnt were reduced compared with control group.Coinciding with decreased AR expression at d40 and d48,the levels of PDGFRα were significantly declined (P<0.05).The expression of basement membrane components laminin α3 was up-regulated,and laminin α5 was down-regulated in DHT-induced AGA mouse. Conclusion DHT can stably induce androgenetic alopecia in mice.DHT can inhibit the expression of hair growth factor FGFR,IGF-BP5,Ptch1 and Wnt signaling by activating the AR in DP cells and interacting with epithelial cells in the hair follicle.
Dehydrotestosterone Androgen receptorAlopecia Modelm Signal pathway雄激素性脱毛(androgenetic alopecia,AGA)作为非 瘢痕性秃发疾病中最常见的一类,影响着70%男性和40%女性的生活,在美国其发病率在50%~80%[1]。二氢睾酮(dehydrotestosterone,DHT)可经毛发乳头细胞周围的毛细血管渗出或直接由毛发乳头细胞生成,并与毛发乳头细胞膜上的雄激素受体(AR)相结合,导致毛发生长异常[2-3]。本研究将不同浓度的DHT作用于雌性小鼠,建立AGA小鼠模型,并利用该模型探讨DHT导致AGA发生、发展的分子机制,现报道如下。
2017-01-16)
(本文编辑:李媚)
10.12056/j.issn.1006-2785.2017.39.18.2017-128
国家自然科学基金(81101206);宁波市自然科学基金(2013A610253)
315200 宁波卫生职业技术学院(林蕾);宁波大学医学院(杨梦洁、高晶);宁波大学医学院附属医院肿瘤血液科(吴骁、王少敏、倪曙民、叶孟)
林蕾,E-mail:1596250063@qq.com
图7 实验1组与对照组AGA小鼠毛囊中不同时期毛发生长相关因子的mRNA表达水平比较(与对照组比较,*P<0.05)

