OBC/SF复合软骨支架的制备及性能
马 倩, 王 可, 王曙东,,, 朱立成, 马丕波, 朱玲玲(. 盐城工业职业技术学院 纺织服装学院,江苏 盐城 4005;. 武汉纺织大学 湖北省纺织新材料及其应用重点实验室,武汉 4000;.江南大学 生态纺织教育部重点实验室,江苏 无锡 4)
研究与技术
OBC/SF复合软骨支架的制备及性能
马 倩1, 王 可1, 王曙东1,2,3, 朱立成2, 马丕波3, 朱玲玲1
(1. 盐城工业职业技术学院 纺织服装学院,江苏 盐城 224005;2. 武汉纺织大学 湖北省纺织新材料及其应用重点实验室,武汉 430200;3.江南大学 生态纺织教育部重点实验室,江苏 无锡 214122)
采用TEMPO/NaBr/NaClO体系对细菌纤维素(BC)进行氧化改性,然后以氧化细菌纤维素(OBC)、丝蛋白(SF)作为基础材料,负载骨形态发生蛋白(BMP-2),经电凝胶技术制备负载BMP-2的OBC/SF复合水凝胶。通过扫描电镜(SEM)、孔隙率、力学性能、体外降解率测试对所制备的复合水凝胶进行表征,将软骨细胞种植于负载BMP-2的OBC/SF复合水凝胶支架上进行体外联合培养,观察软骨细胞在支架中的增殖情况。结果表明:该OBC/SF复合水凝胶是一种具有细腻、疏松的双网络孔隙结构,良好的降解性能、优异的力学性能,适合细胞增殖的骨组织工程支架材料;BMP-2的加入有诱导软骨细胞分化,维持软骨细胞特点的作用。
BMP-2;细菌纤维素;氧化;丝蛋白;水凝胶;电凝胶技术
随着人类社会的老龄化及高能、高速创伤的不断增多,软骨组织缺损和软骨组织退行性病变的问题日益突出[1]。近年来,采用组织工程学的方法,将软骨细胞或生长因子种植于具有良好生物相容性、高机械强度的可降解生物支架材料上进行体外联合培养形成软骨模块,然后植入软骨缺损处来修复软骨损伤的技术为软骨缺损的修复提供了新途径[2]。软骨组织工程支架作为软骨细胞外基质的替代物,是软骨组织工程的基础,理想的细胞支架有利于植入细胞在其上的黏附、增殖及促进基质分泌,完成软骨复合体的再生。选择合适的材料以尽可能绿色环保的工艺正确制备结构、性能符合要求的支架材料,对于实现细胞支架的作用和功能具有重要意义[3]。
目前,天然生物材料如胶原蛋白、丝蛋白(silk fibroin, SF)、弹力蛋白、细菌纤维素(bacterial cellulose, BC)等,由于来源广泛、绿色环保,生物相容性好,细胞黏附性好,能促进软骨细胞生长、代谢,使软骨细胞分化、增殖形成新软骨,从而成为软骨组织工程的研究热点[4-10]。但是,SF水凝胶的力学性能较差,易脆[11];BC是由超细纤维网络层层堆叠而成,这种独特的结构使得BC的力学性能呈各向异性,即垂直于纤维层的方向(沿厚度方向)压缩模量较低,纤维素中的水分在受力时容易挤出,溶胀性能不易恢复,而且BC过于致密的结构及光滑的表面也会影响细胞在其上的黏附、增殖[12]。目前有研究报道,以SF与BC作为原料,将两者的功能性相结合可制备性能优异的生物工程支架。赖琛等[13]采用N-羟基琥珀酰亚胺和碳二亚胺作为交联剂,将经羧基化改性的BC和SF交联复合可形成复合材料用于人工小口径血管,但化学交联剂的加入势必会影响BC和SF复合材料的生物相容性能。因此,以绿色、环保的方式制备出生物相容性好、可降解、微观结构孔径材料组分可调控的高强度生物工程支架显得尤为重要。
本研究首先采用TEMPO/NaBr/NaClO氧化体系选择性地将BC中C6位的羟基氧化成羧基,然后以氧化细菌纤维素(oxidized bacterial cellulose, OBC)、SF作为基础材料,负载骨形态发生蛋白-2(bone morphogenic protein, BMP-2),经电凝胶技术以制备得到负载BMP-2的OBC/SF复合水凝胶,探讨其作为构建组织工程软骨支架的可行性。
1 试 验
1.1 材料、药品和仪器
蚕茧(江苏富安茧丝绸有限公司),木葡糖酸醋杆菌(Gluconacetobacter xylinus ATCC53582)(American Type Culture Collection),培养基所需酵母浸膏、胰蛋白胨与琼脂粉(中国医药集团上海化学试剂有限公司),培养基所需其他试剂,如TEMPO、NaClO(有效氯≥10%)、NaBr、Na2CO3、CaCl2、NaOH、无水乙醇、体积分数为75%的酒精、HCL等均为分析纯(上海国药集团),Ham F12培养液(Thermo Fisher 公司),BMP-2细胞生长因子、胰蛋白酶、Π型胶原酶、PBS粉剂(Sigma公司),小牛血清(杭州四季青公司),截留分子量为3.5 kDa的透析袋(上海源叶生物科技有限公司);3月龄新西兰兔12只(苏州大学实验动物中心)。
MIR-H263-PC型CO2恒温培养箱(日本SNYNO公司),FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司),HD5000万能材料试验机(南通宏大实验仪器有限公司),S-4700型扫描电镜(FESEM)(日本Hitachi公司)。
1.2 方 法
1.2.1 BC膜的制备及处理
以木葡糖酸醋杆菌为菌种,配制液态种子培养基、木葡糖酸醋杆菌斜面培养基、发酵培养基,所有培养基均在121 ℃灭菌20 min。取种子培养基及活化过的菌种斜面,用接种环挑取两环菌种接入液体培养基中,整个过程无菌操作。将培养基摇匀后,放入温控摇瓶柜中,在30 ℃,转速为160 r/min下培养24 h。取培养完成的种子液以一定的接种量接入发酵培养基中,30 ℃恒温静置培养10 d,在培养基和空气的交界面生成凝胶状BC膜。将凝胶状BC膜取出,用去离子水冲洗后,浸入0.5 mol/L的NaOH水溶液中,在80 ℃温度下处理2 h,再浸入去离子水中处理,以除去残存的菌体和培养基,得到厚度为2 cm的透明凝胶状BC膜,121 ℃灭菌20 min后室温保存。
1.2.2 OBC的制备
将0.005 g TEMPO和0.05 g NaBr溶于100 mL水中,加入质量为0.187 g的BC,静置半小时后,用0.1 mol/L的NaOH溶液调节pH值至10.5。将1 mL(26 mmol/g)pH值调节至10.5的NaClO溶液加入上述溶液开始反应,反应过程中控制反应溶液pH值稳定在10.5左右,室温下反应至溶液pH值不再下降后加入5 mL乙醇终止反应。取出制备的OBC反复用蒸馏水浸泡清洗以去除残存的化学试剂,之后放入冰箱4 ℃冷藏。
1.2.3 BMP-2/SF溶液的制备
将计量蚕茧用0.05% Na2CO3溶液以1︰50的浴比在100 ℃下煮沸30 min,重复三次,放在室温通风处晾干,即得丝素。将脱胶后的丝素纤维以1︰10的浴比分批加入摩尔比为1︰2︰8的CaCl2-C2H5OH-H2O三元溶液中,置于(76±2) ℃的水浴锅内恒温搅拌,直至完全溶解,过滤、透析得到质量分数为3%的SF溶液。在SF溶液中加入5 mL含BMP-2(400 ng/mL)的F12完全培养液,混合均匀,形成SF的质量分数为90%的BMP-2/SF溶液。
1.2.4 SF水凝胶的制备
将所制备的质量分数为3%的SF溶液装入圆柱形模具中,置于37 ℃的恒温水浴锅中直至凝胶。
1.2.5 负载BMP-2的OBC/SF复合水凝胶的制备
将制备的OBC置于BMP-2/SF溶液中,在制备的OBC中插入正电极铜棒,在BMP-2/SF溶液插入负电极铜棒,施加15 V的直流电压,经电凝胶技术制备得到负载BMP-2的OBC/SF复合水凝胶。正常状态下,丝素蛋白水溶液中无规卷曲结构所占比例较高,施加电场使得丝素蛋白水溶液中电源正极附近的pH值小于蛋白质的等电点,导致无规卷曲结构转变为β-折叠结构,并逐渐交联形成SF水凝胶[14]。负载BMP-2的OBC/SF复合水凝胶的制备方法如图1所示。
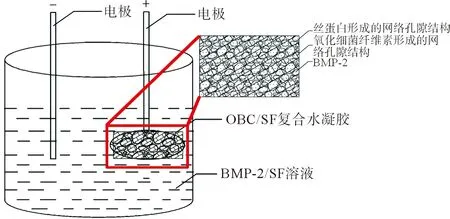
图1 OBC/SF复合水凝胶的制备方法示意Fig.1 Illustration of the preparation of the OBC/SF composite hydrogel
1.2.6 软骨细胞的培养、处理
首先进行兔关节软骨细胞的分离、培养、传代,在37 ℃,5% CO2恒温箱中培养;然后对各组样品进行灭菌处理,将各组样品经高压蒸汽灭菌后置于24孔培养板孔中;最后收集传代3代以内的软骨细胞,用F12培养液制成1×106/mL的细胞悬液,种植到各组水凝胶样品上,置于37 ℃,5% CO2恒温箱内进行体外复合培养。
1.3 性能表征
1.3.1 孔隙率测定
理想的生物支架材料应具备三维多孔结构及合适的孔隙率。这样,在保证支架具备足够力学强度的前提下,既可为细胞的生长提供足够的空间,也可为细胞生长所需营养成分的渗入提供条件。一般孔隙率达到90%左右的生物工程支架可满足要求。参照文献[15]的方法测定各组支架的孔隙率。湿重测量:将各组样品置于真空冻干机中干燥72 h,冻干后的样品置于装有蒸馏水的烧杯中浸泡48 h吸水,取出样品吸干表面的水分进行称重。浮重测量:取装有1 000 mL蒸馏水的烧杯,将边缘带铁丝挂钩的平板放在分析天平的托盘上,使挂钩浸入蒸馏水中,将边缘打孔的各组样品挂在平板的挂钩上进行称重。孔隙率计算公式如下:

(1)
1.3.2 压缩与拉伸性能测试
利用HD5000万能材料试验机对各组水凝胶样本进行压缩与拉伸性能测试,试验均在室温下进行,试验时应变速率均设置为10%/min。进行压缩试验时,样品的形状是圆柱形(直径为10 mm,厚度为5 mm),将试样放入上下平行的两块金属压板间进行测试。进行拉伸试验时,样品的形状为哑铃型(销的宽度为2 mm,厚度为2 mm,长度为10 mm;铃的宽度为10 mm,厚度为2 mm,长度为7 mm),将试样两端分别固定于上下夹头进行测试。压缩、拉伸试验的失效点为应力-应变曲线的最大值点,压缩、拉伸模量为应力-应变曲线直线部分的斜率。
1.3.3 软骨细胞增殖检测
细胞支架复合物培养7 d,每日各组中取4孔标本,剪切成小块,取软骨细胞支架复合体用0.25%胰蛋白酶消化,台盼蓝染色,进行活细胞计数,取平均值作图,绘制细胞生长曲线。
1.3.4 体外降解性测定
参照文献[16]的方法,采用失重率来评估各组支架的体外降解性。将冻干的各组样品切成10 mm×10 mm×10 mm的立方体块,称重为W1,然后将其浸没在盛有50 mL、pH7.4 PBS缓冲液的锥形瓶中,放入37 ℃恒温箱中培育,每天更换缓冲液。分别在0、3、7、14、21、28、35、42、49 d时,用滤纸进行过滤,将滤渣用去离子水清洗后冻干称重,计为W2。支架材料的失重率计算公式如下:
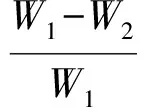
(2)
2 结果与分析
2.1 FE-SEM结果
图2为BC、OBC、SF与OBC/SF支架的FE-SEM照。由图2可以看出,SF支架呈现较为平整、光滑的片状结构,孔径较大,孔与孔之间呈断裂状态;BC则体现出由纤维交错而成的精细纳米网络结构,结构致密,孔径较小、较为均匀,孔之间连通性较好;OBC保持了BC的纤维网络结构,但表面形态更为疏松、多孔,纤维单根状态更为清楚;而将OBC与SF复合后,明显改善了SF支架与BC支架的缺点,支架整体呈现细腻、疏松的双网络孔隙结构,孔径适宜而均匀,孔之间连通性好。

图2 BC、OBC、SF与OBC/SF支架的FE-SEM照Fig.2 FE-SEM images of BC, OBC, SF and OBC/SF scaffolds
2.2 孔隙率测定结果
各组样品孔隙率的测定结果如图3所示。由图3可以看出,BC支架的孔隙率为89%,OBC支架的孔隙率为91%,SF支架的孔隙率为95%,OBC/SF支架的孔隙率为96%,因此,各组支架的孔隙率都较高。氧化改性过程没有明显提高BC支架的孔隙率,这间接反映出TEMPO/NaBr/NaClO体系没有影响BC原有的三维多孔结构。而OBC与SF复合后,同BC、OBC支架相比,OBC/SF支架孔隙率显著增大。
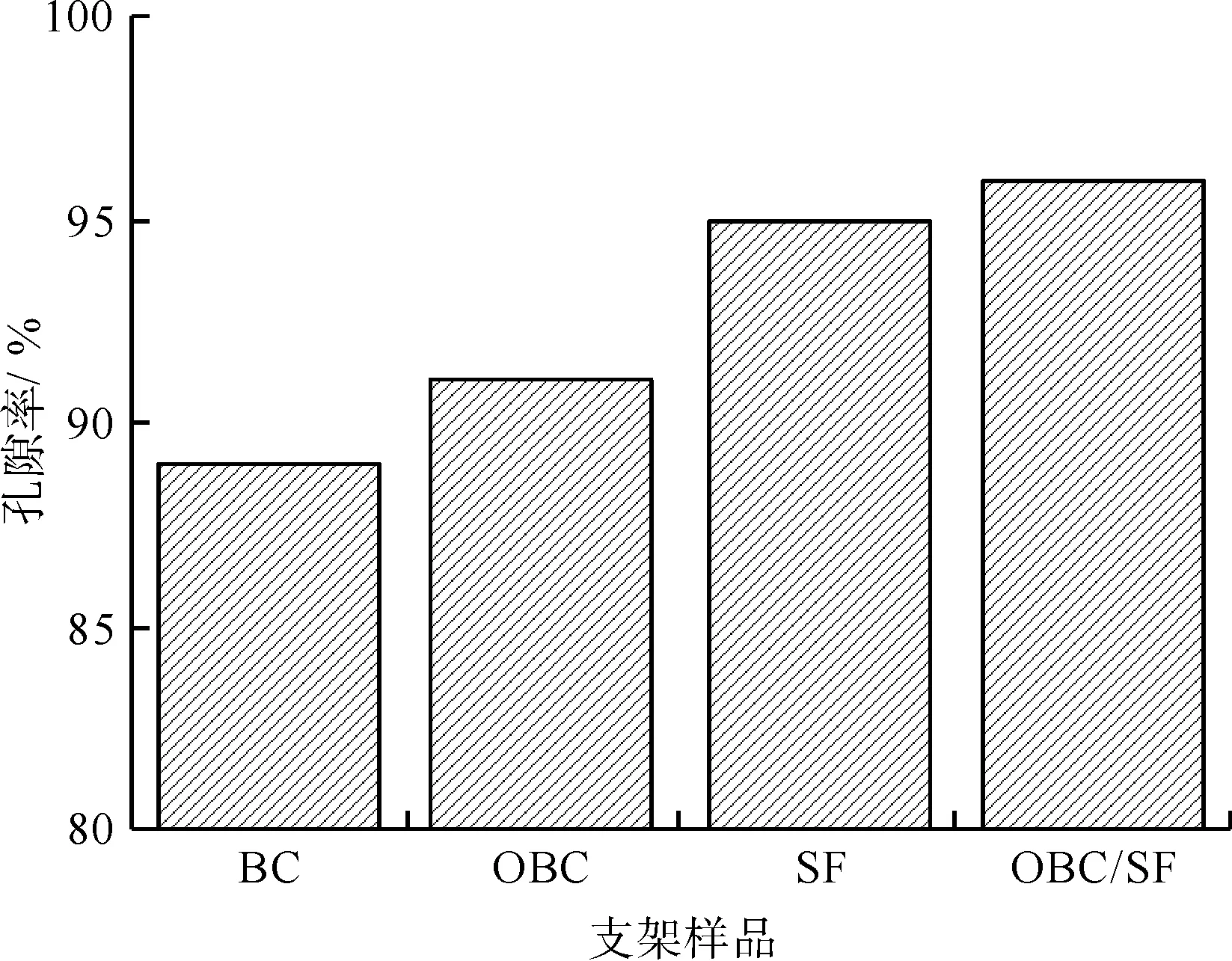
图3 BC、OBC、SF与OBC/SF支架的孔隙率Fig.3 Porosity of BC, OBC, SF and OBC/SF scaffolds
2.3 压缩与拉伸性能测试结果
各组样品压缩与拉伸性能测试的测定结果如表1所示。由表1可以看出,BC呈现出高拉伸强度和弹性模量,经氧化改性后,OBC支架的力学性能略受影响。这主要是由于氧化改性将部分BC纤维单体上的羟基氧化成羧基,使得纤维间的部分无定形区域被溶解,但并未改变BC纤维间特有的超细三维网络结构的网状结构所致。SF的力学性能取决于其所含的三种结构(无规卷曲结构、silkⅠ结构及β-折叠结构(silkⅡ结构))的比例。表1还可看出,SF拉伸性能及压缩性能欠佳、脆性大。分析认为是由于凝胶过程使SF所含无规卷曲或silkⅠ结构转变为β-折叠结构,使得SF所含β-折叠结构比例较高所致。OBC/SF支架较BC支架、SF支架而言,拉伸与压缩性能均显著提高,压缩模量、压缩应力、拉伸模量、拉伸强度分别高达1.6、3.6、23.1、2.9 MPa。这是因为氧化使得OBC纤维间结构较疏松,SF分子易于通过空隙进入纤维素结构的内部。一方面OBC的羧基与SF上的氨基间形成了共价键,另一方面OBC与SF复合形成了细腻、疏松的双网络孔隙结构,OBC的三维网络结构包围SF分子,起到了增强、增弹的作用;SF分子填充了OBC的空隙,改善了纤维素中的水分在受力时容易挤出的缺点,从而提高了复合材料的压缩性能。因此,OBC/SF支架的力学性能在结合了BC、SF性能优势的基础上又进一步提高。
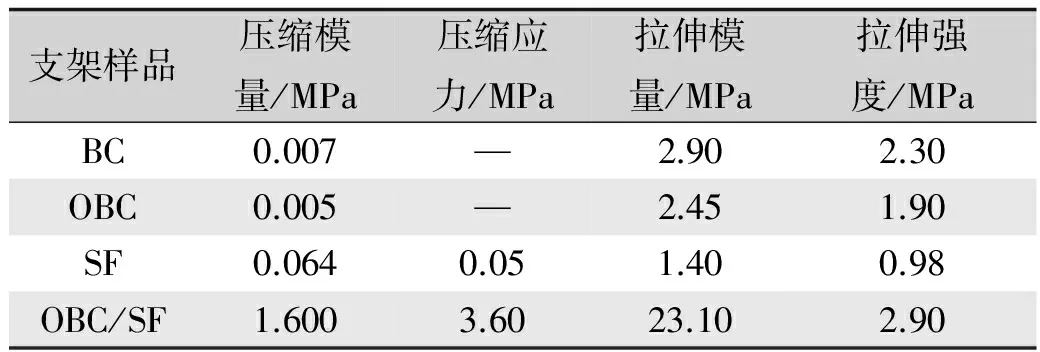
表1 BC、OBC、SF与OBC/SF支架力学性能测试结果Tab.1 Test results of mechanical properties of BC, OBC,SF and OBC/SF scaffolds
2.4 软骨细胞增殖检测结果
各组样品支架上细胞生长曲线如图4所示。检测结果表明,软骨细胞在BC、OBC、SF支架上的生长速度无明显差别。BC支架细胞倍增时间为4.5 d,OBC支架与SF支架细胞倍增时间为4 d。BC经过氧化改性后,细胞在OBC上的增殖情况略有改善。较BC、OBC、SF支架而言,OBC/SF支架对软骨细胞的黏附、增殖及扩散显著提高,细胞倍增时间为3 d。这一结果可归因于复合支架细腻、疏松的双网络孔隙结构,大小适宜而均匀的孔结构及孔之间较好的连通性,这样的结构更利于细胞的吸附、迁移及增殖。图5为软骨细胞在单纯的OBC/SF支架及添加了BMP-2的OBC/SF支架上培养7d后的FE-SEM照片。与单纯的OBC/SF支架相比,软骨细胞在加入BMP-2的OBC/SF支架上生长较好,细胞紧密排列、融合成片,显示出较好的分化特点,证实了BMP-2有诱导软骨细胞分化、维持软骨细胞特点的作用[17]。

图4 软骨细胞在BC、OBC、SF与OBC/SF支架上的生长曲线Fig.4 Growth curves of cartilage cells on BC, OBC, SF and OBC/SF scaffolds

图5 软骨细胞在加入BMP-2前后的OBC/SF支架上培养7d后的FE-SEM照Fig.5 FE-SEM images of cartilage cells on OBC/SF scaffolds before and after the addition of BMP-2
2.5 体外降解测试结果
BC、OBC、SF和OBC/SF支架材料的失重曲线如图6所示。由图6可以看出,BC在PBS溶液中的降解非常缓慢,质量几乎没变。与BC相比,OBC的体外降解速率明显较快,这主要是由于BC的C6位上羟基被氧化为羧基,使得BC更易于吸收PBS溶液而溶胀、降解所致。此外,OBC的羧基加速了OBC的水解。图6还可以看出,SF支架的降解速度与OBC相当,明显快于BC支架的降解速度,这是由于SF支架中含有易溶于水的无规卷曲结构、silkⅠ结构所致。比较OBC/SF和OBC、SF的降解情况,可以看出,在初始阶段OBC/SF支架的降解率小于OBC支架与SF支架的降解率,这可归因于OBC的羧基与SF上的氨基间所形成的共价键的存在[18];在后期阶段OBC/SF支架的降解率显著上升,超过OBC支架及SF支架的降解率,这主要是因为氧化改性有利于BC对SF溶液的吸收,OBC/SF支架中OBC的水解使得OBC的羧基与SF上的氨基间所形成的共价键断裂,进而加快了OBC/SF支架降解的速度。

图6 BC、OBC、SF与OBC/SF支架在PBS中的降解Fig.6 Degradation of BC, OBC, SF and OBC/SF scaffolds in PBS
3 结 论
本研究首先采用TEMPO/NaBr/NaClO体系对BC进行氧化,然后以OBC、SF作为基础材料,负载BMP-2,经电凝胶技术制备得到负载BMP-2的OBC/SF复合水凝胶。结果表明,将力学性能互补的SF与OBC复合,改善了SF水凝胶力学性能较差、易脆的缺点及BC垂直于纤维层方向压缩模量较低、结构过于致密、表面过于光滑的不足。该负载BMP-2的OBC/SF复合水凝胶具有细腻、疏松的双网络孔隙结构,孔隙率高,孔径适宜、均匀,孔径连通性好;力学性能良好;体外降解性能良好;细胞黏附、增殖能力较好,适合作为软骨修复支架。
[1]WANG Y, KIM U J, BLASIOLI D J, et al. In vitro cartilage tissue engineering with 3D porous aqueous-derived silk scaffolds and mesenchymal stem cells[J]. Biomaterials,2005,26:7082.
[2]YODMUANG S, MCNAMARA S L, NOVER A B, et al. Silk microfiber-reinforced silk hydrogel composites for functional cartilage tissue repair[J]. Acta Biomaterialia,2015,11:27-36.
[3]BOSCHETTI F, PENNATI G, GERVASO F, et al. Biomechanical properties of human articular cartilage under compressive loads[J]. Biorheology,2004,41:159.
[4]YU F, CAO X D, LI Y L, et al. Diels-Alder crosslinked HA/PEG hydrogels with high elasticity and fatigue resistance for cell encapsulation and articular cartilage tissue repair[J]. Polymer Chemistry,2014,5:5116.
[5]CHAO P G, YODMUANG S, WANG X Q, et al. Silk hydrogel for cartilage tissue engineering[J]. Journal of Biomedical Materials Research B: Applied Biomaterials,2010,95B(1):84-90.
[6]WANG S D, ZHANG Y Z, WANG H W, et al. Fabrication and properties of the electrospun polylactide/silk fibroin-gelatin composite tubular scaffold[J]. Biomacromolecules,2009,10:2240-2244.
[7]WANG S D, ZHANG Y Z, WANG H W, et al. Preparation, characterization and biocompatibility of electrospinning heparin-modified silk fibroin nanofibers[J]. International Journal of Biological Macromolecules,2011,48:345-353.
[8]PHISALAPHONG M, SUWANMAJO T, SANGTHERAPITIKUL P. Novel nanoporous membranes from regenerated bacterial cellulose[J]. Journal of Applied Polymer Science,2008,107:292-299.
[9]ASHJARAN A, YAZDANSHENAS M E, RASHIDI A, et al. Overview of bio nanofabric from bacterial cellulose[J]. The Journal of the Textile Institute,2013,104(2):121-131.
[10]XU X Z, ZHOU J, NAGARAJU H D, et al. Flexible, highly graphitized carbon aerogel based on bacterial cellulose/lignin: catalyst-free synthesis and its application in energy storage devices[J]. Advanced Functional Materials,2015,25(21):3193-3202.
[11]MOO M B, GENE L.Electrospinning of silk fibroin nanofibers and its effect on the adhesion and spreading of normal human keratinocytes and fibroblasts in vitro[J]. Biomaterials 2004,25(7/8):1289-1297.
[12]LI Y, WANG S W, HUANG R, et al. Evaluation of the effect of the structure of bacterial cellulose on full thickness skin wound repair on a microfluidic chip[J]. Biomacromolecules,2015,16:780-789.
[13]赖琛,奚廷斐,王巧莉,等.用于人工小口径血管制备的复合材料及其制备方法:105031736A[P].2015-11-11.
LAI Chen, XI Tingfei, WANG Qiaoli, et al. The preparation of composite products for small diameter artificial blood vessels:105031736A[P]. 2015-11-11.
[14]陈宏武,王曙东.蚕丝蛋白水凝胶的研究现状[J].纺织学报,2015,36(11):156-163.
CHEN Hongwu, WANG Shudong. Research progress of silk fibroin hydrogels[J]. Journal of Textile Research,2015,36(11):156-163.
[15]王宗良,贾原媛,石毅,等.纳米细菌纤维素膜的表征与生物相容性研究[J].高等学校化学学报,2009,30(8):1553-1558.
WANG Zongliang, JIA Yuanyuan, SHI Yi, et al. Research on characterization and biocompatibility of nanobacterial cellulose membrane[J]. Chemical Journal of Chinese Universities,2009,30(8):1553-1558.
[16]廖世波,黄淑玉,赖琛,等.C6位氧化型细菌纤维素/壳聚糖复合材料的制备及表征[J].中国生物医学工程学报,2014,33(5):600-608.
LIAO Shibo, HUANG Shuyu, LAI Chen, et al. Preparation and characterization of C6-oxidated bacterial cellulose/chitosan composite[J]. Chinese Journal of Biomedical Engineering,2014,33(5):600-608.
[17]符来想,程迅生.负载BMP-2组织工程骨修复骨缺损的研究进展[J].医学综述,2013,19(4):355-358.
FU Laixiang, CHENG Xunsheng. Research progess of repairing bone defects with BMP-2 loaded tissue engineerd bone[J]. Medical Recapitulate,2013,19(4):355-358.
[18]王甩艳,黄涛,赖琛,等.交联对氧化纤维素/蚕丝蛋白复合膜结构和性能的影响[J].中国生物医学工程学报,2015,34(2):212-219.
WANG Shuaiyan, HUANG Tao, LAI Chen, et al. The effect of crosslink on the structures and performance of oxidized bacterial cellulose/silk fibroin composite films[J]. Chinese Journal of Biomedical Engineering,2015,34(2):212-219.
Preparationandperformanceofoxidizedbacterialcellulose/silkfibroincompositecartilagescaffold
MAQian1,WANGKe1,WANGShudong1,2,3,ZHULicheng2,MAPibo3,ZHULingling1
(1.College of Textile and Clothing, Yancheng Vocational Institute of Industry Technology, Yancheng 224005, China;2. Key Laboratory of Hubei New Textile Material & Application, Wuhan Textile University, Wuhan 430200, China;3. Key Laboratory of Eco-Textiles, Ministry of Education, Jiangnan University, Wuxi 214112, China)
The bacterial cellulose was modified by TEMPO/NaBr/NaClO-mediated oxidation. The oxidized bacterial cellulose/silk fibroin (OBC/SF) composite hydrogel containing bone morphogenic protein (BMP-2) for cartilage repair was prepared by gel electrophoresis. The prepared composite hydrogel was characterized by Scanning Electron Microscopy (SEM), porosity, mechanical testing and in-vitro degradation. The chondrocytes were grown on the prepared OBC/SF composite hydrogel scaffold for in-vitro culture. The growth of the chondrocytes on the composite scaffold was observed. Results show that the prepared OBC/SF composite hydrogel is an ideal scaffold for bone tissue engineering, with fine and loose double network structure, appropriate degradability, excellent mechanical properties and native environment for cell proliferation. Besides, the addition of BMP-2 contributes to the differentiation of chondrocytes and helps to maintain the characteristics of chondrocytes.
BMP-2; bacterial cellulose; oxidation; silk fibroin; hydrogel; gel electrophoresis
TQ340.64
A
1001-7003(2017)10-0018-06 < class="emphasis_bold">引用页码
页码: 101104
10.3969/j.issn.1001-7003.2017.10.004
2016-12-19;
2017-09-01
江苏省高校自然科学基金项目(16KJB540005);湖北省纺织新材料及其应用重点实验室开放课题(Fzxcl2017016);生态纺织教育部重点实验室(江南大学)开放课题(KLET1601);江苏省盐城市农业科技指导性计划项目(YKN2016012、YKN2016013);江苏高校品牌专业建设工程资助项目(PPZY2015C254);盐城工业职业技术学院院级重点课题(ygy201501);江苏省高校优秀中青年教师境外研修计划项目(苏教师〔2014〕24号);江苏省高等学校大学生创新创业训练计划项目(201713752017X)


