瘤苗联合CpG ODN对白血病小鼠Treg细胞的影响
杨 云,白 菊,何爱丽,王芳侠,沈 莹
(西安交通大学第二附属医院血液科,西安 710004;*通讯作者,E-mail:yangyun108@163.com)
瘤苗联合CpGODN对白血病小鼠Treg细胞的影响
杨 云*,白 菊,何爱丽,王芳侠,沈 莹
(西安交通大学第二附属医院血液科,西安 710004;*通讯作者,E-mail:yangyun108@163.com)
目的 探讨红白血病FBL-3细胞瘤苗联合CpG 1826治疗白血病小鼠时调节性T细胞(regulatory T cells,Treg)的变化及其意义。 方法 50只小鼠随机分为对照组、PBS组、瘤苗组、CpG 1826组和瘤苗加CpG 1826组,皮下注射红白血病FBL-3细胞建立小鼠白血病模型,丝裂霉素C灭活FBL-3细胞制备瘤苗。PBS组、瘤苗组、CpG 1826组和瘤苗加CpG 1826组分别利用PBS、瘤苗、CpG 1826和瘤苗加CpG 1826进行治疗,而对照组不进行任何处理。流式细胞术检测小鼠脾细胞中Treg细胞百分率,逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)测定Foxp3 mRNA的表达,ELISA法检测血清中IL-10水平。 结果 与对照组小鼠相比,PBS组、瘤苗组小鼠CD4+FoxP3+Treg细胞百分率、Foxp3 mRNA的表达水平、血清中IL-10水平明显增高,差异具有统计学意义(P<0.05),而PBS组与瘤苗组小鼠之间差异无统计学意义(P>0.05)。CpG 1826组、瘤苗联合CpG 1826组小鼠CD4+FoxP3+Treg细胞百分率、Foxp3 mRNA的表达水平、血清中IL-10水平比PBS组及瘤苗组明显下降,差异具有统计学意义(P<0.05)。 结论 瘤苗联合CpG 1826治疗小鼠白血病时Treg细胞减少,Treg细胞在白血病及免疫治疗中可能发挥了重要作用。
白血病; 免疫治疗; 瘤苗; 调节性T细胞
目前白血病的治疗主要依靠化疗,但由于化疗的毒副作用、耐药及复发等原因限制了疗效,随着生物学技术的发展,白血病的免疫治疗特别是肿瘤疫苗受到重视[1-4]。CpG ODN是指一类人工合成的含CpG基序的寡聚脱氧核糖核苷酸,可以激活小鼠或人的B淋巴细胞、NK细胞、巨噬细胞、树突状细胞等多种免疫细胞,动物实验发现CpG ODN作为疫苗佐剂可以增强瘤苗的抗白血病效果[5-7]。Treg细胞是不同于Th1和Th2细胞、具有特异细胞膜表面分子和核转录因子的一类细胞亚群,在自身免疫、肿瘤免疫、移植免疫耐受及抗感染免疫等方面发挥重要的作用[8-10]。目前认为瘤苗和CpG ODN主要激活机体CTL、NK细胞发挥抗肿瘤作用[5,6],关于瘤苗及CpG ODN对Treg细胞的影响研究甚少。本实验利用白血病FBL-3细胞建立白血病小鼠模型,并用丝裂霉素C灭活FBL-3细胞制备瘤苗,对白血病小鼠采用瘤苗联合CpG ODN进行治疗,观察小鼠体内Treg细胞的变化。
1 材料和方法
1.1 细胞株及小鼠
小鼠红白血病细胞株FBL-3细胞由西安交通大学生命科学院惠赠。6-8周龄雌性C57BL/6小鼠50只,清洁级,体质量18-21 g,由西安交通大学医学院动物中心提供。小鼠生产许可证号为scxk(陕)2012-003。
1.2 主要试剂与仪器
TRIzol液为美国Invitrogen公司产品,逆转录试剂盒购自立陶宛Fermentas公司,SYBR®Premix Ex TaqTM Ⅱ为大连宝生物工程有限公司产品,CpG 1826及PCR引物由上海生工生物工程技术服务有限公司合成,小鼠IL-10 ELISA检测试剂盒为美国R&D公司产品,PE anti-mouse FoxP3、FITC anti-mouse CD4购自美国eBioscience公司。冷冻高速离心机(5804)购自德国Eppendorf公司,酶标仪(ELx808)购自美国bio-tek公司,荧光定量PCR扩增仪(CFX96)购自美国Bio-Rad公司,FACS Calibur流式细胞仪购自美国BD公司。
1.3 小鼠白血病动物模型的建立及瘤苗制备
大量收集对数生长期小鼠红白血病细胞FBL-3细胞,调整细胞浓度4×106/ml,取0.5 ml细胞悬液分别接种于C57BL/6小鼠皮下(对照组不接种细胞)制作白血病小鼠模型。
取对数生长期FBL-3细胞,加入丝裂霉素C(终浓度为100 μg/ml)灭活,37 ℃水浴30 min,2 000 r/min离心5 min,弃上清液,用PBS洗涤3次,调整细胞浓度至2×107/ml用作瘤苗备用。
1.4 实验分组及免疫治疗
6-8周龄雌性C57BL/6小鼠50只被随机分为5组:对照组、PBS组、瘤苗组、CpG 1826组和瘤苗加CpG 1826组,每组10只。PBS组:0.2 ml PBS;瘤苗组:0.1 ml瘤苗+0.1 ml PBS;CpG 1826组:0.1 ml CpG 1826+0.1 ml PBS;瘤苗加CpG 1826组:0.1 ml CpG 1826+0.1 ml瘤苗。
小鼠接种白血病细胞7 d后开始给予免疫治疗,两肋皮下注射,每周1次,共4周。对照组为正常小鼠不做任何处理。
1.5 疗效观察
每天观察各组小鼠注射部位有无红肿、硬结、溃疡等;观察一般状况、肿瘤缓解率、瘤结节生长、消退、复发、转移情况及生存期;每周称量小鼠体质量1次;观察小鼠若处在濒死状态,则及时处死小鼠,分离脾脏组织,制备脾细胞悬液。
1.6 流式细胞术检测脾细胞中Treg细胞
制备脾细胞单细胞悬液,调整细胞浓度至1×106/ml,取100 μl单细胞悬液加入FITC-CD4抗体,温和混匀,常温下避光孵育20 min。2 ml PBS洗涤、离心后弃上清;重悬细胞,加入2 ml 4 ℃ 1×固定液,温和混匀后4 ℃避光孵育30 min。离心弃上清后加入2 ml 1×破膜液,37 ℃避光孵育30 min,离心弃上清后PBS洗涤细胞后重悬细胞,每管加入20 μl PE-Foxp3抗体,轻轻混匀后室温避光孵育20 min。PBS洗涤2次,重悬细胞,应用FACS Calibur型流式细胞仪检测,以CD4+T细胞为门通过Cellquest软件进行收集分析数据。
1.7 RT-PCR测定Foxp3 mRNA的表达
采用TRIzol液提取脾细胞总RNA,利用逆转录试剂盒进行cDNA第一链合成,严格按照试剂盒说明书进行操作。根据文献[11]报道合成Foxp3及内参HPRT引物,Foxp3上游引物:5′-CCCAGGAAAGACAGCAACCTT-3′,下游引物:5′-TTCTCACAACCAGGCCACTTG-3′,产物大小89 bp;HPRT上游引物:5′-TGATTAGCGATGATGAACCAG-3′,下游引物:5′-AGAGGGCCACAATGTGATG-3′,产物大小171 bp。20 μl PCR扩增体系包括10 μl SYBR®Premix Ex TaqTM Ⅱ(2×)、上下游引物各0.8 μl、2.0 μl DNA模板、6.4 μl ddH2O(灭菌蒸馏水),扩增条件为:95 ℃预变性30 s,95 ℃ 5 s、60 ℃ 30 s,40个循环。扩增结束后采用Bio-Rad iQ520 Standard Edition Optical System Software V2.0分析数据。
1.8 ELISA检测小鼠血清中IL-10水平
小鼠眼球取血后1 000 r/min离心5 min后收集上清,采用ELISA试剂盒进行检测IL-10水平,试剂盒检测范围为15.6-1 000 pg/ml,严格按照试剂盒说明进行操作。
1.9 统计学分析
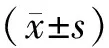
2 结果
2.1 各组小鼠一般状况的观察
免疫治疗结束后观察各组小鼠的一般状况,对照组毛发正常有光泽,活动正常,精神好,进食活跃,体质量平稳增加;PBS组小鼠活动迟缓,毛发无光泽,精神萎靡,活动力明显下降,有的最后丧失活动能力,瘤结节增长比较快,瘤体局部出现破溃;瘤苗组、CpG 1826组及瘤苗加CpG1826组小鼠毛发尚可、活动、进食正常,体质量变化不明显,瘤体体积减小,瘤苗加CpG1826组小鼠在免疫治疗后瘤体体积减小明显。
2.2 生存分析
PBS组最长的生存时间是45 d,其中位生存时间是35 d;瘤苗组小鼠有2只长期存活(大于90 d),其中位生存时间为58 d;CpG 1826组小鼠有2只长期存活,中位生存时间为54 d;瘤苗加CpG 1826组有3只小鼠长期存活,中位生存期78 d;CpG 1826组、瘤苗加CpG 1826组的中位生存期均明显长于PBS组,且瘤苗加CpG 1826组中位生存时间最长。
2.3 白血病小鼠免疫治疗前后CD4+FoxP3+Treg细胞变化
取出小鼠脾脏后制备单细胞悬液,进行细胞内Foxp3染色后进行流式细胞检测,以CD4+细胞设门进行分析,结果见图1,2。结果显示:对照组小鼠脾细胞中CD4+FoxP3+Treg细胞百分比为11.84%±1.56%,而PBS组小鼠体内CD4+FoxP3+Treg细胞数量明显增多,为23.17%±3.89%,两组相比差异有统计学意义(P<0.05)。瘤苗组小鼠体内CD4+FoxP3+Treg细胞百分比为21.41%±3.57%,与PBS组相比差异无统计学意义(P>0.05)。CpG 1826组小鼠体内CD4+FoxP3+Treg细胞数量明显减少,百分比为15.57%±2.01%,与PBS组相比差异有统计学意义(P<0.05),瘤苗联合CpG 1826时,CD4+FoxP3+Treg细胞百分比为15.09%±1.82%,明显低于PBS组及瘤苗组(P<0.05),也高于对照组,差异有统计学意义(P>0.05)。
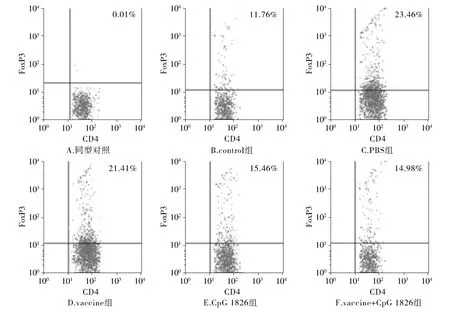
图1 不同分组小鼠外周血CD4+FoxP3+Treg细胞百分比变化Figure 1 Percentage of CD4+FoxP3+Treg cells in peripheral blood of mice in different groups

与对照组比较,*P<0.05;与PBS组及瘤苗组比较,#P<0.05图2 不同分组小鼠外周血CD4+FoxP3+Treg细胞百分比变化Figure 2 Percentage of CD4+FoxP3+Treg cells in peripheral blood of mice in different groups
2.4 白血病小鼠免疫治疗前后核转录因子Foxp3 mRNA的表达变化
利用荧光定量PCR检测了不同分组Treg细胞核转录因子Foxp3 mRNA表达情况,结果显示,PBS组小鼠Foxp3 mRNA水平明显高于对照组,差异具有统计学意义(P<0.05),瘤苗组小鼠Foxp3 mRNA与PBS组比较差异没有统计学意义(P>0.05,见表1)。CpG 1826组、瘤苗联合CpG 1826组小鼠Foxp3 mRNA水平均比PBS组及瘤苗组小鼠明显下降,差异具有统计学意义(P<0.05),也明显高于对照组(P<0.05,见表1)。
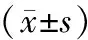
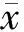

组别nFoxp3mRNAIL⁃10(pg/ml)对照组10734±196 2815±624 PBS组101585±357∗15723±3125∗瘤苗组101438±275∗14358±2879∗CpG1826组101019±228∗#5776±1327∗#瘤苗+CpG1826组10938±203∗#5148±1247∗#
与对照组比较,*P<0.05;与PBS组及瘤苗组比较,#P<0.05
2.5 白血病小鼠免疫治疗前后小鼠血清中IL-10的水平变化
利用ELISA法检测小鼠血清中IL-10水平,与对照组小鼠相比,PBS组小鼠血清中IL-10水平明显增高,差异具有统计学意义(P<0.05),瘤苗组小鼠血清中IL-10水平与PBS组比较差异没有统计学意义(P>0.05)。CpG 1826组、瘤苗联合CpG 1826组小鼠血清中IL-10水平比PBS组及瘤苗组明显下降,差异具有统计学意义(P<0.05),而且明显高于对照组(P<0.05,见表1)。
3 讨论
1995年Sakaguchi等[12]首先报道了小鼠体内天然存在一类CD4+T细胞表面持续表达CD25(IL-2受体α链),这群细胞占小鼠外周淋巴器官中CD4+T细胞的5%-10%。越来越多研究证实CD4+Foxp3+Treg细胞是一群有特异细胞膜表面分子和核转录因子并具有免疫抑制作用的T细胞亚群,在自身免疫、肿瘤免疫、移植免疫耐受及抗感染免疫等方面发挥重要的作用[8-10]。国内外研究证实CD4+Foxp3+Treg细胞在肺癌、胰腺癌、恶性黑色素瘤、胃肠道肿瘤、卵巢癌、肝癌等多种实体瘤中数量增多[13-17],研究还发现在白血病[18-21]、淋巴瘤[22,23]、多发性骨髓瘤[24-26]等恶性血液病中CD4+CD25+Treg细胞数量也增多,参与了疾病的发生发展过程。本实验利用注射FBL-3细胞建立白血病小鼠模型,分离小鼠脾细胞进行研究后发现白血病小鼠体内CD4+FoxP3+Treg细胞数量明显增多,Foxp3 mRNA及血清中IL-10水平升高,与对照小鼠相比差异有统计学意义(P<0.05),这与以往的临床研究基本一致[18-21],说明Treg细胞参与了白血病的发病过程,在白血病的免疫逃逸中发挥重要作用。
肿瘤疫苗包括自体肿瘤细胞疫苗、多肽疫苗及DNA疫苗等,为肿瘤的免疫治疗展示了新的前景。在动物实验中,单独应用或和其他的抗肿瘤制剂联合应用的CpG ODN表现出了抗肿瘤的活性[27,28]。CpG ODN能增强MS11C6(抗淋巴瘤抗体)体内抗小鼠38C13淋巴瘤的功能[29],采用可移植的同系前B细胞急性白血病模型小鼠的研究发现,给小鼠先注射模拟最低疾病残余状态的ALL细胞,7 d后应用CpC ODN治疗,小鼠的缓解期超过了6个月,研究发现CpGODN可通过激活固有免疫诱导早期急性白血病细胞的杀伤,从而产生治疗作用,同时缓解的小鼠可抵抗ALL细胞的再次攻击,这说明小鼠体内出现了ALL细胞的免疫记忆[30]。CpG 1826属于B型CpG ODN,具有全硫代修饰骨架,其序列为5′-TCCATCACGTTCCTGACGTT-3′,研究发现可以刺激免疫细胞增殖,分化和分泌,产生IFN-α、IL-6等细胞因子,在抗白血病中发挥一定作用[7]。本实验利用丝裂霉素C灭活FBL-3细胞制成瘤苗,对白血病小鼠进行瘤苗、CpG 1826治疗,实验结果显示瘤苗联合CpG 1826组生存时间最长,治疗效果最好。分离小鼠脾细胞进行研究后发现利用瘤苗治疗后,CD4+FoxP3+Treg细胞与白血病小鼠相比无显著性差异,提示瘤苗发挥抗白血病作用不是通过减少Treg细胞来发挥的。单独用CpG 1826治疗时,小鼠体内CD4+FoxP3+Treg细胞数量明显减少,Foxp3 mRNA及血清中IL-10水平降低,提示CpG 1826可以通过下调Foxp3使CD4+FoxP3+Treg细胞减少,IL-10分泌降低,从而发挥抗白血病作用。瘤苗联合CpG 1826治疗时,CD4+FoxP3+Treg细胞数量与CpG 1826治疗组差异没有统计学意义,但小鼠生存时间最长,治疗效果最好,说明瘤苗联合CpG 1826治疗可以提高疗效。
总之,本研究结果提示瘤苗联合CpG 1826治疗白血病时小鼠体内Treg细胞减少,Treg细胞可能在白血病及免疫治疗中发挥了重要作用,但需要更进一步的实验来研究Treg细胞在免疫治疗中的具体作用,以期为白血病的免疫治疗提供新的靶点。
[1] Lichtenegger FS, Krupka C, Köhnke T,etal. Immunotherapy for Acute Myeloid Leukemia[J]. Semin Hematol, 2015, 52(3):207-214.
[2] Smahel M. Antigens in chronic myeloid leukemia: implications for vaccine development[J]. Cancer Immunol Immunother, 2011, 60(12):1655-1668.
[3] Rezvani K. Peptide vaccine therapy for leukemia[J]. Int J Hematol, 2011, 93(3):274-280.
[4] Hofmann S, Mead A, Malinovskis A,etal. Analogue peptides for the immunotherapy of human acute myeloid leukemia[J]. Cancer Immunol Immunother, 2015, 64(11):1357-1367.
[5] Ursu R, Carpentier AF. Immunotherapeutic approach with oligodeoxynucleotides containing CpG motifs (CpG-ODN) in malignant glioma[J]. Adv Exp Med Biol, 2012, 746:95-108.
[6] Lin X, Chen J, Huang H. Immunostimulation by cytosine-phosphate-guanine oligodeoxynucleotides in combination with IL-2 can improve the success rate of karyotype analysis in chronic lymphocytic leukaemia[J]. Br J Biomed Sci, 2016, 73(3):110-114.
[7] 何爱丽,陈虹,张王刚,等.两种CpG ODN佐剂对小鼠白血病局灶瘤的抗瘤作用研究[J].中国实验血液学杂志,2007,15(5):1042-1045.
[8] Persa E, Balogh A, Sfrny G,etal. The effect of ionizing radiation on regulatory T cells in health and disease[J]. Cancer Lett, 2015, 368(2):252-261.
[9] Alroqi FJ, Chatila TA. T regulatory cell biology in health and disease[J]. Curr Allergy Asthma Rep, 2016, 16(4):27.
[10] Teh PP, Vasanthakumar A, Kallies A. Development and function of effector regulatory T cells[J]. Prog Mol Biol Transl Sci, 2015, 136:155-174.
[11] 李洁琼,纪玉强,杨威,等.CpG ODN对Treg细胞及Th17细胞分化的影响[J].华中科技大学学报(医学版),2015,44(4):383-389.
[12] Sakaguchi S,Sakaguchi N,Asano M,etal.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1551-1164.
[13] Tanaka A, Sakaguchi S. Regulatory T cells in cancer immunotherapy[J]. Cell Res, 2017, 27(1):109-118.
[14] Singh M, Loftus T, Webb E,etal. Minireview: regulatory T cells and ovarian cancer[J]. Immunol Invest, 2016, 45(8):712-720.
[15] Wang K, Vella AT. Regulatory T cells and cancer: a two-sided story[J]. Immunol Invest, 2016, 45(8):797-812.
[16] Takeuchi Y, Nishikawa H. Roles of regulatory T cells in cancer immunity[J]. Int Immunol, 2016, 28(8):401-409.
[17] Roychoudhuri R, Eil RL, Restifo NP. The interplay of effector and regulatory T cells in cancer[J]. Curr Opin Immunol, 2015, 33:101-111.
[18] Ureshino H, Shindo T, Nishikawa H,etal. Effector Regulatory T Cells Reflect the Equilibrium between Antitumor Immunity and Autoimmunity in Adult T-cell Leukemia[J]. Cancer Immunol Res, 2016, 4(8):644-649.
[19] Idris SZ, Hassan N, Lee LJ,etal. Increased regulatory T cells in acute lymphoblastic leukemia patients[J]. Hematology, 2015, 20(9):523-529.
[20] Jadidi-Niaragh F, Ghalamfarsa G, Yousefi M,etal. Regulatory T cells in chronic lymphocytic leukemia: implication for immunotherapeutic interventions[J]. Tumour Biol, 2013, 34(4):2031-2039.
[21] Ustun C, Miller JS, Munn DH,etal. Regulatory T cells in acute myelogenous leukemia: is it time for immunomodulation?[J]. Blood, 2011, 118(19):5084-5095.
[22] Pizzi M, Boi M, Bertoni F,etal. Emerging therapies provide new opportunities to reshape the multifaceted interactions between the immune system and lymphoma cells[J]. Leukemia, 2016, 30(9):1805-1815.
[23] Grygorowicz MA, Biernacka M, Bujko M,etal. Human regulatory T cells suppress proliferation of B lymphoma cells[J]. Leuk Lymphoma, 2016, 57(8):1903-1920.
[24] Ercetin AP, Ozcan MA, Aktas S,etal. Ex vivo evaluation of the effect of regulatory T cells on the anti-tumor activity of bortezomib in multiple myeloma[J]. Exp Hematol, 2016, 44(4):223-230.
[25] Ma Y, Lei H, Tan J,etal. Characterization of γδ regulatory T cells from peripheral blood in patients with multiple myeloma[J]. Biochem Biophys Res Commun, 2016, 480(4):594-601.
[26] Raja KR, Hajek R. Contribution of regulatory T cells to immunosuppression and disease progression in multiple myeloma patients[J]. Oncoimmunology, 2013, 2(9):e25619.
[27] Yan W, Sun TY, Yang CM,etal. CpG ODN 1826 enhances radiosensitivity of the human lung cancer cell line A549 in a rat model[J]. Genet Mol Res, 2015, 14(3):9804-9812.
[28] Makkouk A, Joshi VB, Wongrakpanich A,etal. Biodegradable microparticles loaded with doxorubicin and CpG ODN for in situ immunization against cancer[J]. AAPS J, 2015, 17(1):184-193.
[29] Wooldridge JE, Ballas Z, Krieg AM,etal. Immunostimulatory oligodeoxynucleotides containing CpG motifs enhance the efficacy of monoclonal antibody therapy of lymphoma[J]. Blood, 1997, 89(8): 2994-2998.
[30] Seif AE, Barrett DM, Milone M,etal. Long-term protection from syngeneic acute lymphoblastic leukemia by CpG ODN-mediated stimulation of innate and adaptive immune responses[J]. Blood, 2009, 114(12): 2459-2466.
EffectoftumorvaccinecombinedwithCpGODNonTregcellsinmicewithleukemia
YANG Yun*,BAI Ju,HE Aili,WANG Fangxia,SHEN Ying
(DepartmentofHematology,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China;*Correspondingauthor,E-mail:yangyun108@163.com)
ObjectiveTo explore the effect of tumor vaccine combined with CpG ODN on change of regulatory T(Treg) cells in mice with leukemia.MethodsFifty mice were randomly divided into control group, PBS group, tumor vaccine group, CpG 1826 group and tumor vaccine with CpG group(combination group).The animal model of mouse with leukemia was established by subcutaneous injection with erythroleukemia FBL-3 cells. Tumor vaccine was prepared by mitomycin C inactivating FBL-3 cells. The mice in PBS group, tumor vaccine group, CpG 1826 group and combination group were treated with PBS, tumor vaccine, CpG 1826 and tumor vaccine+CpG, respectively. The mice in control group
no treatment. The percentages of Treg cells were detected by flow cytometry and the expression levels of Foxp3 mRNA were detected by reverse transcription polymerase chain reaction(RT-PCR). Serum IL-10 levels were measured by enzyme-linked immunosorbent assay(ELISA).ResultsCompared with normal control group, the percentages of CD4+FoxP3+Treg cells,the mRNA expression of Foxp3 and the serum IL-10 levels in PBS group and tumor vaccine group were statistically increased(P<0.05), but there was no significant difference between PBS group and tumor vaccine group(P>0.05). The percentage of CD4+FoxP3+Treg cells,the mRNA expression of Foxp3 and the serum IL-10 levels in CpG 1826 group and combination group were statistically lower than those in PBS group and tumor vaccine group(P<0.05).ConclusionThe tumor vaccine combined with CpG ODN may reduce Treg cells in mice with leukemia, and Treg cells may play roles in lukemia and immunotherapy.
leukemia; immunotherapy; tumor vaccine; regulatory T cells
R733.7
A
1007-6611(2017)09-0930-06
10.13753/j.issn.1007-6611.2017.09.014
西安市科技计划基金资助项目(SF1418)
杨云,女,1970-10生,博士,副主任医师,E-mail:yangyun108@163.com
2017-04-24

