碘催化的α-酮酰胺合成进展
耿蔚华,任相伟
(1.北方食品有限公司,天津 300350;2.天津大学理学院,天津 300350)
碘催化的α-酮酰胺合成进展
耿蔚华1,任相伟2*
(1.北方食品有限公司,天津 300350;2.天津大学理学院,天津 300350)
α-酮酰胺结构广泛存在于天然产物、药物、农药和生物活性分子中。α-酮酰胺作为重要的合成中间体,在有机合成、制药等领域具有广泛应用。近年来,关于α-酮酰胺的合成及应用已有很多报道,综述了碘催化合成α-酮酰胺的研究进展,以期对该领域的深入研究提供一定的参考作用。
碘;α-酮酰胺;催化;合成
α-酮酰胺的骨架结构广泛存在于天然产物、药物、农药和生物活性分子中[1-4],如:Orexin 受体拮抗剂、HIV 蛋白酶抑制剂、Histone脱乙酰酶抑制剂、LTA4水解酶抑制剂(图1)等,是生物活性物质的重要组成部分。作为有机合成中间体,α-酮酰胺在有机合成、制药等领域被广泛应用。
α-酮酰胺的传统合成方法是用α-酮酸与有机胺发生亲核取代反应制得(图2a)。α-酮酸是采用二氧化硒、高锰酸钾等过渡金属氧化剂[5-7]氧化苯乙酮制得。这类反应的缺点是原料不易得、反应需要分两步进行、总收率低、操作复杂,且过渡金属氧化剂存在毒性高、污染环境、价格昂贵、对空气敏感等缺点,因此,人们对非金属催化剂进行了深入研究,如碘具有价格便宜、催化效果好、环境友好等优点。碘催化C-H的氧化偶联反应已经取得一定进展,碘催化剂有TBHP-I2、I2、I2-O2等[8-10]。
目前,α-酮酰胺的合成方法主要有3种:氧化胺化、氨基化合物双羰基化、插羰基法(图2b、c、d)。其中以碘作为催化剂氧化胺化合成α-酮酰胺具有反应条件温和、环境友好等优点,受到人们广泛关注。作者对近几年碘催化合成α-酮酰胺的方法进行了总结。

图 1 具有α-酮酰胺骨架结构的非天然生物活性物质Fig.1 Non-natural bioactive substances containingα-ketoamide structure

图 2 α-酮酰胺的合成方法Fig.2 Synthetic methods of α-ketoamides
1 氧化胺化法合成α-酮酰胺
用碘作为催化剂、过氧化叔丁醇作为氧化剂,可以将苯乙酮氧化成α-酮酸。2012年,Wang课题组[11]报道了苯乙酮与有机胺在TBHP-I2体系下生成α-酮酰胺(图3)。该反应克服了过渡金属催化剂的缺点,同时不需要加入溶剂,体现了绿色化学的环保理念;反应条件温和,在室温下以较高的收率得到目标产物;反应底物为便宜易得的苯乙酮,一锅法合成α-酮酰胺简化了反应步骤。

图 3 苯乙酮与胺的氧化偶联反应Fig.3 The oxidative coupling reaction of acetophenoneswith amines
通过控制实验对反应机理进行研究,发现加入2,2,6,6-四甲基哌啶氧化物(TEMPO)可以抑制反应的进行,反应原料没被消耗,证明反应经历自由基的历程。碘代苯乙酮与哌啶在过氧化叔丁醇作为氧化剂的条件下也可以进行氧化胺化反应,得到目标产物,其反应机理如图4所示。
DMSO作为良好的反应溶剂,也可以作为氧化剂参与反应。2015年,Ahmed课题组[12]报道了DMSO-I2体系下苯乙酮与胺反应合成α-酮酰胺(图5)。该反应实现了碘催化下C(sp3)-H的氧化偶联合成α-酮酰胺。

图4 氧化胺化的反应机理Fig.4 Reaction mechanism of oxidative amination
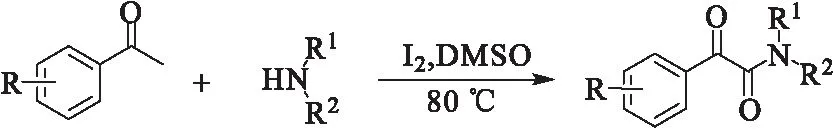
图 5 C(sp3)-H氧化偶联合成α-酮酰胺Fig.5 Synthesis of α-ketoamides by oxidative couplingreaction of C(sp3)-H
如何利用绿色环保的氧气作为氧化剂,是人们日益关注的研究方向。2016年,Guo等[13]报道了单质碘作为催化剂、氧气作为氧化剂,苯乙酮与有机胺反应生成α-酮酰胺(图6),实现了C(sp3)-H的催化氧化。其反应机理如图7所示。

图 6 碘催化的氧气氧化偶联反应Fig.6 Aerobic oxidative coupling reaction catalyzed by iodine
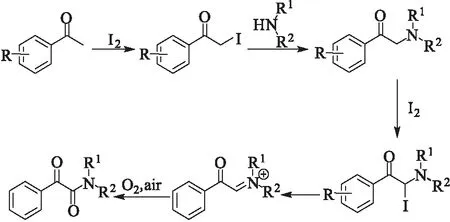
图 7 苯乙酮与胺在氧气氧化下生成α-酮酰胺的反应机理Fig.7 Reaction mechanism proposed for aerobic oxidativecoupling of acetophenones with amines to α-ketoamides
与苯乙酮类似,苯乙炔在碘作为催化剂的条件下也可以与胺反应生成α-酮酰胺。2014年,Shah课题组[14]报道了在TMSOTf-I2体系下,末端炔与胺反应合成α-酮酰胺(图8)。该反应优点是伯胺和仲胺都能很好地反应。
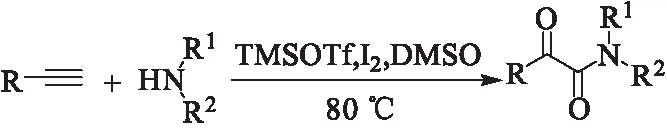
图 8 末端炔的氧化胺化Fig.8 Oxidative amination of terminal alkynes
2015年,赵温涛课题组[15]报道了在TBHP-I2体系下,苯乙烯和苯乙炔与胺反应生成α-酮酰胺(图9)。反应底物从苯乙酮扩展到苯乙炔、苯乙烯等,丰富了α-酮酰胺的合成途径。
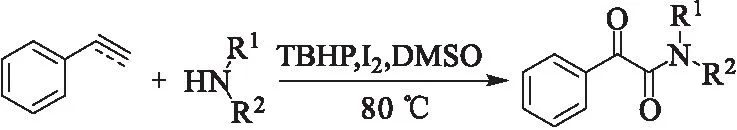
图 9 碘催化一锅法合成α-酮酰胺Fig.9 One-pot iodine-catalyzed synthesis of α-ketoamides
通过控制实验发现,反应经历了中间体碘代苯乙酮,其反应机理如图10所示。

图10 碘催化一锅法合成α-酮酰胺的反应机理Fig.10 Reaction mechanism proposed for one-potiodine-catalyzed synthesis of α-ketoamides
2015年,Sekar课题组[16]报道了IBX-I2催化氧化末端烯烃与胺反应合成α-酮酰胺(图11)。

图11 以苯乙烯为原料一锅法合成α-酮酰胺Fig.11 One-pot synthesis of α-ketoamides from styrenes
对反应机理进行了初步研究,发现该反应经历了碘代苯乙酮中间体,其反应机理如图12所示。
2015年,Shah课题组[17]报道了在DMSO-I2或TBHP-I2体系下,催化氧化苯乙烯与胺反应合成α-酮酰胺(图13)。

图 12 苯乙烯与胺氧化偶联合成α-酮酰胺的反应机理Fig.12 Reaction mechanism proposed for oxidativecoupling of styrenes with amines to α-ketoamides

图 13 用苯乙烯合成α-酮酰胺Fig.13 Synthesis of α-ketoamides from styrenes
与苯乙烯和苯乙炔相比,乙基苯的活性更低,发生氧化反应难度更大。但研究发现,乙基苯也可以在碘存在下发生反应生成α-酮酰胺。2016年,Liu课题组[18]报道了用碘作为催化剂,乙基苯与胺反应得到α-酮酰胺(图14)。该反应的优点是扩展了反应底物应用范围,适用于伯胺和仲胺。

图14 用乙基苯合成α-酮酰胺Fig.14 Synthesis of α-ketoamides from ethylbenzenes
2014年,Chaskar课题组[19]报道了在I2-TBHP-DMSO体系下,乙基苯、苯乙烯、苯乙炔与盐酸苯甲脒反应合成α-酮酰胺(图15)。

图15 用乙基苯、苯乙烯或苯乙炔合成α-酮酰胺Fig.15 Synthesis of α-ketoamides from ethylbenzenes,styrenes,or phenylacetylenes
2 脱羰基制备α-酮酰胺
用碘作为催化剂、苯乙酮为底物合成α-酮酰胺的报道中,有一类反应可以发生脱羰基反应生成α-酮酰胺。DMF作为常用的溶剂,可以脱羰基参与反应。2013年,Wang课题组[20]报道了苯乙酮与DMF在TBHP-I2体系下生成α-酮酰胺(图16)。该反应需要加入苯甲酸作为引发剂,在碘催化下,DMF发生酰胺键断裂与苯乙酮反应生成α-酮酰胺。通过该方法可以制备单取代或双取代的α-酮酰胺。
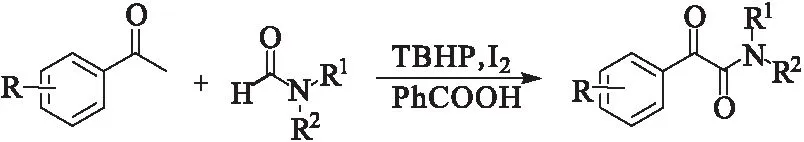
图16 苯乙酮与DMF的氧化偶联Fig.16 Oxidative coupling of acetophenones withN,N-dimethylformamide
对反应机理进行研究,发现反应是自由基机理。同时,反应经历了碘代苯乙酮中间体,其反应机理如图17所示。

图17 苯乙酮与DMF氧化偶联合成α-酮酰胺的反应机理Fig.17 Reaction mechanism proposed for oxidative coupling ofacetophenones with N,N-dimethylformamide to α-ketoamides
2016年,Zhu课题组[21]研究了苯乙酮与DMF在CuO-I2体系下空气氧催化氧化合成芳基α-酮酰胺(图18)。

图18 苯乙酮与DMF合成芳基α-酮酰胺Fig.18 Synthesis of aryl-α-ketoamides from acetophenonesand N,N-dimethylformamide
3 从其它原料出发合成α-酮酰胺
有报道从其它原料出发合成α-酮酰胺,进一步扩展了α-酮酰胺合成方法。2013年,Wang课题组[22]报道了β-二酮与仲胺在TBHP-I2体系下生成α-酮酰胺(图19)。在TBHP-I2体系下,β-二酮发生碳碳键断裂,同时发生氧化反应,一锅法得到目标产物α-酮酰胺。

图19 β-二酮与胺的氧化偶联Fig.19 Oxidative coupling of β-diketones with amines
2014年,Zhu课题组[23]报道了在n-Bu4NI-TBHP体系下,炔胺发生氧化反应制备α-酮酰胺(图20)。

图20 碘催化氧化炔胺Fig.20 Catalytic oxidation of ynamides by iodine
该反应的优点是可以制备N原子上连有H的α-酮酰胺。对其反应机理进行研究发现,反应经历了自由基历程;同时,反应需要氧气参与,经历了碘中间体。其反应机理如图21所示。

图21 炔胺氧化的反应机理Fig.21 Reaction mechanism of ynamides oxidation
以往合成α-酮酰胺的N原子上通常连有取代基。2015年,Wu课题组[24]报道了在DMSO-I2体系下苯乙酮与甲脒盐酸盐反应制备α-酮酰胺(图22)。该反应优点是,目标产物α-酮酰胺的N原子上不连接任何基团。与以往报道不同的是,此反应采用DMSO作为氧化剂。这个反应扩展了α-酮酰胺的合成范围,可以选择性地合成N原子上连接取代基或者N原子连有H的α-酮酰胺。

图22 N原子上连接H(N-H)的α-酮酰胺的合成Fig.22 Synthesis of free(N-H) α-ketoamides
4 结语
近几年,α-酮酰胺的合成研究取得了很大进展。合成底物不再局限于α-酮酸,而是扩展到苯乙酮、苯乙烯、苯乙炔、乙基苯等原料。反应用碘代替重金属催化剂,解决了过渡金属催化剂价格昂贵、污染环境等缺点。在氧化剂方面,用空气氧作为氧化剂,反应更加绿色环保。目前,α-酮酰胺的合成主要是以仲胺为主,研发由伯胺和氨制备相应的酮酰胺的方法,有待进一步研究及推广。
[1] ZHANG C,XU Z J,ZHANG L G,et al.Copper-catalyzed aerobic oxidative coupling of aryl acetaldehydes with anilines leading toα-ketoamides[J].Angewandte Chemie International Edition,2011,50(47):11088-11092.
[2] SHEHA M M,MAHFOUZ N M,HASSAN H Y,et al.Synthesis of di- and tripeptide analogues containingα-ketoamide as a new core structure for inhibition of HIV-1 protease[J].European Journal of Medicinal Chemistry,2000,35(10):887-894.
[3] WADA C K,FREY R R,JI Z Q,et al.α-Keto amides as inhibitors of histone deacetylase[J].Bioorganic & Medicinal Chemistry Letters,2003,13(19):3331-3335.
[4] de RISI C,POLLINI G P,ZANIRATO V.Recent developments in general methodologies for the synthesis ofα-ketoamides[J].Chemical Reviews,2016,116(5):3241-3305.
[5] ZHU Z Z,TANG X D,LI J X,et al.Synthesis of enaminonesviacopper-catalyzed decarboxylative coupling reaction under redox-neutral conditions[J].Chemical Communications,2017,53(22):3228-3231.
[6] JIANG L,MA N,QIU J,et al.The photochemical synthesis ofN-arylacetyl lactams[J].Journal of Chemical Research,2013,37(3):143-145.
[7] WU Q Q,LIU S L,WANG F Y,et al.Amino acid salt catalyzed asymmetric synthesis of 1,2-diols with a quaternary carbon center[J].Synlett,2015,26(17):2442-2446.
[8] JIANG H F,HUANG H W,CAO H,et al.TBHP/I2-mediated domino oxidative cyclization for one-pot synthesis of polysubstituted oxazoles[J].Organic Letters,2010,12(23):5561-5563.
[9] HE Z H,LI H R,LI Z P.Iodine-mediated synthesis of 3H-indolesviaintramolecular cyclization of enamines[J].Journal of Organic Chemistry,2010,75(13):4636-4639.
[10] AZYAZOV V N,PICHUGIN S Y,HEAVEN M.Formation and quenching mechanisms of excited particles in an oxygen-iodine laser medium[J].Optics and Spectroscopy,2009,107(3):363-367.
[11] ZHANG X B,WANG L.TBHP/I2-promoted oxidative coupling of acetophenones with amines at room temperature under metal-free and solvent-free conditions for the synthesis ofα-ketoamides[J].Green Chemistry,2012,14(8):2141-2145.
[12] MUPPARAPU N,VISHWAKARMA R A,AHMED Q N.Iodine-DMSO promoted C-H(sp3) functionalization approach toα-ketoamides[J].Tetrahedron,2015,71(21):3417-3421.
[13] GUO S Y,FANG Z,YANG Z,et al.I2-promoted aerobic oxidative coupling of acetophenes with amines under metal-free conditions:facile access toα-ketoamides[J].RSC Advances,2016,6(2):1503-1507.
[14] DESHIDI R,KUMAR M,DEVARI S,et al.A general metal free approach toα-ketoamidesviaoxidative amidation-diketonization of terminal alkynes[J].Chemical Communications,2014,50(67):9533-9535.
[15] 任相伟,王光伟,唐向阳,等.不饱和烃在碘催化下一锅法合成α-酮酰胺[J].有机化学,2015,35(8):1733-1738.
[16] DUTTA S,KOTHA S S,SEKAR G.Metal free one-pot synthesis ofα-ketoamides from terminal alkenes[J].RSC Advances,2015,5(58):47265-47269.
[17] DESHIDI R,DEVARI S,SHAH B A.Iodine-promoted oxidative amidation of terminal alkenes-synthesis ofα-ketoamides,benzothiazoles,and quinazolines[J].European Journal of Organic Chemistry,2015,2015(7):1428-1432.
[18] RAMANATHAN M,KUO C K,LIU S T.One pot synthesis ofα-ketoamides from ethylarenes and amines:a metal free difunctionalization strategy[J].Organic & Biomolecular Chemistry,2016,14(48):11446-11453.
[19] KALMODE H P,VADAGAONKAR K S,CHASKAR A C.Metal-freeinsitusp3,sp2,andspC-H functionalization and oxidative cross coupling with benzamidines hydrochloride:a promising approach for the synthesis ofα-ketoimides[J].RSC Advances,2014,4(104):60316-60326.
[20] ZHAO Q,MIAO T,ZHANG X B,et al.Direct use of formamides as amino group sourcesviaC-N bond cleavage:a catalytic oxidative synthesis ofα-ketoamides from acetophenones and formamides under metal-free conditions[J].Organic & Biomolecular Chemistry,2013,11(11):1867-1873.
[21] LIU W B,XU S S,CHEN C,et al.An expedient approach to synthesize aryl-α-ketoamides from acetophenones andN,N-dimethylformamide[J].Chemistry Select,2016,47(30):612-614.
[22] ZHANG X B,WANG M,ZHANG Y C,et al.A novel and metal-free approach towardsα-ketoamides using a TBHP/I2-promoted tandem reaction of amines withβ-diketonesviaC-C bond cleavage[J].RSC Advances,2013,3(5):1311-1316.
[23] HUANG H,HE G K,ZHU X L,et al.Iodine-mediated oxidation of ynamides:a facile access toN-monosubstitutedα-ketoamides andα-ketoimides[J].European Journal of Organic Chemistry,2014,2014(32):7174-7183.
[24] LIU S,GAO Q H,WU X,et al.Formamidine hydrochloride as an amino surrogate:I2-catalyzed oxidative amidation of aryl methyl ketones leading to free(N-H)α-ketoamides[J].Organic & Biomolecular Chemistry,2015,13(8):2239-2242.
ProgressinIodine-CatalyzedSynthesisofα-Ketoamides
GENG Wei-hua1,REN Xiang-wei2*
(1.NorthFoodCo.,Ltd.,Tianjin300350,China;2.SchoolofScience,TianjinUniversity,Tianjin300350,China)
The structures ofα-ketoamides are widely found in natural products,drugs,pesticides,and biological active molecules.As important synthetic intermediates,α-ketoamides have been widely used in many fields such as organic synthesis and pharmaceutical industry.In recent years,the synthesis and applications ofα-ketoamides have been reported many times.Herein,we summarize the research progress in iodine-catalyzed synthesis ofα-ketoamides,in order to provide some reference for in-depth research of this field.
iodine;α-ketoamide;catalysis;synthesis
TQ225.261
A
1672-5425(2017)10-0011-05
2017-05-09
耿蔚华(1970-),男,河北束鹿人,高级工程师,研究方向:食品添加剂,E-mail:gengwh06@sina.com;通讯作者:任相伟,工程师,E-mail:xiangwei_ren@tju.edu.cn。
10.3969/j.issn.1672-5425.2017.10.003
耿蔚华,任相伟.碘催化的α-酮酰胺合成进展[J].化学与生物工程,2017,34(10):11-15.

