新疆7所医院药品不良反应监测报告工作督查分析
耿东升,王晓娟,赵文燕
(中国人民解放军新疆军区药品仪器检验所,新疆 乌鲁木齐 830063)
药 事
新疆7所医院药品不良反应监测报告工作督查分析
耿东升,王晓娟,赵文燕
(中国人民解放军新疆军区药品仪器检验所,新疆 乌鲁木齐 830063)
目的督导医院开展药品不良反应(ADR)报告和监测工作。方法以特别制订的“检查表”为载体,通过查阅工作制度及记录、现场调阅“药品不良反应/事件报告表”、询问答疑、辅导授课和检查点评的方式,监督、检查新疆7所医院开展ADR的报告和监测工作。结果医院ADR报告率普遍较低;ADR报告和监测的管理工作制度及记录不完善;医生主动报告ADR的积极性低;中成药和抗菌药物针剂仍是发生ADR的主要品种。结论加强和发挥药政监督职能,可促进医院对ADR报告和监测工作的重视和落实。
监督;检查;药品不良反应;药品不良反应报告;药品不良反应监测;医院
据世界卫生组织(WHO)调查发现,发展中国家住院患者的药品不良反应(ADR)发生率为10% ~20%,有5%的患者因ADR而住院,且ADR高发的主要原因是不合理用药[1]。2011年,国家卫生部出台并施行《药品不良反应报告和监测管理办法》(简称《办法》)[2],药政监督部门人员以此为依据督导基层医院的ADR报告和监测工作,掌握辖区各级医疗机构开展ADR监测和报告工作的情况,并探索有效的督查方法。本调查中调查了2015年新疆地区随机抽查的7所医院ADR监测报告情况,现报道如下。
1 资料来源
资料来源于新疆地区7所三级甲等和二级甲等医院2015年度住院患者与用药概况,详见表1。
2 方法与结果
2.1 督导方式
2.1.1 以“检查表”为载体
主要通过查阅医务部(处)、药剂科、质量管理科相关的组织制度及实际工作记录,现场调阅“药品不良反应/事件报告表”,对负责ADR报告和监测的人员询问答疑的方式,填写为督查特别制订的《××医院2015年度药品不良反应报告与监测管理检查表》。根据“办法”的精神和要求,主要从管理工作角度设计检查表的内容,重点检查ADR报告和监测工作的制度建设与执行情况。制度建设主要包括:法规制度的建立和完善,组织结构和人员职责是否明确,档案管理是否规范;制度执行主要调查医疗机构在ADR的发现、报告、评价和控制,以及医务人员培训、讲评、信息交流和奖惩等工作的开展情况。详见表2。
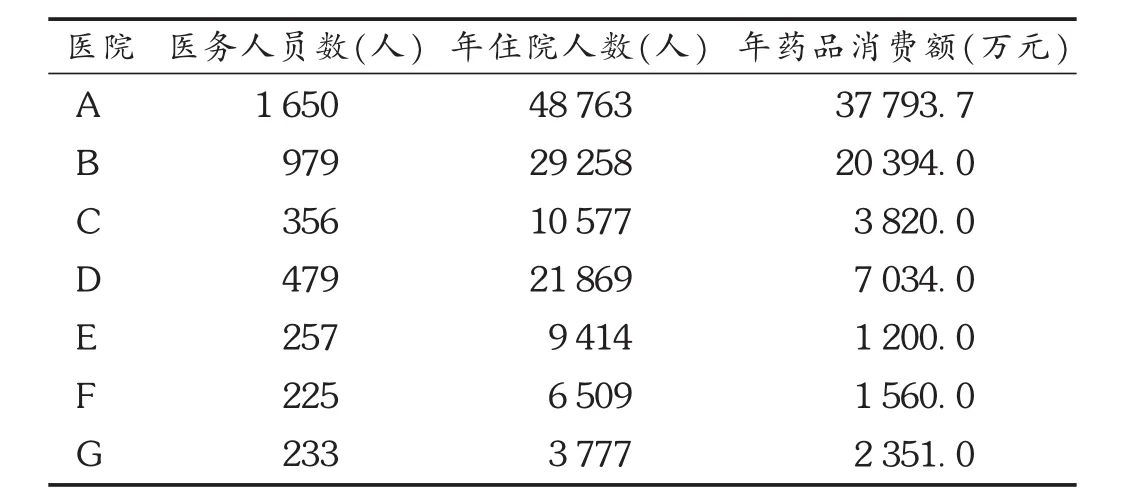
表1 2015年7所医院调查基本资料
2.1.2 培训与讲评相结合
督查期间,邀请工作组专家为全院医务人员辅导授课,宣贯“药品不良反应/事件概述”和“药品不良反应报告和监测管理办法”;针对医院相关管理人员存在的问题和疑惑,给予现场传帮带;结束时对医院进行检查点评。以期提高对ADR报告和监测重要性的认识,明确并落实ADR报告和监测的管理工作制度,更加主动认真地开展ADR报告和监测工作。
2.2 主要督导内容
2.2.1 组织建设
各级医院均成立了抗菌药物使用的管理组织,但组织中各个部门的相关任务、要求未明确,易造成如医务部(处)及质量管理科职能和作用不清;或存在人员变动未更新;或未纳入信息部门,弱化ADR信息查询、整理、监测功能;ADR的牵头部门是药剂科,但医务部(处)对ADR报告监测工作不够重视,导致医生主动报告ADR不足;或只见文件资料、未见实际运行的管理组织。
2.2.2 制度规范
检查发现,有的医院未编写符合本院实际的处方集,并未制订统一和定期更新的制度;或医院未建立ADR相关知识和管理的培训制度,或缺少考核和认定环节;医院未明确发生ADR的责任区分,也未规定报告的ADR需要在病历中记录;或医院未制订ADR定期分析与讲评制度、ADR预防与纠正措施,以及定期将本院发生的ADR上报上级技术分析中心同步,上报至核发医疗机构许可证的卫生行政部门的制度。
2.2.3 工作记录
ADR报告和监测的数据参差不齐:检查发现,医院ADR的报告率普遍低,D和F医院尚未开展ADR报告和监测工作,可见,三甲医院ADR报告和监测工作开展较好;报告的临床类型以一般的ADR为主;ADR报告者职业主要是药师和护师;发生ADR的药品主要为中成药如致康胶囊、热毒宁注射液、红花黄色素注射液和参麦注射液等;临床用量较大的抗菌药物如氧氟沙星、头孢霉素和阿奇霉素注射液;蛋白质类药物如白眉蛇血凝酶和复方氨基酸注射液;大分子营养药物如脂肪乳注射液。详见表3。
制度落实上还存在一些不容忽视的问题:督查发现,在被检查的医院中,只有2所医院参加了全军ADR监测网,D和F医院未开展ADR监测工作;E和G医院ADR报告形式和内容不规范。或无ADR相关知识及其报告监测的培训计划;或被提问回答进行了培训,但未存留培训记录;或培训缺ADR报告和监测的内容,大部分医院有授课无考核,培训不扎实;或“药品不良反应/事件”报表,但无同一ADR的病历记录,真实性不足;或“药品不良反应/事件”报表中的描述与病历记录不一致,如某医院在报表中的描述是“患者服某药后突发恶心、呕吐”,其病程记录对ADR的叙述是“服某药后患者有出血倾向”,因此还使用了止血剂;大多数医院的ADR管理小组很少针对ADR的报告及监测工作进行专题研究和讲评;对ADR报告和监测工作优劣的奖惩方式,医院主要是给未达标(每月不低于收治患者数的1%)的科室扣分,很少在业务大会上表扬和批评,以及将其作为科室或个人医疗质量的考评指标;目前未参加全国ADR监测网的医院,尚无ADR上报至区域ADR监测中心(技术机构)和卫生行政部门(管理机构)的渠道。
3 讨论
3.1 强化对ADR报告和监测工作的重视
各级医疗机构法人和管理者应充分认识ADR报告和监测工作的目的和意义,树立紧迫感和责任意识;才可能避免ADR报告和监测工作无专业组织、无专人负责、制度不健全、落实不到位,尤其是发生在基层医疗机构的突出问题[3-7],承担起ADR报告和监测工作的领导和组织职能。
3.2 增强责任意识,激发上报ADR的主动性
医生和护士是使用药品的主体,也是ADR诊治的核心力量。如何强化其对ADR报告和监测工作重要性的认识,全面了解药品作用和ADR的研究进展,纠正其医疗的重点是药物疗效而非ADR、ADR报告和监测工作不是主业的片面意识,消除其发生ADR怕担责、工作忙、填报ADR怕麻烦的心理,主动报告ADR。对此提出如下建议:
1)切实发挥ADR管理小组的领导和管理职能,对报告ADR提出明确要求。

表2 XX医院XXXX年度药品不良反应报告与监测管理检查表
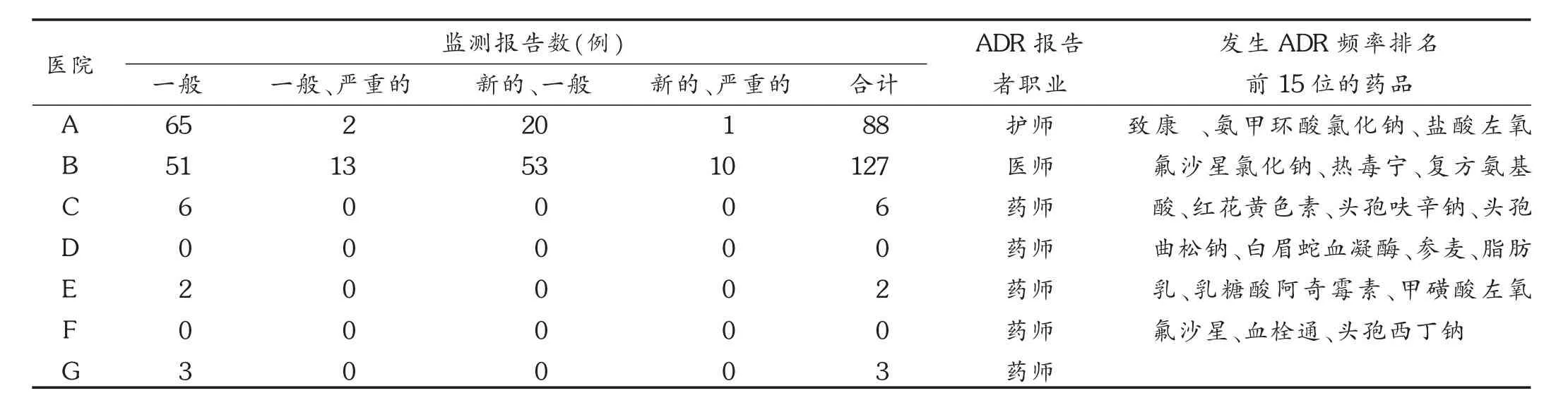
表3 2015年各级医院ADR监测报告数据统计结果
2)加强医务人员尤其是医生和护士对ADR相关知识及ADR报告内容的培训,逐步提高其对ADR的认知水平,熟悉“药品不良反应/事件”报表的填报内容、方法及判断标准等[8]。
3)进一步明确发生ADR的责任区分,将ADR报告质量纳入医疗质量考评。同时,在国家层面建立ADR赔偿救济制度出台之前[9],探索医疗机构对主动报告ADR的医务人员施行奖励的制度,和医院主体对合理用药发生的ADR实行责任承担的承诺机制,鼓励医护人员积极主动报告ADR,消除医护人员担心医疗事故纠缠的顾虑。
4)在医生的确认和查阅病程记录下,利用ADR报告填写的专门人员如药师或部分临床联络员协助医生填写完成“药品不良反应/事件”报表[4]。
3.3 建议扩充“ADR监测范围”
《办法》规定,非新药监测期的国产药品和进口满5年的进口药品,报告新的和严重的ADR;同时我国ADR报告不包括假药和劣药[8]。建议:
1)ADR监测的对象应该全覆盖,无论是新药还是上市5年以上的药品,对其已知(药品说明书写明)和未知(药品说明书未写明或未见报道)的ADR均应报告、监测和统计分析,即使是药品说明书已写明的一般ADR,通过对某药品大样本报告的统计分析,也可能重新修订该药品说明书中所提示的某ADR发生的概率、易损人群和性质与程度。
2)ADR监测的内容应该全覆盖,不论药物本身即药品中药物固有的或天然的不良反应,还是与药品相关的缺陷如制剂生产、运输保管、质量检验、使用操作等不当原因,应向英国学习,即药品警戒是监测所有可能影响药品安全性的因素[8,10]。ADR针对的不应只是主药化学体的药理作用,还应包括主药与附加剂形成药品的质量优劣、药品保管贮藏的条件变化而改变了的药物性质,以及不合理和不当使用药品等带给患者的伤害。
3.4 充分发挥相关部门的监管作用
国家及地方食品药品监督管理和卫生行政部门,应当发挥其现场检查和督导的职能,深入一线检查,寻找问题,通过解疑释惑、传帮带解决问题;同时,将ADR报告和监测工作纳入“风险管理”[10-11],对医疗机构开展ADR的监测体系,从过程效果、产出效果和结果效果进行科学评价[9,12];尽快建立各级医疗机构对于国内外ADR的信息共享,促进和协调医疗机构之间ADR报告和监测工作同步、健康发展。
[1]杨新波,黄正明.药物不良反应与药源性疾病的防治[M].北京:军事医学科学出版社,2009:1.
[2]中华人民共和国卫生部.药品不良反应报告和监测管理办法[Z].卫生部令第 81号,2011.
[3]班炳坤,韦敬士,李二平,等.基于报告数量和质量分析基层药品不良反应监测工作现状[J].中国药物警戒,2016,13(6):344-346.
[4]刘 江,曹伟灵,宋 芳.临床药师参与药品不良反应监测工作的体会[J].中国药业,2014,23(23):73 - 74.
[5]高宏亮.浅议加强基层药品不良反应监测体系建设的必要性[J].中国药事,2010,24(3):268 - 269.
[6]梁丽君.药剂科在药品不良反应监测管理中存在的问题与对策研究[J].海峡药学,2015,27(12):283 - 284.
[8]金 锋,曲 毅,樊若曦,等.我国基层药品不良反应监测体系建设现状分析及展望[J].中国药物警戒,2015,12(5):275-278.
[7]周 围,刘艾林,杜冠华.中国与英国药品不良反应监测制度的对比研究[J].中国药物评价,2015,32(6):376 -380.
[9]邵 蓉,唐吉锋.我国药品不良反应监测体系实施效果评价[J].中国卫生政策研究,2014,7(8):29 -36.
[10]胡国权,陈建伟,曹 琳.基于标准化模型构建药品质量风险管理体系的研究[J].中国现代应用药学,2016,33(10):1347-1354.
[11]刘翠丽,夏东胜.我国基本药物不良反应监测实践与药品的风险管理[J].中国药物警戒,2014,11(10):614 -617.
[12]罗雪梅.应借鉴国外经验完善我国基层不良反应监测体系建设[J].中国药业,2014,23(10):7 -9.
Supervision and Analysis of Reports and Monitoring of Adverse Drug Reaction in Seven Hospitals in Xinjiang
Geng Dongsheng,Wang Xiaojuan,Zhao Wenyan
(Institute for Drug and Instrument Control of Xinjiang Military Command,Urumqi,Xinjiang,China 830063)
Objective To supervise the development of the reports and monitoring of adverse drug reaction (ADR)in hospitals.Methods The specially formulated checklist was adopted as the supporter,by the way of consulting of work institution and records,on-site accessing to the table of adverse drug reaction/event,asking and answering questions,publicizing teaching and the mentoring,reviewing comments,the jobs of the reports and monitoring of ADR were inspected and supervised in seven hospitals in Xinjiang.Results The report rate of ADR in hospital was commonly lower.The management system and records of ADR reports and monitoring were imperfection.The doctor′s initiative to report ADR has not yet been stimulated.Chinese patent drugs and injections of antibiotics were still main drugs that induced to ADR.Conclusion The function of regulatory oversight of the drug administration department should be strengthened and brought into play so that the reports and monitoring of ADR in hospitals are paid attention to and implemented.
supervision;inspection;adverse drug reaction;report of adverse drug reaction;monitoring of adverse drug reaction;hospital
R954
A
1006-4931(2017)19-0078-04
10.3969 /j.issn.1006 - 4931.2017.19.023
耿东升(1959-),硕士研究生,主任药师,研究方向为抗炎免疫药理与药品质量监督,(电话)0991-4975278(电子信箱)dongsheng811@ sina.com。
2017-06-06)

