HPLC梯度洗脱法同时测定金嗓散结胶囊中6种主要成分的含量
谭雄斯,庞武耀(肇庆医学高等专科学校,广东 肇庆 526020)
·实验研究·
HPLC梯度洗脱法同时测定金嗓散结胶囊中6种主要成分的含量
谭雄斯,庞武耀(肇庆医学高等专科学校,广东 肇庆 526020)
目的:建立同时测定金嗓散结胶囊中6种主要成分的HPLC梯度洗脱方法。方法:选用Venusil MP C18色谱柱;流动相:乙腈(A)和0.03%磷酸溶液(B),梯度洗脱:0 ~ 9 min 15.0%A,9 ~ 16 min 15.0%→21.0%A,16 ~ 22 min 21.0%→36.0%A,22 ~ 30 min 36.0%→55.0%A,30 ~ 37 min 55.0%→75.0%A,37 ~ 45 min 75.0%→15.0%A;流速:0.8 mL·min-1;柱温:30 ℃;进样量:10 µL;检测波长:210 nm(苦杏仁苷、哈巴苷)、280 nm(安格洛苷C、哈巴俄苷)和208 nm(24-乙酰泽泻醇A、23-乙酰泽泻醇B)。结果:苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B分别在一定的线性范围内线性关系良好(r ≥ 0.9992);平均回收率96.77% ~ 100.05%,RSD值0.60% ~ 1.55%;精密度和重复性良好;室温下金嗓散结胶囊供试品溶液在12 h内稳定。结论:该方法操作简便,结果准确,可用于金嗓散结胶囊中6种主要成分含量的同时测定。
金嗓散结胶囊;苦杏仁苷;哈巴苷;安格洛苷C;哈巴俄苷;24-乙酰泽泻醇A;23-乙酰泽泻醇B
[KEY WORDS]Jinsangsanjie capsules; Amygdalin; Harpagide; Angoroside C; Harpagoside; 24-acetate alisol A; 23-acetate alisol B
金嗓散结胶囊由桃仁、玄参、泽泻等16味中药材加工而成,具有清热解毒、活血化瘀、利湿化痰的功效,对慢喉喑(声带小结、声带息肉、声带黏膜增厚)及由此而引起的声音嘶哑等症状的治疗效果明显。张甦琳等[1]采用金嗓散结胶囊对75例声带息肉及声带小结患者进行治疗,结果显示金嗓散结胶囊安全方便,对声带息肉及声带小结疗效显著,声带小结总有效率达到93.8%,声带息肉总有效率达到89.7%,室带息肉总有效率达到100.0%,声带小结伴急性充血、声带息肉伴急性充血总有效率达到100.0%,声带慢性充血伴肥厚总有效率达到66.7%。贤清惠[2]报道重用玄参治疗声带息肉效果显著。金嗓散结胶囊收录于中药成方制剂第12册,其主药桃仁、红花、贝母行气活血、化淤通络、化痰散结,辅以玄参、泽泻、金银花、蒲公英,共达淤行痰化结散之功效。标准中仅规定了其性状、鉴别及胶囊剂通则项下的检测项目[3],未对方中的主要药物进行定量测定控制,为确保用药安全,全面控制本品质量,笔者对桃仁中的苦杏仁苷,玄参中的哈巴苷、安格洛苷C、哈巴俄苷,泽泻中的24-乙酰泽泻醇A、23-乙酰泽泻醇B采用HPLC波长切换法进行了同时测定,可用于金嗓散结胶囊的质量控制和治疗药物监测。
1 仪器与试药
Agilent 1200系列四元梯度泵高效液相色谱仪(美国安捷伦公司);AG-245型十万分之一电子分析天平(瑞士Mettler-Toledo公司);SB-5200DTD超声波发生器(宁波新芝生物科技股份有限公司)。
金嗓散结胶囊(西安碑林药业股份有限公司,规格:0.4 g,批号:JA116010011、JA116020051、JA116050091);苦杏仁苷对照品(批号:110820-201607,含量90.7%,2 ~ 10 ℃冷处保存)、哈巴苷对照品(批号:111729-201506,含量95.9%)、哈巴俄苷对照品(批号:111730-201307,含量97.1%,极具引湿性开封后一次使用完毕)、23-乙酰泽泻醇B对照品(批号:111846-201504,含量99.0%,冷冻保存)购于中国食品药品检定研究院;安格洛苷C对照品(批号:115909-22-3,含量98.0%)购于上海宝曼生物科技有限公司;24-乙酰泽泻醇A对照品(批号:18674-16-3,含量98.0%)购于宝鸡辰光生物科技有限公司。乙腈为色谱纯,其它试剂为分析纯。
2 方法与结果
2.1 色谱条件
采用Venusil MP C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.03%磷酸溶液,梯度洗脱(0 ~ 9 min,15.0%A;9 ~ 16 min,15.0%→21.0%A;16 ~ 22 min,21.0%→36.0%A;22 ~ 30 min,36.0%→55.0%A;30 ~ 37 min,55.0%→75.0%A;37 ~45 min,75.0%→15.0%A);0 ~ 22 min时在210 nm[4-6]波长下检测苦杏仁苷和哈巴苷,22 ~ 30 min在280 nm[7-8]波长下检测安格洛苷C和哈巴俄苷,30 ~ 45 min在208 nm[9-10]波长下检测24-乙酰泽泻醇A和23-乙酰泽泻醇B;流速:0.8 mL·min-1;柱温:30 ℃;进样量:10 µL。
2.2 溶液的制备
2.2.1 对照品溶液 分别精密称取对照品苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B各适量,用50%甲醇分别制成每毫升中含苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B各1.418、2.634、1.196、0.832、0.524、0.430 mg的对照品储备溶液。再分别依次量取上面的各对照品储备液:5.0、5.0、5.0、5.0、2.5、2.0 mL,置同一100 mL量瓶中,用50%甲醇稀释至刻度,摇匀,即得混合对照品溶液。
2.2.2 供试品溶液 取装量差异项下的本品内容物适量,研细,取1.0 g,精密称定,置25 mL量瓶中,加入50%甲醇适量,SB-5200DTD超声波发生器超声处理30 min,放冷,用50%甲醇加至刻度,摇匀,过滤,取续滤液,即得。
2.2.3 阴性样品溶液 按《中华人民共和国卫生部药品标准》中药成方制剂第十二册中金嗓散结胶囊的处方及工艺过程,制备不含桃仁(去皮)、玄参和泽泻的阴性样品,再按“2.2.2”项下的方法制成阴性样品溶液。
2.3 专属性实验
精密吸取“2.2.1 ~ 2.2.3”项下的溶液各适量,按照“2.1”项下色谱条件及方法进行检测。试验结果显示,阴性样品溶液的色谱图中,在对照品混合溶液所显示的苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B对应的位置无干扰,各峰之间的分离度大于1.5,理论塔板数均大于3000,详见图1。
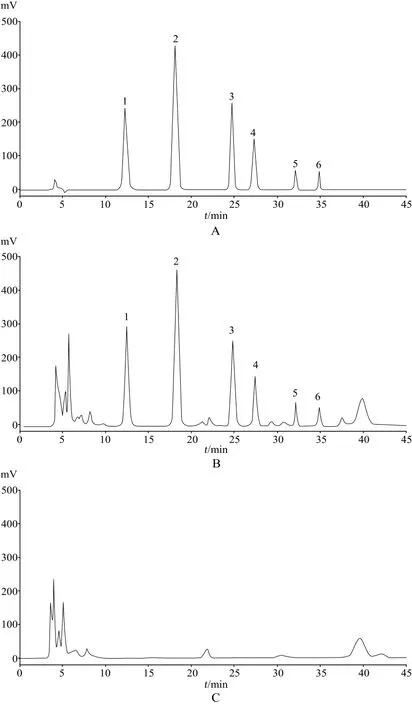
图1 HPLC色谱图Fig 1 HPLC chromatograms
2.4 线性关系考察
分别精密吸取“2.2.1”项下对照品储备液各0.1、0.2、0.5、1.0、1.5、2.0 mL,将其置于20 mL量瓶中,用50%甲醇稀释至刻度,摇匀,即得到一系列浓度的混合对照品溶液,按照上述测定方法进行测定,采用质量浓度(X)作为横坐标,测得的峰面积(Y)作为纵坐标,绘制标准曲线,得回归方程,如表1所示。
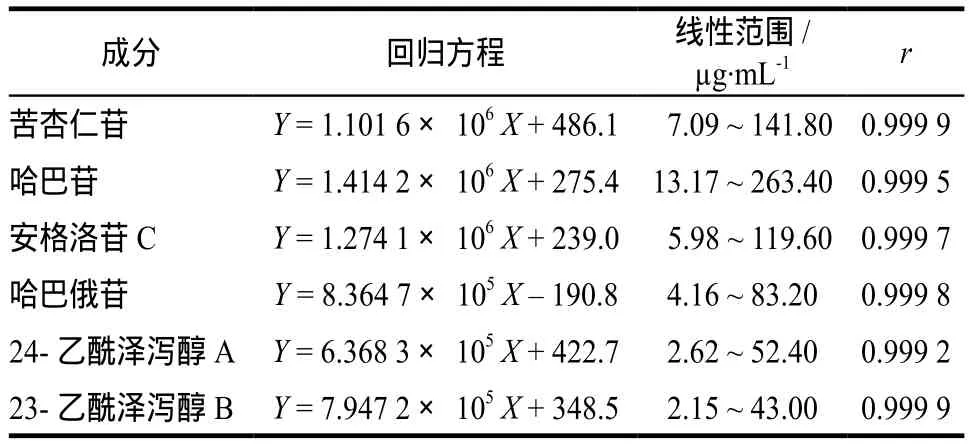
表1 线性关系实验结果Tab 1 The results of the linear relationship test
2.5 加样回收率实验
分别精密称取对照品苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A、23-乙酰泽泻醇B各适量,用50%甲醇分别溶解并稀释制成含苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A、23-乙酰泽泻醇B为0.509、0.758、0.677、0.572、0.380、0.254 mg·mL-1对照品溶液,备用。
取金嗓散结胶囊(批号:JA116010011)6份,倾出内容物,研细,取0.5 g,研细,置25 mL量瓶中,依次精密加入上述备用对照品溶液适量,再按“2.2.2”项下的方法制备样品,作为加样回收样品溶液。按照“2.1”项下色谱条件及检测方法,计算苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的回收率及相应的RSD,详见表2。
2.6 重复性实验
取金嗓散结胶囊样品(批号:JA116010011),按“2.2.2”项下方法制备供试品溶液6份,按“2.1”项下的色谱条件及检测方法进行测定,分别计算苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的含量,并计算所测组分含量的RSD,结果所测6个组分的RSD依次为1.02%、0.57%、1.26%、0.81%、0.73%和1.69%。
2.7 精密度实验
取“2.2.1”项下的混合对照品溶液,按“2.1”项下色谱条件及方法测定,连续进样6次,测定峰面积,结果显示苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B峰面积的RSD(n=6)分别为0.62%、1.01%、0.55%、0.89%、1.07%和1.09%。
2.8 稳定性实验
取“2.2.2”项下的供试品溶液(批号:JA116010011),在室温下放置0、2、4、6、8、10、12 h,按“2.1”项下色谱条件及方法测定,测定苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的峰面积值,并求得这6个组分峰面积的RSD分别为0.88%、0.74%、1.06%、0.92%、1.15%和1.21%。结果表明室温下金嗓散结胶囊中苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B在12 h内稳定。

表2 苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的回收率Tab 2 Recovery test results of amygdalin, harpagide,angoroside C, harpagoside, 24-acetate alisol A and 23-acetate alisol B
2.9 样品测定
取三批金嗓散结胶囊,按“2.2.2”项下方法制备金嗓散结胶囊供试品溶液,按“2.1”项下色谱条件进样,测定苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的含量,结果见表3。
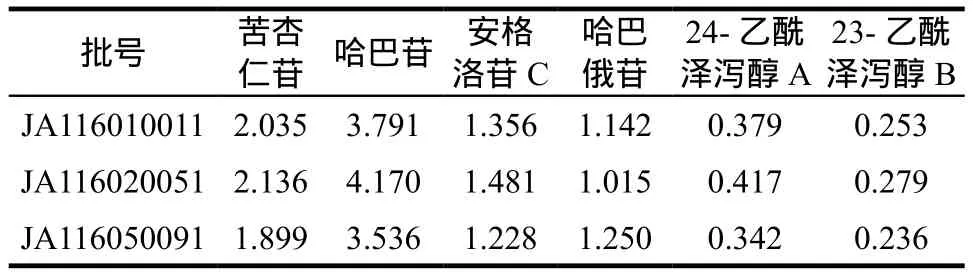
表3 含量测定结果. mg·g-1Tab 3 Results of content determination. mg·g-1
3 讨论
3.1 色谱条件的考察
分别考察乙腈-水流动相体系[5,8-10]、乙腈-冰醋酸溶液流动相体系[11]和乙腈-磷酸溶液流动相体系[4,6-7],以基线的平稳情况、所测各成分苦杏仁苷、哈巴苷、安格洛苷C、哈巴俄苷、24-乙酰泽泻醇A和23-乙酰泽泻醇B的峰形以及分离情况为指标,优选最佳的流动相体系,对比结果显示以乙腈-磷酸溶液为流动相体系时,所测各组分峰形对称,所测各成分色谱峰分离度符合要求,基线较平稳。在此基础上又对磷酸溶液的浓度进行摸索,最终确定以乙腈-0.03%磷酸溶液为流动相,并按照文中的比例梯度洗脱对金嗓散结胶囊中6个成分进行同时测定。
3.2 供试品提取方式的确定
在供试品溶液的制备实验中,作者分别考察了提取方法(回流、超声、索氏)及提取溶剂(50%甲醇、甲醇、乙醇),结果显示,以50%甲醇超声提取时操作最为简便、所测各成分的提取效率最佳。在此基础上又分别对提取时间(15、30、45 min)及溶剂量(1 g : 20 mL,1 g : 25 mL,1 g : 50 mL)进行了考察,最终优选最佳的供试品溶液制备方法为:供试品中加入25倍量的50%甲醇溶液,超声提取30 min。
综上,本研究采用简单、快速、准确的高效液相波长切换联合梯度洗脱法测定金嗓散结胶囊中6个成分的含量,为金嗓散结胶囊质量标准的提高提供了数据支持,具有一定的实际意义。本文采用波长切换法同时对金嗓散结胶囊中6个成分进行同时测定,也存在一定的不足之处,对照品使用量较大,尤其对于极具引湿性、要求开封后一次使用完毕的哈巴俄苷对照品,检验成本偏高。采用一测多评法对金嗓散结胶囊中多组分进行同时测定有待更深入的研究。
[1] 张甦琳,李云程,王彦君,等.金嗓散结胶囊治疗声带息肉及声带小结的临床疗效分析[J].临床耳鼻咽喉头颈外科杂志,2012,26(15):690-691.
[2] 贤清惠.重用玄参治疗声带息肉1例[J].医学理论与实践,2012,25(4):414.
[3] 中华人民共和国卫生部药典委员会.卫生部颁药品标准(中药成方制剂第十二册)[M].北京:人民卫生出版社,1997:96.
[4] 国家药典委员会.中华人民共和国药典(一部)[S].2015年版.北京:中国医药科技出版社,2015:117,227-229.
[5] 叶晶晶.HPLC法测定不同产地桃仁中苦杏仁苷的含量[J].中华中医药学刊,2011,29(1):206-207.
[6] 程晓莉.HPLC测定中药材玄参中有效成分的含量分析[J].实用中医内科杂志,2012,26(11):6-7.
[7] 白云娥,袁鹏飞,王庆辉,等.HPLC-UV波长转换法测定玄参药材及饮片中哈巴苷与哈巴俄苷的含量[J].中国中药杂志,2011,36(19):2697-2702.
[8] 刘利利,刘颖新,毛群芳,等.HPLC法同时测定苍术-玄参药对中4种活性成分的含量[J].药物分析杂志,2016,36(1):81-85.
[9] 赵万里,张方方,黄小强,等.一测多评法测定泽泻中4种三萜类成分的含量[J].中国药学杂志,2015,50(15):1347-1352.
[10] 赵万里,黄小强,许文,等.RP-HPLC-DAD同时测定泽泻中11个三萜类成分[J].中草药,2016,47(16):2933-2937.
[11] 周小雅,赖飞娥,刘雪梅.高效液相色谱-紫外双波长法同时测定玄参配方颗粒中3种主要成分的含量[J].中国中医药信息杂志,2014,21(5):78-80.
Simultaneous determination of six main constituents in Jinsangsanjie capsules by HPLC gradient elution
TAN Xiong-si, PANG Wu-yao(Zhaoqing Medical College, Zhaoqing 526020, China)
Objective:To establish the quantitative method to determine six main constituents simultaneously in Jinsangsanjie capsules by HPLC gradient elution.Methods:The separation was performed on Venusil MP C18chromatographic column by HPLC gradient elution. The mobile phase consisted of acetonitrile (A) and 0.03% phosphoric acid solution (B).Gradient elution was as follows: 0 – 9 min 15.0%A, 9 – 16 min 15.0%→21.0%A, 16 – 22 min 21.0%→36.0%A, 22 – 30 min 36.0%→55.0%A, 30 – 37 min 55.0%→75.0%A, 37 – 45 min 75.0%→15.0%A. The flow rate was 0.8 mL·min-1. The column temperature was set at 30 ℃ . The sample quantity was 10 µL. The detection wavelength were set at 210 nm (amygdalin, harpagide),280 nm (angoroside C, harpagoside) and 208 nm (24-acetate alisol A, 23-acetate alisol B).Results:Amygdalin, harpagide,angoroside C, harpagoside, 24-acetate alisol A and 23-acetate alisol B had a good linear relationship in a certain linear range (r ≥ 0.9992)respectively. The average recovery was 96.77% – 100.05% and the corresponding RSD was 0.60% – 1.55%. The precision and the repeatability were good. Test solution was stable at room temperature within 12 h.Conclusion:The method was reliable, simple. It could be used for the simultaneous determination of 6 main components in Jinsangsanjie capsules.
R917
A
1672 – 8157(2017)05 – 0263 – 04
2016年肇庆市科技创新指导类项目(201624030406)
谭雄斯,男,药师,副教授,主要从事药物分析、质量标准研究及药学教育工作。E-mail:tanxiongsizhaoqing@163.com
2017-01-08
2017-03-06)

