保元汤心肌保护作用靶点群的鉴定与功能分析
万彦军+廖理曦+刘瑜琦+姜勇+刘莲英+曾克武+屠鹏飞

[摘要] 保元汤作为治疗元气虚弱的著名方剂,临床上广泛用于冠心病治疗,但由于成分复杂,因此其作用靶点及药理机制尚不明确。该研究构建了一种表面键合有光敏化学基团二苯甲酮的固相微球,利用紫外光激发下二苯甲酮基团与中药化学成分中的碳氢键发生化学偶联反应,将中药保元汤的化学成分组整体键合到微球的表面,并与小鼠心脏组织裂解液共孵育,进而富集保元汤对应的心肌保护靶点群。针对靶点群进行蛋白质组学分析,共发现46个潜在结合靶点蛋白,且大多数定位于线粒体。KEGG分析发现这些靶点蛋白主要与三羧酸循环和氨基酸代谢信号通路关系密切,提示保元汤可能主要通过调控线粒体功能及ATP能量产生进而发挥心肌保护作用。此外JC-1荧光染色实验也证实,保元汤对线粒体损伤具有明显的保护作用。综上所述,该研究通过 “钩钓”直接作用靶点蛋白从源头上解释了保元汤发挥心肌保护作用的潜在药理机制,进而从分子细胞水平上诠释了保元汤的传统功效。此外,该研究也提供了一种用于研究中药复杂方剂多靶点作用机制的新方法,有助于进一步推动传统中药药理机制的现代科学解析。
[关键词] 中药复方; 保元汤; 心肌保护; 靶点; 作用机制
[Abstract] Baoyuan decoction (BYD) is a well-known traditional Chinese medicine formula for coronary heart disease with Qi deficiency. However, the detailed pharmacological mechanism of BYD is still unknown because of its complicated chemical compositions. In this study, we synthesized a kind of solid beads with benzophenone groups on its surface. Benzophenone can be activated and chemically cross-linked with the C-H bonds of the chemical compositions in BYD (BYD beads) under UV activation. We thus captured all the target proteins from mouse heart tissue lysates by using BYD beads. Based on proteomics analysis, we discovered totally 46 potential binding target proteins, most of which were located in mitochondria. KEGG analysis revealed that these target proteins were mainly associated with TCA cycle and amino acid metabolism signaling pathways, suggesting that the cardioprotection of BYD might be associated with regulating mitochondrial function and energy production. Moreover, JC-1 staining analysis also confirmed the protective effect of BYD on mitochondrial damage. In summary, our findings elucidated the potential mechanism of BYD on cardioprotection through "target fishing" strategy, and further explained its traditional efficacy in the molecular level. In addition, we also provide an approach for investigating the target group of complicated compositions in Chinese herbal formula. This novel method may provide a methodological reference for exploring the pharmacological mechanism of traditional Chinese formula in the future.
[Key words] traditional Chinese formula; Baoyuan decoction; myocardial protection; target; mechanism
中藥复杂方剂在中医药理论指导下,临床疗效确切,但是,由于药效物质基础不明和作用靶点不清,方剂配伍规律的诠释仍停留在经验水平。因此,探究中药复杂体系的作用靶点群,建立一套“基于靶点发现技术”药物机制研究体系,揭示药物作用机制及发现新靶点,对中医药现代化研究具有重要意义[1-2]。
保元汤(Baoyuan decoction,BYD)最早见于明代魏直的《博爱心鉴》[3],是治疗元气虚弱的著名方剂,主要包含黄芪、人参、甘草(炙)、肉桂4味药材,临床上广泛用于冠心病治疗[4],经过历代医家数百年的运用验证,保元汤临床疗效确切。由于中药复方是一个复杂体系,因此研究保元汤心肌保护的药理机制就要从多成分、多靶点协同作用的角度进行。本研究利用光化学偶联反应将保元汤的化学成分整体键合到表面修饰有光敏基团二苯甲酮的固相微球上,进而与心脏组织裂解液混合孵育,富集相应的结合蛋白并用高分辨质谱进行鉴定。接着针对每个结合蛋白的功能进行生物信息学分析,阐释保元汤心肌保护作用的分子机制。因此本研究不仅从分子水平上阐释了保元汤多成分、多靶点的药理作用机制,同时对其他中药或复杂方剂体系的作用机制研究也具有重要的借鉴意义。endprint
1 材料
1.1 藥物
保元汤由黄芪、人参、甘草(炙)、肉桂4味药材组成,药材均购于河北省安国药材市场,经北京大学药学院天然药物学系屠鹏飞教授鉴定,黄芪为豆科植物蒙古黄芪Astragalus membranaceus的干燥根的饮片,人参为五加科植物人参Panax ginseng的干燥根和根茎,甘草为豆科植物甘草Glycyrrhiza uralensis的干燥根和根茎经蜜制后的饮片,肉桂为樟科植物肉桂Cinnamomum cassia的干燥茎皮。各味药材按6∶2∶2∶1混合后,加水浸泡过夜,常压回流提取2 h。分离水提液和药渣,药渣再加水,常压回流提取2 h,提取2次。最后合并3次滤液,提取液混合后低温冷冻干燥成粉末[5],备用。
1.2 动物
1~2 d龄SD乳鼠,SPF级;6~7周龄ICR小鼠(雄),20~25 g,SPF级,生产许可证号SCXK(京)2016-0010,均由北京大学医学部实验动物中心提供。
1.3 试剂
H9c2心肌细胞系购自于中国医学科学院基础医学研究所细胞中心;DMEM培养基购自Macgene公司;胎牛血清购自PAN Biotech公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),4′,6-二脒基-2-苯基吲哚(DAPI)均购自Sigma公司;JC-1试剂盒购自上海碧云天公司,α-actin抗体和荧光二抗均购自北京中杉金桥生物技术有限公司。
1.4 仪器
FDU-1100冷冻干燥机(Eyela,日本);ND-1000微量紫外分光光度计(NanoDrop公司,美国);Sunrise-Basic酶标仪(TECAN公司,瑞士);5424R离心机(Eppendorf,德国);CIX100显微镜(OLYMPUS,日本)。
2 方法
2.1 BYD药效作用研究
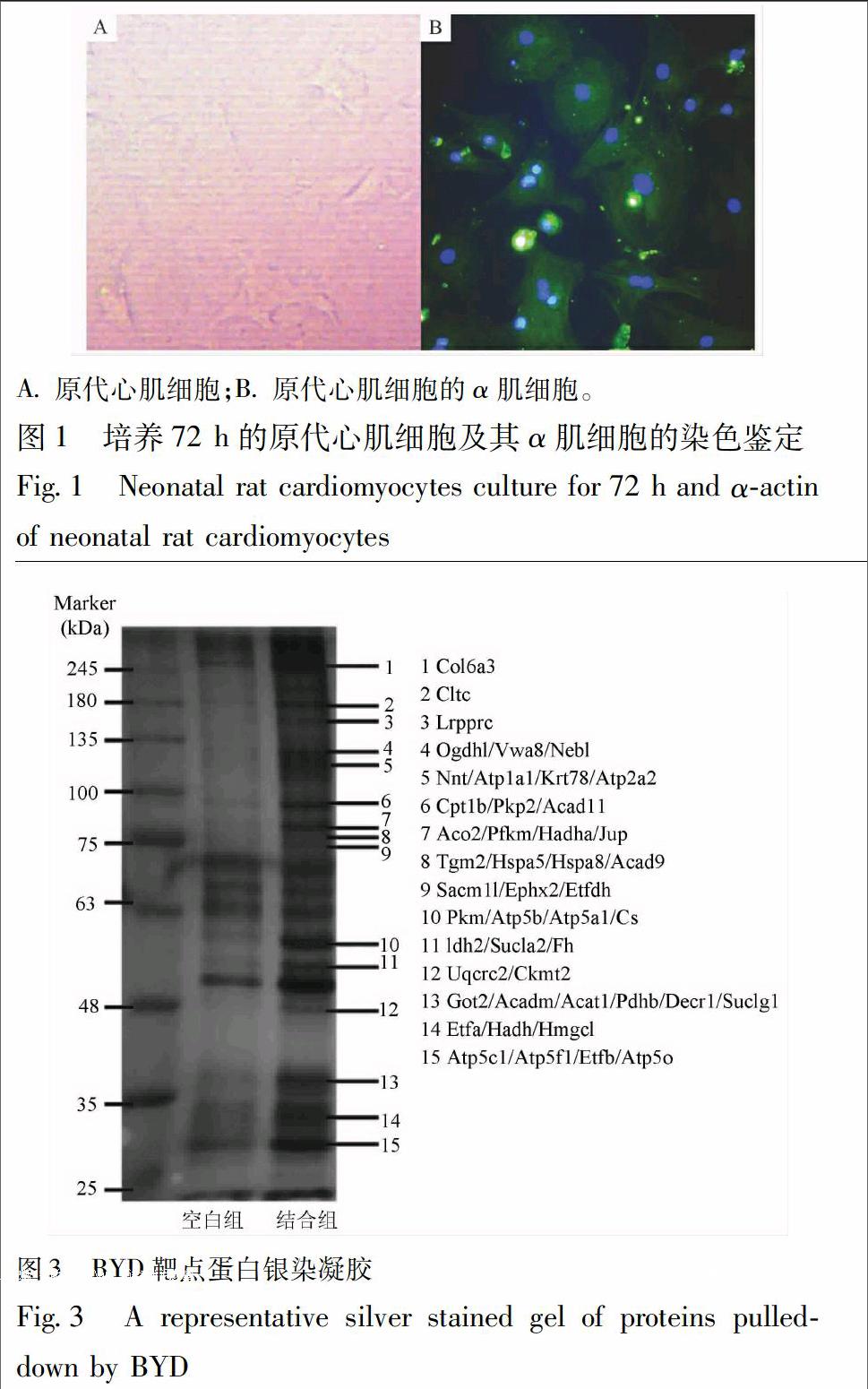
2.1.1 原代心肌细胞培养 1~2 d龄SD新生乳鼠用75%的乙醇消毒,在胸骨剑突下稍左侧打开胸腔,左手轻轻用力,使心脏跃出,取心脏,置于预冷10 mL的DMEM中,在预冷的DMEM中漂洗2次,用眼科弯镊将心脏撕裂成3份,放入预冷的0.25%胰酶中4 ℃过夜(12~15 h)[6]。取出心脏组织,预冷D-Hanks液漂洗2次,加入消化酶溶液(0.1%胶原酶Ⅰ和0.01% DNA酶)37 ℃振摇消化5 min,将消化液过200目细胞筛,并加入血清终止消化,然后2 000 r·min-1离心10 min,去除上清,在沉淀中加入5 mL正常DMEM培养基(含10%胎牛血清,100 U·L-1青霉素和链霉素)轻轻吹打以重悬细胞,接种于6孔板(成纤维细胞首先贴壁),30 min后取出细胞悬液再次接种,贴壁后即为心肌细胞。
2.1.2 心肌细胞形态学观察 心肌细胞接种于6孔板中培养,贴壁后,倒置显微镜下观察心肌细胞形态并拍照。
2.1.3 心肌细胞纯度鉴定(α肌细胞纯度鉴定) 心肌细胞接种于6孔板中培养,贴壁后吸取培养基,PBS液轻柔漂洗,4%多聚甲醛室温固定30 min,PBS液漂洗5 min,弃PBS液,加入0.5% Triton X-100室温轻微振摇10 min,PBS液漂洗5 min,弃PBS液,0.1%血清封闭,室温轻微振摇30 min,加入α-actin抗体工作液,4 ℃过夜,PBS液漂洗5 min,弃PBS液,滴加二抗(mouse anti-goat,1∶200稀释),37 ℃避光孵育1.5 h,PBS液避光漂洗5 min,加入DAPI(1∶100稀释),37 ℃避光孵育20 min,PBS液避光漂洗5 min。荧光显微镜下观察,激发波长分别为527,358 nm,拍照,免疫荧光染色阳性者为心肌细胞,蓝色表示细胞核,绿色表示心肌细胞。同一视野下普通光下观察、拍照、统计细胞总数,并计算心肌细胞纯度。
2.1.4 氧糖剥夺/复氧糖(OGD/R)模型的建立 H9c2细胞或原代心肌细胞接种后培养24 h,弃上清,更换为无糖、无血清培养基并置于95%氮气、5% CO2中培养8 h,然后更换为正常DMEM培养基并在95%空气、5%CO2中复氧糖培养24 h,即为OGD/R模型。
2.1.5 MTT法测定细胞活力 H9c2细胞或心肌细胞接种于96孔板,24 h后,更换为无糖、无血清培养基或含有不同浓度BYD(50,100,200,400,800 mg·L-1)无糖、无血清培养基养于缺氧小室中8 h,然后更换为正常DMEM培养基或含有不同浓度BYD(50,100,200,400,800 mg·L-1)正常DMEM培养基,并在95%空气、5%CO2中培养24 h,于570 nm处测定各组吸光度。
2.2 BYD作用靶点研究
2.2.1 心脏蛋白提取 ICR小鼠腹腔注射1%戊巴比妥钠麻醉,打开胸腔,从左心室注入生理盐水,减去右心耳,直至流水无血色(约50 mL)。按照每100 mg的组织加入1 mL的裂解液的比例加入裂解液(含cocktail蛋白酶抑制剂)。用匀浆机将组织充分裂解,匀浆的整个过程需要在冰上完成。充分裂解后在4 ℃离心10 min,离心力为12 000 r·min-1,取上清液,BCA方法测定蛋白含量并于-80 ℃条件保存。
2.2.2 光敏微球的制备 将分散聚合所得交联聚苯乙烯(PSt)微球[7](650 nm,0.1 g)加入一含甲醇(30 mL)的50 mL单口烧瓶中,超声分散、搅拌(100 r·min-1);加入乙氧基化三羟甲基丙烷三丙烯酸酯(E-TMPTA,0.31 g)、三羟甲基丙烷三(3-巯基丙酸酯)(TMPTA,0.086 g)和三乙胺(TEA,0.1 mL)于室温反应2 h;然后加入含巯基聚氧乙烯(HS-PEG1k-SH,0.05 g,按文献制备[8])和4,4-双丙烯酰氧基二苯甲酮(ABPA,0.03 g,按文献方法制备[9])继续反应2 h;所得粒子(PSt-BP)经离心分离、甲醇洗涤至少3次并分散于少量甲醇中备用。endprint
2.2.3 中藥化学成分的固相微球包被 将表面含二苯甲酮结构单元的聚合物微球PSt-BP(0.01 g),保元汤提取物(0.01 g)及20 mL去离子水加入一带磨口、平面石英盖的直管光照反应瓶中,通入N2 30 min后,置于UV光下(375 W汞灯,光强12.5 W·m-2,λ=254 nm)反应1 h,所得产物经离心分离,并用去离子水洗涤至少3次。
2.2.4 靶点群的富集与鉴定 将表面包被有保元汤化学组分的微球及表面未被保元汤化学组分包被的微球分别与小鼠心脏组织裂解液充分混合,于4 ℃下孵育12 h,使保元汤与靶点蛋白充分结合。然后用0.1%SDS洗脱液反复清洗微球6遍,并加入适量的loading buffer(6×),98 ℃,煮沸8 min。然后8 000 r·min-1离心5 min,取上清液并进行SDS-PAGE凝胶电泳,银染并对2组有差异蛋白条带进行酶解和高分辨质谱鉴定,检索每个靶点蛋白的属性及名称。
2.2.5 作用靶点群的KEGG通路分析 Cytoscape是一个网络可视化和分析的开放性免费软件,它根据基本的数据结合成可视化网络,进行网络参数分析和生物功能注释[10]。将每个靶点蛋白名称导入Cytoscape软件,使用插件GlueGo进行KEGG Pathway分析,以P<0.01为显著性阈值,得到蛋白集合相对于背景具有统计学意义的信号转导及疾病通路。
2.3 BYD作用靶点的功能验证(JC-1染色)
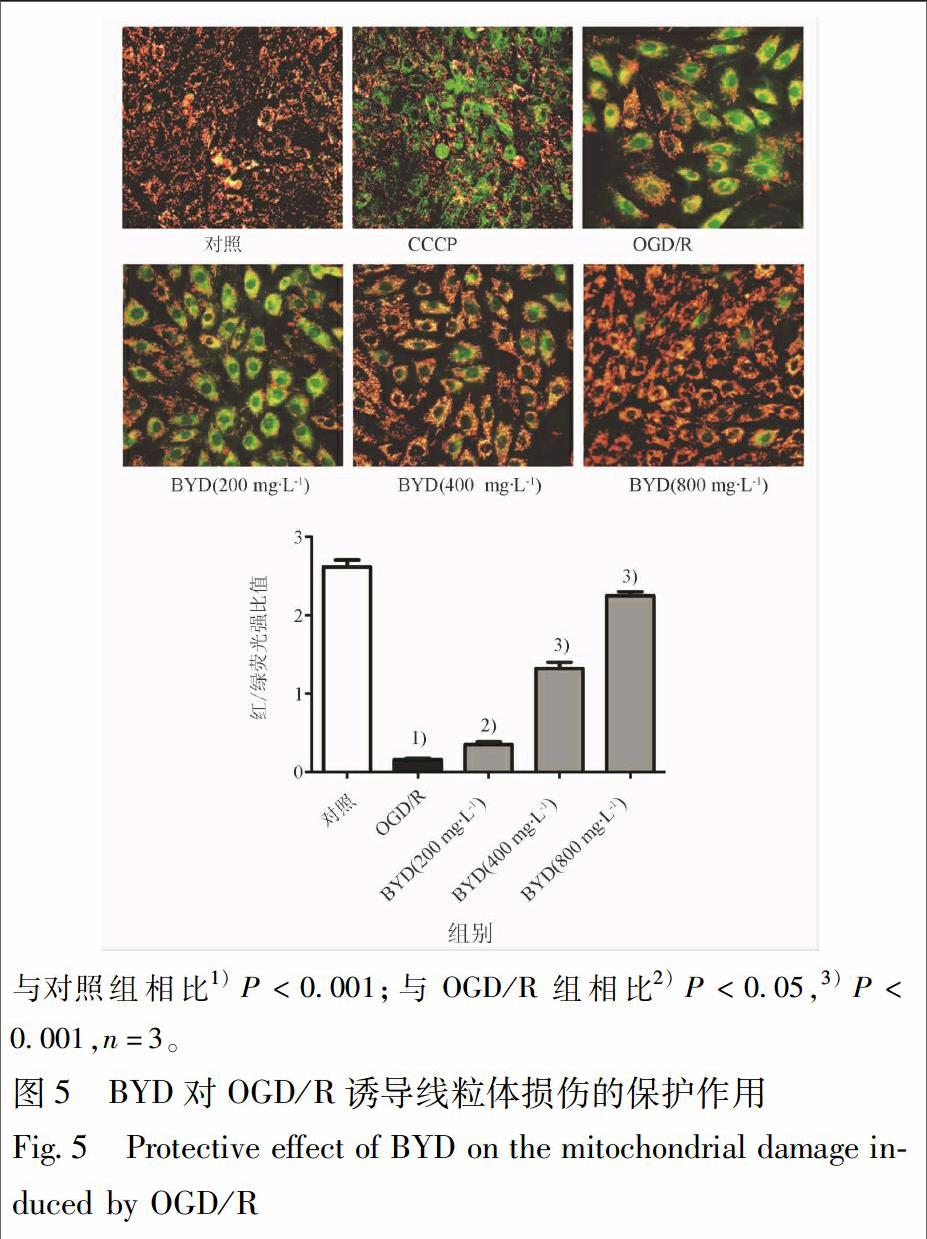
H9c2细胞接种于6孔板后,检测不同浓度BYD(200,400,800 mg·L-1)处理对OGD/R诱导的心肌细胞线粒体去极化水平的调控能力,利用JC-1染色进行鉴定。同时,CCCP属于线粒体电子传递链抑制剂,作为阳性对照。CCCP(10 mmol·L-1)按照1∶1 000的比例加入到细胞培养液中,稀释至10 μmol·L-1,处理细胞20 min,线粒体的膜电位会完全丧失。当膜电位水平较高时,JC-1主要以聚合体形式存在,激发波长为590 nm,呈红色荧光,当膜电位水平较低时,主要以单体形式存在,激发波长为527 nm,呈绿色荧光。通过荧光显微镜观察,并拍照。利用Image Pro Plus图像分析软件测定细胞内的红色和绿色荧光强度,评估线粒体的膜电位水平。
2.4 统计方法
数据均用SPSS 20.0统计分析软件进行处理,各组数据以±s表示,各组数据比较采用t检验,以P<0.05,P<0.01或P<0.001表示差异具有统计学意义。
3 结果与分析
3.1 原代心肌细胞形态学观察
原代心肌细胞在24 h左右开始长出伪足;48 h左右,伪足在镜下成纤维条索状,细胞胞体呈不规则形状,如梭形、菱形,见图1。72 h左右出现自发性搏动,78~90次/min。
3.2 原代心肌细胞纯度鉴定
原代心肌细胞的α肌细胞纯度染色呈阳性,可见明显的心肌特异性横纹肌结构,细胞核周围可见绿色颗粒,见图1。心肌细胞阳性率大于95%。
3.3 保元汤对OGD/R损伤的H9c2细胞及原代心肌细胞的保护作用
H9c2细胞及原代心肌细胞经过OGD/R处理后,显示细胞存活率极显著下降(P<0.001),说明造模成功。与模型组相比,BYD(50,100,200,400,800 mg·L-1)均显著改善OGD/R所诱导的H9c2细胞及原代心肌细胞的损伤,且随着BYD浓度增加,细胞活力增加,显示剂量依赖性,见图2。
3.4 保元汤心肌保护作用靶点群的富集与鉴定
对富集得到的靶点蛋白进行凝胶电泳后,银染,共发现15条主要蛋白条带。对每个蛋白条带分别酶解后,进行LC-MS/MS高分辨质谱鉴定,共计发现46个潜在结合靶点蛋白,见图3。因此推测,保元汤的作用靶点群可能主要包括这46个靶点蛋白。
3.5 保元汤作用靶点群的分类与功能解析
根据鉴定得到的靶点群,按照不同蛋白功能进行了分类,主要可分为如下8类功能靶点蛋白:①线粒体类核体(mitochondrial nucleoid):主要包括Atp5b,Hadha,Lrpprc;②碳氧裂解酶活性(carbon-oxygen lyase activity):主要包括Aco2,Fh1;③酰基辅酶A代谢过程(acyl-CoA metabolic process):主要包括Acat1,Hmgcl,Pdhb,Sucla2;④三羧酸循环(tricarboxylic acid cycle):主要包括Acadm,Cs,Etfdh,Got2,Idh2,Ogdhl,Pfkm,Suclg1;⑤心肌收缩功能调控(regulation of cardiac muscle cell contraction):主要包括Atp1a1,Atp2a2,Jup,Pkp2,Col6a3;⑥脂肪酸β脂氧化(fatty acid beta-oxidation):主要包括Acad11,Acad9,Cpt1b,Decr1,Ephx2,Etfa,Etfb,Hadh,Hmgcl,Idh2;⑦髓鞘(myelin sheath):主要包括Atp5a1,Atp5c1,Atp5f1,Atp5o,Cltc,Hspa5,Hspa8,Nnt,Pkm,Uqcrc2;⑧其他:Krt78,Nebl,Sacm1l,Tgm2,Vwa8,Ckmt2。
3.6 保元汤心肌保护作用的机制诠释
通过生物信息学分析对鉴定得到的46个靶点蛋白进行了研究。KEGG分析发现,这些靶点主要与6条信号通路相关,包括:①三羧酸循环(TCA cycle);②致心律失常右室心肌病相关(ARVC);③糖酵解,糖异生途径;④丙酮酸代谢、氧化磷酸化途径;⑤神经退行性疾病相关;⑥氨基酸代谢途径,见图4。其中,保元汤与三羧酸循环信号通路的相关性最为密切(P=5.5×10-13)。三羧酸循环是一组酶学反应,在线粒体基质中进行,催化底物转变,并在此过程中产生能量。在三羧酸循环信号通路中主要包含 Aco2,Cs,Fh1,Idh2,Ogdhl,Pdhb,Sucla2和Suclg1等靶点。其次是氨基酸代谢途径(P=5.6×10-8),包括脂肪酸降解,缬氨酸、亮氨酸和异亮氨酸降解,赖氨酸降解,色氨酸代谢,丙酸代谢,丁酸甲酯代谢,这6条信号通路与调节线粒体功能及产生能量密切相关。因此,推测保元汤中活性成分可能通过保护线粒体功能,调控线粒体内有氧呼吸,保证能量正常释放,进而保护心肌功能。三羧酸循环代谢通路障碍在线粒体功能缺失中起着重要作用。线粒体功能受损,不能给心脏跳动提供足够的ATP以供能。因此,保护线粒体功能在保元汤调控心肌功能中发挥了重要角色。endprint
3.7 保元汤对H9c2细胞线粒体膜电位的影响
正常对照组细胞红色荧光强,而绿色荧光较弱,CCCP组绿色荧光较强,说明染色方法合适。OGD/R模型组红色荧光弱,绿色荧光强,红/绿荧光强度比值下降。与模型组相比,随着保元汤浓度的增加,红色荧光增强,绿色荧光减弱,红/绿荧光强度比值升高,见图5。OGD/R模型组,保元汤200,400,800 mg·L-1组细胞红/绿荧光强度比值分别为(0.16±0.03),(0.35±0.06),(1.32±0.14),(2.25±0.09),与正常对照组(2.62±0.15)相比OGD/R模型组比值显著降低;与OGD/R模型组相比保元汤400,800 mg·L-1组比值均显著升高(P<0.001,n=3)。表明保元汤可改善OGD/R诱导的H9c2细胞线粒体膜电位的下降。
4 讨论
中药复杂方剂具有多成分、多靶点的特性,决定了中药发挥作用的复杂性。长期以来,中药复杂方剂中哪些成分起作用以及各种成分与治疗作用之间有何联系等问题,还不是很清楚。因此,明确其作用靶点,阐明药物作用机制,对中药研究至关重要。本研究根据中药成分富含碳氢键的特性,利用表面光敏偶联反应将中药成分键合到固相微球上,进行靶点研究。
通过分析保元汤所结合的靶点蛋白的生物学功能,笔者发现了8类结合蛋白,包括:线粒体类核、碳氧裂解酶活性、酰基辅酶A代谢过程、三羧酸循环、心肌收缩功能调控、脂肪酸β谢氧化、脂肪酸β化氧化与髓鞘以及其他功能等。线粒体类核体即线粒体DNA,是线粒体基因组的功能单位,保证mtDNA免受各种损害且不影响其复制和转录的基本功能,其结构与细胞核内将DNA组装成染色体的结构完全不同。类核的部分结构非常接近微管,与线粒体内膜相连,沿线粒体网状结构成行排列,对线粒体功能具有很重要作用[11];心肌收缩功能调控靶点可能主要参与心脏收缩舒张功能,对心脏组织发挥正常生理功能有重要作用[12];碳氧裂解酶活性、酰基辅酶A代谢过程、三羧酸循环可能与调控线粒体内能量代谢相关,并可增强心肌细胞线粒体内的ATP合成,以提高线粒体功能,进而为心肌细胞提供更多的能量[13];髓鞘是包裹在神经细胞轴突外面的一层膜,即髓鞘由施旺细胞和髓鞘细胞膜组成,起绝缘作用,防止神经电冲动从神经元轴突传递至另一神经元轴突[14]。总之,保元汤的作用靶点群主要与线粒体功能、ATP能量产生、心肌收缩及神经传导相关。
此外,通过KEGG通路富集分析发现保元汤可能主要是通过作用于两大类信号级联发挥心肌保护作用的,即三羧酸循环和氨基酸代谢通路。这2个通路均与线粒体功能相关,因此推测保元汤的核心调控机制可能是保护线粒体功能,保证产生足够的能量发挥心肌保护作用[12]。通过线粒体膜电位实验证实保元汤确实具有保护线粒体损伤作用。因此,本研究提出了一种研究中药复杂方剂的可靠方法,为今后中药复杂方剂靶点研究提供了新的思路。
[参考文献]
[1] 朴胜华,罗朵生. 中药物质基础研究方法评述[J]. 中国药房,2012,23(23):2194.
[2] 肖斌,王耘. 中药功能靶点的研究[J]. 中西医结合学报,2010,8(12):1190.
[3] 禹志领,严永清,付剑江,等. 保元汤研究概况[J]. 时珍国医国药,1999,10(5):379.
[4] 陈铁汉,郭恕,朱伟光,等. 保元汤治疗冠心病22例临床和实验观察[J]. 湖南中医杂志,1995(6):20.
[5] 舒泽柳,曾克武,马晓丽,等. 保元汤中具有心肌保护作用的活性成分及其潜在作用靶点研究[J]. 中国中药杂志,2016,41(5):922.
[6] 吴启端,袁德俊,王绮雯,等. 石菖蒲挥发油对心肌细胞形态学及细胞活力的影响[J]. 中药材,2009,32(2):242.
[7] 曹乐,刘莲英,杨万泰. 光敏性单分散核-壳树莓状PSt/PAM微球制备[J]. 高分子学报,2012(2):117.
[8] Lundberg P,Walter M, Montanez M I, et al. Linear dendritic polymeric amphiphiles with intrinsic biocompatibility: synthesis and characterization to fabrication of micelles and honeycomb membranes[J]. Polym Chem,2011, 2: 394.
[9] Wang S L, Yue K, Liu L Y, et al. Photoreactive, core-shell cross-linked/hollow microspheres prepared by delayed addition of cross-linker in dispersion polymerization for antifouling and immobilization of protein[J]. J Colloid Interface Sci, 2013, 389:126.
[10] 唐羽,李敏.基于Cytoscape的蛋白质网络可视化聚类分析插件[J]. 生物信息学,2014,12(1):38.
[11] Kukat C, Larsson N G. mtDNA makes a U-turn for the mitochondrial nucleoid[J]. Trends Cell Biol, 2013, 23(9):457.
[12] Guth R, Pinch M, Unguez G A. Mechanisms of muscle gene regulation in the electric organ of Sternopygus macrurus[J]. J Exp Biol, 2013, 216(Pt 13):2469.
[13] Bechler M E, Byrne L, Ffrench-Constant C. CNS myelin sheath lengths are an intrinsic property of oligodendrocytes[J]. Curr Biol, 2015,25(18):2411.
[14] Koubaa M, Cocuron J C, Thomasset B, et al. Highlighting the tricarboxylic acid cycle: liquid and gas chromatography-mass spectrometry analyses of (13)C-labeled organic acids[J]. Anal Biochem, 2013, 436(2):151.
[責任编辑 张宁宁]endprint

