近红外光热转换纳米晶研究进展
李欣远,纪穆为,王虹智,涂国鹏,万晓冬,刘佳佳,刘 佳,徐 萌,张加涛
(北京理工大学 材料学院 结构可控先进功能材料与绿色应用北京市重点实验室,北京 100081)
近红外光热转换纳米晶研究进展
李欣远,纪穆为,王虹智,涂国鹏,万晓冬,刘佳佳,刘 佳,徐 萌*,张加涛*
(北京理工大学 材料学院 结构可控先进功能材料与绿色应用北京市重点实验室,北京 100081)
近红外光热转换纳米晶材料因其在近红外区(普遍位于780~1 400 nm)的高效光热转换性能,已广泛应用于光热杀死癌细胞、肿瘤治疗、海水淡化等领域。因其多样的液相制备方法和形貌控制、纳米结构复合、逐渐提高的光热转换效率以及表面易于药物修饰等优点,该材料在光热成像诊断、光热治疗等领域引起了学术界的广泛关注。本文综述了近红外光热转换纳米晶的研究进展,主要包括贵金属纳米晶、铜硫族半导体纳米晶、碳相关纳米晶以及这些纳米晶材料构成的复合结构,同时介绍了具有较高光热转换效率的表面等离子体共振(SPR)材料的研究进展,尤其是双模态SPR性质的耦合在光热转换领域的应用前景。基于其性能协同耦合的特性,双模态表面等离子体共振耦合的复合纳米晶将是近几年光热转换纳米晶发展的重要方向。
纳米晶;近红外光热转换;光热治疗;表面等离子体共振
1 引 言
近年来,光热材料用于生物医疗方向的研究是纳米学术界的重点课题,而光热治疗肿瘤细胞更是吸引了生物医学界的广泛兴趣。在疾病诊断及治疗等领域,具有光热转换性能的纳米材料在光热治疗[2-3]、光热成像诊断[6-12]、药物速递[7,13]、生物靶向治疗[8]等领域发挥着重要的作用。
针对应用于生物光热治疗的光热转换纳米材料,还需要具备以下特点:(1)其光谱吸收峰最好位于近红外光范围(Near Infrared Region,NIR),从而增加光的透皮传播深度、减少生物体本身对光的吸收。(2)具有良好的生物相容性及较低的细胞毒性。(3)易于进行表面修饰,使其易与其他靶向分子官能团结合以实现靶向治疗。(4)在生物体内环境中具有良好的分散性与亲和性[2-3]。
现阶段,被广泛研究的光热转换纳米材料主要包括贵金属纳米晶(Nanocrystals NCs)[2-3,10,14-27],铜基硫族半导体纳米晶(Cu2-xS(Se))[6,9,28-32],贵金属/Cu2-xS(Se)异质纳米晶[32-35]以及碳基纳米晶材料[37-48],其光热转换原理与光热转换材料结构密切相关。本文综述了近几年国内外主要的近红外光热转换纳米晶材料以及其光热治疗方面的研究进展,在讨论光热转换的机理、光热转换效率的计算基础上,论述近红外光热转换纳米晶的制备、结构复合,尤其是结构复合产生的双模态表面等离子体共振耦合效应新原理以及其在光热性能方面的提高。
2 光热转换
2.1光热转换的机理及光热转换效率的计算

图1 纳米粒子在光照情况下的示意图[3] Fig.1 Schematic diagram of nanoparticle when irradiated by a light beam[3]
光热转换主要是因为材料在吸收电磁辐射后产生晶格振动或电子振荡而引起材料温度升高,对于不同的光热转换材料,其光热转换的原理也不尽相同。比如贵金属纳米晶(如Pt NCs等)由于吸收外来辐射后,表面电子振荡增强[49-50],在没有形成光电效应的情况下主要以热能形式释放增加的能量从而形成光热转换;而具有LSPR的半导体纳米晶(如Cu2-xS NCs等)材料,主要是通过表面等离子体共振效应增强光吸收和光热转换;碳材料(如碳纳米管,石墨烯以及碳基复合材料)基于其特殊的结构在近红外光区有很强的吸收和光热转换效率[3]。由此可见,材料的光热转换性能主要与材料吸收外来辐射和产生声子的强弱有关,通常采用光热转化效率(η)进行表征。
通常情况下,将纳米晶分散于水或其它溶剂中形成溶胶后光照,监测溶胶温度随光照时间的变化。相应的光热转换效率使用Roper等建立的热传递模型进行计算[48]:
友好的欢迎和支持总是能让我们倍感温暖。在皮兰,当地政府批准我们驾驶那些跑车进入原本禁止游客车辆进入的中心广场,我们在那里瞬间成为了所有人关注的焦点。起初,我还自作多情地以为那里的游客是为我们这些“有钱人”而来,但过了一段时间我才意识到,他们真正感兴趣的只是那几辆跑车而已。在那里,我们听到最多的话就是:“不好意思,稍微靠边一点好吗,顺便帮我和这辆车拍张合影吧?”
式中,Tmax和Tsurr分别为溶胶最高温度和环境温度。I和A分别为激光光强能量密度和纳米晶在λ波长处的吸收值,h、S和Qdis分别为热传导系数,辐射面积和体系热量流失。
其中,hS可以通过以下公式进行计算:
式中,mi和Cp,i分别表示纳米溶胶的质量和热容。在实际计算中由于纳米晶的浓度很小,纳米溶胶一般近似于纯水处理。t表示光照之后,溶胶冷却至室温所需时间。
2.2近红外光热转换纳米晶材料
常见的光热转换纳米材料包括Au、Ag、Pt和Pd等贵金属纳米晶,Cu2-xS、Cu2-xTe等半导体纳米材料,以及碳基纳米材料等。
贵金属纳米晶由于其在Vis-NIR光区的吸收主要取决于其形貌与尺寸,且具有连续可调性,在光热转换治疗、药物释放等方面具有重要的意义。比如Lin课题组利用Au纳米颗粒在532 nm和565 nm激光的作用实现了对肿瘤细胞的有效杀伤,并发现其对目标淋巴细胞具有光热解作用[14]。Halas等人制备了在硅颗粒表面形成金纳米壳层,在近650到950 nm有很好的吸收[15]。El-Sayed等人成功合成了Au纳米棒(Nanorods,NRs),并通过调节Au纳米棒的长径比实现了其吸收光谱在可见光-近红外光区连续可调[10]。Xia等人制备的贵金属纳米笼,通过控制贵金属的置换反应程度,也实现了光谱吸收峰从500到900 nm的可调光吸收[16]。这些纳米晶的制备和形貌调控为贵金属纳米晶在光热材料的应用奠定了良好的基础。如El-Sayed等将具有红外吸收的Au纳米棒应用于光热疗杀死癌细胞实验中取得了良好的效果。
Cu2-xS等铜基硫族半导体(Cu2-xX,X=S,Se,Te)纳米晶等由于其组分非化学计量比导致的Cu空穴在光电场作用下的共振引起LSPR效应,在近红外光区具有较强的吸收和较高的光热转换效率,可作为光热疗试剂。Hu等人制备了纳米花状Cu2-xS纳米晶,实现了在980 nm的激发光下25.7%的光热转换效率[28]。Wang等人成功合成的Cu7S4纳米晶,在808 nm激光照射下,光热转换效率达到52.92%,在光热成像以及光学指纹侦测领域具有良好的应用价值[6]。
通过在Cu2-xS纳米晶与贵金属形成异质纳米结构是增强体系光吸收和光热转换效率的有效手段。Jiang等在惰性气体保护下制备合成了Au-Cu9S5二元等离子体异质纳米晶,实现了Au和Cu9S5的LSPR耦合增强效果[33]。
Au与Cu2-xS纳米晶具有两种不同模式的LSPR效应,其二元协同耦合效果的最大化,是提高其光热转换效率的有效途径。最近,Zhang课题组使用阳离子交换引发的全新非外延生长制备方法[61-62],成功合成了具有高结晶性且形貌与尺寸精确可控的Au@Cu2-xS核壳纳米晶[34]。通过研究其在光热转换和抑制宫颈癌细胞生长的应用发现,核壳结构有效地实现了Au和半导体壳层两种不同模式LSPR效应二元协同耦合作用的最大化,并有效提高了其光热转化效率和在光热疗中的应用潜力。通过此种方法制备具有晶面最大程度直接接触的金属@半导体核壳结构纳米晶,可以实现金属核和半导体壳层的功能最大程度耦合,实现不同模态的SPR性能的耦合及光热性能的提高。最近,Zhang等人实现了三元半导体纳米晶与贵金属Au耦合的核壳纳米晶,即Au@Ag3AuTe2核壳纳米晶的精准制备。通过Au与Ag3AuTe2在纳米尺度的最大程度耦合,实现了对可见光、近红外光的连续吸收及高效光热转换性能[52]。因为yolk-shell纳米复合结构还能提供微反应腔,Zhang课题组最近通过连续可控的阴离子交换和阳离子交换反应原理,普适性制备了一系列Au/半导体yolk-shell纳米晶结构,为后续的纳米光热疗及光热催化合成新应用奠定了坚实的材料基础[36]。
3 光热转换纳米晶材料的可控制备及性能开发研究进展
近年来,光热转换材料的概念吸引了科学界的广泛关注,其潜在应用非常广泛,例如针对肿瘤细胞的光热治疗等。光热转换材料,作为光热转换过程的重要部分,对于光热转换效率起到非常重要的作用。尽管关于光热转换材料的研究近年来一直是热点课题,目前阶段的光热转换材料仍面临着很多挑战,比如光热转换效率有待提高,无毒性,持久性有待进一步研究等等。本部分将对近几年的近红外光热转换纳米晶的可控制备、结构复合及性能耦合进行综述,并综述其在光热疗方面的应用前景,以及作为光热催化剂的前景展望。
3.1贵金属纳米晶
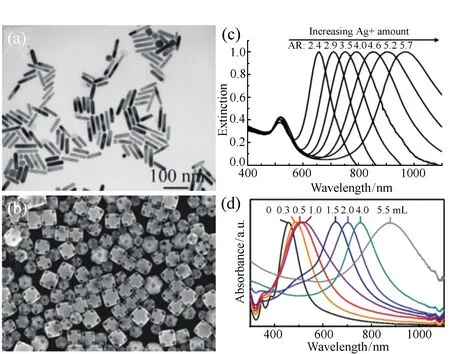
图2 不同形貌的金纳米晶及对应光谱吸收图。 (a,c)Au纳米棒(长径比为5.2)的低分辨透射电子显微镜图片,以及不同长径比的Au纳米棒的消光光谱图[10]; (b,d)Au纳米笼的扫描电子显微镜图,以及置换反应程度的吸收光谱图[16] Fig.2 LRTEM images of Au with various types of nanostructures and their plasmonic absorbance respectively. (a,c)LRTEM image of Au nanorods with aspect ratio 5.2 and the extinction of Au NRs with different aspect ratio[10]; (b,d)LRTEM image of Au nanocages and their plasmonic absorbance[16]
贵金属(如Au、Ag、Pt、Pd等)纳米晶,作为传统的光热转换材料吸引了全世界科研工作者的广泛兴趣,其中Au纳米晶的合成方法最成熟且光热应用研究最为广泛。本部分以Au纳米晶为例,介绍贵金属纳米晶的光热转换特点。Au纳米晶的光热特性主要来源于其局域表面等离子体共振效应,很多课题组已经证实Au纳米晶是一种通用的稳定的癌症诊断和光热疗材料。相比于其他材料,Au纳米晶具有以下优点:(1)通过调节其形貌、尺寸与结构,Au纳米晶在可见-近红外光区具有连续可调的吸收,尤其,Au纳米球的光谱吸收峰位于520 nm左右,而对于Au纳米棒,随着其长径比的增加,表面等离子体共振吸收逐渐红移,其吸收峰在600~1 300 nm内连续可调;(2)Au纳米晶的合成方法研究较为成熟,易于进行表面修饰,为后续的应用提供了前提条件;(3)Au纳米晶是一种化学惰性材料,具有较好的生物相容性,在生物体内疾病治疗方面具有很好的应用前景。
2003年,Lin课题组利用Au纳米颗粒在532 nm和565 nm激光的作用实现了对肿瘤细胞的有效杀伤,并发现其对目标淋巴细胞具有光热解作用[14]。此外,在实验中脉冲激光的成本较高,且由于脉冲时间较短使得热量散失较快,致使光热转换效率较低。然而,限制Au纳米颗粒光热应用的最主要因素在于其吸收峰主要集中于可见光范围(520 nm左右),而此波长下的可见光被生物体组织的吸收很严重,光的透过性较差,难以实现有效的体内肿瘤等疾病治疗。Kim等人通过调节反应环境的pH值,实现了Au纳米颗粒的可控聚集,使其表面等离子体共振吸收峰从524 nm到650 nm的红移[18]。2005年,West和Drezek等人制备了以硅纳米球为核,Au为壳层的异质纳米结构,并通过调节Au纳米壳层的厚度,实现了其在650 nm到950 nm近红外区的高效吸收和光谱可调,为光热治疗和光热成像提供了基础[15,19]。Au纳米棒,由于其特殊的结构特点,短轴和长轴具有两种表面等离子体共振模式,短轴模式的共振范围在520 nm左右(类似Au球),长轴模式的共振范围则与Au纳米棒的长径比有关,随长径比的增加而增大,因而具有从可见光区到近红外光区的连续可调光吸收效应(600 nm到1 300 nm),被认为具有更广泛的光热转换应用潜力[10]。目前,制备Au纳米棒的主要方法为种子生长法,这种方法目前十分成熟,具有产率高,步骤简单,以及形貌易于调控等特点。2001年,Jana等人首次通过种子生长法合成了Au纳米棒溶胶,将柠檬酸钠体系中合成的小尺寸Au颗粒放入具有CTAB,抗坏血酸,银离子和氯金酸的生长液中,从而制得了Au纳米棒溶胶[26]。2003年,El-Sayed等人对Jana等人的方法进行改进,通过引入CTAB包附的Au种子,生长液中加入BDAC并调节Ag离子的加入量,实现了产率的提高和长径比的可调,并于2006年,证实了Au纳米棒可用于体内分子成像以及光热治疗[20,27]。Van Maltzahn等人制备了聚乙二醇(PEG)包附Au纳米棒,实现了在功率为2 W/cm2的810 nm激光照射下,在5 min内将体系温度由室温提高到70 ℃,实现了Au纳米棒的体内光热治疗应用[21]。2010年,Wang等人同样利用种子生长法合成的Au纳米棒,探究入射激光波长、光热转换纳米晶浓度、以及表面壳层等因素对于光热转换效率的影响,并实现了Au纳米棒溶胶在810 nm的激光照射10 min后使体系温度从室温提高到75 ℃,且转换效率高达95%[22]。除Au纳米棒外,Xia等人通过贵金属间的置换反应,制备了Au纳米笼,根据置换反应的程度的不同实现了其光谱吸收峰从500 nm到900 nm的连续调节[16]。除上述材料外,Ray等人制备的Au纳米花(nanopopcorn)[23],Vo-Dinh 等人制备的Au纳米星(nanostars)[24],de la Fuente等人制备的Au纳米三棱柱(nanoprisms)结构[25],均在NIR光区具有良好的光热转换效果,为贵金属纳米颗粒在光热转换及光热治疗领域的应用提供了多元发展方向。
3.2Cu2-xX(X=S,Se,Te)半导体纳米晶

图3 (a)疏水性Cu7S4纳米颗粒的低分辨透射电子显微镜图; (b)亲水性的Cu7S4纳米晶的低分辨透射显微镜图; (c)亲水性Cu7S4纳米晶形成机理; (d)两种材料的在808 nm的激光照射下的光热转换图谱; (e)光热成像指纹检测示意图[6] Fig.3 (a)LRTEM image of hydrophobic Cu7S4 NPs. (b)LRTEM image of amphiphilic Cu7S4 NCs. (c)Fabrication strategy for Cu7S4 NCs. (d)PT activity of Cu7S4 NPs and NCs. (e)Schematic representation of photothermal imaging process[6]
贵金属纳米材料具有良好的光热转换效率,但昂贵的价格限制了其实际应用。相比之下,铜基硫族化合物,如CuS[9]、Cu2-xS[6,28,30]、Cu2-xTe[31]等因为非计量比引起的铜空位产生的在近红外区的SPR性能,都具有光热转换能力,并且具有价格优势,是理想的光热转换材料。多年来,制约铜的硫族化物应用于光热转换领域的重要因素在于其光热转换效率相对贵金属材料较低。2010年,Li课题组成功合成了不含螯合剂的平均粒径为11 nm的CuS纳米晶,实现了对930 nm近红外光的有效吸收,具有一定的体内肿瘤细胞光热治疗的应用前景[9]。2011年,Hu等人制备了平均粒径1 um的花状硫化铜纳米晶,在980 nm的NIR光区有良好的光热转换效果[29]。同年,Hu等人通过热分解和表面配体交换相结合的方法,成功合成了亲水性的Cu9S5纳米片,由于其中存在Cu+空位,使其具有LSPR效应[28]。该亲水性的Cu9S5纳米片,在40 ppm的浓度下,经功率为0.51 W/cm2的980 nm波长激光照射7 分钟,体系温度提高了15.1 ℃,该Cu9S5纳米片在980 nm波长近红外光下的光热转换效率为25.7%。2015年,Pellegrino等人通过液相法和配体交换法,成功合成了Cu2-xS纳米晶,该纳米晶的平均粒径为6.5 nm,如图3所示。并通过ESR光谱和DCF荧光免疫法证实,该Cu2-xS纳米晶在具有良好的光热治疗效果的同时,还具有光动力治疗效果[30]。通过在所合成的Cu2-xS纳米晶表面包覆PEG分子,使其具有良好的生物相容性在不影响其光热治疗效果的同时,更容易与病灶部位结合,从而为其的进一步应用提供了可能。Wang等人也成功合成了Cu7S4纳米晶(如图3所示),并证实了其具有良好的光热转换性能(808 nm,1.0 W/cm2激光照射下,光热转换效率达到52.92%),在光热成像以及光学指纹侦测领域具有良好的应用价值[6]。Kriegel等人以CdTe或CdSe为原料通过离子交换法制备了Cu2-xTe以及Cu2-xSe等纳米晶,通过控制其形貌实现了可见光范围到近红外区(Cu2-xTe纳米棒吸收峰位于1 103 nm)的吸收光谱可调[31]。然而,Cu2-xX(X=S,Se,Te)半导体纳米晶虽然成本相对贵金属材料较低,但其光热转换效率有待进一步提高,且实际应用中的光热稳定性仍有提高空间。
3.3双模态表面等离子体共振耦合的复合纳米晶
多组分材料的整合是目前纳米材料研究领域的重要课题,通过多组分的协同作用,纳米晶的物理化学性质有显著的提高[54-55]。核壳结构,作为二元协同材料,由于其良好的界面调控以及最大化的接触面积,实现了在光学[56]、光催化[57-58]、太阳能电池[56]以及生物技术领域[8,16,20,60]的广泛应用。贵金属纳米颗粒所具备的等离子体的共振效应已经被广泛应用于光热转换,生物医学和光电应用,然而一些非金属纳米材料通过掺杂引起的自由电子也能引发表面等离子效应。基于多组分协同的思想,将具有表面等离子体效应的非金属和贵金属材料的耦合,是目前纳米光热材料合成和发展中的重要方向之一,然而此类研究更是少之又少。表面等离子体共振耦合材料相比于贵金属纳米材料和半导体材料,其优势在于相比贵金属材料可以节约成本,而相比半导体材料可以显著提高其光热转换效率,且共振耦合材料产生的效果要高于两者的直接混合材料,从而有更广阔的应用前景。

图4 (a)Au-Cu9S5异质二聚体纳米晶材料; (b)Au-Cu9S5元素分部图; (c)Au颗粒,Cu9S5纳米颗粒,Au-Cu9S5异质结构的UV-Vis吸收示意图; (d)Au-Cu9S5异质结构和Au与Cu9S5混合机构的光热准换效率对比图[33] Fig.4 (a)Schematic representation of Au-Cu9S5 dual plasmonic hybrid NCs when irradiated by laser. (b)STEM image of Au-Cu9S5 NCs and their EDS element mapping images. (c)Molar extinction coefficient of Au-Cu9S5, Cu9S5 and Au colloidal respectively. (d)PT activity comparison of Au-Cu9S5 and physical mixture of Au and Cu9S5 at same concentration when irradiated by 808 nm, 0.7 W/cm2 laser[33]
2013年,Jiang等人利用有机体系合成的Au纳米颗粒并通过外延法在惰性气体保护下成功合成了Au-Cu9S5异质二聚体纳米晶材料,如图4所示[33]。同样的条件下,由于Au-Cu9S5纳米晶的LSPR协同耦合作用,相比于单独的Cu9S5纳米晶,等离子体效应提高50%(1 064 nm处的吸收峰值提高50%),且经计算,其光热转换效率提高了37%。同时,DDA的计算值表明Au和Cu9S5确实有局域场增强效果。另外,Au-Cu9S5用较好的光稳定性,以及较低的生物毒性,从而被认为是光热治疗肿瘤细胞的理想材料。
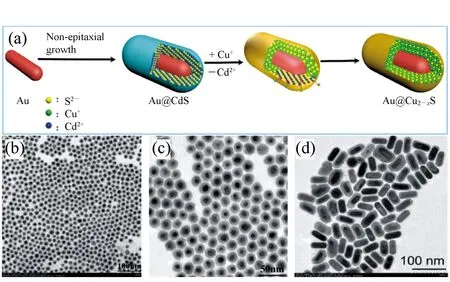
图5 (a)Au纳米颗粒到Au@Cu2-xS NCs合成示意图; (b,c)Au@Cu2-xS纳米晶的低分辨透射电子显微镜图; (d)Au@Cu2-xS纳米棒的低分辨投射电子显微镜图[34] Fig.5 (a)Schematic of the synthesis method of Au@Cu2-xS NCs from Au NPs. (b,c)LRTEM of Au@Cu2-xS NCs. (d)LRTEM image of Au@Cu2-xS NRs[34]

图6 (a)Au@Cu2-xS纳米棒高分辨透射电子显微镜图; (b~d)Au@Cu2-xS纳米颗粒高分辨透射电子显微镜图[34] Fig.6 (a)HRTEM images of Au@Cu2-xS NRs. (b-d)LRTEM images of Au@Cu2-xS NPs [34]
Cu2-xS纳米晶由于其材料组分的非化学计量比,导致材料内的Cu空穴在近红外光作用下发生共振,引起LSPR效应,同时,通过调节Cu2-xS中亚铜离子的化学计量比,可以调节其LSPR吸收峰的位置[6,28,30]。基于之前的研究成果,Zhang课题组利用阳离子交换诱发的非外延生长方法成功合成了单分散性良好(如图5(b)~5(d)),且具有高结晶性的Au@Cu2-xS核壳纳米晶(如图6),实现了在大晶格失配度下核壳纳米晶形貌、尺寸及异质界面的精确调控并首次实现了不同产生机理的LSPR效应在三维方向上最大程度的协同耦合[34]。在合成方法上,基于之前的研究工作[61-62],通过将非外延生长法合成的Au@CdS单晶核壳纳米晶颗粒与Cu(CH(CH(CH3CN)CN)CN)4PF6进行离子交换反应,成功得到形貌完整保持,壳层均匀完整,且结晶性良好的Au@Cu2-xS核壳纳米晶,其合成示意图及低分辨透射电镜图如图5所示。同时,在保证结晶性的前提下,实现了不同尺寸和壳层厚度的球状或棒状Au@Cu2-xS纳米晶的合成。其中通过调控Au@Cu2-xS纳米棒的长径比,利用实验与理论模拟相结合的方法,证实了其在不同NIR光区(750~900 nm的第一NIR窗口区及1 000~1 400 nm的第二NIR窗口区)均具有高效的LSPR协同耦合效应及较高的光热转换效率(图7(a)~7(c))。通过计算得出,Au@Cu2-xS核壳纳米晶溶胶在808 nm激光下的光热转换效率为59.01%,在1 064 nm下的光热转换效率为43.25%。在具有较高光热转换效率的同时,在808 nm和1 064 nm的激光照射下,使用Au@Cu2-xS纳米棒实现了对宫颈癌细胞的高效光热杀伤(图7(e))。实验证明,利用Au@Cu2-xS纳米棒在光照10 min后,宫颈癌细胞的存活率下降到仅为20%。Au@Cu2-xS纳米棒比单独的Au纳米棒或Cu2-xS纳米颗粒有更好的杀伤效果,从而证明了LSPR协同耦合效应在光热转换效应中所发挥的重要作用,并证明该材料在肿瘤光热治疗领域的应用潜力。
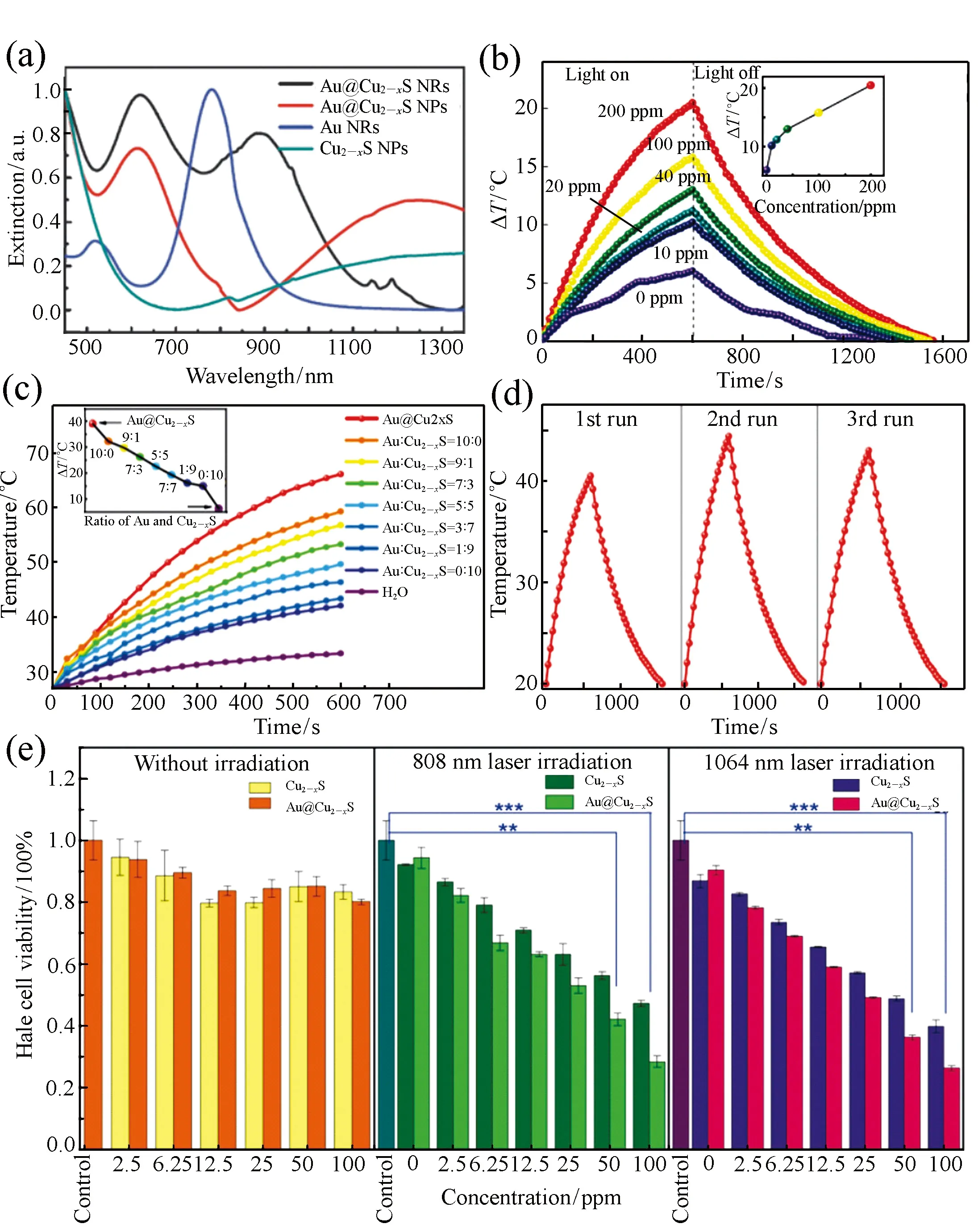
图7 (a)Au@Cu2-xS纳米棒,Au@Cu2-xS纳米颗粒,Au纳米棒以及Cu2-xS纳米颗粒溶胶的UV-Vis-NIR光谱图; (b)不同浓度的Au@Cu2-xS纳米棒胶体在0.7 W/cm2 1 064 nm 的激光照射下的光热转换曲线; (c)Au@Cu2-xS与不同配比的Au,Cu2-xS的混合胶体的光热转换曲线对比; (d)Au@Cu2-xS纳米棒胶体在0.7 W/cm2 1 064 nm激光照射下的光热转换循环测试; (e)Au@Cu2-xS纳米棒和Cu2-xS纳米晶在808nm和1 064nm激光照射下赫拉细胞存活率对比[34] Fig.7 (a)UV-Vis-NIR spectra of the as prepared Au@Cu2-xS nanorods, Au@Cu2-xS NPs, Au nanorods and Cu2-xS NPs colloidal respectively. (b)PT conversion curve of Au@Cu2-xS NRs by 0.7 W/cm2 1 064 nm laser. (c)PT activity of Au NRs, Cu2-xS nanoparticles and their physical mixtures for various ratios compared with Au@Cu2-xS nanorods. (d)PT cycling test of Au@Cu2-xS nanorods irradiated by 0.7 W/cm2 1 064 nm laser. (e)Hela cell viability of Au@Cu2-xS NRs under irradiation of 808 nm and 1 064 nm laser irradiation compared to Cu2-xS NPs[34]
Au纳米颗粒或LSPR二元协同耦合效应纳米颗粒在光热应用方面具有良好的前景,然而这类材料的NIR光区吸收范围普遍较窄,因此如何拓宽该类材料的吸收范围是提高其光热转换率拓宽应用范围的重要方面。基于之前对于纳米材料合成和光热转换领域的研究,以及多元化纳米晶的特殊性能优势[63],Zhang等人实现了三元半导体纳米晶与贵金属Au耦合,且在NIR区具有连续吸收能力的Au@Ag3AuX2(X=Te,Se)核壳纳米晶,在合成上实现了纳米晶壳层从二元到三元的拓展,性能上为拓宽该类材料在NIR区的吸收提供了一种有效的方法[52]。合成方法上通过将Au@Ag核壳立方块纳米晶与Te的水合肼溶液进行水热反应,生成结晶性良好且形貌、尺寸可控的Au@Ag3AuX2(X=Te,Se)纳米晶(图8(b)),其在700 nm到1 200 nm的NIR光区具有连续吸收。通过使用808 nm和1 064 nm的激光照射,测得Au@Ag3AuTe2(Au@Ag3AuSe2)纳米晶的光热转换效率分别高达76.7%(50.7%)和49.6%(34.1%),(图8(c),8(d))从而证明Au@Ag3AuX2(X=Te,Se)为良好的光热转换材料,且有较好的光热转换应用潜力。

图8 (a)Au@Ag3AuTe2 纳米晶效果图; (b)Au@Ag3AuTe2 纳米晶的低分辨透射电子显微镜和高分辨透射电子显微镜图; (c,d)不同浓度下Au@Ag3AuTe2纳米晶在808 nm和1 064 nm激光照射下的光热转换曲线[52] Fig.8 (a)Scheme of Au@Ag3AuTe2 NCs. (b)LRTEM and HRTEM images of Au@Ag3AuTe2 NCs. (c,d)PT conversion characterizations of Au@Ag3AuTe2 NCs colloid with various concentrations by 0.7 W/cm2 808 nm (c), 0.7 W/cm2 1 064 nm (d)[52]

图9 (a)Au@MS(M=Cd, Sn) yolk-shell纳米晶合成过程示意图。(b,c)Au@CdS与Au@SnS yolk-shell纳米晶分别的低分辨透射电子显微镜图[36] Fig.9 (a)Synthesis scheme of Au@MS(M=Cd,Sn) yolk-shell NCs. (b,c)LRTEM images of Au@CdS and Au@SnS yolk-shell NCs, respectively[36]
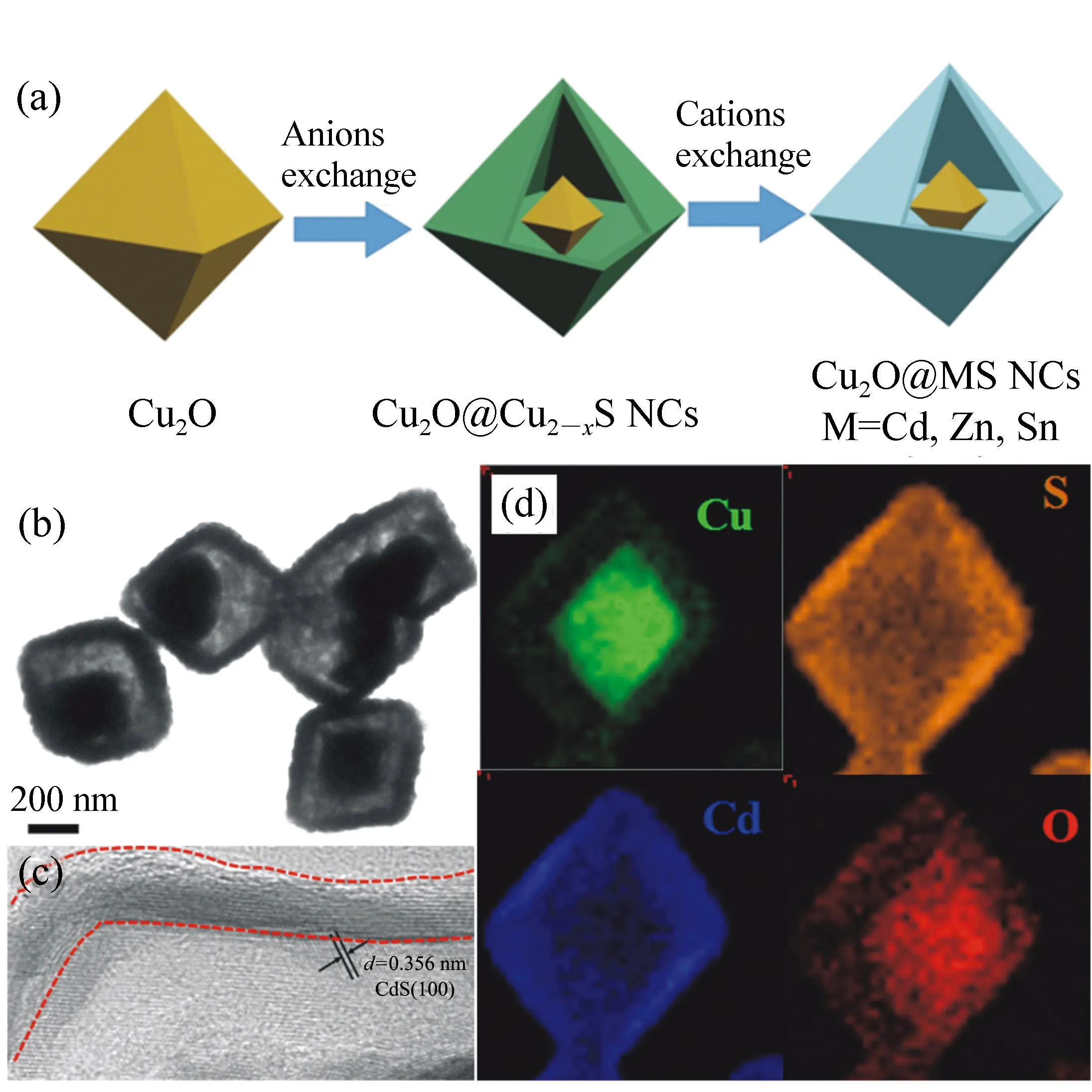
图10 (a)Cu2O@MS(M=Cd,Zn,Sn) yolk-shell纳米晶合成过程示意图; (b)Cu2O@CdS yolk-shell纳米晶低分辨透射电子显微镜图; (c)Cu2O@CdS yolk-shell纳米晶 高分辨透射电子显微镜图; (d)Cu2O@CdS yolk-shell纳米晶STEM模式下的元素分布图[36] Fig.10 (a)Synthesis scheme of Cu2O@MS (M=Cd,Zn,Sn) yolk-shell NCs. (b)LRTEM image of Cu2O@CdS yolk-shell NCs. (c)HRTEM image of Cu2O@CdS yolk-shell NCs. (d)Element mapping of Cu2O@CdS yolk-shell NCs[36]
相比于二元材料实现最大限度接触的核壳结构,yolk-shell结构纳米材料具有与之完全不同的界面环境,为药物缓释、靶向治疗和光热疗的协同作用提供了材料学基础[64]。光热治疗杀死癌细胞是光热研究的重要应用方向之一,然而在实际临床应用中,光热转换材料在到达指定部位光生热的同时,需要化疗药物同时到达指定肿瘤部位,从而定向协同发挥作用,这对于药物输送来说仍具备很大挑战。yolk-shell结构不同于核壳结构,其在结合两种组分材料的同时,还留有可控空间的微反应腔,因此在光热治疗的同时,为药物缓释,靶向治疗,药物定向输送等提供了良好的操作环境,可以实现药物和光热转换材料同时到达指定治疗部位。Zhang课题组最近通过连续可控的阴离子交换和阳离子交换反应原理,普适性制备了一系列Au/半导体yolk-shell纳米晶结构,为后续的纳米光热疗及光热催化合成新应用奠定了坚实的材料基础[36]。合成方法通过将Cu2O或Au@Cu2O纳米晶经过阴离子交换反应引发的柯肯达尔效应,形成Cu2O@Cu2-xS或Au@Cu2-xS,再通过膦配体引发的离子交换反应,实现了普适性的Cu2O@MS和Au@MS(M=Cd,Zn,Sn) yolk-shell结构的合成(如图9、图10所示)。此方法合成的yolk-shell纳米晶,具有很高的单分散性(如图9(a)、9(b)所示),且具有较好的结晶性(如图10(c)所示),这种普适性的合成方法,为具有光热治疗效果的同时具有药物缓释功能的研究提供了材料学基础。Yang等人通过种子合成法合成了长径比均一的Au纳米棒,并通过外延法合成出Au@Cu2O纳米棒,再进一步将之转化为Au@Cu7S4yolk-shell纳米晶[65-66],在915 nm的NIR光照射下其光热转化效率达到了68.6%[35]。并且进一步研究了腔体尺寸、壳层厚度对光热转换效率的影响,证实了在其实验条件下,一定的耦合空间范围内(157.2 nm的yolk-shell结构)有最佳的耦合共振效果。其对表面介孔性质的研究为其作为理想药物缓释材料提供了重要的事实依据。此外,除了核壳和yolk-shell结构外,Zhang和Liu等人制备的Au纳米棒/介孔硅基材料(PMO)Janus结构纳米晶,为药物光热协同治疗提供了材料学基础[67]。
3.4碳基纳米晶
近年来,sp2碳材料吸引了广泛的兴趣。最典型的也是最受欢迎的碳材料包括零维富勒烯材料,一维碳纳米管以及二维石墨烯,这几类材料在药物传递,生物成像探针等领域等应用收到了广泛的研究。碳纳米材料的特点在于其具有紫外到近红外的较宽的光谱吸收,且具有可观的光热稳定性,另外其毒性和生物相容性基本取决于其表面的化学配体。2005年,Dai等人利用经DNA分子修饰的碳纳米管材料,在808 nm,1.4 W/cm2的激光照射2 min后,实现了其针对肿瘤细胞的有效体外光热杀伤效果[37]。2009年,Moon等人证实了经PEG修饰的单壁碳纳米管通过瘤内注射的方法,在808 nm的近红外光照下实现了对肿瘤细胞的高效光热杀伤效果[38]。Burke和Ghosh课题组均利用合成多壁碳纳米管,通过在其表面负载不同的基团,在生物体内实现了良好的肿瘤光热治疗效果[39-40]。Liu等人通过改变碳纳米管的表面配体,改善了瘤内注射所涉及到的光热转化率较低和纳米管体内残留等问题。基于碳纳米管在光热领域的成功,由于石墨烯在近红外区的高效光吸收及更好的生物相容性,被认为在光热疾病治疗领域有潜在的应用价值[41]。2010年,Liu等人首次研究了PEG包覆的石墨烯纳米片(NGS-PEG)在体内注射治疗肿瘤细胞的效果,其示意图及光热转换图谱如图11所示,通过使用2 W/cm2的激光照射在20 mg/kg的剂量下实现了100%的肿瘤细胞杀伤效果,为后续的石墨烯光热治疗研究奠定了基础[42]。在其后续的nRGO-PEG的研究工作中,实现了0.15 W/cm2光照5 min杀死全部肿瘤细胞的效果[43]。2009年,Kim等人将Au纳米颗粒负载到碳纳米管表面,实现了其在生物体内的成像和光热治疗效果,为碳基复合材料的研究奠定了基础[44]。类似的,近年来很多研究组成功制备了贵金属颗粒等物质在碳纳米管和石墨烯上的负载,从而在光热治疗领域实现了不同程度的提高[45-46]。然而制约碳材料进一步应用于光热治疗领域的因素在于其光吸收系数有待提高,且制备过程相比其他材料较为复杂,如需应用于光热治疗则需要对其表面进行大量配体修饰以保证其生物相容性,其表面配体的稳定性还有很大的提高空间。最近的研究中,Zhu和Wang等人通过热解ZIF-8纳米立方块,制备了石墨纳米立方块,在具有良好的的生物相容性和光热稳定性的同时,实现了40.4%的光热转换效率[47]。
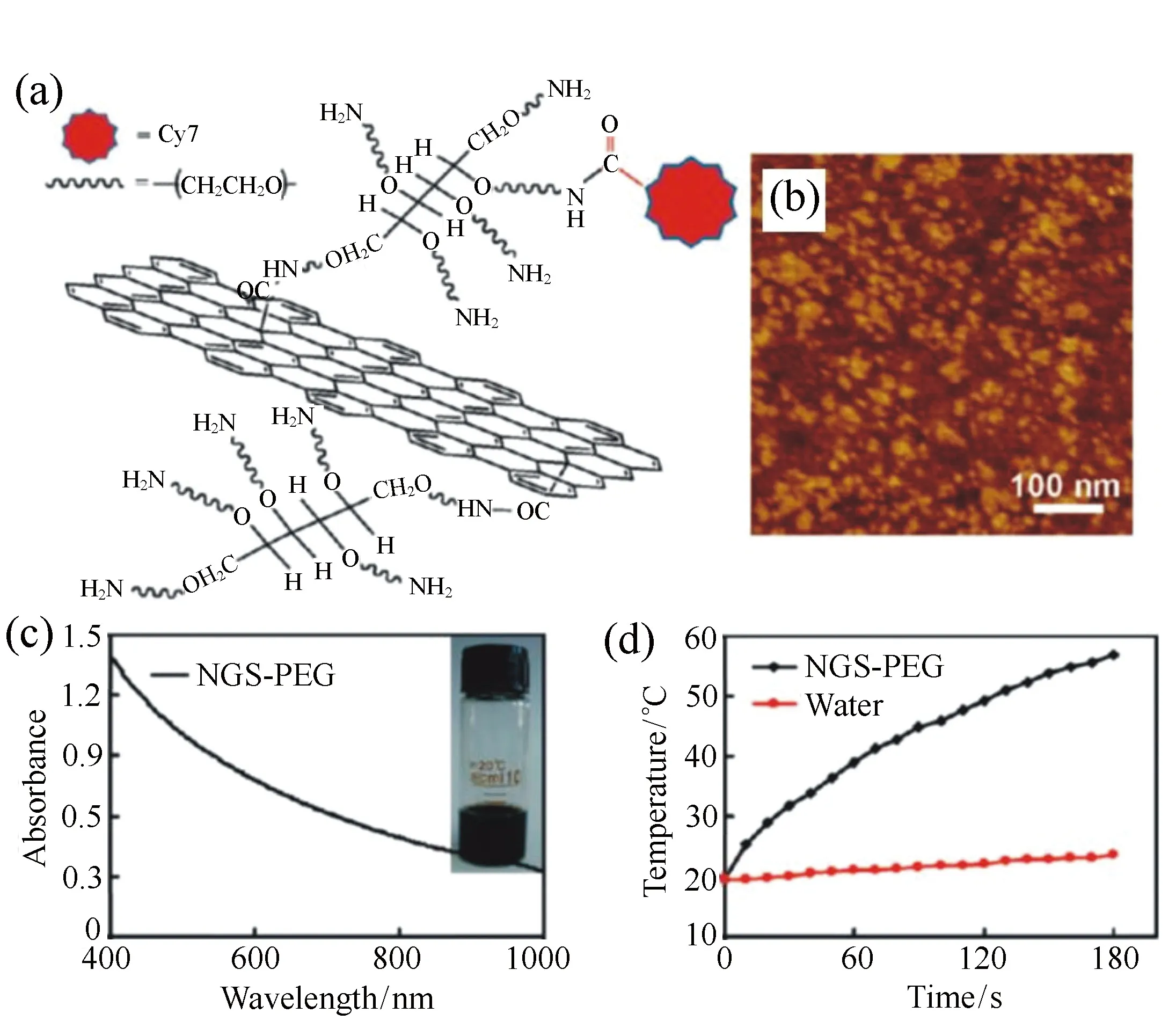
图11 PEG包附的石墨烯纳米片(NGS-PEG)。(a)Cy7修饰的NGS-PEG示意图; (b)NGS-PEG的原子力显微镜图; (c)NGS-PEG的UV-Vis-NIR吸收光谱图'; (d)808 nm,2 W/cm2激光照射下NGS-PEG的光热转换图谱[42] Fig.11 NGS coated with PEG. (a)schematic diagram of NGS-PEG labeled with Cy7. (b)AFM image of NGS-PEG. (c)UV-Vis-NIR absorbance of NGS-PEG solution. (d)PT activity of NGS-PEG under 808 nm 2 W/cm2 laser treatment[42]
4 结束语
光热转换效应在肿瘤治疗、光热催化等领域有广泛的应用潜力,纳米光热转换材料由于其较高的光热转换效率,吸引了学术界的广泛关注。目前,纳米光热转换材料的主要应用领域在于光热成像,光热治疗以及药物缓释等生物医学领域。贵金属纳米颗粒,空位半导体材料以及碳材料是受关注最早,最被广泛研究的3种光热转换材料。贵金属纳米颗粒,以Au纳米棒为主,通过控制其形貌,调节其光谱吸收峰位置,从而实现了近红外区较高的光热转换效率,然而其昂贵的价格是制约其实际应用的重要因素。空位半导体材料,相比于贵金属颗粒,价格较为便宜,但其光热转换效率及生物相容性有待进一步研究。碳材料,以碳纳米管,石墨烯以及碳基复合材料为主,近年来吸引了学术界的广泛兴趣。其优势在于材料成本低,且表面易于修饰,以实现生物靶向治疗。然而其制备工艺比较复杂,且表面配体生物相容性和持久性有待研究。
双模态表面等离子体共振耦合的复合纳米晶,通过形成异质结构的两种材料(以贵金属颗粒和半导体材料形成异质结构居多),基于贵金属和空位半导体材料的表面等离子体共振效应,实现了两种材料的协同耦合效果。通过制备高结晶性及形貌可控的贵金属/空位半导体核壳结构,实现了两种不同模式LSPR效应二元协同耦合作用的最大化,从而在提高光热转化效率的同时降低了材料的成本,为光热转换材料的未来发展提供了重要手段。通过制备具有微反应腔的yolk-shell异质结构纳米晶,为后续的光热疗及光热催化新应用奠定了材料学基础。
[1] CHEN X,CHEN Y,YAN M,etal.. Nanosecond photothermal effects in plasmonic nanostructures[J].ACSNano,2012,6(3):2550-2557.
[2] CHENG L,WANG C,FENG L,etal.. Functional nanomaterials for phototherapies of cancer[J].ChemicalReviews,2014,114(21):10869-10939.
[3] JAQUE D,MARTINEZ MAESTRO L,DEL ROSAL B,etal.. Nanoparticles for photothermal therapies[J].Nanoscale,2014,6(16):9494-9530.
[4] ZHU G,XU J,ZHAO W,etal.. Constructing black titania with unique nanocage structure for solar desalination[J].ACSAppliedMaterials&Interfaces,2016,8(46):31716-31721.
[5] WANG X,OU G,WANG N,etal.. Graphene-based recyclable photo-absorbers for high-efficiency seawater desalination[J].ACSAppliedMaterials&Interfaces,2016,8(14):9194-9199.
[6] CUI J,XU S,GUO C,etal.. Highly efficient photothermal semiconductor nanocomposites for photothermal imaging of latent fingerprints[J].AnalyticalChemistry,2015,87(22):11592-11598.
[7] CHEN G,ROY I,YANG C,etal.. Nanochemistry and nanomedicine for nanoparticle-based diagnostics and therapy[J].ChemicalReviews,2016,116(5):2826-2885.
[8] CHENG L,YANG K,LI Y,etal.. Facile preparation of multifunctional upconversion nanoprobes for multimodal imaging and dual-targeted photothermal therapy[J].AngewandteChemieInternationalEdition,2011,50(32):7385-7390.
[9] ZHOU M,ZHANG R,HUANG M,etal.. A chelator-free multifunctional [64Cu]CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy[J].J.AmericanChemicalSociety,2010,132(43):15351-15358.
[10] HUANG X,NERETINA S,EL-SAYED M A. Gold nanorods:from synthesis and properties to biological and biomedical applications[J].AdvancedMaterials,2009,21(48):4880-4910.
[11] MOU J,CHEN Y,MA M,etal.. Facile synthesis of liposome/Cu2-xS-based nanocomposite for multimodal imaging and photothermal therapy[J].ScienceChinaMaterials,2015,58(4):294-301.
[12] 王英帅,周颖,王珺楠,等.金纳米棒核/二氧化硅壳纳米复合结构的可控制备及细胞成像[J].中国光学,2013,6(5):743-749.
WANG Y SH,ZHOU Y,WANG J,etal.. Controlled synthesis and cell imaging of gold nanorod-silica core-shell nanoparticles[J].ChineseOptics,2013,6(5):743-749.(in Chinese)
[13] CHAI Z,HU X,LU W. Cell membrane-coated nanoparticles for tumor-targeted drug delivery[J].ScienceChinaMaterials,2017:1-7.
[14] PITSILLIDES C M,JOE E K,WEI X,etal.. Selective cell targeting with light-absorbing microparticles and nanoparticles[J].BiophysicalJournal,2003,84(6):4023-4032.
[15] LOO C,LOWERY A,HALAS N,etal.. Immunotargeted nanoshells for integrated cancer imaging and therapy[J].NanoLetters,2005,5(4):709-711.
[16] SKRABALAK S E,CHEN J,SUN Y,etal.. Gold nanocages:synthesis, properties, and applications[J].AccountsofChemicalResearch,2008,41(12):1587-1595.
[17] EL-SAYED I H,HUANG X,EL-SAYED M A. Selective laser photo-thermal therapy of epithelial carcinoma using anti-EGFR antibody conjugated gold nanoparticles[J].CancerLetters,2006,239(1):129-135.
[18] NAM J,WON N,JIN H,etal.. pH-induced aggregation of gold nanoparticles for photothermal cancer therapy[J].J.AmericanChemicalSociety,2009,131(38):13639-13645.
[19] GOBIN A M,LEE M H,HALAS N J,etal.. Near-infrared resonant nanoshells for combined optical imaging and photothermal cancer therapy[J].NanoLetters,2007,7(7):1929-1934.
[20] HUANG W,QIAN W,EL-SAYED M A. Gold nanoparticles propulsion from surface fueled by absorption of femtosecond laser pulse at their surface plasmon resonance[J].J.AmericanChemicalSociety,2006,128(41):13330-13331.
[21] VON MALTZAHN G,PARK J-H,AGRAWAL A,etal.. Computationally guided photothermal tumor therapy using long-circulating gold nanorod antennas[J].CancerResearch,2009,69(9):3892-3900.
[22] CHEN H,SHAO L,MING T,etal.. understanding the photothermal conversion efficiency of gold nanocrystals[J].Small,2010,6(20):2272-2280.
[23] LU W,SINGH A K,KHAN S A,etal.. Gold nano-popcorn-based targeted diagnosis, nanotherapy treatment, and in situ monitoring of photothermal therapy response of prostate cancer cells using surface-enhanced raman spectroscopy[J].J.AmericanChemicalSociety,2010,132(51):18103-18114.
[24] YUAN H,FALES A M,VO-DINH T. TAT peptide-functionalized gold nanostars:enhanced intracellular delivery and efficient NIR photothermal therapy using ultralow irradiance[J].J.AmericanChemicalSociety,2012,134(28):11358-11361.
[25] PELAZ B,GRAZU V,IBARRA A,etal.. Tailoring the synthesis and heating ability of gold nanoprisms for bioapplications[J].Langmuir,2012,28(24):8965-8970.
[26] JANA N R,GEARHEART L,MURPHY C J. Seed-mediated growth approach for shape-controlled synthesis of spheroidal and rod-like gold nanoparticles using a surfactant template[J].AdvancedMaterials,2001,13(18):1389-1393.
[27] NIKOOBAKHT B,EL-SAYED M A. Preparation and growth mechanism of gold nanorods(NRs) using seed-mediated growth method[J].ChemistryofMaterials,2003,15(10):1957-1962.
[28] TIAN Q,JIANG F,ZOU R,etal.. Hydrophilic Cu9S5nanocrystals: a photothermal agent with a 25.7% heat conversion efficiency for photothermal ablation of cancer cells in vivo[J].ACSNano,2011,5(12):9761-9771.
[29] TIAN Q,TANG M,SUN Y,etal.. Hydrophilic flower-like CuS superstructures as an efficient 980 nm laser-driven photothermal agent for ablation of cancer cells[J].AdvancedMaterials,2011,23(31):3542-3547.
[30] WANG S,RIEDINGER A,LI H,etal.. Plasmonic copper sulfide nanocrystals exhibiting near-infrared photothermal and photodynamic therapeutic effects[J].ACSNano,2015,9(2):1788-1800.
[31] KRIEGEL I,RODR GUEZ-FERN NDEZ J,WISNET A,etal.. Shedding light on vacancy-doped copper chalcogenides:shape-controlled synthesis, optical properties, and modeling of copper telluride nanocrystals with near-infrared plasmon resonances[J].ACSNano,2013,7(5):4367-4377.
[32] HUANG S,LIU J,HE Q,etal. Smart Cu1.75S nanocapsules with high and stable photothermal efficiency for nir photo-triggered drug release[J].NanoResearch,2015,8(12):4038-4047.
[33] DING X,LIOW C H,ZHANG M,etal.. Surface plasmon resonance enhanced light absorption and photothermal therapy in the second near-infrared window[J].JournaloftheAmericanChemicalSociety,2014,136(44):15684-15693.
[34] JI M,XU M,ZHANG W,etal.. Structurally well-defined Au@Cu2-xS core-shell nanocrystals for improved cancer treatment based on enhanced photothermal efficiency[J].AdvancedMaterials,2016,28(16):3094-3101.
[35] YU X,BI J,YANG G,etal.. Synergistic effect induced high photothermal performance of Au nanorod@Cu7S4Yolk-Shell nanooctahedron particles[J].TheJournalofPhysicalChemistryC,2016,120(43):24533-24541.
[36] JI M,LI X,WANG H,etal.. Versatile synthesis of yolk/shell hybrid nanocrystals via more kinds of ions exchange reactions:towards novel metal/semiconductor and semiconductor/semiconductor conformations[J].NanoResearch,2017,DOI:10.1007/s12274-017-1508-4.
[37] KAM N W S,O'CONNELL M,WISDOM J A,etal.. Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction[J].ProceedingsoftheNationalAcademyofSciences,2005,102(33):11600-11605.
[38] MOON H K,LEE S H,CHOI H C,etal.. In vivo near-infrared mediated tumor destruction by photothermal effect of carbon nanotubes[J].ACSNano,2009,3(11):3707-3713.
[39] BURKE A,DING X,SINGH R,etal.. Long-term survival following a single treatment of kidney tumors with multiwalled carbon nanotubes and near-infrared radiation[J].ProceedingsoftheNationalAcademyofSciences,2009,106(31):12897-12902.
[40] GHOSH S,DUTTA S,GOMES E,etal.. Increased heating efficiency and selective thermal ablation of malignant tissue with DNA-encased multiwalled carbon nanotubes[J].ACSNano,2009,3(9):2667-2673.
[41] LIU X,TAO H,YANG K,etal.. Optimization of surface chemistry on single-walled carbon nanotubes for in vivo photothermal ablation of tumors[J].Biomaterials,2011,32(1):144-151.
[42] YANG K,ZHANG S,ZHANG G,etal.. Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal therapy[J].NanoLetters,2010,10(9):3318-3323.
[43] YANG K,WAN J,ZHANG S,etal.. The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J].Biomaterials,2012,33(7):2206-2214.
[44] KIM J.-W,GALANZHA E I,SHASHKOV E V,etal.. Golden carbon nanotubes as multimodal photoacoustic and photothermal high-contrast molecular agents[J].NatNano,2009,4(10):688-694.
[45] WANG C,LI J,AMATORE C,etal.. Gold nanoclusters and graphene nanocomposites for drug delivery and imaging of cancer cells[J].AngewandteChemieInternationalEdition,2011,50(49):11644-11648.
[46] MA X,TAO H,YANG K,etal.. A functionalized graphene oxide-iron oxide nanocomposite for magnetically targeted drug delivery, photothermal therapy, and magnetic resonance imaging[J].NanoResearch,2012,5(3):199-212.
[47] CHEN W,ZHANG X,AI F,etal.. Graphitic carbon nanocubes derived from ZIF-8 for photothermal therapy[J].InorganicChemistry,2016,55(12):5750-5752.
[48] SONG X,CHEN Q,LIU Z,etal.. Recent advances in the development of organic photothermal nano-agents[J].NanoResearch,2015,8(2):340-354.
[49] 苏彦勋,柯沅锋,蔡士良,等.层层自组装金纳米粒子表面等离子体引发光电流应用于等离子体增感太阳能电池[J].中国光学,2014,7(2):267-273.
SU Y X,KE Y F,CAI SH L,etal.. Layer self-assembly of gold nanoparticles surface plasmon triggered photoelectric current applied plasmon sensitized solar cell[J].ChineseOptics,2014,7(2):267-273.(in Chinese)
[50] 秦沛,任玉,刘丽炜,等.金属纳米颗粒等离激元共振增强非线性介质谐波的发展现状[J].中国光学,2016,9(2):213-225.
QIN P,REN Y,LIU L W,etal.. Development of plasmon-resonance of metal nanoparticles enhanced harmonic generation in nonlinear medium[J].ChineseOptics,2016,9(2):213-225.(in Chinese)
[51] ROPER D K,AHN W,HOEPFNER M. Microscale heat transfer transduced by surface plasmon resonant gold nanoparticles[J].TheJournalofPhysicalChemistryC,2007,111(9):3636-3641.
[52] CHEN T,XU M,JI M,etal.. Aqueous phase synthesis of Au@Ag3AuX2(X=Se,Te) core/shell nanocrystals and their broad NIR photothermal conversion application[J].Cryst.Eng.Comm.,2016,18(29):5418-5422.
[53] KIM J,PARK J,KIM H,etal.. Transfection and intracellular trafficking properties of carbon dot-gold nanoparticle molecular assembly conjugated with PEI-pDNA[J].Biomaterials,2013,34(29):7168-7180.
[54] JIANG R,LI B,FANG C,etal.. Metal/Semiconductor hybrid nanostructures for plasmon-enhanced applications[J].AdvancedMaterials,2014,26(31):5274-5309.
[55] COZZOLI P D,PELLEGRINO T,MANNA L. Synthesis, properties and perspectives of hybrid nanocrystal structures[J].ChemicalSocietyReviews,2006,35(11):1195-1208.
[56] JANSSENS S,WILLIAMS G V M,CLARKE D. Systematic study of sensitized LaF3∶Eu3+nanoparticles[J].J.AppliedPhysics,2011,109(2):023506.
[57] ZHANG Q,LEE I,JOO J B,etal.. Core-Shell nanostructured catalysts[J].AccountsofChemicalResearch,2013,46(8):1816-1824.
[58] HU Y,LIU Y,LI Z,etal.. Highly asymmetric, interfaced dimers made of Au nanoparticles and bimetallic nanoshells:synthesis and photo-enhanced catalysis[J].AdvancedFunctionalMaterials,2014,24(19):2828-2836.
[59] SHEEHAN S W,NOH H,BRUDVIG G W,etal.. Plasmonic enhancement of dye-sensitized solar cells using Core-Shell-Shell nanostructures[J].TheJournalofPhysicalChemistryC,2013,117(2):927-934.
[60] HALAS N J,LAL S,CHANG W S,etal.. Plasmons in strongly coupled metallic nanostructures[J].ChemicalReviews,2011,111(6):3913-3961.
[61] GUI J,JI M,LIU J,etal.. Phosphine-initiated cation exchange for precisely tailoring composition and properties of semiconductor nanostructures:old concept, new applications[J].AngewandteChemieInternationalEdition,2015,54(12):3683-3687.
[62] ZHANG J,TANG Y,LEE K,etal.. Nonepitaxial growth of hybrid Core-Shell nanostructures with large lattice mismatches[J].Science,2010,327(5973):1634-1638.
[63] YU Z,XIONG S,JIANG J,etal.. Phase-controlled synthesis of Cu2ZnSnS4nanocrystals:the role of reactivity between Zn and S[J].J.AmericanChemicalSociety,2013,135(49):18377-18384.
[64] WANG X,FENG J,BAI C,etal.. Synthesis, properties, and applications of hollow micro-/nanostructures[J].ChemicalReview,2016,116:10983-11060.
[65] KONG L,CHEN W,MA D Y,etal.. Size control of Au@Cu2O octahedra for excellent photocatalytic performance[J].J.MaterialsChemistry,2012,22(2):719-724.
[66] KUO C H,CHU Y T,SONG Y F,etal.. Cu2O nanocrystal-templated growth of Cu2S nanocages with encapsulated Au nanoparticles and in-situ transmission X-ray microscopy study[J].AdvancedFunctionalMaterials,2011,21(4):792-797.
[67] HU H,LIU J,YU J,etal.. Synthesis of Janus Au@periodic mesoporous organosilica(PMO) nanostructures with precisely controllable morphology:a seed-shape defined growth mechanism[J].Nanoscale,2017,9:4826-4834.
Researchprogressofnear-infraredphotothermalconversionnanocrystals
LI Xin-yuan, JI Mu-wei, WANG Hong-zhi, TU Guo-peng, WAN Xiao-dong, LIU Jia-jia, LIU Jia, XU Meng*, ZHANG Jia-tao*
(BeijingKeyLaboratoryofConstruction-TailorableAdvancedFunctionalMaterialsandGreenApplication,SchoolofMaterialsScience&Engineering,BeijingInstituteofTechnology,Beijing100081,China)
Near-infrared photothermal(PT) conversion nanocrystals(NCs), due to their excellent PT conversion performance in near-infrared region(generally in range of 780-1 400 nm), has a wide application potential in the field of cancer cell killing, tumor therapy as well as desalination. These NCs attracted great attention on PT imaging and PT therapy, because of their diverse liquid phase synthesize methods, morphology-controll, nanostructure composite, increasing PT conversion efficiency and easy functionalization . This review aimed to summarize the research progress of near-infrared PT conversion NCs, including noble metal NCs, copper chalcogenide semiconductor NCs, carbon-related NCs, hybrid structure composed of nanocrystalline materials. In addition, the research progress of surface plasmon resonance(SPR) materials with high photothermal conversion efficiency is introduced, especially the application prospect of dual-mode SPR coupling in the field of photothermal conversion. Through the research on the literatures at home and abroad, it is known that the hybrid nanocrystals with dual mode surface plasmon resonance coupling will be an important direction for the development of photothermal conversion nanocrystals in recent years due to the characteristics of performance coordination and coupling.
nanocrystals;near-infrared photothermal conversion;photothermal therapy;surface plasmon resonance
TP394.1; TH691.9
A
10.3788/CO.20171005.0541

李欣远 (1991—),男,黑龙江齐齐哈尔人,博士研究生,2014年于哈尔滨工业大学获得学士学位,2015年于英国曼彻斯特大学获得硕士学位,主要从事纳米晶合成方面的研究。E-mail:137419214@qq.com

徐 萌(1986—),男,黑龙江哈尔滨人,讲师,2009年于浙江大学获得学士学位,2014年于中科院国家纳米科学中心获得博士学位,主要从事纳米晶合成及生物应用方面的研究。E-mail:xumeng@bit.edu.cn

张加涛 (1975—),男,山东临沂人,教授,博士生导师,2000年于山东建材学院获得学士学位,2003年于在北京理工大学获得硕士学位,2006年于清华大学获得博士学位,主要从事多功能低维纳米复合材料的形貌设计、合成、光电性能及其在光电信息、能源转化与存储、光催化应用方面的研究。E-mail:zhangjt@bit.edu.cn
2017-04-18;
2017-05-19
国家自然科学基金项目(No.21643003, No.51631001, No.91323301, No.51501010, No.51372025)
Supported by National Natural Science Foundation of China(No.21643003, No.51631001, No.91323301, No.51501010, No.51372025)
2095-1531(2017)05-0541-14
*Correspondingauthor,E-mail:zhangjt@bit.edu.cn;xumeng@bit.edu.cn
——庆祝中国共产党成立一百周年贵金属纪念币展

