干旱胁迫下硅对肥皂草抗氧化系统及膜质稳定性的影响
杨慧颖,邓雅楠,许凌欣,严俊鑫*
(1.东北林业大学东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040;2.东北林业大学园林学院,黑龙江 哈尔滨 150040)
干旱胁迫下硅对肥皂草抗氧化系统及膜质稳定性的影响
杨慧颖1,2,邓雅楠2,许凌欣2,严俊鑫1,2*
(1.东北林业大学东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040;2.东北林业大学园林学院,黑龙江 哈尔滨 150040)
以盆栽肥皂草为试验材料,通过对每kg干土施0.1,0.2,0.3,0.4 g SiO2并设置正常水分、轻度胁迫、重度胁迫3种水分梯度,测定并分析胁迫期间肥皂草叶片保护酶活性、抗氧化剂含量、丙二醛含量和相对电导率的变化情况,以期探讨干旱胁迫下硅对抗氧化系统与膜质稳定性的影响。结果表明,随着干旱胁迫程度和天数的增加,肥皂草叶片SOD、POD、CAT活性和GSH、ASA含量呈现先上升后下降趋势,而丙二醛含量与叶片相对电导率呈现增加趋势。与CK相比,施一定量的硅能使干旱条件下肥皂草SOD、POD、CAT活性最高增加30%以上,丙二醛含量和相对电导率降低达25%以上,并稳定了GSH、ASA含量,说明硅能有效缓解干旱对肥皂草细胞膜的破坏,提高肥皂草抗氧化系统的防御能力,保护其正常生理机能不被破坏。随着硅浓度的增加,肥皂草抗旱性逐渐增强并趋于平稳,最适宜硅肥浓度为每kg干土SiO2含量0.3~0.4 g。
硅;干旱胁迫;保护酶;抗氧化系统;细胞膜
硅在地壳中的含量仅次于氧,是植物有益元素,促进植物生长发育[1]。土壤中含硅量为50%~70%,但植物可以直接吸收利用的有效硅一般为50~250 mg/kg[2]。干旱是植物面临的主要逆境之一,不仅抑制植物生长发育[3-4],在园林应用上则限制植物种类、降低观赏效果、增加养护成本,对水资源短缺地区园林绿化管理不利。干旱条件下植物体内生成大量活性氧,破坏膜脂稳定性,膜脂过氧化产物丙二醛含量增加,植物自身的保护酶与抗氧化剂等协调作用可以清除这些活性氧,减缓细胞膜损害,但随着胁迫的持续,植物自身防御能力有限,活性氧不断积累,损害发生[5-6]。研究表明,外源硅能够缓解干旱对植物造成的伤害,提高植物的抗旱性[7-10],但这类研究以农作物和草坪植物为主,针对园林植物施加硅的研究甚少。
肥皂草(Saponariaofficinalis)是石竹科(Caryophyllaceae)肥皂草属(Saponaria)多年生草本植物,花期长,繁殖快,生命力强,短期就能形成优美景观,适用于多种园林景观形式,是园林中常见的植物材料。已有研究得出,硅可以促进盐胁迫下肥皂草种子萌发[11],增强干旱胁迫下肥皂草光合呼吸作用[12],而关于硅在肥皂草干旱胁迫下抗氧化系统和细胞膜稳定性方面的研究未见报道。因此,有必要研究外源硅对干旱胁迫下肥皂草保护酶、抗氧化剂及细胞膜稳定性的影响,进一步探索硅在肥皂草抗氧化防御系统方面的作用,以期为加强园林植物抗旱能力、优化旱区植物配置、节约养护成本、发展生态园林提供更多参考。
1 材料与方法
1.1试验材料与处理方法
2015年5月选取长势一致的肥皂草裸根苗移栽到直径25 cm花盆中,用1∶3的蛭石和草炭土作为基质,混匀,测得pH 5.84,有效磷为63.35 mg/kg,有效氮为96.45 mg/kg,速效钾为187.34 mg/kg,有效硅为129.19 mg/kg,有机质为41.6 g/kg。试验在东北林业大学苗圃内进行,以硫酸钾为基肥,硅酸钾(K2SiO4)作硅肥,加入硅酸钾所引入的钾量从硫酸钾中扣除。基肥和硅肥一次性施入土壤,混合均匀。试验设4个硅处理水平,每kg干土施硅量分别为:0.1,0.2,0.3,0.4 g SiO2(分别用Si1,Si2,Si3,Si4表示,每盆干土净重约1.3 kg)。设置1个对照CK(不施硅)。同年6月,采用称重法[9-10]测定土壤含水量,并用自然干旱法对水分进行控制,根据预实验得出水分控制的最佳梯度,分别是土壤田间持水量的80%~90%、50%~65%、30%~45%(分别用T1、T2、T3表示正常水分、轻度胁迫、重度胁迫)。土壤相对含水量达到干旱胁迫条件时,称重补水使水分保持在相应梯度,于胁迫后的1,5,10,15,20 d选择成熟健康的植株叶片于液氮中速冻后放入-80 ℃冰箱保存,重复3次。
1.2测定指标与方法
(1)取叶片0.5 g,加1 mL预冷的磷酸缓冲液在冰浴上研磨成浆,4 ℃下4000 r/min离心15 min,上清液,即为粗酶液,用于超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的测定。
SOD活性测定采用氮蓝四唑(NBT)法[13]:取5 mL指形管数支,2支作为对照管,将下列试剂依次加入各试管中:0.05 mol/L磷酸缓冲液1.5 mL;130 mmol/L 甲硫氨酸(Met)溶液0.3 mL;750 μmol/L的氮蓝四唑(NBT)溶液0.3 mL;100 μmol/L的乙二胺四乙酸二钠(EDTA-Na2)溶液0.3 mL;2.0 μmol/L的核黄素溶液0.3 mL;酶液0.05 mL,2支对照管以磷酸缓冲液代替酶液;蒸馏水0.25 mL。总体积3 mL。混匀后将1支对照管置暗处,其他各管于4000 lx日光下反应20 min,反应结束,以不照光的对照管做空白,在560 nm下测定吸光度。
POD活性的测定采用愈创木酚法[13-14]:酶活性测定的反应体系为,2.9 mL 0.05 mol/L磷酸缓冲液;1 mL 2% H2O2,1 mL 0.05 mol/L愈创木酚和0.1 mL酶液。用加热煮沸5 min的酶液为对照,反应体系加入酶液后立即于37 ℃中保温15 min左右,然后迅速转入冰浴,加入2 mL 20% 三氯乙酸(TCA)终止反应,5000 r/min离心10 min,470 nm波长下测定吸光度。
CAT活性的测定采用紫外分光光度计法[15]:取2.9 mL Tris-HCl缓冲液,加入50 μL粗酶液,快速混匀,倒入比色皿中,封口,预热5 min,加入50 μL的750 mmol/L H2O2并计时,在波长240 nm处测量吸光度,每隔30 s读一次。以每min内240 nm处吸光度变化0.01为1个过氧化物酶活性单位(1 U)。
(2)取叶片0.5 g加入5 mL 5% TCA溶液研磨匀浆,在12000 r/min离心10 min,上清液定容至5 mL,用于抗坏血酸(ASA)含量和还原型谷胱甘肽(GSH)含量的测定。
ASA含量的测定参照Hodges等[16]的方法:吸取上述制备好的样品上清液0.2 mL,分别加入150 mmol的NaH2PO4(pH 7.4)0.2 mL、H2O 0.2 mL,混合均匀,至少30 s后,再依次分别往各管中加入0.4 mL 10% TCA,0.4 mL 44% H3PO4,0.4 mL 4% 2,2-二联吡啶和0.2 mL 3% FeCl3,混合后在37 ℃水浴中保温60 min,然后测525 nm处的吸光值。同样程序制作标准曲线,根据标准曲线计算样品中ASA的含量。
GSH含量的测定参照Griffith[17]的方法:分别取上述样品提取液0.25 mL,各加入2.6 mL 150 mmol NaH2PO4(pH 7.7)、2-硝基苯甲酸(DNTB)试剂0.18 mL,以加磷酸缓冲液代替DNTB试剂作空白。摇匀后,于30 ℃保温反应5 min,测定412 nm波长下的吸光度值,同样程序制作标准曲线,根据标准曲线计算样品中GSH的含量。
(3)丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法[13]:取叶片0.2 g,加入5% TCA 5 mL研磨至匀浆,匀浆以5000 r/min离心10 min。吸取上清液2 mL于试管中,加0.67% TBA 2 mL,混合后在100 ℃沸水浴中反应30 min,冷却后再次离心。取上清液测定450,532,600 nm处吸光度值,计算MDA含量。
(4)细胞膜透性的测定采用电导法[13]:选取叶片0.5 g,用自来水和去离子水分别冲洗表面,吸干叶片表面水分后,剪碎成大小相近的叶片放入小烧杯中,用尼龙网压住,加入20 mL去离子水,浸没叶片。将烧杯放入真空抽气泵抽气20 min,在室内放置1 h,用电导仪测定溶液电导率,后放入100 ℃沸水浴中煮沸15 min,待冷却至室温后测定其煮沸电导率,计算相对电导率。
1.3数据处理
采用SPSS 19.0软件对所测数据进行分析,采用Duncan法在P<0.05水平上进行多重比较。
2 结果与分析
2.1硅对干旱胁迫下肥皂草叶片保护酶的影响
2.1.1硅对干旱胁迫下肥皂草SOD活性的影响 T1条件下,肥皂草SOD活性在第10天开始缓慢下降,施硅增加了SOD活性,随着硅浓度的增加提高作用逐渐明显并趋于平稳,Si3、Si4处理效果相近,高于Si1、Si2处理。T2、T3条件下,各个处理下的肥皂草SOD活性随着时间的增加呈现先上升后下降趋势,施硅增加了SOD活性。Si3、Si4处理在T2、T3条件下的20 d内与CK相比差异均显著(P<0.05),在T2条件下分别比CK提高了16%~26%、14%~28%,T3条件下分别比CK提高了17%~38%、15%~39%,优于Si1、Si2处理(表1)。
2.1.2硅对干旱胁迫下肥皂草POD活性的影响 由表2可知,T1条件下,肥皂草POD活性在第10天开始缓慢上升,施硅增加了POD活性,且随着硅浓度的增加先上升后小幅下降,Si3、Si4处理均在一定时间点上与CK相比差异显著(P<0.05),Si1、Si2处理在20 d内与CK相比差异不显著(P>0.05)。T2、T3条件下,各处理下的肥皂草POD活性随着时间的增加呈现先上升后下降趋势,施硅增加了POD活性,且随着硅浓度的增加效果逐渐增加并趋于平稳,Si3、Si4处理在T2、T3条件下的20 d内与CK相比差异均显著(P<0.05),T2条件下分别比CK提高了18%~28%、16%~27%,T3条件下分别比CK提高了16%~39%、11%~36%,优于Si1、Si2处理。
2.1.3硅对干旱胁迫下肥皂草CAT活性的影响 由表3可知,T1条件下,肥皂草CAT活性在20 d内变化不明显,施硅增加了CAT活性,但各硅处理与CK相比差异均不显著(P>0.05)。T2、T3条件下,各处理下的肥皂草CAT活性随着时间的增加呈现先上升后下降趋势,施硅增加了CAT活性,且随着硅浓度的增加大体呈现先上升后小幅下降或平稳的趋势,T2条件下,除Si1处理在20 d内与CK相比差异不显著(P>0.05)外,Si2、Si3、Si4处理均在5~20 d与CK相比差异显著(P<0.05)。T3条件下,除Si3处理在20 d内与CK相比差异均显著(P<0.05),比CK提高了16%~38%外,其余硅处理效果为Si4>Si2>Si1。
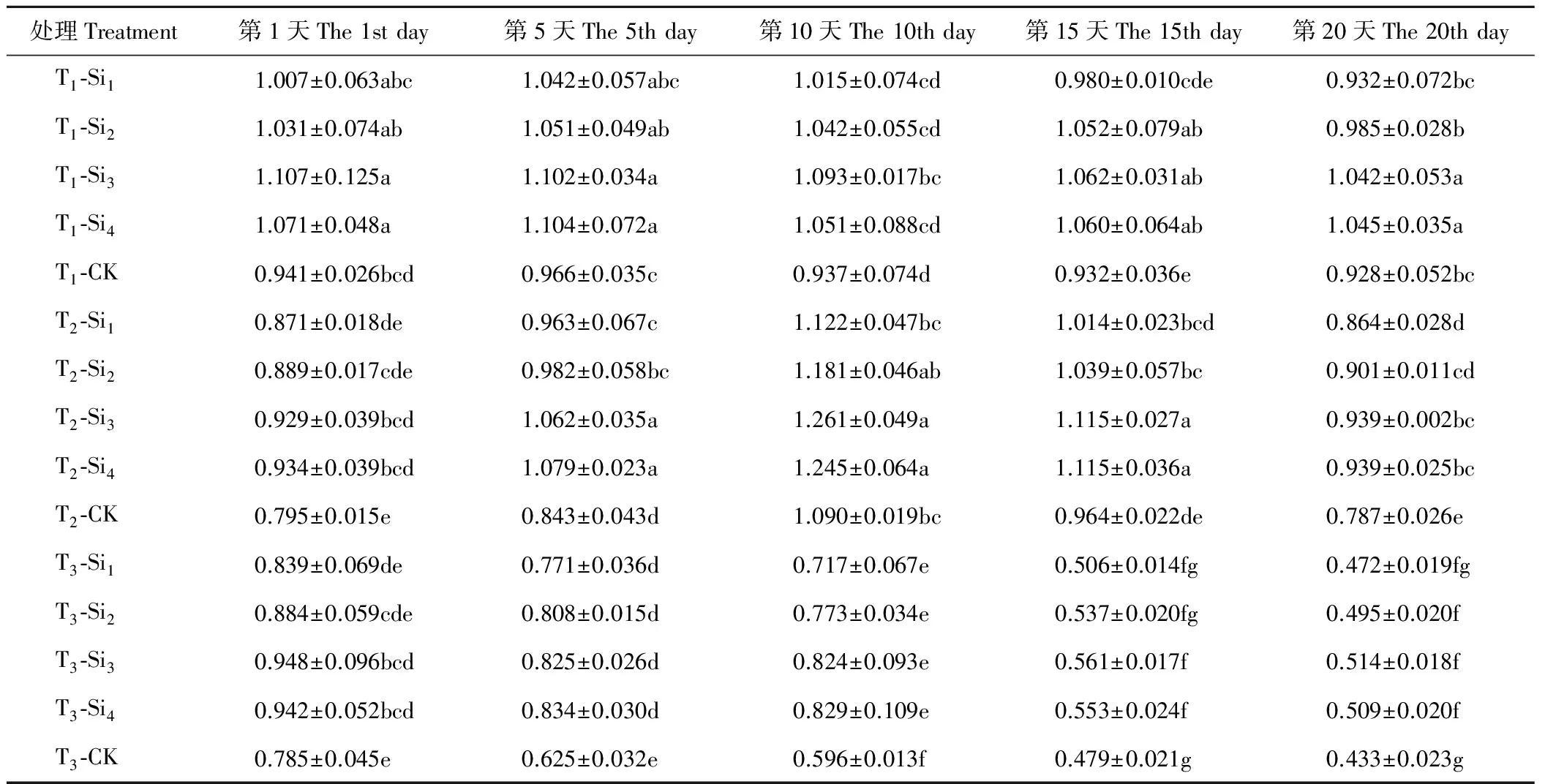
表1 硅对干旱胁迫下肥皂草SOD的影响Table 1 Effects of Si on SOD of S. officinalis under drought stress U/mg
注:同列不同字母代表差异显著(P<0.05)。下同。
Note: The different letters in the same column represent significant difference atP<0.05 level. The same below.
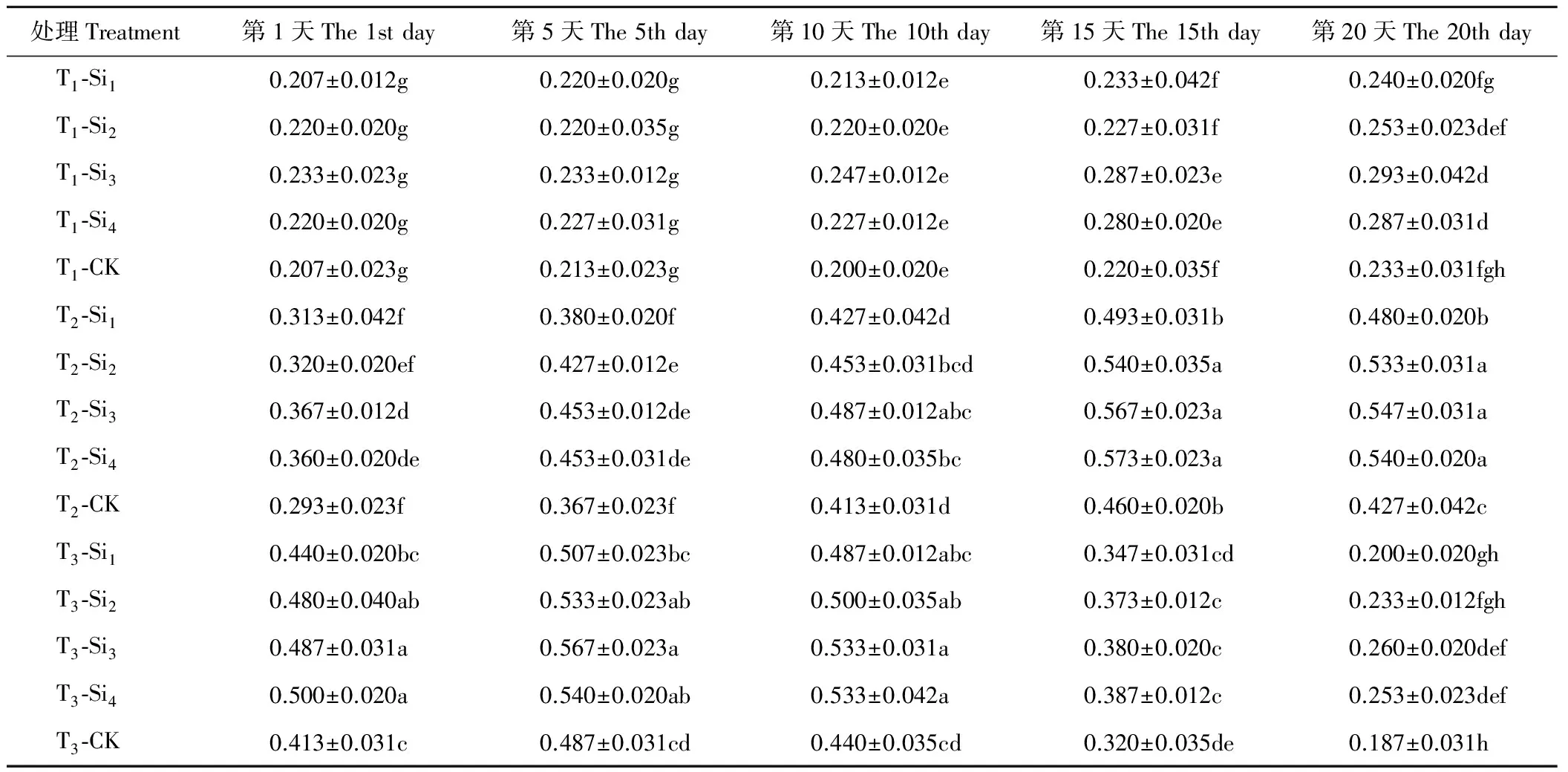
表2 硅对干旱胁迫下肥皂草POD的影响Table 2 Effects of Si on POD of S. officinalis under drought stress U/mg

表3 硅对干旱胁迫下肥皂草CAT的影响Table 3 Effects of Si on CAT of S. officinalis under drought stress U/mg
2.2硅对干旱胁迫下肥皂草抗氧化剂含量的影响
2.2.1硅对干旱胁迫下肥皂草ASA含量的影响 由表4可知,T1条件下,肥皂草ASA含量在20 d内变化不明显,Si1、Si2、Si3、Si4处理在20 d内与CK相比差异均不显著(P>0.05)。T2、T3条件均增加了各处理肥皂草的ASA含量,但到了T3的后10 d,各处理ASA含量急剧下降。T2条件下,除Si1处理和CK的ASA含量随着时间的增加呈现先上升后下降趋势外,其余硅处理下的肥皂草ASA含量随着时间的增加呈现上升趋势,在前15 d施硅降低了肥皂草ASA含量,在第20天除Si1外,其他硅处理均增加了ASA含量,Si3、Si4处理效果较Si1、Si2处理明显。T3条件下,各处理的肥皂草ASA含量随着时间的增加呈现先上升后急剧下降趋势,在前5 d施硅降低了ASA含量,在10~20 d,施硅提高了ASA含量。按照硅处理在T3条件下效果显著的时间点范围与数值大小得出,硅处理效果为Si4>Si3>Si2>Si1。
2.2.2硅对干旱胁迫下肥皂草GSH含量的影响 由表5可知,T1条件下,各处理肥皂草GSH含量除Si3随着时间增加呈上升趋势外,其余各处理均随着时间增加呈现先上升后下降趋势,施硅降低了肥皂草的GSH含量,但Si1、Si2、Si3、Si4处理在20 d内与CK相比差异均不显著(P>0.05)。T2条件下,Si1和CK的肥皂草GSH含量随着时间增加呈先上升后下降趋势,其余各处理的肥皂草GSH含量随着时间增加呈上升趋势。施硅在1~15 d降低了肥皂草GSH含量,在第20天,除Si1处理外,其余硅处理GSH含量均高于CK。T2条件下,Si1、Si2处理在20 d内与CK相比差异均不显著(P>0.05),Si3、Si4处理在1~15 d与CK相比差异显著(P<0.05),分别比CK降低了15%~20%、11%~20%。T3条件下,各处理的肥皂草GSH含量随着时间增加呈先上升后下降趋势。前5 d,施硅降低了肥皂草GSH含量,在10~20 d,施硅增加了肥皂草GSH含量。按照硅处理在T3条件下效果显著的时间点范围与数值大小得出,硅处理效果为Si4>Si3>Si2>Si1。
2.3硅对干旱胁迫下肥皂草MDA含量的影响
由表6可知,T1条件下,各处理肥皂草叶片的MDA含量在20 d内变化不明显,Si1、Si2、Si3、Si4处理在20 d内与CK相比差异均不显著(P>0.05)。T2、T3条件均增加了肥皂草叶片MDA含量,且随着干旱程度和时间的增加而增大,施硅降低了MDA含量。T2、T3条件下, 随着硅浓度的增加,MDA含量逐渐下降并趋于稳定。T2条件下的Si3、Si4处理在1~20 d与CK相比差异均显著(P<0.05),分别比CK降低了15%~25%、18%~26%,优于Si1、Si2处理。T3条件下的Si3、Si4处理在1~15 d与CK相比均差异显著,分别比CK降低了12%~18%、10%~18%,优于Si1、Si2处理。
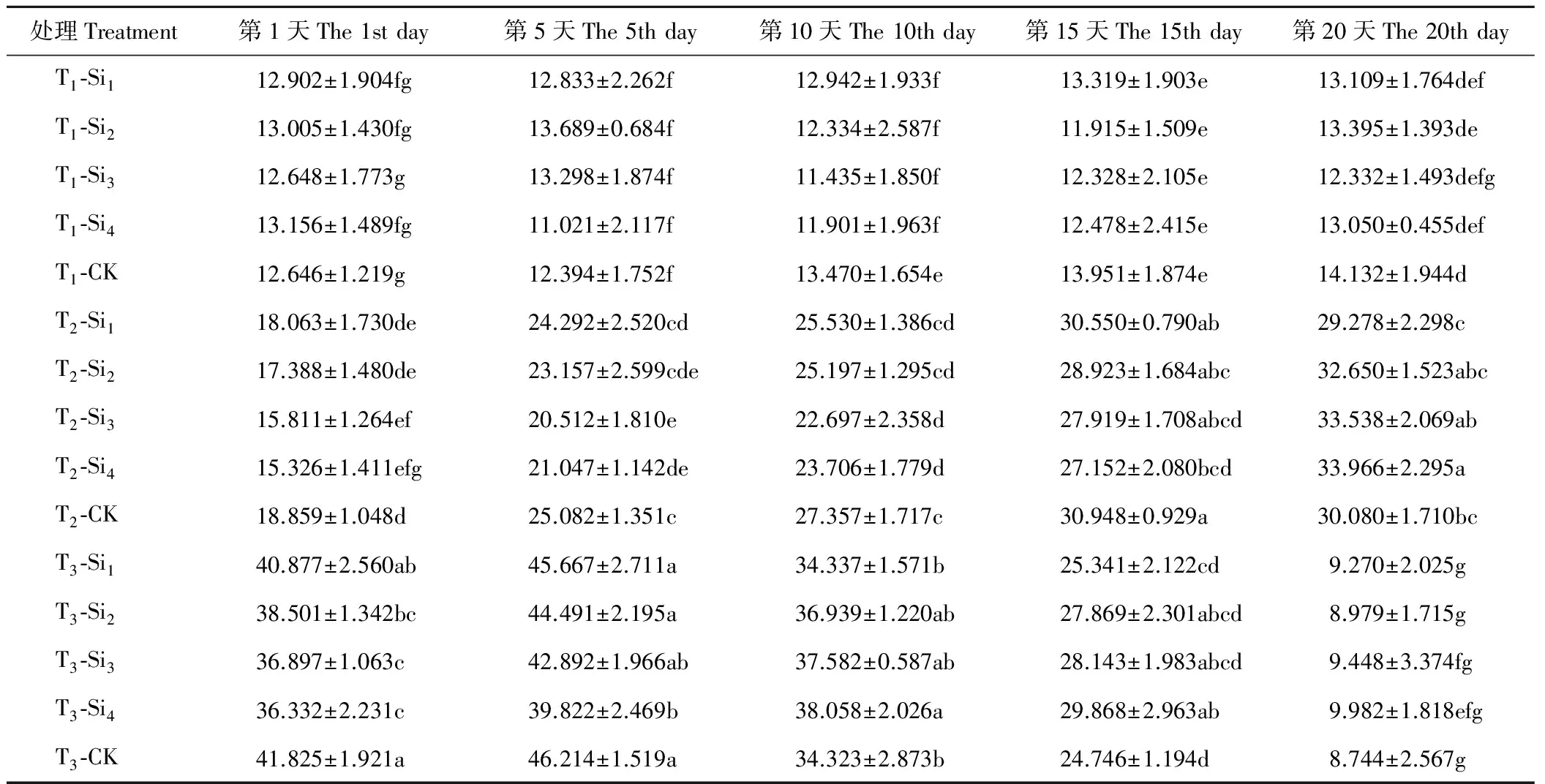
表4 硅对干旱胁迫下肥皂草ASA的影响Table 4 Effects of Si on ASA of S. officinalis under drought stress mg/g
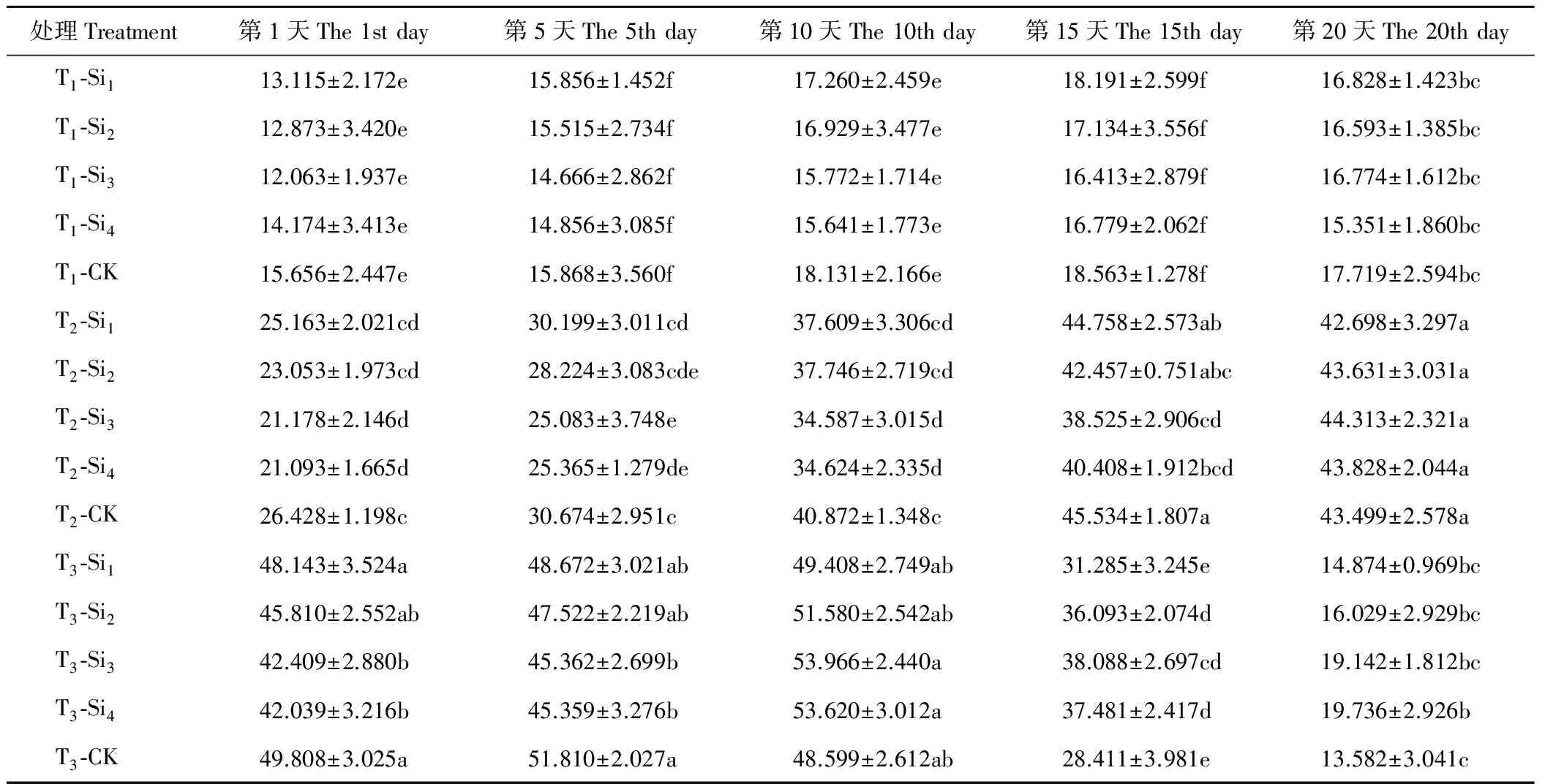
表5 硅对干旱胁迫下肥皂草GSH的影响 Table 5 Effects of Si on GSH of S. officinalis under drought stress μg/g
2.4硅对干旱胁迫下肥皂草膜透性的影响
由表7可知,T1条件下,CK的肥皂草叶片相对电导率缓慢上升,各硅处理的相对电导率在20 d内变化不明显,施硅降低了叶片相对电导率,但Si1、Si2、Si3、Si4处理在20 d内与CK相比差异均不显著(P>0.05)。T2、T3条件下,各处理下的肥皂草叶片相对电导率随着时间和胁迫程度的增加呈现上升趋势,施硅降低了叶片相对电导率。T2条件下,Si1、Si2处理在20 d内与CK相比差异均不显著(P>0.05);Si3、Si4处理在10~20 d与CK相比差异显著(P<0.05),分别比CK降低了21%~27%、19%~25%。T3条件下,Si3、Si4处理在20 d内与CK相比均差异显著(P<0.05),分别比CK降低了13%~23%、13%~24%,优于Si1、Si2处理。
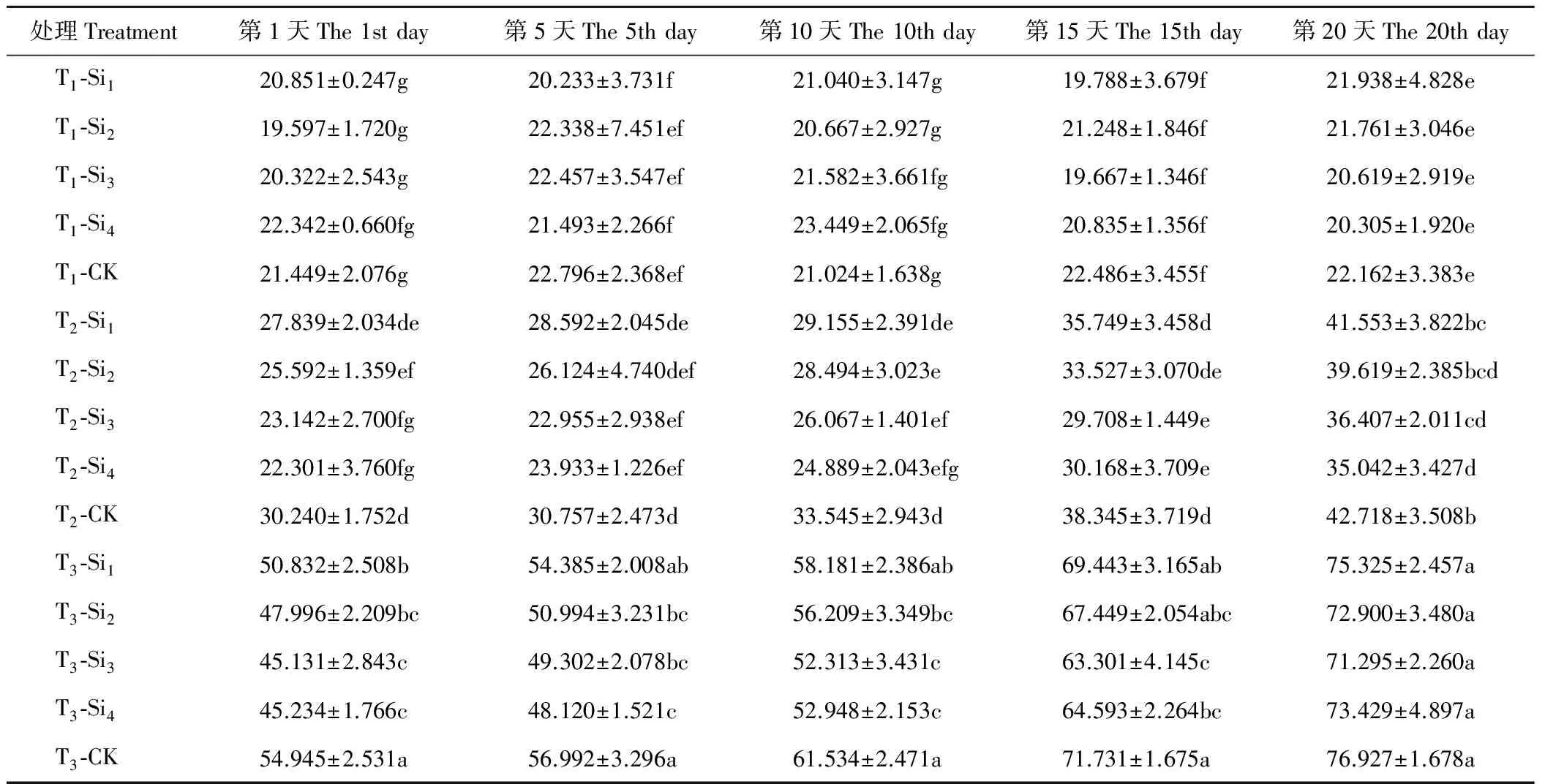
表6 硅对干旱胁迫下肥皂草MDA的影响Table 6 Effects of Si on MDA of S. officinalis under drought stress mmol/g
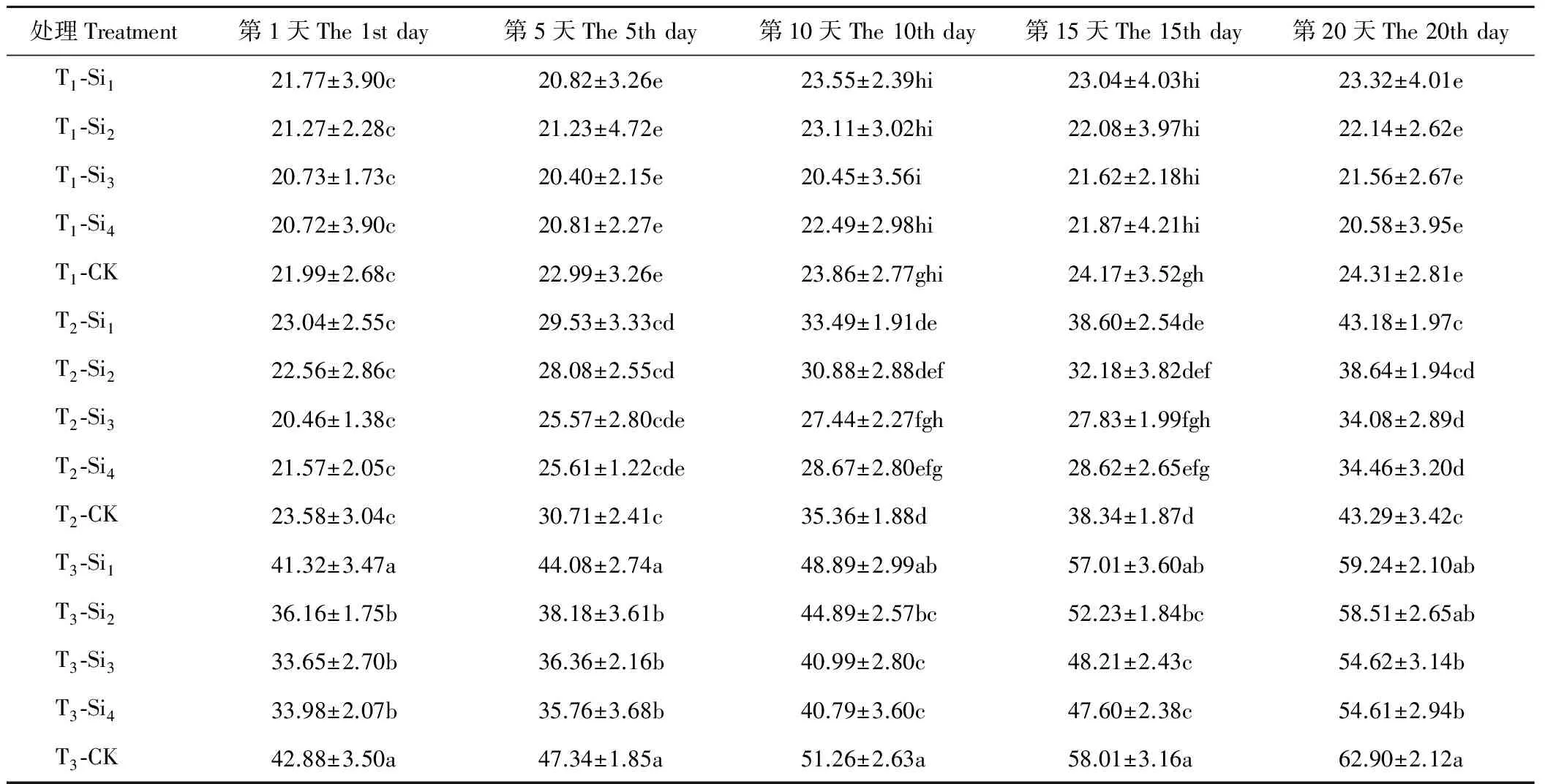
表7 硅对干旱胁迫下肥皂草叶片相对电导率的影响Table 7 Effects of Si on relative electric conductivity of S. officinalis leaves under drought stress %
3 讨论
干旱影响植物正常生长和代谢,植物细胞由于代谢受阻则产生大量活性氧与自由基,如O2-、H2O2、·OH,致使植物体内活性氧的产生与清除之间动态平衡被破坏,降低植物叶片保护酶的活性、引起膜脂过氧化、膜脂过氧化的产物MDA增加[18-19],而植物自身的防御机制有一套活性氧清除系统,由抗氧化酶SOD、POD、CAT和抗氧化物质ASA、GSH等来清除这些活性氧与自由基,减缓逆境对植物造成的伤害[20],植物体内的抗氧化酶活性与抗氧化物质的含量也反映了植物应对逆境的适应能力。研究表明,随着干旱程度的加剧,玉米(Zeamays)叶片保护酶SOD、POD、CAT活性呈现先上升后下降趋势,MDA呈下降趋势[21];随着干旱时间的增加,香根草(Vetiveriazizanioides)MDA含量、膜透性增加,SOD、CAT活性下降、POD活性上升,ASA含量上升,GSH含量先降后升再降[22]。在本试验中,随着干旱胁迫程度和天数的增加,肥皂草叶片SOD、POD、CAT活性呈现先上升后下降趋势,而MDA含量与膜透性呈现增加趋势,这与季杨等[23]在鸭茅(Dactylisglomerata)上面的研究结果基本一致。轻度干旱促使肥皂草ASA和GSH含量上升,但重度干旱胁迫下,两种物质呈现先上升后下降趋势,这与前人研究有所不同,但与单长卷等[24]在冰草(Agropyroncristatum)上的研究基本一致,这可能与不同植物抗旱能力的差异性相关,总之,干旱致使肥皂草细胞膜发生一定程度的损害,肥皂草自身的抗氧化系统在干旱胁迫时段的前期充分发挥了调节作用,但随着损害加剧,正常的调节功能受损。
施硅提高了干旱胁迫下玉米、黄瓜(Cucumissativus)的SOD、POD、CAT活性,抑制了干旱胁迫下玉米叶片膜透性和MDA的升高[25-26]。明东风等[27]得出PEG胁迫下施硅使两个水稻(Oryzasativa)品种叶片MDA含量、膜透性降低,减缓水稻根系抗氧化酶SOD、POD、CAT活性的下降,缩小因胁迫导致的GSH含量的变化幅度,提高ASA含量。丁燕芳[28]得出干旱条件下施硅使小麦(Triticumaestivum)叶片SOD、CAT活性和ASA、GSH含量增加,POD活性、MDA含量降低。本研究得出,施硅增加了干旱条件下肥皂草叶片SOD、POD、CAT活性,且在重度水分胁迫条件下这种作用更加显著,施硅还降低了肥皂草MDA含量和相对电导率,这与前人的研究结果基本一致,说明硅能有效提高干旱条件下肥皂草3种叶片保护酶活性,减缓膜脂过氧化作用;施硅后的肥皂草GSH和ASA含量在轻度和重度干旱条件下均呈现先低于CK后高于CK规律,这可能是硅提高了叶片保护酶活性,有效缓解了胁迫造成的损害,使GSH和ASA含量稳定在了一定水平。除此之外,本研究还得出,正常水分条件下,施硅增加了肥皂草叶片SOD、POD活性,但增加水平远远低于干旱条件下施硅,而施硅对肥皂草的GSH、ASA、MDA、CAT和相对电导率影响不大,这可能与肥皂草受氧化胁迫程度较低有关。
综上分析得出,干旱条件下Si3、Si4处理较Si1、Si2处理更能有效提高肥皂草叶片保护酶活性和稳定抗氧化剂含量,进而降低MDA和膜透性,T3条件下施硅较T2条件下施硅对肥皂草叶片保护酶提高的百分数更大,这也可能因为T3所参照的CK受干旱影响大、测得值太低。总之,硅增强肥皂草抗旱性与干旱程度和施硅量有关,每kg干土施硅0.3~0.4 g能有效缓解干旱对肥皂草的损害,这为硅肥在园林观赏植物中的应用提供了一定可能性。同时,关于硅是否参与与植物抗旱性密切相关的渗透调节和硅对肥皂草干旱下开花习性的影响还需进行深入研究,从而进一步揭示硅对肥皂草抗旱作用机制。
4 结论
本试验通过对肥皂草施加外源硅并模拟干旱胁迫,得出随着硅浓度的增加,肥皂草抗旱性逐渐增强并趋于平稳,其中Si3、Si4处理在T3条件的一定时期内使3种酶活性比CK提高30%以上。施硅量控制在每kg干土0.3~0.4 g SiO2均能有效提高干旱胁迫下肥皂草叶片保护酶活性,从而使抗氧化剂含量居于较稳定水平,缓解膜脂过氧化产物的增加并减缓细胞膜的破坏,保护肥皂草正常生理机能不被破坏,同时正常水分下施硅也对肥皂草叶片保护酶活性产生了一定提高作用。
References:
[1] Epstein E. Silicon. Plant Biology, 1999, 50(50): 641-664.
[2] Gao D, Chen J N, Cai K Z,etal. Distribution and absorption of silicon in plant and its role in plant disease resistance under environmental stress. Acta Ecologica Sinica, 2010, 30(10): 2745-2755.
高丹, 陈基宁, 蔡昆争, 等. 硅在植物体内的分布和吸收及其在病害逆境胁迫中的抗性作用. 生态学报, 2010, 30(10): 2745-2755.
[3] Liu A R, Zhang Y B, Tan Z J,etal. Effect of drought stress using PEG-6000 on the growth and osmotic ofSedumlineate. Acta Prataculturae Sinica, 2012, 21(3): 156-162.
刘爱荣, 张远兵, 谭志静, 等. 模拟干旱对佛甲草生长和渗透调节物质积累的影响. 草业学报, 2012, 21(3): 156-162.
[4] Zhang J Z, Zhang Q Y, Sun G F,etal. Effect of drought stress and re-watering on growth and photosynthesis ofHosta. Acta Prataculturae Sinica, 2014, 23(1): 167-176.
张金政, 张起源, 孙国峰, 等. 干旱胁迫及复水对玉簪生长和光合作用的影响. 草业学报, 2014, 23(1): 167-176.
[5] Reddy A R, Chaitanya K V, Vivekanandan M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, 161(11): 1189-202.
[6] Iaki Iturbe-Ormaetxe, Pedro R. Escuredo, Cesar Arrese-Igor,etal. Oxidative damage in pea plants exposed to water deficit or paraquat. Plant Physiology, 1998, 116(1): 173-181.
[7] Wang S Y, Li Z X, Bai H L,etal. Effects and mechanisms of silicon on drought resistance of Kentucky bluegrass. Pratacultural Science, 2008, 25(2): 116-120.
王生银, 李泽西, 白贺兰, 等. 硅肥提高草地早熟禾抗旱性的效应及机制. 草业科学, 2008, 25(2): 116-120.
[8] Chen H, Wang J J, Ren J H,etal. Effects of silicon fertilizer treatment on buckwheat seedlings drought resistance. Chinese Agricultural Science Bulletin, 2015, 31(12): 40-44.
陈花, 王建军, 任建宏, 等. 硅肥处理对荞麦幼苗抗旱性的影响. 中国农学通报, 2015, 31(12): 40-44.
[9] Chen W, Cai K Z, Chen J N. Effects of silicon application and drought stress on photosynthetic traits and mineral nutrient absorption of rice leaves. Acta Ecologica Sinica, 2012, 32(8): 2620-2628.
陈伟, 蔡昆争, 陈基宁. 硅和干旱胁迫对水稻叶片光合特性和矿质养分吸收的影响. 生态学报, 2012, 32(8): 2620-2628.
[10] Liu H X, Wang K Y, Guo X H. Effect of addition of silicon on seed emergence and growth of tall fescue (Festucaarundinacea) under the different soil moistures. Acta Prataculturae Sinica, 2012, 21(1): 199-205.
刘慧霞, 王康英, 郭兴华. 不同土壤水分条件下硅对坪用高羊茅种子出苗及生物学特性的影响. 草业学报, 2012, 21(1): 199-205.
[11] Wang C L, Bian Q, Li T T,etal. Effects of exogenous silicon on soapwort seed germination and the growth of seedlings under NaCl stress. Journal of Northeast Forestry University, 2016, (11): 41-44.
王财丽, 边琦, 李婷婷, 等. 外源Si对NaCl胁迫下肥皂草种子萌发及幼苗生长的影响. 东北林业大学学报, 2016, (11): 41-44.
[12] Yan J X, Yang H Y, Deng Y N,etal. Effects of silicon on photosynthetic traits ofSaponariaofficinalisunder drought stress. Pratacultural Science, 2016, 33(10): 2082-2092.
严俊鑫, 杨慧颖, 邓雅楠, 等. 干旱胁迫下硅对肥皂草光合特性的影响. 草业科学, 2016, 33(10): 2082-2092.
[13] Wang X K, Huang J L. Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2015: 131-133.
王学奎, 黄见良. 植物生理生化实验原理和技术[M]. 第3版. 北京: 高等教育出版社, 2015: 131-133.
[14] Yan J X, Xu L X, Yu J,etal. Effects of MeJA on the insect-resistant physiological indexes of Rosa rugose ‘Plena’ and the feeding ofMonoleptahieroglyphica. Journal of Northeast Forestry University, 2017, (1): 77-81.
严俊鑫, 许凌欣, 宇佳, 等. 茉莉酸甲酯对重瓣玫瑰抗虫生理指标和双斑萤叶甲取食的影响. 东北林业大学学报, 2017, (1): 77-81.
[15] Li H S. Plant Physiological Biochemical Experiment Principle and Technology[M]. Beijing: Higher Education Press, 2000.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[16] Hodges D M, Andrews C J, Johnson D A,etal. Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines. Physiologia Plantarum, 1996, 98(4): 685-692.
[17] Griffith O W. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine. Analytical Biochemistry, 1980, 106(1): 207-212.
[18] Wang Z. Plant Physiology[M]. Beijing: China Agriculture Press, 2010: 422-439.
王忠. 植物生理学[M]. 北京: 中国农业出版社, 2010: 422-439.
[19] Ramachandra R A, Chaitanya K V, Vivekanandan M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, 161(11): 1189-1202.
[20] Foyer C H, Noctor G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context. Plant Cell & Environment, 2005, 28(8): 1056-1071.
[21] Zhang R H, Zheng Y J, Ma G S,etal. Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding. Acta Ecologica Sinica, 2011, 31(5): 1303-1311.
张仁和, 郑友军, 马国胜, 等. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响. 生态学报, 2011, 31(5): 1303-1311.
[22] Hu Z J, Feng X L, Wu C B,etal. Effects of abscisic acid and 6-Benzylaminopurine on the drought resistance ofVetiveriazizanioides. Acta Agrestia Sinica, 2015, 23(6): 1220-1225.
胡志群, 冯学兰, 吴楚彬, 等. 脱落酸和细胞分裂素对香根草抗旱性的影响. 草地学报, 2015, 23(6): 1220-1225.
[23] Ji Y, Zhang X Q, Peng Y,etal. Effects of drought stress on lipid peroxidation, osmotic adjustment and activities of protective enzymes in the roots and leaves of prchardgrass. Acta Prataculturae Sinica, 2014, 23(3): 144-151.
季杨, 张新全, 彭燕, 等. 干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响. 草业学报, 2014, 23(3): 144-151.
[24] Shan C J, Han R L, Liang Z S. Responses to drought stress of the biosynthetic and recycling metabolism of glutathione and ascorbate inAgropyroncristatumleaves on the Loess Plateau of China. Chinese Journal of Plant Ecology, 2011, 35(6): 653-662.
单长卷, 韩蕊莲, 梁宗锁. 黄土高原冰草叶片抗坏血酸和谷胱甘肽合成及循环代谢对干旱胁迫的生理响应. 植物生态学报, 2011, 35(6): 653-662.
[25] Zhou X J, Zhao H B, Ma C C. Studies on silicon increased drought resistance of cucumber seedlings. Chinese Agricultural Science Bulletin, 2010, 26(9): 195-197.
周秀杰, 赵红波, 马成仓. 硅提高黄瓜幼苗抗旱性的研究. 中国农学通报, 2010, 26(9): 195-197.
[26] Li Q F, Ma C C, Shang Q L. Effects of silicon on photosynthesis and antoxidative enzymes of maize under drought stress. Chinese Journal of Applied Ecology, 2007, 18(3): 531-536.
李清芳, 马成仓, 尚启亮. 干旱胁迫下硅对玉米光合作用和保护酶的影响. 应用生态学报, 2007, 18(3): 531-536.
[27] Ming D F, Yuan H M, Wang Y H,etal. Effects of silicon on the physiological and biochemical characteristics of roots of rice seedlings under water stress. Scientia Agricultura Sinica, 2012, 45(12): 2510-2519.
明东风, 袁红梅, 王玉海, 等. 水分胁迫下硅对水稻苗期根系生理生化性状的影响. 中国农业科学, 2012, 45(12): 2510-2519.
[28] Ding Y F. Mechanisms of Silicon-Enhancement of Drought Tolerance in Wheat Seedings[D]. Nanjing: Nanjing Agricultural University, 2006.
丁燕芳. 硅提高小麦抗旱性的机理研究[D]. 南京: 南京农业大学, 2006.
EffectsofsiliconontheantioxidantsystemandmembranestabilityofSaponariaofficinalisunderdroughtstress
YANG Hui-Ying1,2, DENG Ya-Nan2, XU Ling-Xin2, YAN Jun-Xin1,2*
1.KeyLaboratoryofSaline-alkaliVegetationEcologyRestorationinOilField,MinistryofEducation,NortheastForestryUniversity,Harbin150040,China; 2.TheCollegeofLandscape,NortheastForestryUniversity,Harbin150040,China
The aim of this study was to determine the effect of silicon on the antioxidant system and membrane stability ofSaponariaofficinalisunder drought stress. Silicon was added to soil at four concentrations (0.1, 0.2, 0.3, 0.4 g/kg SiO2) and the soil moisture content was adjusted to impose normal conditions, mild drought stress, and severe drought stress onS.officinalis. The protective enzyme activity, antioxidant content, malondialdehyde (MDA) content, and relative electrical conductivity of the leaves ofS.officinaliswere determined. The results showed that with increasing severity and longer duration of drought stress, the activities of superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT), and the contents of reduced glutathione (GSH) and ASA (ascorbic acid) in the leaves ofS.officinalisfirst increased and then decreased, and the MDA content and relative electric conductivity increased. Compared with the control, the treatments with silicon added to soil showed higher activities of SOD, POD, CAT (>30% higher) under drought stress, and lower MDA content and relative electrical conductivity (>25% lower), resulting in more stable GSH and ASA contents. These results indicated that silicon can effectively alleviate damage toS.officinaliscell membranes under drought stress by improving the performance of the antioxidant system. As the concentration of silicon increased, the drought resistance ofS.officinalisincreased gradually and then stabilized. The optimal concentration of SiO2in soil was 0.3-0.4 g/kg.
silicon; drought stress; protective enzyme; antioxidant system; the cell membrane
10.11686/cyxb2016486http//cyxb.lzu.edu.cn
杨慧颖, 邓雅楠, 许凌欣, 严俊鑫. 干旱胁迫下硅对肥皂草抗氧化系统及膜质稳定性的影响. 草业学报, 2017, 26(10): 77-86.
YANG Hui-Ying, DENG Ya-Nan, XU Ling-Xin, YAN Jun-Xin. Effects of silicon on the antioxidant system and membrane stability ofSaponariaofficinalisunder drought stress. Acta Prataculturae Sinica, 2017, 26(10): 77-86.
2016-12-26;改回日期:2017-03-22
东北油田盐碱植被恢复与重建教育部重点实验室(东北林业大学)开放基金(SAVER1609)和中央高校基本科研业务费专项基金(2572016CA11) 资助。
杨慧颖(1992-),女,河北秦皇岛人,硕士。E-mail:ylzwyhy@163.com
*通信作者Corresponding author. E-mail:yanjunxin@163.com

