壳聚糖/海藻酸钠/活性肽复合膜的制备与性能研究*
李楚燕,程 瑜,胡 章,杨 萍,廖铭能,李思东
(广东海洋大学 化学与环境学院 应用化学系,广东 湛江 524088)
壳聚糖/海藻酸钠/活性肽复合膜的制备与性能研究*
李楚燕,程 瑜,胡 章*,杨 萍,廖铭能,李思东*
(广东海洋大学 化学与环境学院 应用化学系,广东 湛江 524088)
以壳聚糖和海藻酸钠高分子为基质原料,采用层层自组装技术形成聚电解质复合多层膜,并包裹深海鱼蛋白活性肽,考察复合膜的厚度、溶胀度、透气性、抗拉伸强度、累积释放度等基本性能。结果表明,制备复合膜的最佳条件为壳聚糖(分子量50kDa)与海藻酸钠的质量分数比2∶1。在此条件下,制备复合膜层数为7层时,其厚度为0.041mm、透气性63.96%、溶胀度为179.92%,断裂拉伸率为12.45%,3h累计释放度为11.58%,显示出优越的生物医用膜性能,这将为开发一种新型的生物创伤医用膜提供参考。
壳聚糖;海藻酸钠;活性肽;层层组装技术;创伤修复
皮肤损伤是日常生活常见的问题,如今市面上存在的外用性创伤医疗用品,基本是以化学物质为主要的有效成分,添加到医用胶布上。长时间使用会造成伤口不透气,使用不当容易导致伤口发炎,且防菌效果不佳,吸水性能较差,使皮肤处于浸泡状态,伤口愈合缓慢,更有甚者减慢了原有的愈合速度。
壳聚糖(chitosan)亦被称为壳多糖、脱乙酰甲壳素,是天然糖中唯一大量存在的碱性氨基多糖。壳聚糖具有优秀的生物相容性、无免疫原性、可生物降解和广谱抗菌性等特点,应用于食品、医药、化妆品、功能材料等领域。目前,被公认是一种非常具有发展潜力的天然高分子材料[1-3]。壳聚糖在医用敷料方面的应用研究成绩卓著,已被广泛用于人造工程皮肤、可吸收的术后缝线、药物载体等方面[4,5]。与其他抑制剂相比,壳聚糖具有抗菌谱广、抑制活性高、杀灭率高的优点[6],因而能更加有效地抑制细菌的繁殖和生长。
海藻酸钠一种来源海洋褐藻的天然高分子材料,安全无毒,温和无刺激,其溶解性、粘性、稳定性等性能优良,广泛用于药物制剂、化妆品及食品等领域[7]。
生物活性肽是指来源于生物体且对生命活动有益或具有促进生理作用的功能肽化合物。研究表明,水产蛋白肽具有生物相容性、低免疫性原性和可降解性,以及来源丰富等优点,已经广泛运用于医学等领域[8]。
本研究以壳聚糖和海藻酸钠大分子为基质原料,采用层层自组装技术形成聚电解质复合多层膜,并包裹深海鱼胶原蛋白肽,制备得到壳聚糖/海藻酸钠/活性肽生物复合膜,通过对复合膜的厚度、溶胀度、透气性、抗拉伸强度等性能检测,优化制备复合膜的操作参数,探讨制备高性能复合膜的最优工艺条件,以期为开发一种新型创伤生物医用膜提供参考。
1 实验部分
1.1 试剂、材料与仪器
海水罗非鱼(湛江东风水产市场);壳聚糖(CS)(分子量5万Da,脱乙酰度≥95%,萨恩化学技术(上海)有限公司);海藻酸钠(AR天津市科密欧化学试剂开发中心);冰乙酸、聚乙二醇400等试剂均为分析纯。
紫外分光光度计UV2800(上海舜宇恒平科学仪器有限公司);索尼数码照相机(W800,索尼(中国)有限公司)。
1.2 鱼肉蛋白肽的制备
取一定量的罗非鱼肉,按料液比为1∶2.5(g/V)的比例加入水,将混合物加热,至50℃时加入中性蛋白酶和木瓜蛋白酶,酶解5h后,升温至100℃灭活10min,冷却,离心,清液经50nm陶瓷膜微滤,得滤液,减压浓缩,喷雾干燥制成粉状。
1.3 壳聚糖/海藻酸钠/活性肽复合膜的制备[9]
壳聚糖膜液 称取壳聚糖2g和鱼蛋白肽1g溶于0.5%冰乙酸水溶液,加入0.25%聚乙二醇400,50℃水浴加热并磁力搅拌至壳聚糖完全溶解,静置脱气。
海藻酸钠膜液 称取海藻酸钠1g和深海鱼肽1g,溶于蒸馏水中,加入0.25%聚乙二醇400,磁力搅拌至海藻酸钠完全溶解,静置脱气。
凝固液 室温下,将5g无水硫酸钠置于烧杯中,加入100mL蒸馏水,搅拌均匀,再加入3gCaCl2,搅拌均匀后把沉淀物过滤得到凝固液。
往洁净的培养皿中倒入一定量的壳聚糖溶液,流延均匀,反应30min后,用去离子水洗涤游离的壳聚糖分子,而后加入海藻酸钠溶液,30min后用去离子水洗涤,重复上述步骤,可制备一定层数的壳聚糖/海藻酸钠层层自组装多层膜,将膜置于真空干燥箱中55℃烘干后,置于凝固浴中交联30min,脱膜,晾干,薄膜保存在冰箱内待用。
1.4 壳聚糖/海藻酸钠/活性肽复合膜的表征
1.4.1 膜的厚度 制备的复合膜层数分为3层、5层、7层、9层,若壳聚糖有n层,则海藻酸钠为n-1层。各选取5张光滑、平整的缓释膜,用螺旋测微器分别测定膜的4个顶点和1个中心点,取平均值作为膜的厚度d(mm)。
1.4.2 透气率的测定 根据关丽[10]等的实验方法测定复合膜的透气性能,取4个洁净的称量瓶,加入无水CaCl2(2g)粉末,称重,其中3个瓶口用样品复合膜密封,另1个不封膜作对照,然后,把4个瓶都置入装有饱和食盐水的密闭容器中,24h后将瓶子取出,把复合膜取下,并再次称重,计算透气率。平行操作3次,计算平均值。公式如下:
透气率=样品瓶吸水量/对照瓶吸水量×100%
1.4.3 溶胀度 取膜2cm×3cm的小片,精确称量后放入生理盐水中,37℃的恒温水浴浸泡24h后取出,用滤纸小心吸干表面水分,称重。平行操作3次,取平均值。溶胀度(Swelling ratio,SR)的计算公式如下[11]:

式中 SR:溶胀度,%;ma和mb分别为膜溶胀前、后的质量,g。
1.4.4 抗拉伸强度和断裂伸长率的测定[12]将长为5cm,宽为1cm的薄膜以对折方式悬挂于玻璃棒上,上端1cm处用手握紧,下端夹挂可以加砝码的小托盘。连托盘质量一起为300g开始,每分钟放置小砝码50g,测量平衡后的膜长度并记录总重量。以复合膜断裂时的总重量为抗张强度,以断裂时的长度与原长度(1.5cm)的比值计算断裂伸长率。平行操作3次,取平均值。
1.4.5 活性肽累积释放度的测定 精密称取一定质量的活性肽,配成0.1mg·mL-1的标准溶液,于紫外可见分光光度计扫描200~400nm的吸光度,确定活性肽的最大吸收波长。在最大吸收波长下绘制活性肽的浓度与吸光度的标准曲线。
取药膜3片,分别投入3个烧杯中。在0.5、1、1.5、2、3h时分别精密取样2mL,同时向烧杯中补加缓冲溶液2mL。取出的2mL放于10mL容量瓶中,加蒸馏水定容至刻度,摇匀。取空白膜,同法操作作为对照,紫外分光光度标准曲线法求出溶液中活性肽的浓度,根据如下公式分别计算活性肽的体外累计释放度(Cumulative release percentage,CRP)[13]。

式中 CRP%:累计释放百分率;Cj:第 j时刻缓冲溶液中药物的浓度,μg·mL-1;V总:释放体系缓冲溶液总体积,100mL-1;Ci:第 i时刻缓冲溶液中药物的浓度,μg·mL-1;V取:每次从释放体系中取出的体积。
2 结果与讨论
2.1 复合膜的外观形态
所制备复合膜呈圆形,质地均匀,表面光滑,透明,柔韧性比较好,见图1。
图1 复合膜的外观形态Fig.1 Appearance of the composite film
2.2 复合膜的厚度和透气率
制备的复合膜层数分为3层、5层、7层、9层,不同层数复合膜的厚度和透气率见表1。
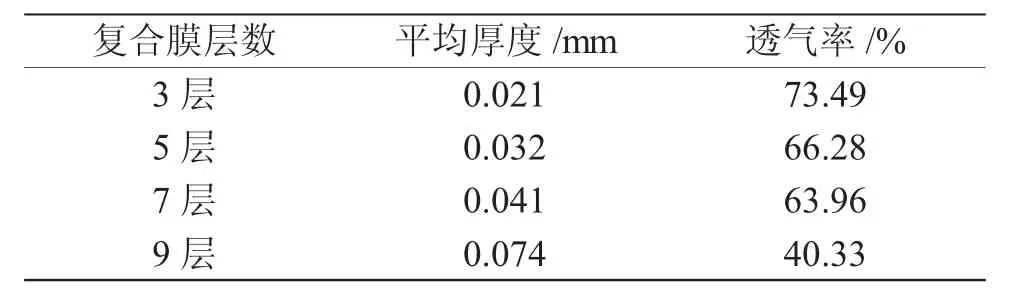
表1 不同层数复合膜的厚度和透气率Tab.1 Thickness and permeability of the composite filmswith different layers
膜的层数越多,其平均厚度越厚,但并非呈线性关系,当膜由7层增加到9层时,厚度急剧增加。膜的透气率与平均厚度呈反比例关系,当膜由7层增加至9层时,透气率急剧降低。由此可见,复合膜7层时对透气率有着重要的转折作用。皮肤需要呼吸,作为生物医用膜材料,创伤膜贴在皮肤表面,应具备一定的透气性能,有助于创面的正常有氧呼吸和新陈代谢,促进组织的修复和伤口的愈合[14]。而7层复合膜透气性达63.96%、透气性相对较好。
2.3 复合膜的溶胀度和抗拉伸性能
复合膜的溶胀度和断裂拉伸率结果见图2。
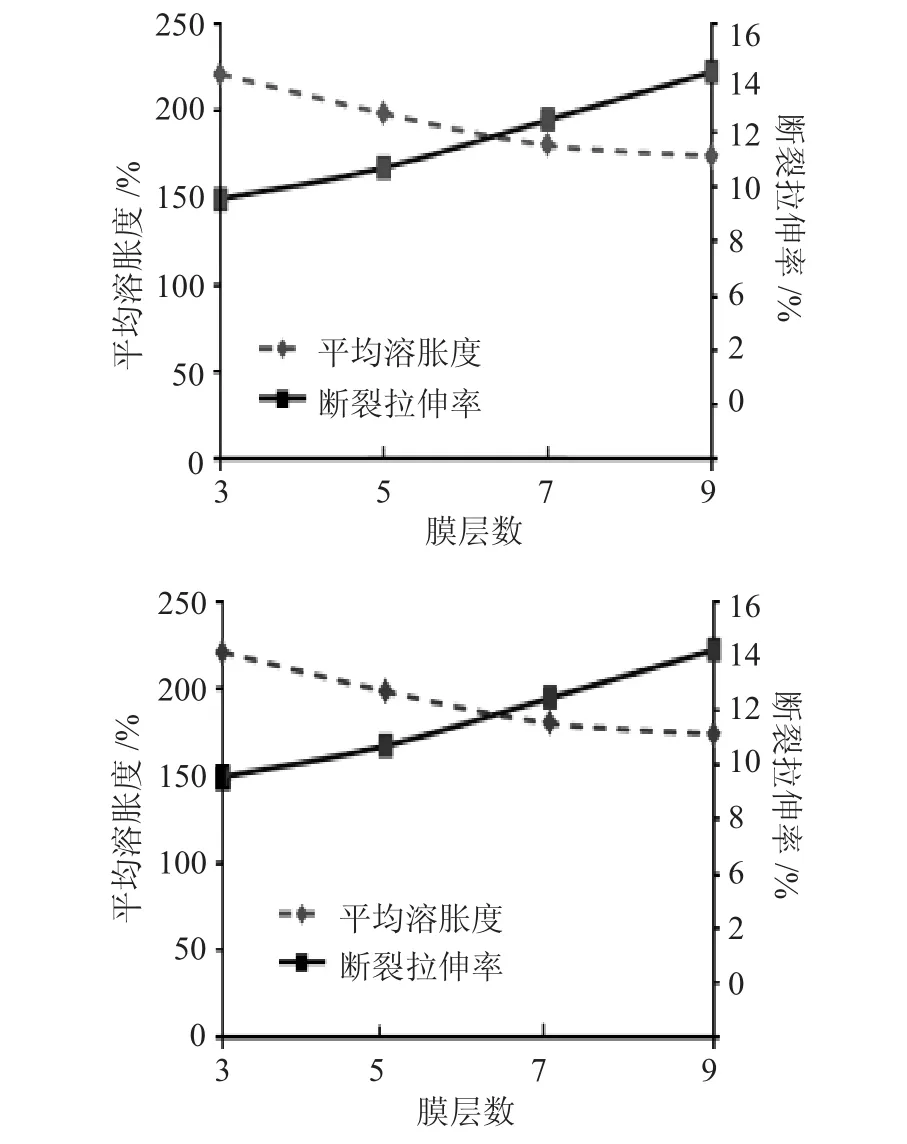
图2 不同层数复合膜的溶胀度和抗拉伸强度Fig.2 Swelling ratio and tensile rate of the composite films with different layers
由图2可知,复合膜溶胀度随着膜的增厚呈降低趋势;而复合膜的抗拉伸性能则正好相反。通过比较,7层壳聚糖/海藻酸钠复合膜各项基本性能更优,其厚度平均值为0.041mm,膜轻薄的外形在临床上可以给与使用者更舒适的感觉。7层复合膜因结构疏松,水分子容易通过,溶胀度为179.92%,抗拉伸率为12.45%。
复合膜的抗拉伸性能取决与膜材料的交联程度。带有相反电荷的阳离子壳聚糖大分子与阴离子海藻酸钠大分子通过静电吸引力相互作用,并且在含有-SO42-和Ca2+凝固浴里,未参与反应的壳聚糖、海藻酸钠分子分别与-SO42-、Ca2+反应30min,使复合膜呈现出交联程度极高、纳米线性交错的牢固结构,科学上称之为“蛋盒结构”。但是过度交联会使膜变脆,力学性能降低,这是由于过度交联使壳聚糖/海藻酸钠间分子作用力受到破坏,影响分子链的紧密排列,降低膜的抗拉强度。
2.4 复合膜的体外释放度
复合膜中鱼蛋白活性肽的释放曲线见图3。

图3 复合膜中活性肽累计释放曲线Fig.3 Curves of the active peptides released from the composite films
从曲线中切线的斜率可以判断出不同层数复合膜中活性肽在溶液中释放速度是先快后慢,0.5h内释放最快。复合膜表层的活性肽最先透过壳聚糖层释放,内部的则透过扩散作用慢慢释放出来。数据表明,复合膜层数越多其缓释期越长,缓释性能越好,由于复合膜层数越多载药量就越高,活性肽被不同程度的裹在海藻酸钠层,交联后复合膜中高分子链空间缩小,越靠近复合膜中心的活性肽就越难释放。据文献报道,药物缓释最长可达180h[15]。复合膜3、5、7和9层中活性肽3h累计释放度分别为14.21%、12.05%、11.58%和6.46%,复合膜中活性肽的累计释放度从3层到7层差异性不是很明显,而7层与9层的累计释放度出现较大的转折。由此可见,复合膜7层表现出合适的累计释放性能。
3 结论
利用层层自组装技术制备的壳聚糖/海藻酸盐复合膜外观透明光滑,轻薄柔韧,操作条件简单,成本要求低。本文采用壳聚糖(分子量50kDa)与海藻酸钠的质量分数比2∶1,在55℃条件下干燥,成膜后用含有-SO42-和Ca2+的凝固浴浸泡交联30min,所制备的复合膜透气性、溶胀度、抗拉伸能力基本符合临床上创伤膜的要求。通过比较,7层复合膜具有更加良好的基本性能,其机械强度、透气保湿能力、稳定的药物释放能力,在作为新型生物医用敷料方面有可观的探究价值和使用价值。
[1] 蒋挺大.壳聚糖(第二版)[M].北京:化学工业出版社,2006.
[2] 袁丹波.壳聚糖抗菌生物医用膜在烧伤创面中的临床应用[J].微生物学免疫学进展,2012,40(1):35-37.
[3] Rinaudo M.Chitin and chitosan:Properties and applications[J].Progress in Polymer Science,2006,31:603-632.
[4] Ravi Kumar M.N.V.,Muzzarelli R.A.A.,Muzzarelli C.,et al.Chitosan Chemistry and pharmaceutical perspectives[J].Chemical Review,2004,104:6017-6084.
[5] 马建标,王红军,何炳林.壳聚糖与胶原或海藻酸复合物海绵的制备以及人胎儿皮肤成纤维细胞在其中的生长[J].自然科学进展,2000,10(10):896-903.
[6] 绍荣,许琦,余晓红,等.壳聚糖抗菌性能的研究[J].食品科学,2007,28(9):121-124.
[7] 张莉华,李科,卜方方.海藻酸钠在药物制剂中的应用进展[J].中南药学,2016,14(1):52-56.
[8] 曾丽,李丽,王加斌,等.水产胶原蛋白肽功能活性及其制备工艺研究进展[J].浙江海洋学院学报,2013,32(2):163-168.
[9] 汪东风,高美玲,杨伟,等.一种具有抗菌功能的海洋多糖多层复合包装膜[P].CN:201010577744.1,2010.
[10] 关丽,黄国程,杨宝芸,等.壳聚糖复合膜剂的制备及性能研究[J].海峡药学,2014,26(1):25-28.
[11] 徐海星,闫玉华,万涛.壳聚糖-聚丙烯酸双层膜的制备与表征[J].武汉理工大学学报,2007,29(10):51-54.
[12] 吕慧英,刘建芳,侯艳宁.正交设计法优化创伤涂膜剂的成膜溶液[J].解放军医药杂志,2012,24(2):30-32.
[13] 廉波,傅桂芹,郑炜.壳聚糖膜的制备及表征[J].牡丹江师范学院学报,2005,(4):21-23.
[14] 王军.组织工程化皮肤支架与创面敷料的研究[D].东南大学硕士学位论文,2004.
[15] 涂依.壳聚糖/壳聚糖衍生物复合膜的制备及性能研究[D].武汉大学硕士学位论文,2005.
Research on the preparation and properties of chitosan-alginate-activated-peptide com posite film s*
LIChu-yan,CHENG Yu,HU Zhang*,YANG Ping,LIAOMing-neng,LISi-dong*
(Department of Applied Chemistry,College of Chemistry and Environment,Guangdong Ocean University,Zhanjiang 524088,China)
In order to prepare chitosan alginate-peptide composite films from chitosan and alginate,polyelectrolytemultilayer compositemembraneswere formed by layer-by-layer self-assembly technique and the fish protein peptideswere packed.Basic properties of the compositemembranes including thickness,degree of swelling,permeability,tensile strength and the accumulative release percentage were detected.The results showed that the optimum conditionswere as follows:themass ratio of chitosan (molecularweight50kDa)and sodium alginate 2∶1 and 7layers of the films.Under the conditions,the composite filmswere prepared with thickness 0.041mm,swelling ratio 179.92%,permeability 63.96%,tensile rate 12.45%and the accumulative release percentage 11.58%.It will provide the references for developing a novel trauma biomedicalmembrane.
chitosan;alginate;activated peptide;layer-by-layer self-assembly technique;wound healing
S667.1
A
10.16247/j.cnki.23-1171/tq.20170409
2017-02-18
广东省自然科学基金(2016A030308009);广东海洋大学“创新强校工程”项目(2015KTSCX053,GDOU2013050221)
李楚燕(1993-),女,广东人,本科学士,助理工程师,研究方向为制药工程。

