含砷中药复方青黄散安全有效治疗骨髓增生异常综合征方法研究
邓中阳++方苏++王洪志++郭小青++杨秀鹏++麻柔++许勇钢++杨晓红++赵攀++王明镜++伊博文++尚晓泓++胡晓梅
摘要:目的 建立含砷中药复方青黄散安全有效治疗骨髓增生异常综合征(MDS)的应用方法。方法 纳入MDS患者200例,予复方青黄散治疗。治疗1个月时,血砷浓度<20 ?g/L者60例,随机分为对照组和试验组各30例。对照组治疗方案不变;试验组增加雄黄剂量,每月测定1次血砷浓度,每次增加雄黄剂量0.1 g,至血砷浓度≥20 ?g/L、雄黄最大剂量≤0.3 g/d。观察2组血砷浓度、临床疗效及安全性。结果 最終2组纳入评价者各24例。与对照组比较,试验组治疗后血砷浓度明显升高(P<0.05)。对照组治疗后血液学进步率为29.2%(7/24),试验组为54.2%(13/24),试验组明显高于对照组(P<0.05)。试验组治疗后中性粒细胞、血红蛋白及血小板与治疗前比较明显升高(P<0.05)。消化道不良反应2组比较差异无统计学意义(P>0.05)。2组肝、肾功能无损害。结论 应用复方青黄散治疗MDS可根据血砷浓度调整雄黄剂量,以提高有效血砷浓度,增强疗效,且不增加临床毒副反应。
关键词:骨髓增生异常综合征;雄黄;砷;安全性
DOI:10.3969/j.issn.1005-5304.2017.10.006
中图分类号:R259.513 文献标识码:A 文章编号:1005-5304(2017)10-0022-05
Study on Safe and Effective Clinical Methods for Arsenic-containing Compound Qinghuang Powder in Treatment of Myelodysplastic Syndrome DENG Zhong-yang, FANG Su, WANG Hong-zhi, GUO Xiao-qing, YANG Xiu-peng, MA Rou, XU Yong-gang, YANG Xiao-hong, ZHAO Pan, WANG Ming-jing, YI Bo-wen, SHANG Xiao-hong, HU Xiao-mei (Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China)
Abstract: Objective To search for application ways for the safe and effective clinical methods of arsenic-containing Compound Qinghuang Powder (Compound QHP) for the treatment of myelodysplastic syndrome (MDS). Methods Totally 200 patients with MDS were included in the study and treated with Compound QHP. After one-month treatment, the 60 patients with the blood arsenic concentrations <20 ?g/L were randomly divided into control group and treatment group, with 30 cases in each group. Control group was given stable treatment, while the treatment group was given increased dose of realgar; blood arsenic concentration was detected monthly; realgar 0.1 g was increased each time until blood arsenic concentrations ≥20 ?g/L and realgar ≤0.3 g/d. The blood arsenic concentration, clinical efficacy and safety in the two groups were observed. Results Totally 24 cases in each group were included for evaluation finally. The average blood arsenic concentration of treatment group was significantly higher than those of control group (P<0.05). The rate of hematologic improvement was significantly higher in treatment group (54.2%, 13/24) than that in control group (29.2%, 7/24) , with significant difference (P<0.05). The Hb, ANC, and PLT significantly increased in treatment group after treatment (P<0.05). There was no significant difference of incidence rate of adverse reaction observed between treatment group and control group (P>0.05). Conclusion In application of Compound QHP, the blood arsenic concentration can be monitored to adjust the dailyendprint
基金项目:国家自然科学基金(81673821);中央级公益性科研院所基本科研业务费专项(ZZ10-016);北京市科委重点项目(Z141100006014003)
通讯作者:胡晓梅,E-mail:huxiaomei_2@163.com
dose of realgar, thus to increase the effective blood arsenic concentration, and then improving efficacy without increasing the clinical toxicity.
Key words: myelodysplastic syndrome; realgar; arsenic; safety
骨髓增生異常综合征(myelodysplastic syndromes,MDS)是一组起源于造血干/祖细胞的获得性克隆性疾病,以骨髓无效造血、长期进行性难治性血细胞减少、高风险向急性白血病转化为特征[1]。本病临床表现为面色苍白、乏力、活动后心悸、气短等症状,或兼有出血、发热、脾大等体征,中医病名定为“髓毒劳”,其中“髓”代表病位,“毒”代表病性,“劳”代表病状[2]。
青黄散含青黛、雄黄,其中雄黄辛温有毒,属于砷制剂。我们既往研究表明,青黄散治疗MDS有效[3],但其疗效与体内血砷浓度有关,有效血砷浓度应在20 ?g/L以上[4]。部分患者服用青黄散后出现消化道不良反应,导致砷吸收减少,血砷浓度不足,影响疗效。复方青黄散是在青黄散基础上优化而成,可明显减少消化道不良反应,保证有效血砷浓度,提高疗效[5-6]。本研究旨在通过检测血砷浓度,对<20 ?g/L者通过调整雄黄用量以提高有效血砷浓度,建立复方青黄散治疗MDS安全有效的临床应用方法。
1 资料与方法
1.1 一般资料
纳入2015年3月-2016年12月本院门诊MDS患者200例。年龄18~72岁,平均(56.5±15.5)岁。本研究经本院临床研究伦理委员会批准并备案。
1.2 诊断标准
参照2007年维也纳关于MDS诊断标准[7],应符合2个必要条件和1个确定标准。必要条件:①持续一系或多系血细胞减少,包括血红蛋白(Hb)<110 g/L、中性粒细胞绝对计数(ANC)<1.5×109/L、血小板(PLT)<100×109/L;②血细胞减少和发育异常的造血及非造血系统疾患。确定标准:①发育异常,即骨髓涂片中红细胞系、粒细胞系、巨核细胞系中发育异常细胞的比例≥10%;②环状铁粒幼红细胞占有核红细胞比例≥15%;③骨髓涂片中原始细胞达5%~19%;④MDS常见染色体异常。辅助标准:①流式细胞术检查显示骨髓细胞表型异常,提示红细胞系和/或髓系存在单克隆细胞群;②遗传学分析提示存在明确的单克隆细胞群;③骨髓和/或外周血中祖细胞CFU(±集簇)形成显著和持久减少。
参照2008年WHO关于MDS分型标准[8]:①难治性贫血伴单系病态造血(RCUD)、难治性贫血(RA)、难治性中性粒细胞减少(RN)、难治性血小板减少(RT);②难治性贫血伴环状铁粒幼细胞(RARS);③难治性血细胞减少伴多系病态造血(RCMD);④难治性贫血伴原始细胞增多(RAEB-1);⑤难治性贫血伴原始细胞增多-2(RAEB-2);⑥MDS-未分类(MDS-U);⑦MDS伴单纯5q-。
参照2013年修订的MDS预后评分系统(IPSS-R)[9],将预后危度分为极低危、低危、中危、高危和极高危。
1.3 纳入标准
①符合上述诊断标准;②入组前2个月内未使用砷剂;③年龄18~75岁;④患者自愿参加本研究,并签署知情同意书。
1.4 排除标准
①合并严重心、肝、肾及周围神经病变者;②精神病患者;③妊娠或哺乳期妇女;④正在参加其他临床研究者。
1.5 治疗方法
所有患者均予复方青黄散:青黄散(雄黄0.1 g、青黛0.2 g,装胶囊),每日1粒,晚餐后服用;白芍6 g、白术3 g、防风3 g、陈皮3 g,配方颗粒,每日1剂,与青黄散胶囊同服。其中,52例患者使用司坦唑醇片6~8 mg/d 6个月以上无效,减为2~4 mg/d继续服用,26例曾使用司坦唑醇片已停药≥1个月。部分患者输注成分血支持治疗。治疗1个月时,测定血砷浓度。将血砷浓度<20 ?g/L者采用SAS软件随机程序按1︰1比例随机分为对照组和试验组。对照组治法同上;试验组增加雄黄剂量,每次增加雄黄0.1 g,每月测定1次血砷浓度,至血砷浓度≥20 ?g/L、雄黄最大剂量<0.3 g/d。共治疗6个月。
1.6 观察指标
1.6.1 血液学指标 治疗前后抽取患者静脉血1 mL,检测外周血细胞计数(ANC、Hb、PLT)。
1.6.2 遗传学 染色体核型分析,采取骨髓细胞短期(24 h)培养法,G-显带,根据《人类细胞遗传学国际命名体制(ISCN,2005)》[10]判定核型。
1.6.3 血砷浓度 取静脉血2 mL,测量时将冻存血消融,取0.5 mL加入1 mL硝酸、磁性转子1粒,应用CEM微波消解仪消解,定容后再根据原子荧光光谱仪PAS 10.055 Excalibur AFS说明书制作标准曲线,并通过Millennium 32软件分析血砷浓度。
1.6.4 安全性检测 ①不良反应:观察患者治疗期间出现的胃脘不适、恶心纳差、腹痛腹泻、肢体麻木、皮肤角化、浮肿等不良反应症状。参照《中药新药临床研究指导原则(试行)》[11]对毒副反应进行分级。轻度:受试者可以忍受,不影响继续治疗,无需处理,对受试者健康无明显影响;中度:受试者难以忍受,需停药或处理,对受试者健康有一定影响;重度:危及受试者生命,致残或致死,需要立即停药并及时处理。②脏器功能:检测用药前后肝、心、肾功能相关指标。endprint
1.7 疗效标准
参照2006年国际工作组疗效标准血液学进步的修订建议[12],将血液学进步和稳定评价为有效,进展或失败评价为无效。①血液学进步。红系反应:Hb升高≥15 g/L,红细胞输注单位减少,与治疗前8周输注单位数比较,每8周输注单位数减少≥4个。PLT反应:治疗前PLT>20×109/L的患者,PLT净增值≥30×109/L;由<20×109/L增高至>20×109/L,且至少增高100%。ANC反应:>100%增高和绝对值增高>0.5×109/L。②稳定:至少8周无疾病进展证据。
③进展或失败:治疗期间死亡或病情进展,患者表现为血细胞减少加重(ANC或PLT下降≥50%,Hb下降≥15 g/L,输血依赖)、骨髓原始细胞比例增高或进展为较治疗前更晚期的亚型。血液学进步率(%)=血液学进步例数÷总例数×100%。总有效率(%)=(血液学进步例数+稳定例数)÷总例数×100%。
1.8 统计学方法
采用GraphPad Prism 6进行统计分析。计量资料以—x±s表示,采用配对t检验或校正t检验。计数资料以百分率表示,采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 分组后一般资料
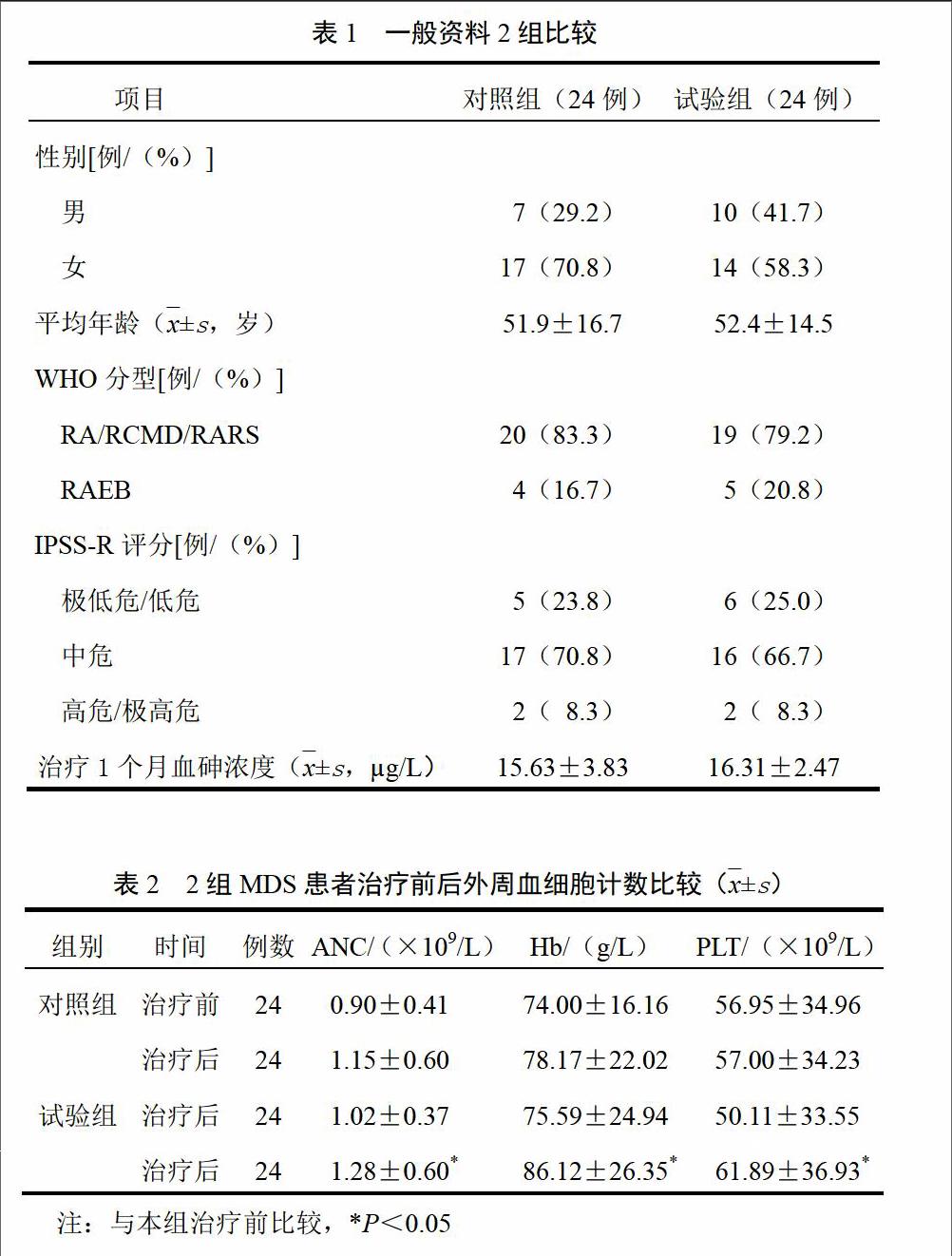
治疗1个月时,血砷浓度<20 ?g/L者60例,采用SAS软件随机程序,按1︰1随机分为对照组和试验组各30例。其中对照组4例、试验组5例患者因就诊不便转诊而脱落;对照組2例、试验组1例患者依从性差,未遵医嘱服药,未纳入分析。最后纳入评价者48例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
2.2 2组治疗前后血砷浓度比较
2组分组前(下称“治疗前”)血砷浓度比较差异无统计学意义(P>0.05),分组治疗后(下称“治疗后”),对照组血砷浓度为(21.39±3.49)?g/L,试验组(增加雄黄剂量至0.2 g/d)为(44.43±10.54)?g/L,试验组治疗后明显高于对照组(P<0.05)。
2.3 2组疗效比较
对照组治疗后血液学进步7例,稳定14例,进展或失败3例,血液学进步率29.2%,总有效率87.5%。试验组治疗后血液学进步13例,稳定8例,无效3例,血液学进步率54.2%,总有效率87.5%。治疗后试验组血液学进步率明显高于对照组(P<0.05)。
2.4 2组治疗前后外周血细胞计数比较
对照组治疗后ANC、Hb、PLT与治疗前比较差异无统计学意义(P>0.05),试验组治疗后Hb、ANC、PLT与治疗前比较明显提高(P<0.05),见表2。
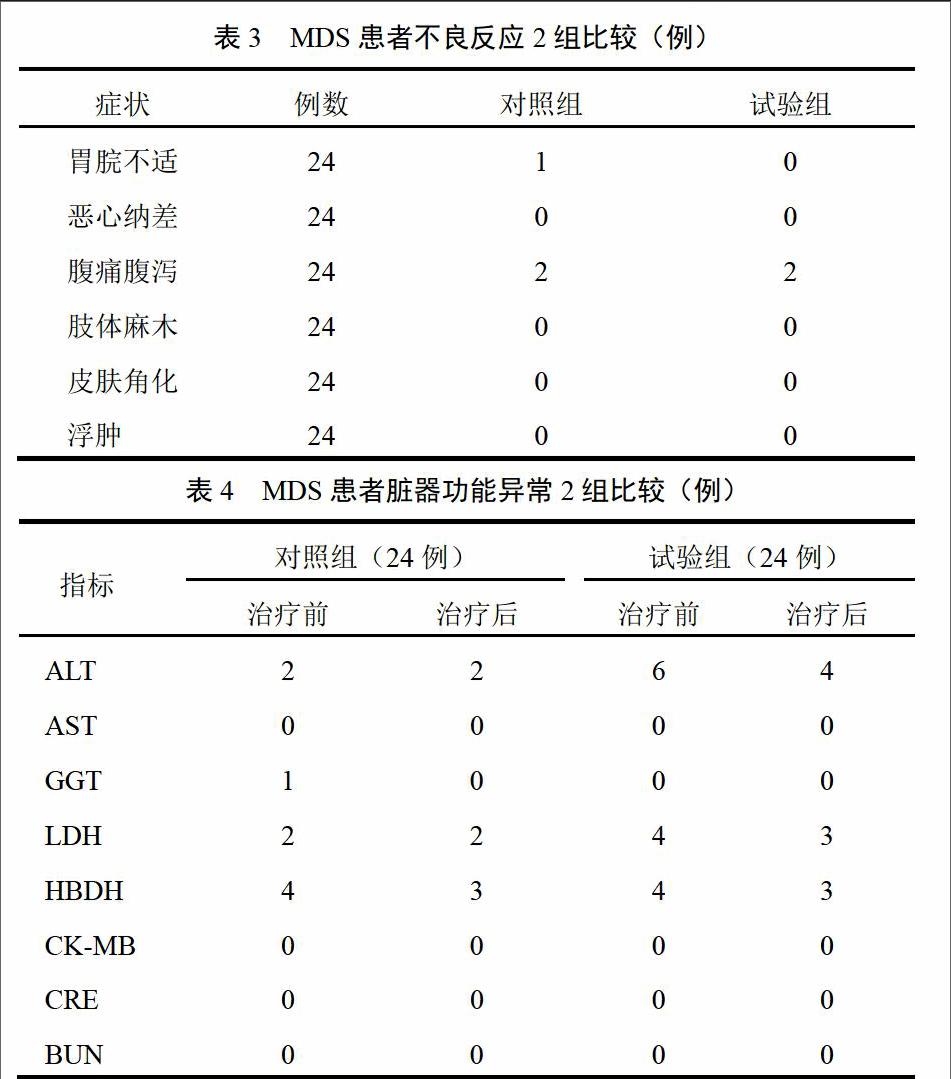
2.5 2组不良反应比较
2组治疗后发生腹痛腹泻等消化道不良反应各2例,对照组胃脘不适1例,见表3。均为轻度,患者未停药。
对照组入组时3例患者存在肝功能异常,包括丙氨酸氨基转移酶(ALT)升高2例、谷氨酰转肽酶(GGT)升高者1例。治疗后1例恢复正常,另外2例肝功能异常减轻,无新增肝功能异常病例。试验组入组时6例存在肝功能异常,均为ALT升高6例,治疗后2例恢复正常,另外4例患者肝功能异常明显减轻,无新增肝功能异常病例。对照组5例患者治疗前存在不同程度心肌酶增高,其中乳酸脱氢酶(LDH)升高者2例、羟丁酸脱氢酶(HBDH)升高者4例、肌酸激酶同工酶(CK-MB)升高者1例,治疗后1例恢复正常,4例心肌酶明显下降,无新增心肌酶增高病例。试验组4例治疗前存在心肌酶增高,其中LDH升高者4例、HBDH升高者4例,治疗2个疗程后1例恢复正常,3例明显减轻。入组时无肾功能异常病例,治疗后无新增肾功能异常病例。见表4。
3 讨论
含砷类中药主要包括砒霜和雄黄,砒霜的主要成分为三氧化二砷(As2O3),雄黄的主要成分为二硫化二砷(As2S2)。含砷中药的应用历史悠久 [13],在治疗MDS的研究中极为活跃[14-15],疗效较好,不良反应小,患者耐受性好,费用低廉。研究显示,口服雄黄制剂(包括单味和复方)治疗恶性血液病,雄黄(包括As4S4纯品)用量0.9 g/d以上,多数用量为3 g/d,毒副反应以消化道反应为主,血砷含量在20~110 ?g/L,而静脉使用As2O3注射液10 mg/d的血砷峰浓度高达900 ?g/L,未出现严重不良反应[15]。
青黄散是本院血液科在长期临床实践中应用的有效方药[3],由青黛和雄黄组成。雄黄辛温有毒,《中华人民共和国药典》对雄黄用量作了几次修改:1977年版规定雄黄的每日内服用量为0.3~1.0 g,1990年版改为0.15~0.3 g,1995年之后的版本均为0.05~0.1 g[16]。
我们既往研究发现,青黄散治疗MDS有良好疗效,但仍有部分患者无效,在治疗无效时常盲目增加青黄散剂量,而剂量增加导致毒副反应增加,尤其消化道不良反应[3]。我们进一步研究发现,青黄散治疗MDS疗效与体内血砷浓度有关,维持一定的血砷浓度是青黄散治疗MDS取得临床疗效的关键,部分患者出现腹痛腹泻等不良反应,影响肠道对砷的吸收,导致血砷浓度不足,疗效显著下降[4]。
复方青黄散是在青黄散基础上增加白芍、白术、防风、陈皮,旨在防治消化道不良反应,保障肠道对砷的吸收。我们前期研究显示,与青黄散相比,复方青黄散治疗MDS的消化道不良反应显著降低,疗效显著提高[5-6]。
我们既往研究表明,青黄散治疗起效的最低血砷浓度是20 ?g/L[4]。本研究将接受复方青黄散治疗后血砷浓度<20 ?g/L的患者随机分为2组,对照组维持雄黄剂量不变,试验组逐渐增加雄黄剂量至血砷浓度≥20 ?g/L,结果显示,试验组治疗后血砷浓度显著高于对照组(P<0.05),试验组血液学进步率显著高于对照组(P<0.05),提示有效血砷浓度是复方青黄散治疗有效的关键因素。虽然增加雄黄剂量后血砷浓度显著提高,但远低于文献中报道的使用其他砷剂的血砷浓度[12],临床也未发现不良反应的发生率或程度增加,提示口服雄黄0.2 g/d是安全的。复方青黄散的君药是雄黄,其活性成分As2S2对MDS/AML细胞具有诱导凋亡与促进分化作用,并呈剂量依赖性[17-20]。endprint
本研究还显示,复方青黄散治疗后虽然出现消化道轻度不良反应,但无需停药,提示患者可耐受复方青黄散的轻度不良反应。治疗前部分患者曾使用雄激素等造成肝功能损伤及长期贫血导致心肌酶升高,复方青黄散治疗后部分患者肝功能及心肌酶恢复正常,且未见新发脏器受损患者,亦未见肾功能异常病例。提示复方青黄散对心、肝、肾脏器功能无损害,与我们的前期研究结果一致[5-6]。
本研究通过监测血砷浓度,调整雄黄剂量,提高有效血砷浓度,可提高疗效,而不增加临床毒副反应,是复方青黄散治疗MDS安全有效的临床应用方法。
参考文献:
[1] 胡晓梅,唐旭东,麻柔,等.骨髓增生异常综合征发病机制的研究进展[J].国际输血及血液学杂志,2006,29(2):132-136.
[2] 陈信义,麻柔,李冬云.规范常见血液病中医病名建议[J].中国中西医结合杂志,2009,29(11):1040-1041.
[3] 胡晓梅,麻柔,许勇钢,等.青黄散在恶性血液病治疗中的应用[J].国际中医中药杂志,2011,33(6):568-570.
[4] 马俊丽,曲文闻,胡晓梅.含砷中药复方青黄散治疗骨髓增生异常综合征的克隆选择性与砷体内效应的相关性研究[J].中国中医药信息杂志,2013,20(6):8-10,22.
[5] 王月,方苏,宋敏敏,等.复方青黄散治疗骨髓增生异常综合征安全性分析[J].国际中医中药杂志,2014,37(12):1074-1077.
[6] 王月,方苏,邓中阳,等.复方青黄散治疗骨髓增生异常综合征疗效分析[J].国际中医中药杂志,2015,37(12):1091-1095.
[7] VANLET P, HORNY H P, BENNET J M, et al. Definitions and standards in the diagnosis and treatment of myelodysplatic snydromes: Consensus statements and report from a working conference[J]. Leuk Res,2007,31:727-736.
[8] SWERDLOW S H, CAMPO E, HARRIS N L, et al. WHO classification of tumours of haematopoietic and lymphoid tissues[M]. Lyon:IARC,2008:88-93.
[9] VOSO M T, FENU S, LATAGLIATA R, et al. Revised International Prognostic Scoring System (IPSS) predicts survival and leukemic evolution of myelodysplastic syndromes significantly better than IPSS and WHO Prognostic Scoring System:validation by the Gruppo Romano Mielodisplasie Italian Regional Database[J]. J Clin Oncol, 2013,31(21):2671-2677.
[10] SHAFFER L G,TOMMERUP N. An international system for human cytogenetic nomenclature (ISCN, 2005)[M]. Basel:S. Karger Publishers,2005.
[11] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:19-20.
[12] TEFFERI A, BAROSI G, MESA R A, et al. International Working Group (IWG) consensus criteria for treatment response in myelofibrosis with myeloid metaplasia: On behalf of the IWG for myelo fibrosis research and treatment (IWG-MRT) [J]. Blood,2006, 108(5):1497-1503.
[13] HU X M, LIU F, MA R. Application and assessment of Chinese arsenic drugs in treating malignant hematopathy in China[J]. Chin J Integr Med,2010,16(4):368-377.
[14] 马俊丽,曲文闻,胡晓梅.砷制剂在骨髓增生异常综合征治疗中的应用[J].中华临床医师杂志(电子版),2012,6(16):4819-4821.
[15] 马俊丽,胡晓梅.含砷类中药治疗恶性血液病药代动力学及代谢机制研究进展[J].国际中医中药杂志,2012,34(1):80-82.
[16] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:316.
[17] HU X M, TANAKA S, ONDA K, et al. Arsenic disulfide induced apoptosis and concurrently promoted erythroid differentiation in cytokine-dependent myelodysplastic syndrome-progressed leukemia cell line F-36p with complex karyotype including monosomy 7[J]. Chin J Integr Med,2014,20(5):387-393.
[18] HU X M, YUAN B, TANAKA S, et al. Involvement of oxidative stress associated with glutathione depletion and p38 mitogen-activated protein kinase activation in arsenic disulfide-induced differentiation in HL-60 cells[J]. Leuk Lymphoma,2014,55(2):392-404.
[19] HU X M, YUAN B, TANAKA S, et al. Arsenic disulfide-triggered apoptosis and erythroid differentiation in myelodysplastic syndrome and acute myeloid leukemia cell lines[J]. Hematology, 2014,19(6):352-360.
[20] HU X M, Y B, S M M, et al. Dose-dependent biphasic effects of arsenic disulfideon differentiation and apoptosis of HL-60 cells[J]. Current Topics in Pharmacology,2014,17(2):13-25.
(收稿日期:2017-02-27)
(修回日期:2017-03-19;編辑:季巍巍)endprint

