蓓蕾蓝靛果花色苷对乙醇诱导小鼠氧化损伤的保护作用
, , ,,,
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.黑龙江省科学院自然与生态研究所,黑龙江哈尔滨 150040;3.北华大学林学院,吉林吉林 132013)
蓓蕾蓝靛果花色苷对乙醇诱导小鼠氧化损伤的保护作用
周丽萍1,2,3,张悦2,王化2,李梦莎2,何丹娆2,杜凤国3,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.黑龙江省科学院自然与生态研究所,黑龙江哈尔滨 150040;3.北华大学林学院,吉林吉林 132013)
探讨蓓蕾蓝靛果(Loniceracaerulea‘Beilei’)花色苷对乙醇诱导小鼠氧化损伤的保护作用。方法:将小鼠按体重随机分为对照组、模型组、VC阳性对照组(20 mg/kg bw)、花色苷低剂量组(50 mg/kg bw)、花色苷中剂量组(100 mg/kg bw)和花色苷高剂量组(200 mg/kg bw),每天经口灌胃,灌胃容量为0.2 mL/10 g,对照组和模型组经口灌胃等体积的生理盐水。30 d后,除对照组外,其他实验组灌胃乙醇造成氧化损伤模型,检测血液和组织中的丙二醛(MDA)、蛋白质羰基(PC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)的含量。结果表明蓓蕾蓝靛果花色苷可以极显著(p<0.01)降低小鼠体内MDA和PC含量,极显著(p<0.01)提高体内SOD、GSH-PX抗氧化酶的活力和抗氧化物质GSH的含量。蓓蕾蓝靛果花色苷具有防护乙醇诱导小鼠氧化损伤的功能。
蓓蕾蓝靛果,花色苷,乙醇,氧化损伤
饮酒是现代生活的重要调和元素,但过量摄入或者低剂量长期摄入都会对身体造成伤害。乙醇代谢会产生大量自由基,机体抗氧化能力不足以应付自由基的积累,从而对机体造成氧化损伤。医学研究表明,氧化伤害是导致机体中各组织器官损伤、病变的重要原因之一,人类许多重大疾病如动脉粥样硬化、风湿性关节炎、糖尿病、癌症以及衰老过程均与自由基造成的氧化损伤有关。从植物中寻找高效、低毒、价廉的抗氧化剂成为研究的热点。研究表明,花色苷不但是天然的抗氧化剂,而且具有延缓衰老、降血脂、预防糖尿病、抗肿瘤[1-4]等多种功效。蓝靛果富含花色苷类物质,是天然抗氧化剂的良好原料。研究表明蓝靛果提取物对DPPH自由基的清除率达到85%,比番茄(平均为43%)、沙棘(74%)和VC(平均为51%)的清除率均要高[5],蓝靛果提取物的总抗氧化能力也高于笃斯越橘和红树莓[6],花色苷类物质是蓝靛果中主要的抗氧化活性物质[7]。
蓓蕾蓝靛果(Loniceracaerulea‘Beilei’)是从俄罗斯引进品种中优选出来的栽培蓝靛果品种。2011年4月通过黑龙江省农作物品种审定委员会审定,其各方面性状优于野生蓝靛果,尤其是花色苷含量是野生蓝靛果的2倍[8]。目前,蓓蕾蓝靛果在黑龙江省各地区已经大量推广栽培,而对其果实的相关功能的研究尚未见报导。为了评价蓓蕾蓝靛果花色苷的体内抗氧化活性,采用建立乙醇诱导氧化损伤小鼠模型,探讨蓓蕾蓝靛果花色苷对乙醇诱导小鼠氧化损伤的保护作用,为蓓蕾蓝靛果的综合开发利用及丰富天然植物源抗氧化剂原料奠定基础。
1 材料与方法
1.1材料与仪器
蓓蕾蓝靛果果实 由哈尔滨市塘坊浩北种植合作有限公司提供;实验动物 健康成年昆明种SPF级雄性小鼠[生产许可证号:SCXK(黑)2016-001、使用许可证号:SYXK(黑)2015-002]90只,体质量(25.0±2.0)g;丙二醛(MDA)、蛋白质羰基(PC)、超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和谷胱甘肽(GSH)检测试剂盒 南京建成生物工程研究所。
Uv-ViSEVO300紫外-可见分光光度计 Thermo公司;低温高速离心机 Thermo公司;洁净动物培养箱 东北林业大学植物药工程研究中心。
1.2实验方法
1.2.1 蓓蕾蓝靛果花色苷冻干粉的制备 蓓蕾蓝靛果花色苷果实粉碎,用70%乙醇提取,提取液真空浓缩,以X-5大孔树脂为固定相,经40%~70%的乙醇水溶液由低浓度到高浓度梯度洗脱,分离纯化蓓蕾蓝靛果花色苷,得到10个组分,以量最大的2号花色苷组分(花色苷纯 度为51.20%)为样品进行本实验研究。
1.2.2 动物建模方法 依据国家食品药品监督管理局以国食药监保化〔2012〕107号印发《抗氧化功能评价方法》中所规定的乙醇氧化损伤模型造模方法建模。
SPF级昆明健康成年雄性小鼠90只,体重25~30 g。实验室温度:(23±2) ℃,相对湿度:(45%±5%),正常适应性喂养3 d后,将小鼠按体重随机分为对照组、模型组、VC阳性对照组和低、中、高剂量花色苷组6组,每组15只。VC阳性对照组(20 mg/kg bw),花色苷低剂量组(50 mg/kg bw)、花色苷中剂量组(100 mg/kg bw)、花色苷高剂量组(200 mg/kg bw),对照组和模型组经口灌胃等体积的生理盐水,灌胃容量为0.2 mL/10 g,连续30 d,并根据体质量来调整灌胃剂量,灌胃期间自由取食和饮水。
末次灌胃后,除对照组外,其他5组禁食16 h,然后1次性经口灌胃,给予50%乙醇12 mL/kg BW,6 h后取材。
采用眼球取全血,4 ℃低温离心分离血清备用;冰上取小鼠脏器,以预冷的生理盐水冲洗后吸干水分,-80 ℃冰箱冷冻备用。
1.2.3 指标测定 指标检测参照各指标的试剂盒说明书方法进行测定。肝、脑组织匀浆的制备,参照试剂盒说明书的方法进行制备。
1.3数据统计分析

2 结果与分析
2.1蓓蕾蓝靛果花色苷对小鼠体质量的影响
实验小鼠随机分组,实验前各组小鼠平均体质量无显著性差异(p>0.05)。根据分组设计分别灌胃,于灌胃前每隔3 d测定各只小鼠的体质量,连续测定28 d,各剂量组小鼠体质量变化结果见图1。
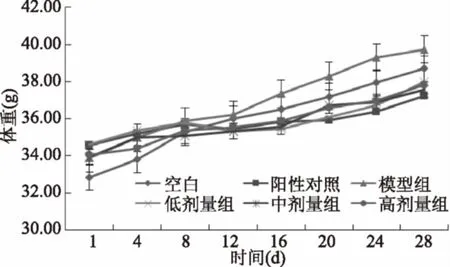
图1 蓓蕾蓝靛果花色苷对小鼠体质量的影响Fig.1 Effect of anthocyanins abstractedfrom Lonicera caerulea ‘Beilei’on the weight in mice(±SE,n=15)
由图1可见,饲喂期间各组小鼠的体质量随着时间的延长,体质量均呈正增长趋势,通过显著性分析各组之间实验终末体质量和净增体质量无显著性差异(p>0.05),这说明花色苷和阳性对照物在实验剂量范围内对小鼠正常生长无影响,对动物机体是安全的。
2.2蓓蕾蓝靛果花色苷对小鼠体内脂质氧化产物MDA含量的影响
MDA是细胞膜脂质过氧化的终产物之一,通过测定机体血清和组织中MDA的含量,可以间接估计乙醇诱导体内氧化损伤的脂质过氧化水平。蓓蕾蓝靛果花色苷各剂量组对小鼠血清和组织中的MDA含量影响见表1。

表1 蓓蕾蓝靛果花色苷对小鼠血清和脏器组织中MDA含量的影响Table 1 Effect of anthocyanins abstractedfrom Lonicera caerulea ‘Beilei’on MDA in serum and organs in mice(±SE,n=15)
注:a:与对照组比较,差异显著(p<0.05);A:与对照组比较,差异极显著(p<0.01);b:与模型组比较,差异显著(p<0.05);B:与模型组比较,差异极显著(p<0.01);c:与阳性对照组比较,差异显著(p<0.05);C:与阳性对照组比较,差异极显著(p<0.01),下同。
由表1可见,模型组血清、脑和肝中MDA含量增加,与对照组之间有极显著性差异(p<0.01),表明乙醇诱导的小鼠氧化损伤,促使体内脂质过氧化产生。花色苷各剂量组血清、肝和脑中的MDA含量极显著(p<0.01)低于模型组,表明蓓蕾蓝靛果花色苷可以有效预防乙醇所致的小鼠机体脂质过氧化伤害。而阳性对照组与模型组比较,小鼠血清和肝中的MDA含量无显著性差异(p>0.05),而脑组织中MDA含量极显著(p<0.01)低于模型对照组,表明阳性对照组VC对脑组织的脂质过氧化损伤具有抑制作用。由此说明花色苷各对小鼠整个机体的氧化损伤保护作用效果优于VC阳性对照组。并且血清中MDA含量随着花色苷计量的增加而减少,说明花色苷抑制小鼠血清中脂质过氧化水平,存在剂量-效应关系,在实验选定范围内,高剂量组最好;而抑制脑中脂质过氧化水平则是低剂量组最好。
2.3蓓蕾蓝靛果花色苷对小鼠体内蛋白质氧化产物PC含量的影响
羰基产物也是机体受到氧化损伤的产物。主要原因是过氧化氢或超氧自由基氧化蛋白质氨基酸侧链,导致羰基产物的积累。通过测定PC的含量,可以间接说明花色苷抑制氧化损伤的能力。结果见表2。

表2 蓓蕾蓝靛果花色苷对小鼠血清和脏器组织中PC含量的影响Table 2 Effect of anthocyanins abstracted from Lonicera caerulea ‘Beilei’on PC in serumand organs in mice(±SE,n=15)
表2结果可知,模型组血清、脑和肝中的蛋白质羰基含量极显著(p<0.01)高于对照组,表明乙醇诱导小鼠氧化损伤可破坏机体内蛋白质一级结构,导致PC含量增加。阳性对照组和花色苷各剂量组血清、脑和肝中的PC含量极显著(p<0.01)低于模型组,表明蓓蕾蓝靛果花色苷可以通过保护蛋白质的一级结构,来降低乙醇氧化对小鼠机体的损伤。并且小鼠血清和肝中PC含量随着花色苷剂量的增加而减少,表明蓓蕾花色苷剂量与PC水平之间存在剂量-效应关系,在实验选定范围内,高剂量组效果最好。
2.4蓓蕾蓝靛果花色苷对小鼠体内过氧化物酶SOD和GSH-Px活力的影响
SOD和GSH-Px是机体内主要的抗氧化酶系,其清除自由基的能力与酶活性成正比。通过测定小鼠血清和组织中抗氧化酶系的活性可以探讨花色苷是否可以通过激活小鼠机体抗氧化酶系,起到预防氧化损伤的效果。蓓蕾蓝靛果花色苷各剂量组对小鼠血清和脏器组织中SOD和GSH-Px含量的影响结果见表3和表4。

表3 蓓蕾蓝靛果花色苷对小鼠血清和脏器组织中SOD的影响Table 3 Effect of anthocyanins abstractedfrom Lonicera caerulea ‘Beilei’on SOD in serum and organs in mice(±SE,n=15)
由表3可见,模型组与对照组比较,模型组血清和肝中的SOD活性极显著(p<0.01)低于对照组,表明乙醇诱导的小鼠氧化损伤降低了机体内SOD酶的活性;阳性对照组与模型组比较,小鼠血清和肝中SOD酶的活性升高极显著(p<0.01),而脑中的SOD酶活性差异不显著(p>0.05);花色苷各剂量组与模型组比较,不但血清和肝中的SOD酶活性提高极显著(p<0.01),同时脑中SOD酶活性也极显著(p<0.01)升高。

表4 蓓蕾蓝靛果花色苷对小鼠血清和脏器组织中GSH-PX的影响 (x(-)±SE,n=15)Table 4 Effect of anthocyanins abstractedfrom Lonicera caerulea ‘Beilei’ on GSH-PXin serum and organs in mice(±SE,n=15)
由表4可见,模型组与对照组比较,模型组血清、脑和肝中的GSH-Px活性极显著(p<0.01)低于对照组,表明乙醇诱导的小鼠氧化损伤降低了机体内GSH-Px酶的活性;阳性对照组和花色苷各剂量与模型组比较,可以极显著(p<0.01)提高血清、脑和肝中的GSH-Px活性,并且花色苷各剂量组提高GSH-Px活性效果极显著(p<0.01)优于阳性对照组。
表3和表4研究结果表明,蓓蕾蓝靛果花色苷可以通过激活机体内SOD和GSH-Px抗氧化酶的活性,来起到保护机体免受氧化损伤。
2.5蓓蕾蓝靛果花色苷对小鼠体内抗氧化物质GSH含量的影响

表5 蓓蕾蓝靛果花色苷对小鼠血清和脏器中GSH含量的影响Table 5 Effect of anthocyanins abstractedfrom Lonicera caerulea ‘Beilei’on GSH in serum and organs in mice(±SE,n=15)
由表5可见,模型组血清和脑中GSH的含量虽然略低于对照组,但是无显著性差异(p>0.05),而模型组肝中的GSH的含量极显著(p<0.01)低于对照组,表明乙醇诱导的小鼠氧化损伤可导致肝中抗氧化物质GSH的含量降低;阳性对照组血清和脑中GSH的含量极显著(p<0.01)高于模型组,表明阳性对照组可以提高机体中GSH的含量;花色苷中、高剂量组血清中GSH的含量极显著(p<0.01)高于模型组,花色苷低剂量组脑和肝中的GSH的含量极显著(p<0.01)高于模型组,表明花色苷可以有效提高机体抗氧化物质GSH的含量,并且存在剂量-效应关系。
3 结论与讨论
蓝靛果富含多酚、花色苷等抗氧化物质,这些物质含有酚羟基,是蓝靛果中主要的抗氧化活性物质[9]。本研究结果表明蓓蕾蓝靛果花色苷对乙醇诱导的小鼠氧化损伤具有防护作用。作用途径可能是通过直接清除自由基、降低脂质过氧化水平、激活机体抗氧化酶活力,增强机体抗氧化酶活性等多个途径来实现的。
乙醇在体内氧化会产生自由基,攻击细胞膜,使细胞受到损伤。丙二醛(MDA)是常用的测定膜脂过氧化指标。Palíková等[10]研究表明18.5%的蓝靛果花色苷提取物对肝微粒体脂质过氧化有抑制作用。本研究结果也表明蓓蕾蓝靛果花色苷可以极显著降低小鼠机体内MDA含量,保护机体免受脂质过氧化伤害。这可能是因为蓓蕾蓝靛果花色苷含有酚羟基,可以直接与乙醇诱导机体产生的自由基结合,从而起到预防氧化伤害。
乙醇进入人体后,90%以上是在肝脏代谢,单次摄入过量酒精所致的急性酒精中毒导致的肝损伤机制之一是通过激活氧分子产生氧自由基,当超过机体抗氧化系统清除能力时便可导致肝细胞膜脂质过氧化反应而引起肝细胞损伤[11]。有研究表明GSH-Px在抵抗酒精所致的肝损伤中起关键作用,其活力水平可以表明酒精性肝损伤时肝脏抗氧化能力[12]。有研究表明蓝靛果果渣提取物可通过提高肥胖大鼠SOD、GSH-Px活性,防止脂质过氧化产物产生[5]。本研究结果也表明蓓蕾蓝靛果花色苷各剂量组小鼠肝内SOD和GSH-Px酶的活力极显著(p<0.01)提高。这说明花色苷一方面可以通过自身与氧化损伤产生的自由基结合,降低乙醇对肝脏的损害,同时也可以通过激活机体内抗氧化酶的活性,使其与氧化损伤产生的自由基结合,起到抗氧化的效果。乙醇对神经有麻醉作用,慢性酗酒和一次性摄入过量均可造成脑损伤[13]。乙醇的致神经毒性的机制被认为与氧自由基的神经毒性以及线粒体细胞色素氧化酶的活性低下有关[14]。有研究表明SOD酶活性和MDA含量的高低与氧自由基导致的脑损伤相关[15,16]。本研究乙醇诱导的小鼠模型中,模型组脑中MDA含量极显著(p<0.01)升高,SOD酶的活力水平极显著(p<0.01)降低,表明乙醇诱导氧化的小鼠造成了脑组织氧化损伤。通过灌胃蓓蕾蓝靛果花色苷,脑中MDA含量极显著(p<0.01)降低,SOD酶的活力水平极显著(p<0.01)升高,这表明蓓蕾蓝靛果花色苷可以通过调节脑中SOD酶活和MDA含量水平预防氧自由基导致的脑损伤。并且花色苷效果优于VC阳性对照,可能与蓓蕾蓝靛果花色苷能通过血脑屏障清除自由基有关。
GSH为一种典型的非酶类抗氧化剂,GSH的含量可以反映出非酶类抗氧化防御系统的状态。本研究结果表明,蓓蕾蓝靛果花色苷可以通过调节机体内抗氧化物质GSH的含量,防护氧化损伤。
蓓蕾蓝靛果花色苷可以通过多个途径预防乙醇诱导的氧化损伤,并且存在剂量-效应关系,在实验选定剂量范围内,高剂量组效果最好,但作用的分子机制尚不清楚,还有待进一步研究。
[1]魏杰,张国坤.花色苷类物质化学成分及抗衰老机制研究进展[J].辽宁大学学报:自然科学版,2016,43(1):68-72.
[2]姜伟伟,任国峰.花色苷的抗肿瘤效应研究进展[J].食品科学,2009,30(9):281-283.
[3]李亚巍,昌盛,王黎明,等.蓝莓花色苷对II型糖尿病小鼠氧化损伤的保护作用[J].食品研究与开发,2016,37(8):5-8.
[4]焦岩,王振宇. 蓝靛果花色苷对高脂膳食诱导肥胖大鼠脂代谢和抗氧化能力的影响[J].食品科学,2010,31(3):230-234.
[5]Raudsepp P,Anton D,Roasto M,et al. The antioxidative and antimicrobial properties of the blue honeysuckle(LoniceracaeruleaL.),Siberian rhubarb(RheumrhaponticumL.)and some other plants,compared to ascorbic acid and sodium nitrite[J]. Food Control,2013,31(1):129-135.
[6]Zhao H,Wang Z,Cheng C,et al. In-vitro free radical scavenging activities of anthocyanins from three berries[J]. Journal of Medicinal Plants Research,2011,5(32):7036-7042.
[8]秦栋,霍俊伟,睢薇. 蓝果忍冬品种蓓蕾蓝靛果引种与选育[J]. 中国果树,2011,37(5):37-39.
[9]Kusznierewicz B,Piekarska A,Mrugalska B,et al. Phenolic composition and antioxidant properties of Polish blue-berried honeysuckle genotypes by HPLC-DAD-MS,HPLC post column derivatization with ABTSor FC,and TLC with DPPH visualization[J]. Journal of Agricultural and Food Chemistry,2012,60(7):1755-1763.
[10]Palíková I,Valentová K,Oborná I,et al. Protectivity of blue honeysuckle extract against oxidative human endothelial cells and rat hepatocyte damage[J]. Journal of Agricultural and Food Chemistry,2009,57(15):6584-6589.
[11]李有贵. 竹节人参皂苷对乙醇性肝损伤的保护机理研究[D]. 杭州:浙江大学,2011.
[12]戈娜. 海兔素改善大鼠酒精性肝损伤的效果及其机制研究[D]. 青岛:青岛大学,2014.
[13]赵美清,冯利东.急性暴饮性饮酒对小鼠脑损伤生物标志物的影响[J].医学研究杂志,2012,41(8):169-171.
[14]Brooks P J. Brain atrophy and neuronal loss in alcoholism:a role for DNA damage[J]. Neurochem Int,2000,37(37):403-412.
[15]Batinic-Haberle I,Reboucas J S,Spasojevic I. Superoxide dismutase mimics:chemistry,pharmacology,and therapeutic potential[J]. Antioxid Redox Signal,2010,13(6):877-9183.
[16]Farmer E E,Davoine C. Reactive electrophile species[J]. Curr Opin Plant Biol,2007,10(4):380-386.
ProtectionofLoniceracaerulea‘Beilei’anthocyaninsonoxidativeinjuryofmiceinducedbyethanol
ZHOULi-ping1,2,3,ZHANGYue2,WANGHua2,LIMeng-sha2,HEDan-rao2,DUFeng-guo3,*
(1.School of Forestry,Northeast Forestry University,Harbin 150040,China;2.Institute of Natural Resources and Ecology,Heilongjiang Academy of Sciences,Harbin 150040,China;3.Forestry College of Beihua University,Jilin 132013,China)
To explore the protection ofLoniceracaerulea‘Beilei’ anthocyanins on ethanol induced oxidative injury in mice.According to the weight,mice were randomly divided into 6 groups,the control group,model group,VCcontrol group(20 mg/kg BW),anthocyanins low dose group(50 mg/kg BW),anthocyanin medium dose group(100 mg/kg BW)and anthocyanin high dose group(200 mg/kg BW). The volume of oral gavage was 0.2 mL/10 g per day,and the control group and model group were filled with normal saline. After 30 days,the oxidative damage model was induced by oral gavage with ethanol except the control group. The content of malondialdehyde(MDA),protein carbonyl(PC),superoxide dismutase(SOD),glutathione peroxidase(GSH-PX)and glutathione(GSH)in blood and tissues were detected. Results showed thatLoniceracaerulea‘Beilei’ anthocyanins could significantly reduce the content of MDA and PC in mice(p<0.01),and it could significantly(p<0.01)improve the activity of SOD and GSH-PXinvivoand raise the content of GSH.Loniceracaerulea‘Beilei’ anthocyanins have protective effect in preventing oxidative damage in mice.
Loniceracaerulea‘Beilei’;anthocyanin;ethanol;oxidative damage
TS201.4
A
1002-0306(2017)19-0293-05
10.13386/j.issn1002-0306.2017.19.054
2017-04-11
周丽萍(1976-),女,博士研究生,副研究员,研究方向:植物活性成分,E-mail:zhoulipingnefu@163.com。
*通讯作者:杜凤国(1960-),男,博士,教授,研究方向:植物资源培育与开发利用,E-mail:dfg4656@qq.com。
“十三五”国家重点研发计划(2016YFC500300);黑龙江省科学院院基金项目(2014);黑龙江省科学院对外合作基金项目(2016)。

