发酵-酶解耦合法大豆苷元转化工艺
,,,,
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
发酵-酶解耦合法大豆苷元转化工艺
李笑梅,向世新,杨春华,马慧玲,张娜
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
以市售大豆异黄酮粉为样品,选用产β-葡萄糖苷酶的LJ-Q2菌种与优化后的固定化β-葡萄糖苷酶进行耦合发酵,采用单因素、响应曲面法对耦合发酵条件进行优化,高效液相法(HPLC)测定大豆异黄酮苷元,考察耦合发酵条件对大豆苷元转化率的影响。研究结果如下:最优条件为温度54 ℃,耦合时间3 h,初始pH7,固定化酶添加量7%;大豆异黄酮苷元绝对质量13.76 mg,大豆异黄酮苷元转化率为76.8%。对大豆苷制备应用技术开发有参考价值。
固定化,耦合发酵,大豆苷元,转化率
大豆异黄酮(Soybean Isoflavone,SI)主要存在于大豆种皮、子叶、胚轴中[1]。是大豆生长过程形成的次级代谢产物,被称为“植物雌激素”,是大豆中一类重要的生理活性物质[2]。分为游离型和结合型两种,也称苷元和糖苷。现在已知的大豆异黄酮的同分异构体一共有12种[3]。游离型苷元又称非糖部分(大豆异黄酮配基),有3种:大豆素(Daidzein)、黄豆黄素(Glycitein)、染料木素(Genistein),以及对应的9种结合型糖苷:葡萄糖苷型3种、乙酰基葡萄糖苷型3种和丙二酰基葡萄糖苷型3种[4-5]。在天然的大豆异黄酮产品中,具有生物活性的大豆异黄酮苷元易被人体吸收[6-8],仅占总量的2%~3%,剩余的是不易被人体吸收的结合型糖苷,占97%~98%[9]。大豆异黄酮具有重要的生物学活性,在类雌激素、抗肿瘤、预防骨质疏松和心血管疾病等方面有确切作用[10]。
国内外研究表明,游离型生物活性高于结合型[11-13],糖苷型的大豆异黄酮不能直接被小肠壁吸收,必须经水解去除糖基转化为游离型的苷元才可被小肠吸收[14],所以要将结合型糖苷转化成游离型苷元,关键技术是提高大豆苷元转化率,开发出大豆苷元转化新途径、新工艺。大豆苷元转化技术主要有酸碱水解法;酶水解法[15],最主要的酶有β-葡萄糖苷酶、葡萄糖苷酶、α-半乳糖苷酶、乳糖酶、真菌乳糖酶和乳糖酶F等[16];微生物降解法,对产β-葡萄糖苷酶的菌种研究主要集中在酵母、曲霉、木霉以及细菌内[17]。韩慧[18]得出微波、炒制、烘箱干燥有利于大豆异黄酮苷元转化。关于苷元转化工艺的相关研究多半侧重于单一技术,耦合方法少见报道。
综合目前的相关研究,存在的问题是,大豆苷元的提取率和转化率都比较低,市售的大豆异黄酮产品总黄酮含量在30%~80%,而且其中苷元绝对质量也很低。另外,作为工业原料的市售大豆异黄酮主要是结合型,但游离型含量较高的产品价格相对较高。因此,开发大豆苷元转化新途径非常有意义。据此,在前期研究工作基础上将产β-葡萄糖苷酶的LJ-Q2肠道菌种与优化后的固定化β-葡萄糖苷酶进行耦合发酵大豆异黄酮粉,旨在开发大豆苷元转化的新工艺,优化耦合工艺条件参数,更好的提高苷元转化率,为促进大豆异黄酮的利用率以及苷元制备技术开发提供参考依据。
1 材料与方法
1.1材料与仪器
大豆异黄酮粉(含量 30%) 河南众信生物科技有限公司;大豆素标准品Daidzein(纯度 99%)、大豆黄素标准品Glycitein(纯度 99%)、染料木素标准品Genistein(纯度 99%)、大豆苷标准品Daidzin(纯度 99%)、大豆黄苷标准品Glycitin(纯度 99%)、染料木苷标准品Genistin(纯度 99%) 西安市天园生物制药厂;LJ-Q2肠道菌 自素食者粪便分离鉴定;黑曲霉β-葡萄糖苷酶 南京生利德生物技术有限公司;壳聚糖 国药集团化学试剂有限公司;海藻酸钠 天津市福晨化学试剂厂;脑心浸出液肉汤培养基(BHI)培养基 青岛海博生物技术有限公司;甲醇 美国天地公司,色谱纯;柠檬酸 天津市光复精细化工研究所,分析纯;磷酸氢 二钾天津市化学试剂一厂,分析纯;氯化钙 吉林宏久试剂厂,分析纯;硫酸铵、硫酸镁、硫酸亚铁、氯化锌 天津市天新精细化工开发,分析纯;吐温-80 邢台蓝星助剂厂。
YQX-Ⅱ型厌氧培养箱 上海新苗医疗器械有限公司;SW-CJ-1超净工作台 北京东联仪器制造有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;Agilent 1200LC高效液相色谱 美国安捷伦公司;TU-1901双光束紫外分光光度计 北京普析通用仪器有限公司;SHZ-D3循环水式真空泵 巩义市予华仪器有限责任公司;AS3120A超声波 天津奥特赛恩斯仪器有限公司;PHS-3C型pH计 上海精密仪器有限公司。
1.2实验方法
1.2.1 固定化β-葡萄糖苷酶的制备 采用海藻酸钠-壳聚糖法将β-葡萄糖苷酶固定化[19]。吸取稀释酶液与质量分数2%的海藻酸钠水溶液混合均匀。用注射器缓慢滴到2%的壳聚糖-醋酸溶液和2%的CaCl2溶液混合溶液,形成微胶囊。然后置于冰箱在恒温层4 ℃的温度下硬化2 h,抽滤。在0.2%的戊二醛中,40 ℃下、交联1 h[20]。洗涤,得到固定化酶,置于冰箱恒温层储存备用。
1.2.2 六种大豆异黄酮定性定量方法 称取一定量大豆苷、大豆黄苷、染料木苷、大豆素、大豆黄素、染料木素标准品,用80%甲醇溶解超声30 min后定容,配制成六种单标液,各浓度为0.4 mg/mL。再用上述六种标液以相同比例分别配制成0.048、0.096、0.144、0.192、0.240 mg/mL系列浓度大豆异黄酮混和标液[21]。
用0.048 mg/mL混标在双光束紫外分光光度计中进行全波长扫描,确定最大吸收波长。
采用高效液相色谱法进行定性定量检测,固定相为Agilent1200LC C18柱(250 mm×4.6 mm 5 μm),以甲醇、水为流动相,以甲醇∶(水+甲醇)=20%~60%的比例进行梯度洗脱,流速为1.2 mL/min,柱温为40 ℃,检测波长为确定的最大吸收波长。将各单标过0.45 μm微孔滤膜于进样瓶中,依次进样,各组分保留时间作为样品的定性依据。用配置好的混合标液进样,得到六种标准品的标准曲线及回归方程。
按公式(1)分别计算每种大豆异黄酮含量,游离型大豆异黄酮总量由三种游离型大豆异黄酮相加得出,结合型大豆异黄酮总量由三种结合型大豆异黄酮相加得出。
m=c×V×10-3
式(1)
式(1)中:c-由各类型大豆异黄酮回归方程得出其浓度,μg/mL;V-定容体积,mL。
按公式(2)计算游离型大豆异黄酮转化率。
式(2)
式(2)中:m-每种大豆异黄酮绝对质量,mg;m1-样品中游离型异黄酮绝对质量,mg;m2-耦合发酵后游离型异黄酮绝对质量,mg;m3-样品中结合型异黄酮绝对质量,mg。
1.2.3 耦合发酵工艺 用于发酵的LJ-Q2肠道菌是前期工作自素食者肠道分离得到的革兰氏阳性球菌,为厌氧型,与黑曲霉相比较,在发酵时间短于64 h时LJ-G1、LJ-Q2产酶能力高于黑曲霉[22],产β-葡萄糖苷酶[23]。配置50 mL脑心浸出液培养基(BHI),将活化后的LJ-Q2肠道菌接种于BHI液体培养基中,接菌量(体积分数)5%、培养基pH8、培养温度38 ℃、培养时间38 h。将大豆异黄酮粉原料进行发酵,待发酵时间剩余3 h时,添加固定化酶于发酵液中,进行耦合酶解发酵,初始pH为7、耦合时间为3 h,固定化酶添加量为5%,温度40 ℃,然后在空气摇床中发酵,得酶解发酵液。
1.2.4 耦合发酵工艺单因素实验 单因素实验主要考察耦合温度,耦合时间,初始pH,固定化酶添加量四个因素,以未经耦合发酵的经炒制后的大豆异黄酮原料为对照组,采用HPLC进行检测,以游离型大豆异黄酮苷元绝对质量为评价指标,各组实验重复三次。
1.2.4.1 初始pH对苷元绝对质量的影响 在其他条件不变的情况下,考察初始pH4、5、6、7、8,耦合温度为40 ℃,耦合时间为3 h,酶添加量为5%。对耦合发酵大豆异黄酮苷元绝对质量的影响。
1.2.4.2 耦合温度对苷元绝对质量的影响 在其他条件不变的情况下,考察耦合温度20、30、40、50、60 ℃,初始pH7,耦合时间为3 h,酶添加量为5%。对耦合发酵大豆异黄酮苷元绝对质量的影响。
1.2.4.3 耦合时间对苷元绝对质量的影响 在其他条件不变的情况下,考察耦合时间1、3、5、7、9 h,初始pH7,耦合温度40 ℃,酶添加量为5%。对耦合发酵大豆异黄酮苷元绝对质量的影响。
1.2.4.4 酶添加量对苷元绝对质量的影响 在其他条件不变的情况下,考察酶添加量1%、3%、5%、7%、9%,初始pH7,耦合温度40 ℃,耦合时间3 h。对耦合发酵大豆异黄酮苷元绝对质量的影响。
1.2.5 响应面法优化耦合发酵工艺条件 采用Box-Behnken模型,以温度、时间、初始pH和酶添加量四个单因素为耦合发酵大豆异黄酮苷元绝对质量影响的主要考察因子(自变量),分别以A、B、C、D表示,并以-1、0、+1分别代表自变量的低、中、高水平对自变量进行编码。因子编码及水平见表1。并采用多元回归分析,拟合二次多项式回归模型的Box-Behnken设计实验[24],进行结果分析,得到固定化酶水解大豆异黄酮粉优化工艺条件,在此基础上,做验证实验。
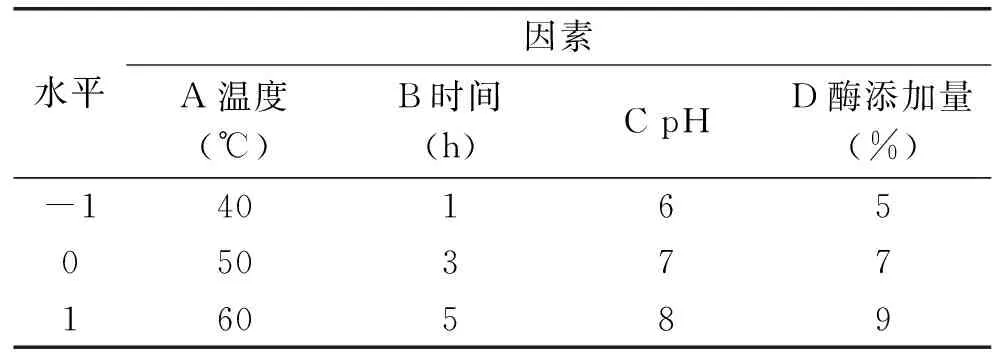
表1 Box-Behnken 实验设计因素水平表Table 1 Factors and levels Table of Box-Behnken design
1.3数据处理
实验操作重复三次,采用SPSS 19.0软件进行单因素显著性分析,采用Design-Expert 8.05b软件设计响应面实验方案、建立数学模型并进行多元回归分析。
2 结果与分析
2.1六种大豆异黄酮标样定性检测
2.1.1 大豆异黄酮最大吸收波长 由紫外扫描图可以看出,确定259 nm为最大吸收波长,作为液相的测定条件。
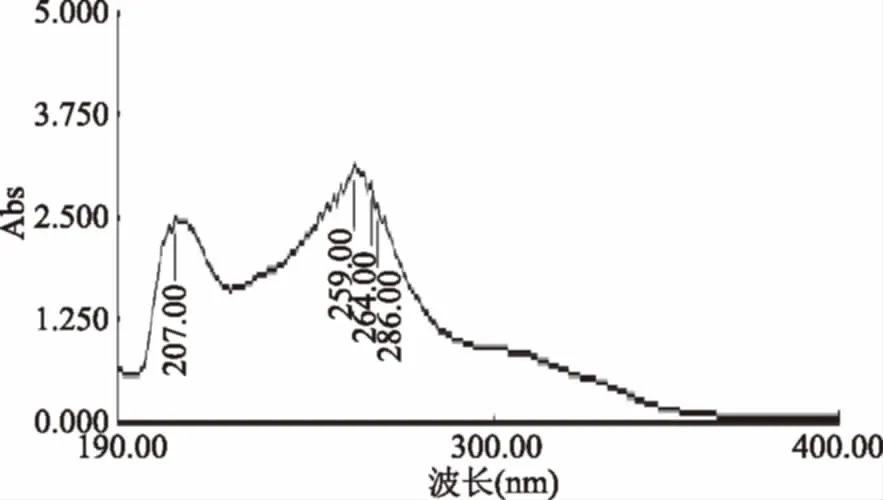
图1 大豆异黄酮紫外全波长扫描图Fig.1 Soy isoflavones full wavelength ultraviolet scan
2.1.2 游离大豆异黄酮的标准曲线 用HPLC法分别测定配制的系列标准溶液,进样量20 μL,n=3。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线。
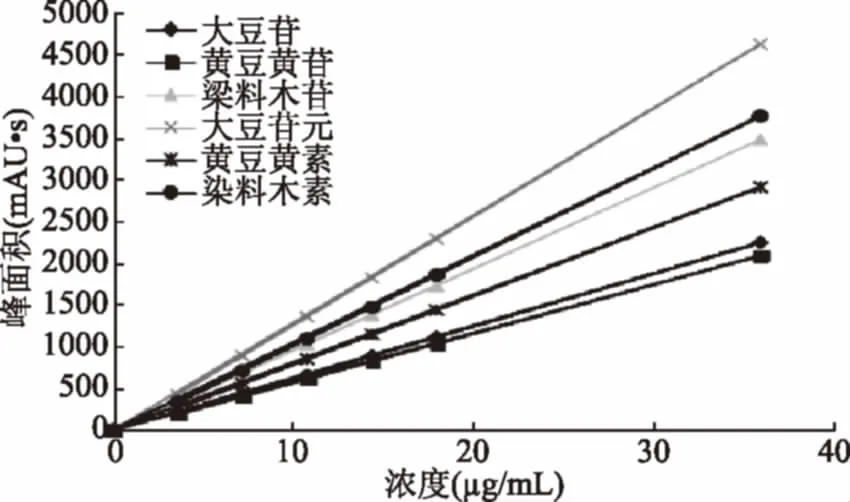
图2 六种大豆异黄酮标准曲线Fig.2 Standard curve of six soybean isoflavones
峰面积y对浓度x(μg/mL)进行回归分析,回归方程分别为:
大豆素:y=129.55x-43.855,r=0.9996;大豆黄素:y=61.151x-53.554,r=0. 998;
染料木素:y=105.85x-50.178,r=0.9991;大豆苷:y=53.574x-34.498,r=0.9987;
大豆黄苷:y=60.494x-43.071,r=0.9986;染料木苷:y=71.444x-27.151,r=0.9990。
式中:y为大豆异黄酮的峰面积:x 为大豆异黄酮的浓度,μg/mL,线性范围是0~40 μg/mL。
2.1.3 大豆异黄酮的定性
2.1.3.1 混合标样中六种大豆异黄酮定性 根据单标的保留时间对混标色谱图各组分进行定性。由图3可知:19.200 min是大豆苷,20.700 min是大豆黄苷,24.604 min是染料木苷,36.321 min是大豆素,38.383 min是大豆黄素,41.861 min是染料木素。
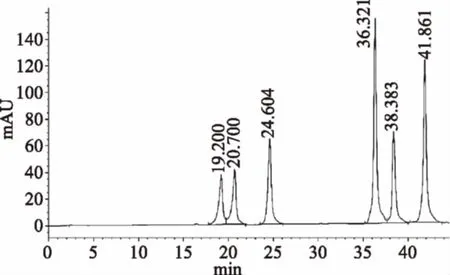
图3 混合标样大豆异黄酮色谱图Fig.3 The chromatogram of six soyisoflavones in standard substance
2.1.3.2 原料中大豆异黄酮的定性定量 由图4可知,原料中各组分大豆异黄酮出峰时间与图3混合标样各组分的出峰时间相同,含有上述六种大豆异黄酮。根据相应标准曲线,计算出原料中大豆苷含量为2.187 mg/g;大豆黄苷含量为1.764 mg/g;染料木苷含量为1.242 mg/g;大豆素含量为3.661 mg/g;大豆黄素含量为0.634 mg/g;染料木素含量为0.4 mg/g。三种结合型异黄酮总含量为5.193 mg/g;三种游离型异黄酮总含量为4.695 mg/g。
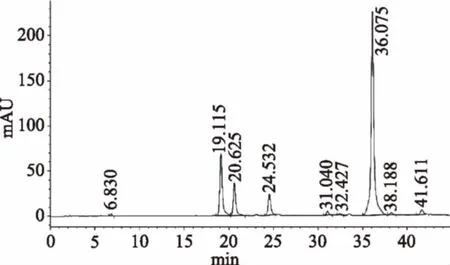
图4 原料未经预处理大豆异黄酮色谱图Fig.4 The chromatogram of soybean isoflavoneswithout any pretreatment in sample
2.2单因素实验
2.2.1 初始pH对苷元绝对质量的影响结果 如图5所示,初始pH是4.0时大豆异黄酮苷元绝对质量较低,然后随pH上升,苷元绝对质量同步增加,初始pH7,苷元绝对质量达到最高,之后开始下降,经显著性分析,pH6和pH7(p>0.05)无显著性差异,pH7和pH8(p>0.05)也无显著性差异。pH5和pH7(p<0.05)存在显著性差异,表明适宜的初始pH为6.0~8.0。
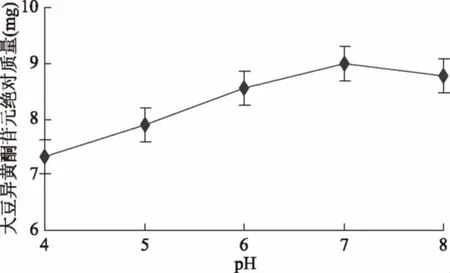
图5 初始pH对苷元绝对质量的影响Fig.5 Effect of initial pH on the absolute quality of aglycone
2.2.2 耦合温度对苷元绝对质量的影响结果 如图6所示,耦合温度为20 ℃时大豆异黄酮苷元绝对质量较低,然后随温度升高,苷元绝对质量也增加,到50 ℃时苷元绝对质量最高,之后开始下降,经显著性分析,40 ℃和50 ℃(p<0.05)存在显著性差异,50 ℃和60 ℃(p<0.05)同样存在显著性差异。表明适宜温度为40~60 ℃。
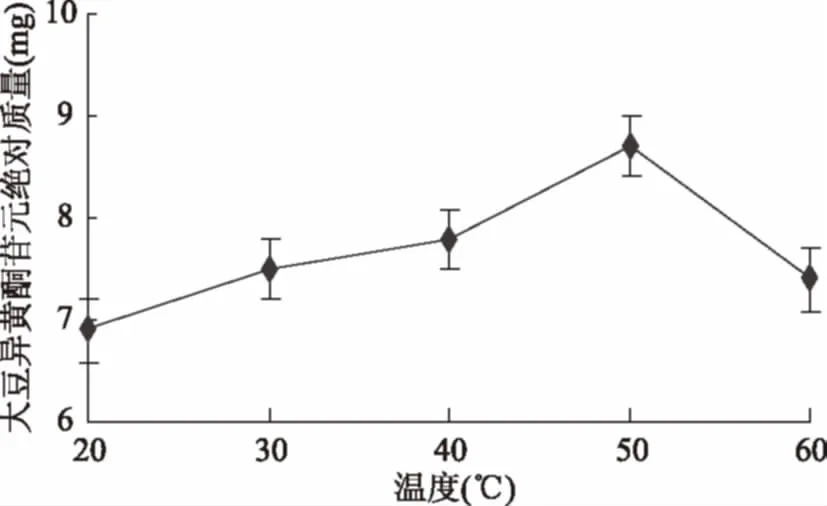
图6 温度对苷元绝对质量的影响Fig.6 Effect of temperature on the absolute quality of aglycone
2.2.3 耦合时间对苷元绝对质量的影响结果 如图7所示,当耦合时间为1 h时大豆异黄酮苷元绝对质量较低,随着耦合时间上升,大豆异黄酮苷元绝对质量升高,耦合时间为3 h时苷元酮绝对质量最高,之后绝对质量开始下降,经显著性分析,1 h和3 h存在显著性差异(p<0.05),3 h和5 h(p>0.05)无显著性差异。表明适宜时间为1~5 h。
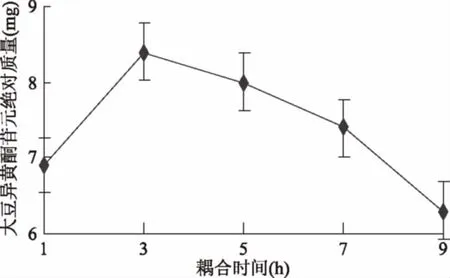
图7 耦合时间对苷元绝对质量的影响Fig.7 Effect of coupling time on absolute quality of aglycone
2.2.4 酶添加量对苷元绝对质量的影响结果 如图8所示,固定化酶添加量为1%时大豆异黄酮苷元绝对质量较低,然后随酶添加量增加,大豆异黄酮苷元绝对质量同步升高,添加量为7%时苷元绝对质量最高,之后开始下降,经显著性分析,5%和7%(p<0.05)有显著性差异,7%和9%(p>0.05)无显著性差异,表明固定化酶适宜添加量为5%~9%。
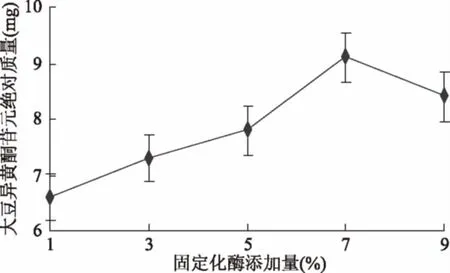
图8 酶添加量对苷元绝对质量的影响Fig.8 Effect of enzyme additionon the absolute quality of aglycone
2.3响应面实验
本实验利用Design-Expert软件,获得响应面实验结果见表2。
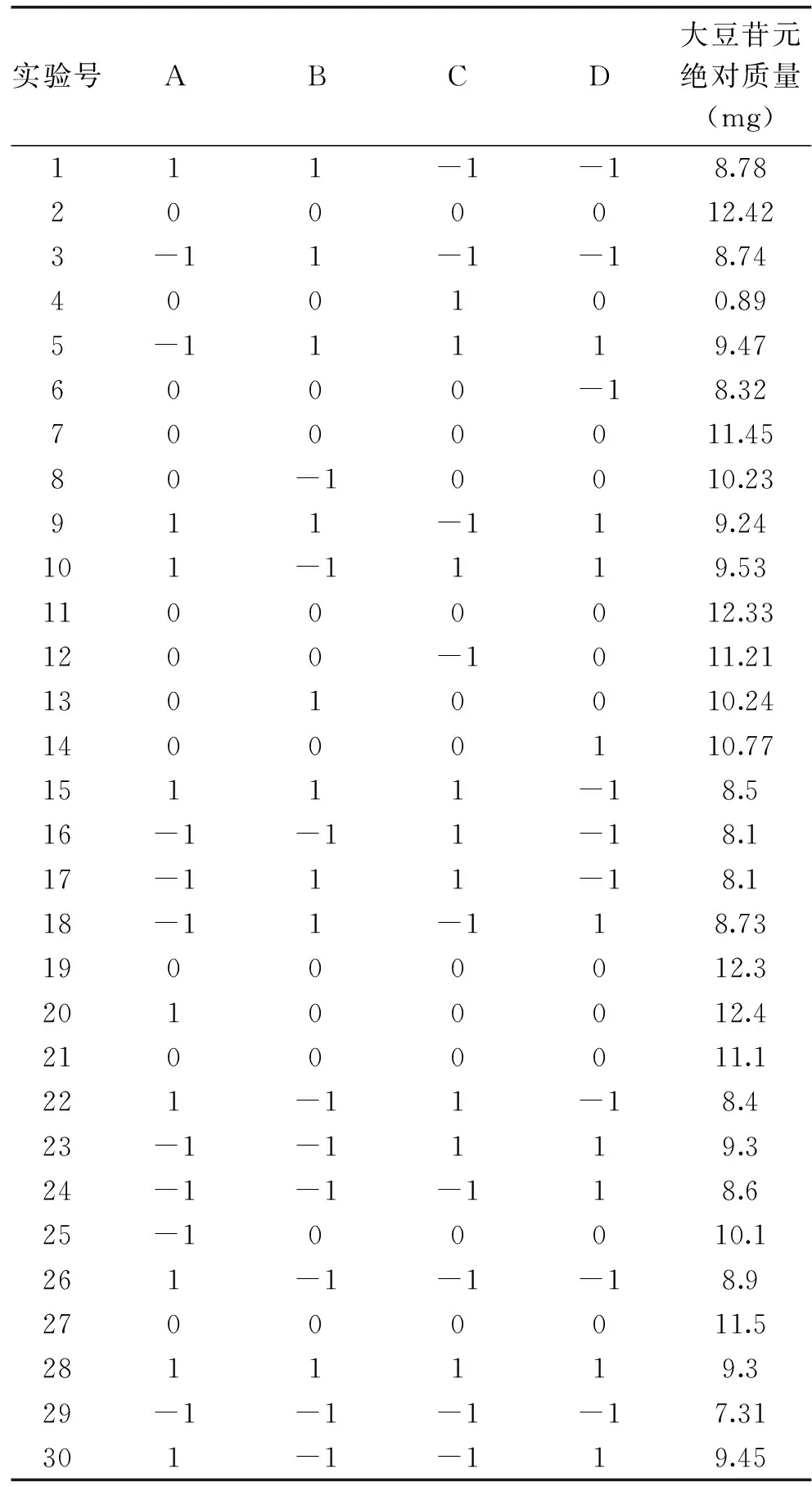
表2 响应面实验结果Table 2 Results of response surface experiment
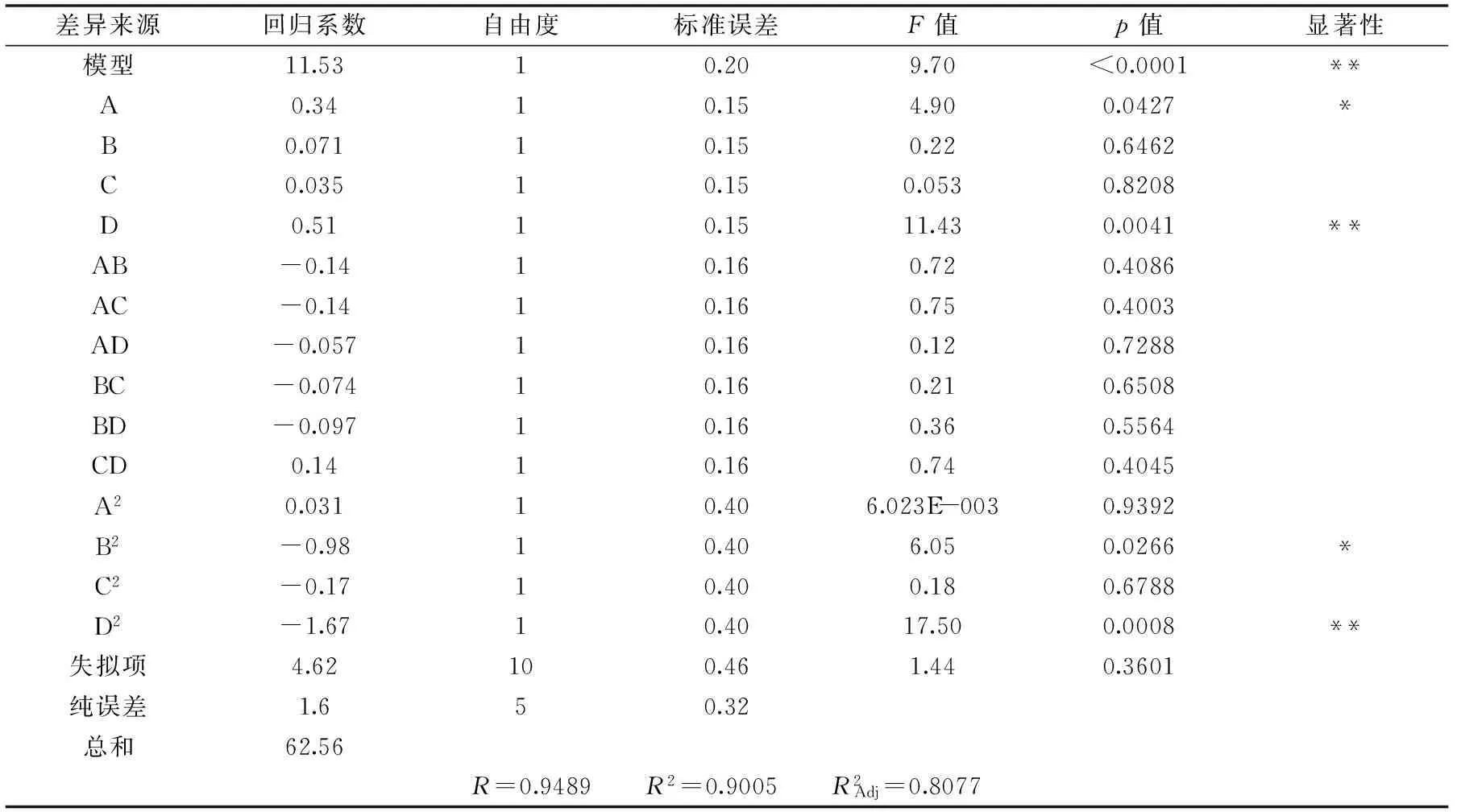
表3 响应面回归方程系数及显著性检验Table 3 Significance test and the regression equation of response surface experiment
注:p<0.01,差异极显著,**表示;p<0.05,差异显著,*表示。
由表2可以看出,2组游离型大豆异黄酮绝对质量最高为12.42 mg。根据表2实验结果,经回归拟合后,各实验因子对响应值的影响可通过以下回归方程表示:
Y=11.53+0.34A+0.071B+0.035C+0.51D-0.14AB-0.14AC-0.057AD-0.074BC-0.097BD+0.14CD+0.031A2-0.98B2-0.17C2-1.67D2
响应面回归方程及显著性分析见表3。
2.4耦合发酵法制备大豆异黄酮苷元响应面分析图
由图9可知,温度为40 ℃,随温度的上升,苷元绝对质量逐渐加大,温度在54 ℃左右,苷元绝对质量为最大值,之后又慢慢下降。随水解时间继续增加,苷元绝对质量增大,在水解时间3 h左右,大豆异黄酮苷元绝对质量为最大值,其后呈下降趋势。
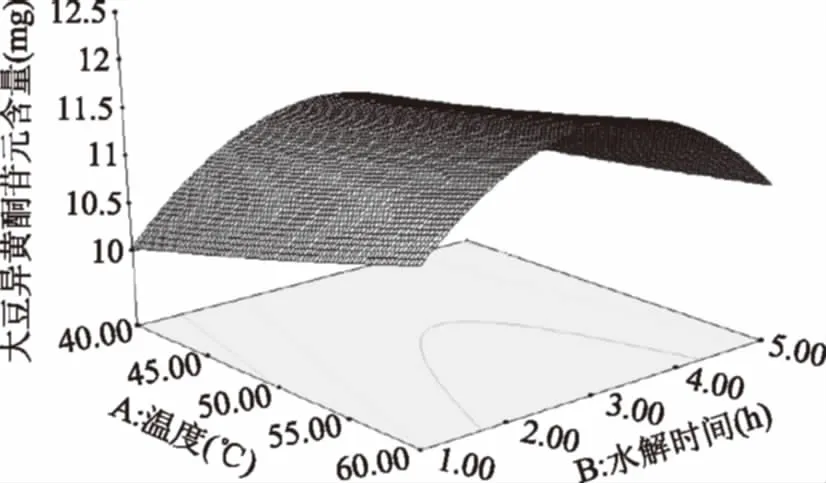
图9 温度和水解时间的交互作用对大豆异黄酮苷元含量的影响Fig.9 Effects of temperature and hydrolysis timeon the content of soybean isoflavone glycosides
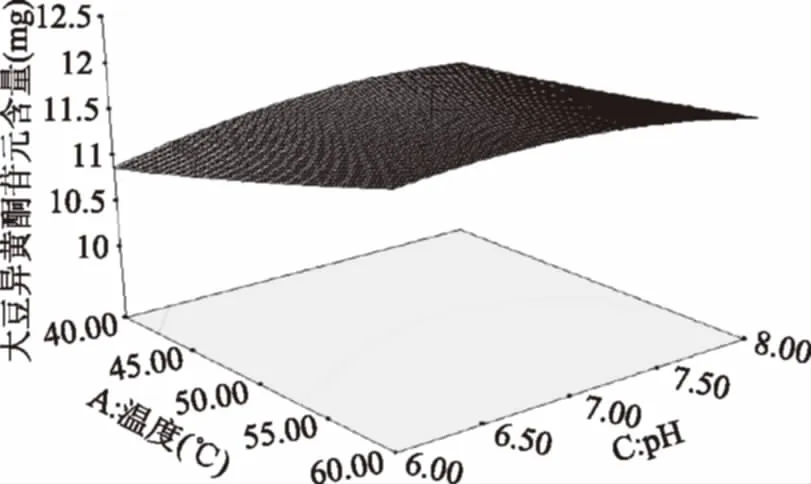
图10 温度和pH的交互作用对大豆异黄酮苷元含量的影响Fig.10 Effects of temperature and pH interactionon the content of soybean isoflavone glycosides
由图10可知,温度为40 ℃,随温度的上升,苷元绝对质量逐渐升高,温度在54 ℃左右,苷元绝对质量为最大值,之后又慢慢下降。然后pH的增加,大豆异黄酮苷元绝对质量增大,在初始pH为7左右,大豆异黄酮苷元绝对质量为最大值,其后呈下降趋势。
由图11可知,随温度的升高,苷元绝对质量逐渐加大,温度在54 ℃左右,苷元绝对质量为最大,之后又慢慢下降。然后固定化酶添加量的增加,大豆异黄酮苷元绝对质量增大,在固定化酶添加量7%左右,大豆异黄酮苷元绝对质量为最大值,其后呈下降趋势。
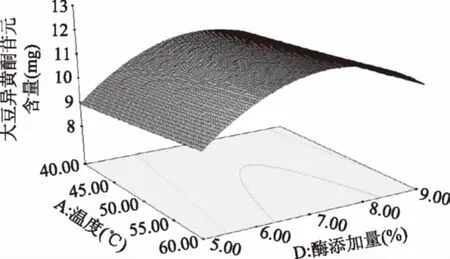
图11 温度和酶添加量的交互作用对大豆异黄酮苷元含量的影响Fig.11 Effects of temperature and enzyme interactionon the content of soybean isoflavone glycosides
由图12可知,水解时间的延长,苷元绝对质量加大,水解时间3 h左右,苷元绝对质量为最大,之后又呈下降趋势。当pH增加苷元绝对质量增大,在初始pH为7左右时,大豆异黄酮苷元绝对质量为最大值,其后呈下降趋势。
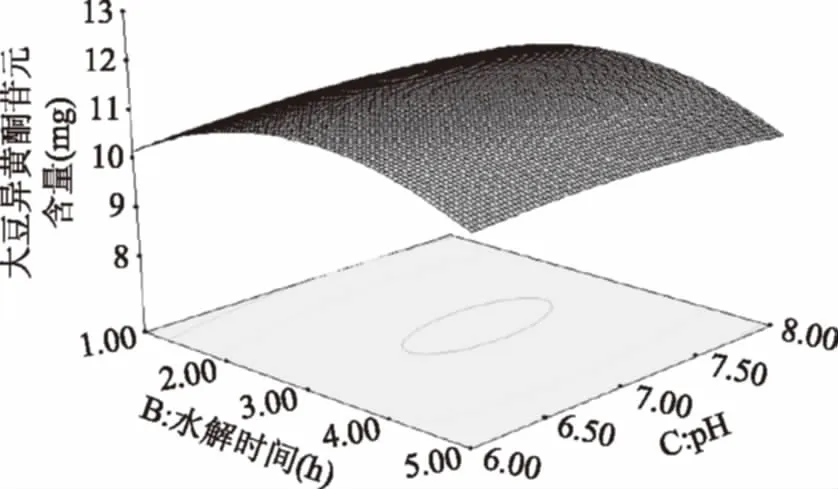
图12 水解时间和pH的交互作用对大豆异黄酮苷元含量的影响Fig.12 Effects of hydrolysis time and pHon the content of soybean isoflavone glycosides
由图13可知,水解时间延长,苷元绝对质量增大,在水解时间3 h左右,苷元绝对质量到达最高点,之后又呈下降趋势。随着固定化酶添加量加大,大豆异黄酮苷元绝对质量增大,在固定化酶添加量在7%左右,大豆异黄酮苷元绝对质量为最大值,其后呈下降趋势。
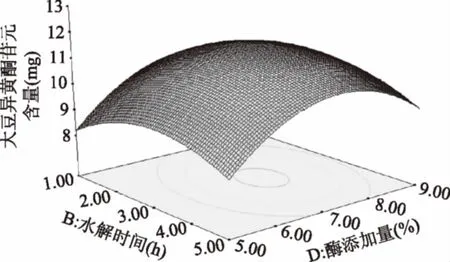
图13 水解时间和酶添加量的交互作用对大豆异黄酮苷元含量的影响Fig.13 Effects of interaction between hydrolysis timeand enzyme content on soybean isoflavone glycoside content
由图14可知,随pH的上升,苷元绝对质量逐渐升高,然后pH在7左右时苷元绝对质量到达最高点,之后又慢慢下降。随着固定化酶添加量的升高,苷元绝对质量增大,在固定化酶添加量在7%左右,苷元绝对质量为最大值,其后呈下降趋势。
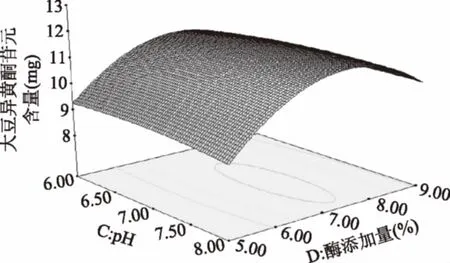
图14 pH和酶添加量的交互作用对大豆异黄酮苷元含量的影响Fig.14 Effects of the interaction of pH and enzyme contenton the content of soybean isoflavone glycosides
由耦合发酵法制备大豆异黄酮苷元响应面分析图得到最优耦合发酵条件温度54.03 ℃,水解时间3 h,初始pH7,固定化酶添加量7.29%。以此优化条件进行验证实验,耦合发酵条件温度54 ℃,水解时间3 h,初始pH7,固定化酶添加量7%,大豆异黄酮苷元绝对质量13.76 mg,与响应曲面实验中的第2组结果12.42 mg差异显著(p<0.05),具有统计学意义。耦合发酵前原料样品中大豆异黄酮苷元绝对质量为6.695 mg,三种结合型异黄酮总绝对质量为9.193 mg,根据公式(2)计算出大豆异黄酮苷元转化率76.8%。
其大豆苷元转化率与近几年相关研究结果相比均有提高,张涛[25](2008)采用固定化酶β-葡萄糖苷酶水解大豆异黄酮转化率达到70%,相比之下转化率增加了6.8%。素食者粪便分离到的肠道菌LJ-Q2具有产β-葡萄糖苷酶能力[13],课题前期李笑梅[22]采用LJ-Q2菌株发酵大豆异黄酮转化率达到 39.4%,相比之下转化率增加了37.4%。与黑曲霉相比产酶能力达到峰值的时间短为36 h,远短于黑曲霉108 h。由此认为采用LJ-Q2菌-β-葡萄糖苷酶耦合发酵法全程发酵时间明显缩短,且可以提高大豆苷元转化率,具有开发应用前景。
3 结论
在单因素实验的基础上通过响应面实验得到耦合发酵最优条件为温度54 ℃,耦合时间3 h,初始pH7,固定化酶添加量7%,此条件下大豆异黄酮苷元转化率为76.8%。其大豆苷元转化率与近几年相关研究结果相比均有提高,对大豆苷制备应用技术开发有参考价值。后续工作应进一步讨论另外六种结合型,即丙二酰基葡萄糖苷型和乙酰基葡萄糖苷型的苷元转化,探讨多种产β-葡萄糖苷酶复合菌种与β-葡萄糖苷酶耦合发酵途径,多途径提高大豆异黄酮苷元的转化率,开发易于实际生产的应用技术。
[1]付丽佳,林海,王玉华.大豆异黄酮雌激素样作用的研究进展[J].中国伤残医学,2008(6):134-135.
[2]梁晓芳. 6种大豆异黄酮单体的分离、纯化及稳定性研究[D].北京:中国农业科学院,2014.
[3]王春娥,刘叔义.大豆异黄酮的成分、含量及特性[J].食品科学,1998(4):39-43.
[4]李笑梅.复合生物法大豆异黄酮苷元制备技术的研究与开发[R].黑龙江省应用技术研究与开发计划项目可行性研究报告.2013.
[5]Wang H J,Murphy P A. Isoflavone composion of American and Japanese soybeans in lowa:Effects if variety crop year and location[J]. Journal of Agricultural and Food Chemistry,1994(42):1674-1677.
[6]Kiyosawa I,Matsuyama J,Arai C,et al. Suppressive effects of the methanol extracts from soyabean products on SOS response of Salmonella typhimurium induced by mutagens and their contents of isoflavones[J]. Journal of the Japanese Society for Food Scie-nce and Technology,1995,42(10):835-842.
[7]Masayoshi Y,Ying H G. Anabolic effect of genistein and genistin on bone metabolism in thefemoral-metaphyseal tissues of elderly rats:The genistein effect is enhanced by zinc[J]. Molecularand Cellular Biochemistry,1998,178(1-2):377-382.
[8]Yamaki K,Kim D H,Ryu N,et al. Effects of naturally occurring isoflavones on prostaglandin E2 production[J]. Planta Medica,2002,68(2):97-100.
[9]周玲,苏黎红.大豆异黄酮研究概况[J].时珍国医国药,2001,12(2):157-158.
[10]王建华. 大豆异黄酮研究进展[J]. 现代中药研究与实践,2013(1):85-88.
[11]Kiyosawa I,Matsuyama J,Arai C,et al. Suppressive effects of the methanol extracts from soybean products on SOS response of Salmonella typhimurium induced by mutagens and their absolute qualitys of isoflavones[J]. Journal of the Japanese Society for Food Science and Technology,1995,42(10):835-842.
[12]Masayoshi Y,Ying H G. Anabolic effect of genistein and genistin on bone metabolism in the femoral-metaphyseal tissues of elderly rats:The genistein effect is enhanced by zinc[J]. Molecular and Cellular Biochemistry,1998,178(1-2):377-382.
[13]Yamaki K,Kim D H,Ryu N,et al. Effects of naturally occurring isoflavones on prostaglandin E2 production[J]. Planta Medica,2002,68(2):97-100.
[14]孙逊,姚文,朱伟云.肠道大豆异黄酮降解菌研究进展[J].世界华人消化杂志,2006,14(10):236-241.
[15]李明元,余渝,杜小琴.水解法提取大豆异黄酮苷元工艺研究[J]. 西南大学学报:自然科学版,2008,30(4):119-122.
[16]张晓红,于殿宇,周凤超.制备大豆异黄酮苷的方法[J]. 食品科学,2006,27(11):583-585.
[17]韩婷,程钢.β-葡萄糖苷酶以及益生菌生物转化大豆异黄酮糖苷的研究进展[J].食品科学,2010,31(9):333-337.
[18]韩慧,张加玲.热处理与大豆异黄酮苷元的转化分析[J].中国食品卫生杂志.2010,22(3):250-253.
[19]马慧玲,李笑梅.响应曲面法优化β-葡萄糖苷酶固定化的研究[J].哈尔滨商业大学学报:自然科学版,2016(3):357-362.
[20]ChangMY,Juang RS. Use of chitosan-clay composite as immobilization support for improved activity and stability of B-glucosidase[J].Biochem Eng J,2007(35):93-98.
[21]Walter E D,et al.J Am Chem Soc,1941(63):327.
[22]李笑梅,马慧玲.两株素食者肠道菌产β-葡萄糖苷酶考察及产酶条件优化[J].食品科学,2016(7):123-127.
[23]李笑梅,贾尧.素食者产雌马酚肠道菌生长条件优化[J].食品科学,2014(23):199-203.
[24]Bemelmans W J,Broer J,Feskens E J,et al. Effect of an increased intake of alpha-linolenic acid and group nutritional education on cardiovacular risk factors:the Mediterranean alpha-linolenic enriched groningen dietary intervention(MARGARIN)study[J]. Am J Clin Nutr,2002(75):221-227.
[25]张涛,黄哲,林章凛.固定化β-葡萄糖苷酶双相体系中水解大豆异黄酮[J].化工学报,2008(2):387-392.
Fermentation-enzymaticcouplingmethodfordaidzeintransformation
LIXiao-mei,XIANGShi-xin,YANGChun-hua,MAHui-ling,ZHANGNa
(Key Laboratory of Food Science and Engineering,Harbin University of Commerce,Harbin 150076,China)
The commercially available soybean isoflavone powder was used as sample,LJ-Q2 strain withβ-glucosidase was selected and coupled with optimized immobilizedβ-glucosidase.The coupling conditions were optimized by single factor and response surface method. The content of soybean isoflavone glycoside was determined by high performance liquid chromatography(HPLC). The effects of coupled fermentation conditions on the conversion of daidzein were investigated.The results of optimal conditions were as follows:temperature 54 ℃,coupling time 3 h,initial pH7,immobilized enzyme addition amount 7%. The absolute quality of soybean isoflavone aglycon was 13.76 mg,the conversion rate of soybean isoflavone aglycon was 76.8%,application of technology development for soybeans glycosides had reference value.
immobilization;coupled fermentation;daidzein;conversion rate
TS201.3
A
1002-0306(2017)19-0118-07
10.13386/j.issn1002-0306.2017.19.023
2017-03-24
李笑梅(1960-),女,大学本科,教授,研究方向:食品科学,E-mail:lixm0451@163.com。
黑龙江省科技厅应用技术项目(GC13B203);黑龙江省高校科技创新团队建设计划项目(2010td04)。

