青海藜麦皂苷超声提取工艺及抗氧化活性
, ,, ,,
(1.青海大学农牧学院,青海西宁 810016;2.青海省青藏高原农产品加工重点实验室,青海西宁 810016;3.三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
青海藜麦皂苷超声提取工艺及抗氧化活性
赵亚东1,2,党斌2,3,*,杨希娟2,3,刘洋3,姚有华3,迟德钊3
(1.青海大学农牧学院,青海西宁 810016;2.青海省青藏高原农产品加工重点实验室,青海西宁 810016;3.三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
通过单因素和正交实验对超声波辅助溶剂提取青海藜麦皂苷的工艺条件进行优化,并对青海不同藜麦皂苷含量及其抗氧化能力进行了评价。结果表明,超声波辅助乙醇提取皂苷的最佳工艺条件为:乙醇体积分数90%,料液比1∶15 (g/mL),提取时间20 min、功率400 W、提取温度45 ℃,在此条件下藜麦皂苷含量达到115.74 mg/100 g。119份藜麦平均皂苷含量为(93.66±18.34) mg/100 g,不同藜麦间皂苷含量与抗氧化能力差异较大。不同粒色比较,红色藜麦的皂苷含量最高且抗氧化能力最强,白色藜麦的皂苷含量最低且抗氧化能力最差。以DPPH·清除能力、铁离子还原能力(FRAP)和ABTS+·清除能力为指标,采用Ward联接(平方欧式距离)法将119份藜麦分为三大类。第Ⅰ类包括69种藜麦,皂苷含量与抗氧化能力均较高;第Ⅱ类包括33种藜麦,皂苷含量与抗氧化能力中等;第Ⅲ类包括17种藜麦,皂苷含量与抗氧化能力均较低;三大类之间皂苷含量与抗氧化能力差异显著(p<0.05)。
藜麦,皂苷,工艺优化,抗氧化活性,聚类分析
藜麦(ChenopodiumquinoaWilld)是一种藜科藜属假谷物,原产于南美洲安第斯山区,有5000多年的种植历史[1-2],主要分布在南美洲的玻利维亚、厄瓜多尔和秘鲁[3]等地,具有抗寒、耐旱、适应性强等特性[4-5],在海拔4000 m以下均有分布[6],藜麦种子大多数为灰白色、乳黄色;也有部分颜色为黑色、紫色、红色等[7]。
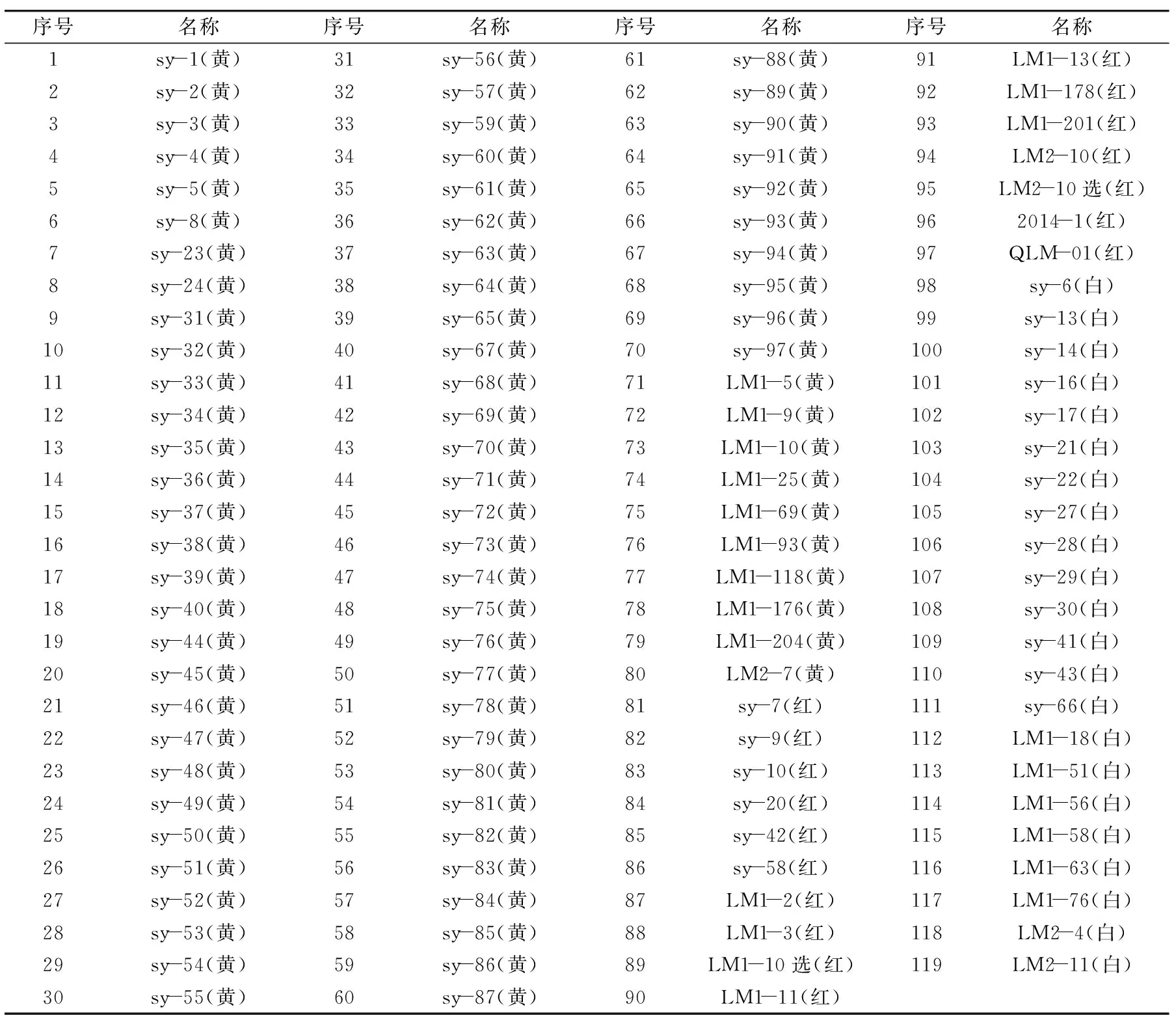
表1 实验材料Table 1 Experiment materials
我国藜麦种植面积较大,主要分布于山西、甘肃、青海和吉林等地区[8]。藜麦丰富的营养价值引起了科学家和消费者的广泛关注,美国国家航空航天局(NASA)证实藜麦营养素含量普遍高于常见谷物,可充分满足人类生命活动的基本物质需求,将藜麦列为航天员的安全食品;并被联合国粮农组织(FAO)列为全球10大营养食品之一[9-11]。
藜麦中皂苷含量丰富,皂苷具有抗菌活性与解热、镇静、抗癌、抗氧化等医药价值[12],可以通过提取、分离等技术得到皂苷。本文利用超声波技术优化提取藜麦皂苷的工艺条件,并进一步分析119份青海藜麦中皂苷含量及其抗氧化活性差异,筛选出皂苷含量较高、抗氧化活性较强的藜麦品种,为藜麦皂苷加工利用、品种选育提供理论依据。
1 材料与方法
1.1材料与试剂
藜麦材料 青海省农林科学院作物育种栽培研究所提供;藜麦粉的制备 利用高速粉碎机制得;甲醇、乙醇、丙酮、冰乙酸、高氯酸、三氯化铁、无水乙酸钠、过硫酸钾 均为分析纯;Trolox、DPPH、TPTZ、ABTS 上海源叶生物科技有限公司;齐墩果酸标准品 北京索莱宝科技公司。
1.2仪器与设备
AL204万分之一分析天平 梅特勒-托利多仪器(上海)有限公司;高速中药粉碎机 天津华鑫仪器厂;KQ-500DE型数控超声波清洗器 昆山市超声波仪器有限公司;TGL-20M高速台式冷冻离心机 上海沪粤明科学仪器有限公司;DKB-600B型电热恒温水箱 上海一恒科学仪器有限公司;Retavapor R-215旋转蒸发仪 瑞士布奇有限公司;N4S紫外可见分光光度计 上海仪电分析仪器有限公司。

表2 正交实验因素水平表Table 2 Levels and factors Table of orthogonal experiment
1.3实验方法
1.3.1 不同提取溶剂对藜麦皂苷含量的影响 按1∶20 (g/mL)的比例向粉碎后的藜麦粉中加入60%(v/v)的甲醇、乙醇、丙酮与蒸馏水,在400 W、20 ℃的条件下萃取20 min,1800×g离心5 min,萃取液于45 ℃减压蒸干,再用甲醇复溶,0.22 μm有机膜过滤,得藜麦皂苷粗提取液,于-22 ℃冰箱中避光储存备用。
1.3.2 皂苷提取的单因素实验 以乙醇为提取试剂,按1.3.1方法提取藜麦皂苷,分别考察乙醇浓度、料液比、提取时间、超声功率、提取温度对藜麦皂苷含量的影响。单因素实验基本条件为乙醇浓度:(20%、40%、60%、80%、100%);料液比:(1∶5、1∶10、1∶20、1∶30、1∶40、1∶50);提取时间(10、20、30、40、50 min);超声功率:(200、300、350、400、500 W);提取温度:(20、30、40、50 ℃)。
1.3.3 皂苷提取的正交实验 根据资料及实验结果,以乙醇浓度、料液比、提取时间、超声功率、提取温度为因素,皂苷含量为指标,按照正交表 L16(45)设计5因素4水平正交实验。
1.3.4 皂苷含量的测定 采用香草醛-高氯酸法,参考文献[13]并稍作修改。吸取200 μL皂苷粗提液加入试管中,70 ℃水浴挥发除去甲醇,加入5%的香草醛-冰乙酸溶液0.2 mL、高氯酸0.8 mL,摇匀;60 ℃水浴15 min后立即用冷水冷却5 min;加入4 mL冰乙酸稀释,室温下避光静置30 min,以不加皂苷粗提液的试管作为空白对照,在波长546 nm下测定吸光度,重复3次。以齐墩果酸为标准品,得到标准曲线为Y1=51.998X1-0.0129(0~0.02 mg/mL,R2=0.9991)。皂苷含量以每100 g藜麦粉中所含相当于齐墩果酸的量mg表示。
皂苷含量(mg/100 g)=(Y×V)/M×100
式中:Y为测定的皂苷浓度(mg/mL);V为皂苷粗提液的总体积(mL);M为藜麦粉干重(g)。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH法 参考文献[14-17]并稍微改进,向试管中加入1 mL皂苷提取液,加入0.1 mmol/L DPPH·甲醇溶液4.5 mL,避光反应30 min,以甲醇代替皂苷提取液调零,在波长517 nm下测定吸光度,重复测定3次,得到Trolox标准曲线为Y2=-0.0042X2+0.0229(0~140 μmol/L,R2=0.9932)。DPPH·清除能力以每100 g藜麦粉(干重)中所含相当于水溶性维生素E的量(μmol/100 g)表示。
1.3.5.2 FRAP法 参照Benzie等[18]方法稍作改进,取1 mL藜麦皂苷提取液与4.5 mL FRAP工作液(包括300 mmol/L pH3.6醋酸钠缓冲液3.75 mL、10 mmol/L TPTZ溶液0.375 mL、20 mmol/L FeCl3溶液0.375 mL)混合均匀,避光反应30 min,以甲醇为空白调零,在波长593 nm下测定吸光度,重复三次,得到Trolox标准曲线为:Y3=0.0072X3+0.0012(0~160 μmol/L,R2=0.9992),铁离子还原能力以每100 g藜麦粉(干重)中所含相当于水溶性维生素E的量(μmol TE/100 g DW)表示。
1.3.5.3 ABTS法 参照Delgado-Andrade等[19]方法稍作改进,ABTS反应液(88 μL的140 mmol/L K2(SO4)2与5 mL的7 mmol/L ABTS混合均匀),室温避光静置12~16 h后,用无水甲醇稀释至在734 nm下的吸光值为(0.7±0.02),200 μL藜麦皂苷粗提液与4.5 mL ABTS反应液混匀,避光反应30 min,以甲醇为空白调零,在波长734 nm下测定吸光度,重复三次,得到Trolox标准曲线为:Y4=-0.0010X4+0.0118(0~600 μmol/L,R2=0.9907),皂苷ABTS+·清除能力以每100 g藜麦粉(干重)中所含相当于水溶性维生素E的量(μmol TE/100 g DW)表示。
1.4统计分析
用Excel进行数据初步处理,显著性分析使用DPS 9.05进行,采用SPSS 19.0进行系统聚类。
2 结果与分析
2.1不同提取试剂对藜麦皂苷含量的影响
如图1所示,甲醇、乙醇作为提取试剂时皂苷含量明显高于丙酮、水提取的效果,甲醇作为提取试剂时皂苷含量达到75.47 mg/100 g DW。甲醇、乙醇的提取效果没有显著差异,乙醇相对于甲醇更安全;因此本实验选择乙醇作为皂苷提取的试剂。

图1 不同提取试剂对皂苷含量的影响Fig.1 Effects of different extractionsolvents on saponins content注:不同字母表示数据差异,p<0.05。
2.2单因素实验
2.2.1 乙醇浓度对皂苷含量的影响 由图2可以看出,皂苷含量随着乙醇浓度的增大先升高后降低。当乙醇浓度为80%时皂苷的含量达到最大,浓度高于80%时,皂苷的含量反而降低,可能是由于乙醇浓度过高导致细胞紧缩,影响皂苷进入溶剂[14];因此,乙醇浓度最佳为80%。

图2 乙醇浓度对皂苷含量的影响Fig.2 Effects of ethanol concentration on saponins content
2.2.2 料液比对皂苷含量的影响 由图3可知,随着料液比的增加,皂苷含量呈现先增后降的趋势,当料液比1∶10时,皂苷含量最大;因此最适料液比为1∶10。

图3 料液比对皂苷含量的影响Fig.3 Effects of the ratio of materialto solvent on saponins content
2.2.3 提取时间对皂苷含量的影响 由图4可知,在10~20 min范围内,随着提取时间的延长皂苷含量增大,在20 min时达到最高;之后随着提取时间的增加,皂苷含量反而下降,最终趋于平稳。因此,提取时间确定为20 min。

图4 提取时间对皂苷含量的影响Fig.4 Effects of the time on saponins content
2.2.4 超声功率对皂苷含量的影响 由图5可知,功率为400 W时,皂苷的含量最大,继续升高功率,皂苷含量下降。超声波通过空化作用与机械振动将藜麦粉细胞壁破碎,增大溶剂进入细胞的渗透性加速皂苷的提取[20],但是功率较高使皂苷结构遭到破坏。因此,藜麦皂苷提取超声功率为400 W。
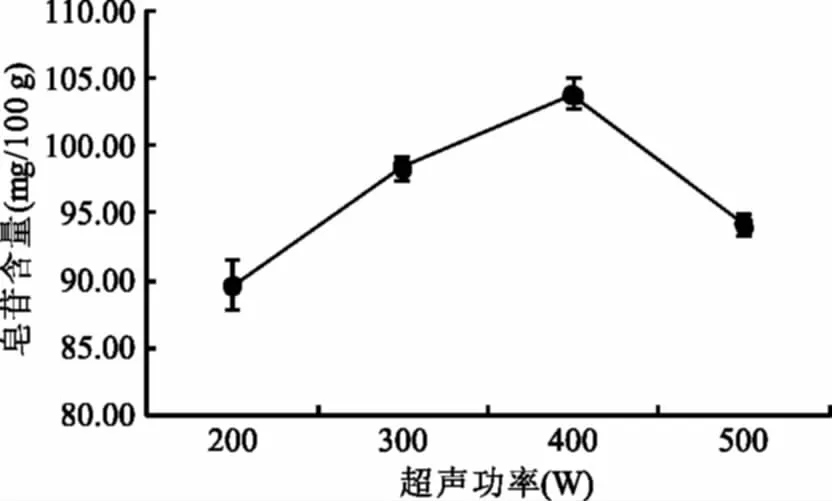
图5 超声功率对皂苷含量的影响Fig.5 Effects of the ultrasonic power on saponins content
2.2.5 提取温度对皂苷含量的影响 由图6可见20~40 ℃范围内随着提取温度升高,皂苷含量逐渐升高,在40 ℃时,皂苷含量达到最大,之后随着温度的升高,皂苷的含量降低,可能是由于高温使部分结构不稳定的皂苷类物质遭到破坏[21];因此皂苷最佳提取温度为40 ℃。

图6 提取温度对皂苷含量的影响Fig.6 Effects of temperature on saponin content of quinoa
2.3正交实验
以乙醇浓度、液料比、提取时间、超声功率、提取温度为考察因素,以皂苷含量为指标,采用五因素四水平的L16(45)正交实验,优化藜麦皂苷最佳提取工艺,实验结果见表3。

表3 正交实验方案及结果Table 3 Results and scheme of orthogonal experiment

表5 119份藜麦皂苷含量与抗氧化能力Table 5 Saponins content and antioxidant capacity of 119 quinoas

表6 皂苷含量及抗氧化能力间的相关系数Table 6 Correlation analysis between saponins content and antioxidant capacity
注:**表示在 0. 01 水平(双侧)上极显著相关。
由表3的极差分析可知,影响皂苷提取的各因素主次顺序为乙醇体积分数>超声功率>料液比>温度>提取时间;提取时间对皂苷含量的影响最小,可作为方差分析的误差项处理。

表4 正交设计方差分析表(完全随机模型)Table 4 Variance analysis of orthogonal experiment(complete stochastic model)
注:*表示因素作为误差处理。
由表4方差分析结果可知,各因素对皂苷含量的影响均达到极显著水平(p<0.01)。综合表3与表4可知,优选组合为A3B3C2D2E3,即乙醇浓度为90%,料液比为1∶15,提取时间为20 min,超声功率为400 W,提取温度为45 ℃。通过验证实验,在此最佳工艺条件下皂苷含量为115.74 mg/100 g,高于任何一个组合,因此由正交实验得到的最佳组合是可行的。
2.4藜麦皂苷含量与抗氧化能力评价
2.4.1 皂苷含量与抗氧化能力总体评价 由表5可知,119份藜麦皂苷含量平均值为(93.66±18.34) mg/100 g,变幅为47.11~136.98 mg/100 g,变异系数达19.58%,表明不同藜麦间皂苷含量有一定差异;皂苷含量高于大豆和燕麦,但低于青豆[22],其中54%藜麦皂苷含量低于93.66 mg/100 g,皂苷含量高于130 mg/100 g的藜麦有7份,分别是LM1-201、LM1-9、LM1-11、LM1-2、LM1-13、LM1-10选、LM1-3;皂苷含量介于二者之间的藜麦占39.5%。119份藜麦的DPPH·、ABTS+·清除能力、FRAP的变异系数分别为27.20%、23.43%、21.41%,表明不同藜麦间抗氧化能力差异较大。

表7 不同粒色藜麦皂苷含量与抗氧化能力Table 7 Saponins content and antioxidant capacity of diferent color grain quinoas
注:同列数据后不同字母表示差异在0.05水平显著,表8同。

表8 119种藜麦皂苷含量与抗氧化能力聚类结果Table 8 Clustering results of saponins content and antioxidant capacity of 119 quinoas
由表6可知DPPH·清除能力与ABTS+·清除能力之间的相关系数为0.717,DPPH·清除能力与FRAP之间的相关系数为0.597,ABTS+·清除能力与FRAP之间的相关系数为0.634,均呈极显著正相关,说明ABTS法、DPPH法、FRAP法所测定的结果基本一致。皂苷含量与DPPH·清除能力、ABTS+·清除能力、FRAP均呈显著正相关,相关系数分别为0.333、0.357、0.664(p<0.01);说明藜麦皂苷含量越高,其抗氧化活性越强,这和杜静婷[23]等人的报道一致。
2.4.2 不同粒色藜麦皂苷含量与抗氧化活性评价 119份藜麦按粒色可分为黄、白、红三种。由表7可以看出,不同粒色藜麦的皂苷含量和抗氧化能力均存在显著差异(p<0.05)。其中红色藜麦的皂苷含量、FRAP、DPPH·清除能力与ABTS+·清除能力均为最高;黄色藜麦次之;白色藜麦相对较低。
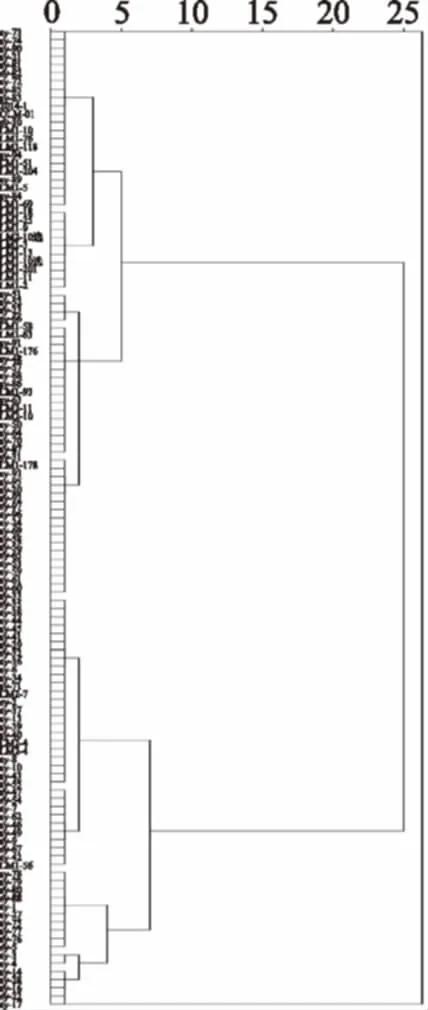
图7 不同藜麦资源皂苷含量与抗氧化能力聚类树状图Fig.7 Clustering tree of saponin contentand antioxidant capacity of different quinoa resources
2.4.3 119种藜麦聚类分析 以皂苷含量、DPPH·清除能力、FRAP、ABTS+·清除能力为指标,采用Ward联接(平方欧式距离为5~10)法将119种藜麦聚为Ⅲ大类(见图7和表8),第Ⅰ类皂苷含量与抗氧化能力均较高,皂苷含量为103.68 mg ·100 g-1、DPPH·清除能力为641.53 μmol TE·100 g-1、FRAP为1653.09 μmol TE·100 g-1、ABTS+·清除能力为1834.11 μmol TE·100 g-1;第Ⅰ类包括69种藜麦,其中黄色藜麦47种、白色藜麦9种、红色藜麦13种;并将其划分为两大亚类,第一大亚类包括32种藜麦,第二大亚类包括37种藜麦。第Ⅱ类藜麦皂苷含量与抗氧化能力处于中间水平,皂苷含量为80.70 mg ·100 g-1、DPPH·清除能力为533.40 μmol TE·100 g-1、FRAP为1280.77 μmol TE·100 g-1、ABTS+·清除能力为1506.16 μmol TE·100 g-1;在第Ⅱ类33种藜麦中有7种白色、22种黄色、4种红色,所占的比例分别为21.21%、66.67%,12.12%。第Ⅲ类藜麦皂苷含量与抗氧化能力均处于较低水平,皂苷含量为78.14 mg ·100 g-1、DPPH·清除能力为287.09 μmol TE·100 g-1、FRAP为951.57 μmol TE·100 g-1、ABTS+·清除能力为1155.72 μmol TE·100 g-1;第Ⅲ类有17种藜麦,可划分为两大亚类,第一大亚类包括10种藜麦,第二大亚类包括7种藜麦。三大类在皂苷含量、DPPH·清除能力、FRAP、ABTS+·清除能力等方面均存在显著差异。
3 结论与讨论
本研究通过正交实验优化了超声波辅助提取藜麦皂苷最佳工艺。即乙醇体积分数90%,料液比1∶15 (g/mL),超声功率400 W、提取温度45 ℃、提取时间20 min;在此最佳工艺条件下,皂苷含量达到115.74 mg/100 g。
比较分析了119种藜麦皂苷含量和抗氧化活性的差异性。参试藜麦中皂苷含量变幅为47.11~136.98 mg/100 g,变异系数为19.58%,不同藜麦间皂苷含量差异较大;119份藜麦均具有较强的抗氧化能力,但不同藜麦间抗氧化能力差异较大。不同粒色藜麦的皂苷含量与抗氧化能力均存在显著差异,红色藜麦的皂苷含量与抗氧化能力最高,黄色的皂苷含量与抗氧化能力次之,白色的皂苷含量与抗氧化能力最低。
以皂苷含量、DPPH·清除能力、FRAP、ABTS+·清除能力为指标,采用Ward联接(平方欧式距离)法将119份藜麦分为3大类。第Ⅰ类藜麦皂苷含量与抗氧化能力均较高,包括69种藜麦,又可划分为两大亚类,第一大亚类有32种藜麦,第二大亚类包括37种藜麦。第Ⅱ类藜麦皂苷含量与抗氧化能力处于中间水平,包括33种藜麦,其中有7种白色、22种黄色、4种红色,所占的比例分别为21.21%、66.67%,12.12%。第Ⅲ类藜麦皂苷含量与抗氧化能力均较低,包括17种藜麦,可划分为两大亚类,第一大亚类包括10种藜麦,第二大亚类包括7种藜麦。三大类别在皂苷含量、DPPH·清除能力、FRAP、ABTS+·清除能力等方面均存在显著差异。此结果为选育高皂苷藜麦和强抗氧化性藜麦品种提供了理论依据。但本研究收集的黄色藜麦较多,红色和白色藜麦数量较少,今后的研究中还应扩大红色和白色藜麦的数量。
[1]Koziol M J. Chemical composition and nutritional evaluation of quinoa(Chenopodium quinoa Willd)[J]. Journal of Food Composition and Analysis,1992,5(1):35.
[2]Repo-Ccarrasco R,Espinoza C and Jacobsen S E N.Nutritional value and use of the Andean crops quinoa(Chenopodiumquinoa)and Kaniwa(Chenopodiumpallidicaule)[J]. Food Reviews international,2003,19(1):179-189.
[3]周海涛,刘浩,么杨,等.藜麦在张家口地区试种的表现与评价[J].植物遗传资源学报,2014(15):222-227.
[4]陆敏佳,蒋玉蓉,陈国林,等.黎麦叶片黄酮类物质的提取及基因型差异[J].浙江农林大学学报,2014,31(4):534-540.
[5]Jacobsen S E,Mujica A,Jensen C R. quinoa(ChenopodiumquinoaWilld.)to adverse abiotic factors[J]. Food Reviews International,2003,19(1-2):99-109.
[6]丁云双,曾亚文,闵康,等.藜麦功能成分综合研究与利用[J].生物技术进展,2015,5(5):340-346.
[7]卢宇,张美莉.藜麦生物活性物质研究进展[J].农产品加工,2015,40(10):58-62.
[8]肖正春,张广伦.藜麦及其资源开发利用[J].中国野生植物资源,2014,33(92):62.
[9]Sehiliek G,Buhenheim D L. Quinoa:An emerging new crop with potential for CELSS[M]. Washington:National Aeronautics and Space Administration,Ames Research Center,1993.
[10]Quinoa FAO. An ancient crop to contribute to worldfood security[D]. Italy:Food and Agriculture Organization,2011.
[11]Abugoch J L E. Quinoa(ChenopodiumquinoaWilld.):composition,chemistry,nutritional,and functional properties[J]. Andvances in Food Nutrition Research,2009,(58):1-31.
[12]Stuardo M,San Martin R. Antifungal properties of quinoa(ChenopodiumquinoaWilld)alkali treated saponins against Botrytis cinerea[J]. Industrial Crops and Products,2008,27,296-302.
[13]刘伟锐,张霞,姜蕊,等.紫外可见分光光度发测定苣荬菜根部总三萜皂苷的的含量[J].西北药学杂志,2014,29(6):554-557.
[14]Tamer H G,El M A A. Phenolic Acids and antioxidant properties of barely whole grain and pearling fractions[J]. Agricultural and Food Science,2012,21:118-131.
[15]RE R,Pellegrini N,Proteggente A,et al. Antioxidant activity applyingan improved ABTS radical cation decolorization assay[J].Free Radical Biology Medicine,1999,26(9):1231-1237.
[16]李青,张名位,张瑞芬,等.5种籼稻品种谷壳中游离态和结合态酚类物质含量及其抗氧化活性比较[J].中国农业科学,2012,45(6):1150-1158.
[17]曾王旻.燕麦抗氧化活性物质提取及抗氧化活性研究[D].杨凌:西北农林科技大学,2011.
[18]Benzie IFF,Strain JJ. The ferric reducing ability of plasma asameasure of “antioxidant power”:the FRAP assay[J].Anal Biochem,1996,239:70-76.
[19]Delgado-Andrade C,Rufiaa-henares J A,Morales F J. Assessing the antioxidant activity of melanoidins from coffee brews by different methods[J]. J Agric Food Chem,2005,53(20):7832-7836.
[20]严伟,李淑芬,田松江.超声波协助提取技术[J].化工进展,2002,21(9):649-651.
[21]蔡建秀,曾炜,陈姗龙,等.紫菜多酚的超声波辅助提取工艺及其抗氧化作用[J].食品研究与开发,2015,36(21):54-60.
[22]Guclu-ustundag O,Mazza G. Saponins:properties,applications and processing[J]. Critical Reviews in Food science and Nutrition,2007,47:231-258.
[23]杜静婷,陈超,范三红.响应面法优化藜麦糠皂苷的提取及抗氧化活性[J].山西农业科学2016,44(7):932-937.
UltrasonicextractiontechnologyofsaponinsanditsantioxidantactivityinquinoafromQinghai
ZHAOYa-dong1,2,DANGBin2,3,*,YANGXi-juan2,3,LIUYang3,YAOYou-hua3,CHIDe-zhao3
(1.Academy of Agriculture and Animal Husbandry,Qinghai University,Xining 810016,China;2.Key Laboratory of Qinghai Province Tibetan Plateau Agric-Product Processing,Xining 810016,China;3.State Key Laboratory of Three Rivers Ecological Farmingand Plateau Agriculture and Animal Husbandry,Xining 810016,China)
Extraction conditions of quinoa saponins from Qinghai were investigated by single factor and orthogonal test on ultrasonic assisted solvents,the content of saponins and antioxidant capacity of different quinoas in Qinghai were analyzed. The results showed that:the volume fraction of ethanol was 90%,solid-liquid ratio was 1∶15 (g/mL),extraction time was 20 min,ultrasonic power was 400 W and extraction temperature was 45 ℃. Under these conditions,the saponins content of quinoa was 115.74 mg/100 g. The average content of saponins in 119 quinoa was(93.66±18.34) mg/100 g,saponins content and antioxidant activities among different quinoas were great different. Among different grain colors,the content of saponins in red quinoas was the highest and the antioxidant activities was the strongest,the saponins content of white quinoas was the lowest and the antioxidant activities was the worst. 119 quinoas were divided into three classes by Ward connection(square European distance)method based on DPPH· scavenging ability,iron ion reduction ability(FRAP)and ABTS+· scavenging ability. ClassⅠ(inciuding 69 quinoas)showed relatively higher saponins content and antioxidant activities,while classⅡ(inciuding 33 quinoas)were midium,class Ⅲ(inciuding 17 quinoas)showed relatively low saponins content and antioxidant activities. Saponins content and antioxidant activities among the three classes were significant different(p<0.05).
quinoa;saponins;process optimization;antioxidant activity;clustering analysis
TS218
B
1002-0306(2017)19-0045-08
10.13386/j.issn1002-0306.2017.19.009
2017-04-11
赵亚东(1991-),男,在读硕士研究生,研究方向:农产品加工与利用,E-mail:zzczyd0424@163.com。
*通讯作者:党斌(1980-),男,硕士,副研究员,研究方向:杂粮营养功能评价及加工利用,E-mail:dangbin811@tom.com。
青海省科技厅农业科技成果转化与推广计划(2015-NK-504);青海省创新平台建设项目(2017-ZJ-Y31)。

