茶多酚对冰藏大黄鱼品质及微生物的影响
雷丽萍,朱跃骅,张剑,杨文鸽,李普友,刘艳杰,钱云霞*
1. 宁波大学海洋学院,浙江 宁波 315211;2. 浙江海味鲜海洋科技发展股份有限公司,浙江 台州 318000
茶多酚对冰藏大黄鱼品质及微生物的影响
雷丽萍1,朱跃骅1,张剑1,杨文鸽1,李普友2,刘艳杰1,钱云霞1*
1. 宁波大学海洋学院,浙江 宁波 315211;2. 浙江海味鲜海洋科技发展股份有限公司,浙江 台州 318000
采用生物保鲜剂茶多酚对大黄鱼进行浸泡处理,研究了大黄鱼在冰藏保鲜过程中品质及微生物的变化。通过测定感官评分值、菌落总数、pH值、挥发性盐基氮(TVB-N值)及硫代巴比妥酸值(TBA值),评价大黄鱼在冰藏过程中品质变化,同时采用16 S rDNA克隆文库及限制性内切酶片段长度多态性(RFLP)技术对大黄鱼在冰藏条件下的腐败菌进行分析。结果表明,在冰藏过程中,茶多酚处理组的菌落总数、pH值、TVB-N值、TBA值均低于对照组,感官评分值优于对照组,大黄鱼在冰藏条件下货架期由12~16 d延长至20~24 d,茶多酚处理组保鲜效果较好。新鲜大黄鱼细菌种类比较丰富,达15种类型,而腐败后细菌种类明显减少,在腐败末期,对照组(20 d)的细菌种类有8种,其中假单胞菌属(Pseudomonas)和希瓦氏菌(Shewanella)为主要腐败菌,所占比例分别为43.7%和39.6%。而茶多酚处理组(24 d)细菌种类较对照组更少,其腐败菌主要为假单胞菌属(Pseudomonas),占细菌总量的76.8%。
大黄鱼;茶多酚;冰藏保鲜;RFLP;腐败菌
大黄鱼(Pseudosciaena crocea)是我国近海重要的经济鱼类[1],也是中国特有的地方性鱼类,主要分布于黄海南部、东海、台湾海峡、南海雷州半岛以东[2]。其肉质鲜嫩,富含蛋白质、维生素和无机质等[3],具有很高的营养价值。然而,相对于其他肉制品,鱼肉极易腐败变质。新鲜鱼肉的腐败主要是因为某些细菌生长和代谢生成胺、硫化物、醛、酮、酯、有机酸等,产生不良气味,味道劣变,使食品变得感官上不可接受,这些细菌就是该鱼肉的特定腐败菌(Specific spoilage organism,SSO)[4-6]。一般来说,SSO种类单一,在特定环境里有较强的忍耐力,在食品贮藏过程中逐步处于优势地位,最终导致食品腐败。
生物保鲜剂是指从动植物、微生物中提取的天然的或利用生物工程技术改造获得的对人体安全的保鲜剂[7],具有安全、无毒、高效等优点,目前已被普遍应用于水产品保鲜中,用以延长水产品的保鲜期。茶多酚是茶叶中一类主要的化学成分,活性成分是以儿茶素为代表的黄烷醇类,由于儿茶素有较强的清除自由基的能力[8],因此,茶多酚具有较好的抗氧化作用和抑菌作用[9],已作为主要的生物保鲜剂应用于食品的保鲜防腐[10]。
为了抑制大黄鱼在贮藏过程中特定腐败菌的生长,本文用茶多酚浸泡处理大黄鱼后进行冰藏保鲜,期间定期测定其感官评分值、细菌总数、pH值、TVB-N值、TBA值,以评价茶多酚对大黄鱼的冰藏保鲜效果。研究水产品的特定腐败菌,对水产品的质量预测和延长货架期特别重要,由于传统的平板培养形态鉴定方法操作繁琐、准确性低、耗时长,而分子生物学方法可以方便、快捷地获得菌落指纹和特征核苷酸序列等[11],故本文采用16 S rDNA克隆文库和RFLP相结合的技术,分析了大黄鱼未浸泡及使用茶多酚浸泡后在冰藏条件下的特定腐败菌,为大黄鱼的贮藏保鲜技术提供理论依据。
1 材料与方法
1.1 实验材料与试剂
大黄鱼,由浙江海味鲜海洋科技发展股份有限公司提供;茶多酚(食品级,淡黄色粉末,95%),购自宁波市镇海海鑫生物制品有限公司;丙二醛(MDA)测试盒,南京建成生物工程研究所。其余试剂均为分析纯。
1.2 实验方法
1.2.1 样品处理
将鲜活大黄鱼以碎冰冻死后,无菌超纯水清洗,然后置于无菌纱布上沥干,平行于脊骨将鱼肉切分成3.0 cm×3.0 cm×1.0 cm的鱼片,将鱼片均匀分成2组。一组用0.20%茶多酚浸泡(TP处理组)[12],另一组用无菌超纯水浸泡(对照组C);浸泡10 min后,取出,无菌纱布上沥干后用蒸煮袋包装[13],置于碎冰上,于冰箱冷藏室中冰浴贮藏。其间每4 d测定1次化学成分和微生物含量,并进行感官评价,同时提取鱼肉微生物 DNA。每次随机取样 3组,测平均值。
1.2.2 感官评分
由6人组成专人评定小组,分别从鱼片的气味、色泽和状态进行评分[14]。按照欧盟1995年感官评定测试方法规定的9级评分法,感官最高分值为9分,其中:7~9分(不包括9分)为新鲜;6~7分(不包括7分)为感官一级鲜度;4~6分(不包括6分)为感官二级鲜度;小于4分为不新鲜[15]。
1.2.3 细菌总数的测定
微生物菌落总数按照 GB 4789.2—2010《食品微生物学检验:菌落总数测定》方法[16],采用平板倾注法计数测定。
1.2.4 pH值测定
按GB/T 5009.45—2003酸度计法[17],称取5 g鱼肉于烧杯中剪碎,加入45 mL纯水,均质2 min,静置,取上清液,测其pH值。
1.2.5 挥发性盐基氮(TVB-N)的测定
按SC/T 3032—2007《水产品中挥发性盐基氮的测定》方法[18],使用半微量蒸馏法测定大黄鱼肌肉中TVB-N值。
1.2.6 硫代巴比妥酸(TBA值)测定
用丙二醛(MDA)测试盒进行测定。
1.2.7 RFLP分析方法
(1)细菌总DNA提取和16S rDNA的PCR扩增
CTAB法提取大黄鱼肌肉细菌总 DNA,具体参考 Shin等[19]的方法。使用细菌通用上下游引物:27F(5'-AGAGTTTGATCCTGGCT CAG-3'),1492R(5'-GGTTACCTTGTTACGA CTT-3')对细菌总DNA的16S rDNA进行扩增[20]。PCR反应体系(50 μL):4 μL DNA,25 μL primx Taq(TaKaRa公司),上下游引物各1 μL,19 μL H2O。PCR条件:94℃,5 min;94℃,30 s;53℃,45 s;72℃,90 s;30个循环;72℃,10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳检测,其余用 DNA凝胶回收试剂盒(上海碧云天生物技术有限公司)切胶纯化。
(2)16 S rDNA克隆文库构建及RFLP分析
将纯化的 16 S rDNA 扩增产物与pMD-18T载体连接后转化至E. coli DH5α感受态细胞,随机挑取50个阳性克隆子于25%甘油中,置于-80℃低温冰箱中保存。用pMD-18T载体通用引物M13f/r对这些克隆子进行扩增,PCR条件:94℃,5 min;94℃,30 s;53℃,45 s;72℃,90 s;循环35次;最后72℃延伸10 min。将PCR产物用Msp Ⅰ(TaKaRa公司)限制性内切酶消化(37℃过夜),酶切体系(20 μL):6 μL PCR产物,2 μL 10×Buffer,2 μL BSA,1 μL Msp Ⅰ,9 μL H2O。酶切产物用3%琼脂糖凝胶电泳分析。
(3)测序及序列分析
把不同 RFLP分型的克隆子送上海英骏生物技术有限公司测序,将测得的16 S rDNA序列与GenBank中的序列进行Blast比对。
1.3 数据分析
实验结果用 Origin 8.5绘图,SPSS 17.0进行方差分析。P<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 感官评分的变化
冰藏过程中大黄鱼感官评分值变化见图1。从图中可以看出,茶多酚处理组与对照组的感官评分值在整个冰藏保鲜过程中都呈下降趋势。在保鲜前期,感官评分差异不大,而从第12天开始,茶多酚处理组和对照组差异显著(P<0.05),此时对照组已降为感官二级鲜度(感官评分值5.6),茶多酚处理组仍在一级鲜度范围内;第16天时对照组已为感官不新鲜(感官评分值3.8),而茶多酚处理组还属于感官二级鲜度范围内(感官评分值5.9),直至第20天时感官评定结果才为不新鲜。可见,茶多酚浸泡处理可延缓大黄鱼在冰藏过程中品质的劣变。
2.2 菌落总数的变化
微生物是导致鱼类等水产品腐败的主要原因,通过测定菌落数可以判断鱼类的腐败程度[21]。
参考SC 127—1984标准,新鲜大黄鱼的菌落总数小于 104CFU·g-1为一级品,菌落总数104~106CFU·g-1为二级品[22]。图2-A为大黄鱼在冰藏过程中菌落总数的变化趋势。结果显示,茶多酚处理组和对照组菌落数都随着冰藏时间的延长呈上升趋势,新鲜大黄鱼的初始菌落总数为103.28CFU·g-1,茶多酚处理组和对照组从第8天开始菌落数差异显著(P<0.05),且对照组在第8天菌落总数大于104CFU·g-1,此时茶多酚处理组未超过104CFU·g-1;对照组在冰藏第16天时细菌总数已超106CFU·g-1,而茶多酚处理组在第20天才达106CFU·g-1。分析显示,由于在大黄鱼冰藏保鲜过程中茶多酚浸泡处理有明显的抑菌作用,所以茶多酚处理组菌落总数比对照组少且增长较缓慢。

图1 冰藏过程中大黄鱼的感官评分值变化Fig. 1 Changes in sensory evaluation values of Pseudosciaena crocea during iced storage
2.3 pH值的变化
经过 0.2%茶多酚浸泡处理,大黄鱼冰藏期间pH值的变化如图2-B所示。从图中可以看出,在整个冰藏过程中,茶多酚处理组的pH值都显著低于对照组(P<0.05),可能是因为茶多酚具有多酚结构,酚羟基游离出的H+,对降低大黄鱼肉的pH起到了一定的作用[23]。同时,在冰藏前期对照组和茶多酚处理组的pH值呈现降低趋势,这可能是因为鱼死后肌肉内会进行酵解反应[24],但随着鱼肉腐败,细菌大量生长繁殖,导致碱性物质生成[25],从冰藏第4天开始,pH又逐渐上升。
2.4 挥发性盐基氮的变化
挥发性盐基氮(TVB-N)是指肉类食品在贮藏过程中蛋白质在微生物及酶的作用下分解产生氨及胺类等挥发性的碱性含氮化合物。TVB-N值与水产品的鲜度有较好的相关性[26],因而,被用来评价鱼类等水产品的腐败程度[27]。图 2-C显示了大黄鱼在冰藏期间TVB-N值的变化情况,在冰藏前期,茶多酚处理组和对照组的差异不显著;大黄鱼最初的TVB-N含量为98 mg·kg-1,而自第8天后,茶多酚处理组TVB-N值的上升速度明显慢于对照组,且显著低于对照组(P<0.05);第20天时,对照组的TVB-N值已达到342.5 mg·kg-1,而茶多酚处理组在保鲜第24天时TVB-N值才增至 326.2 mg·kg-1,可能是由于茶多酚具有抑菌活性,能减慢微生物的生长繁殖,使蛋白等物质的降解缓慢,从而抑制了TVB-N值的增加。
2.5 硫代巴比妥酸的变化
硫代巴比妥酸(TBA)是指动物性油脂中不饱和脂肪酸经氧化分解后产生的衍生物如丙二醛(MDA)等与TBA试剂反应的结果。据Alasalvar等[28]的研究,TBA值可以用来评价鱼类在贮藏过程中质量的变化情况。由图2-D可知,在冰藏期间茶多酚处理组和对照组的TBA值均逐渐上升,但茶多酚处理组保持在较低水平。对照组TBA值在冰藏第20天达到最大值,0.80 mg·kg-1,此时,茶多酚处理组TBA值为0.69 mg·kg-1。结果表明茶多酚处理能够有效抑制大黄鱼冰藏过程中脂肪的氧化,这是因为茶多酚能有效清除脂肪氧化过程中产生的自由基,还能结合氧化酶清除活性氧,螯合金属离子[29],所以有较好的抗氧化性,能减缓脂肪的氧化分解。

图2 冰藏过程中大黄鱼肌肉理化指标的变化Fig. 2 Changes in the physical and chemical indicators of Pseudosciaena crocea muscle during iced storage
2.6 大黄鱼细菌16 S rDNA克隆文库的RFLP分析
为突破传统培养方法的局限性,本研究建立细菌16 S rDNA克隆文库,直接在分子水平上进行腐败菌鉴定。对新鲜鱼肉和保鲜终点腐败鱼肉(对照组和茶多酚处理组)的细菌总DNA构建了 16 S rDNA基因文库 L0(冰藏前)、L20(对照组冰藏20 d)、LTP24(茶多酚处理组冰藏24 d),最后各挑取50个阳性克隆子用Msp I进行RFLP分析。从图3可以看出,L0文库有15种RFLP分型,表明新鲜大黄鱼肉中细菌种类比较丰富,而 L20文库只有 8种RFLP分型(图4),LTP24文库为7种RFLP分型(图5)。
2.7 不同RFLP分型的克隆子测序及序列比对分析

图3 L0文库RFLP酶切图谱Fig. 3 RFLP restriction patterns of L0 library
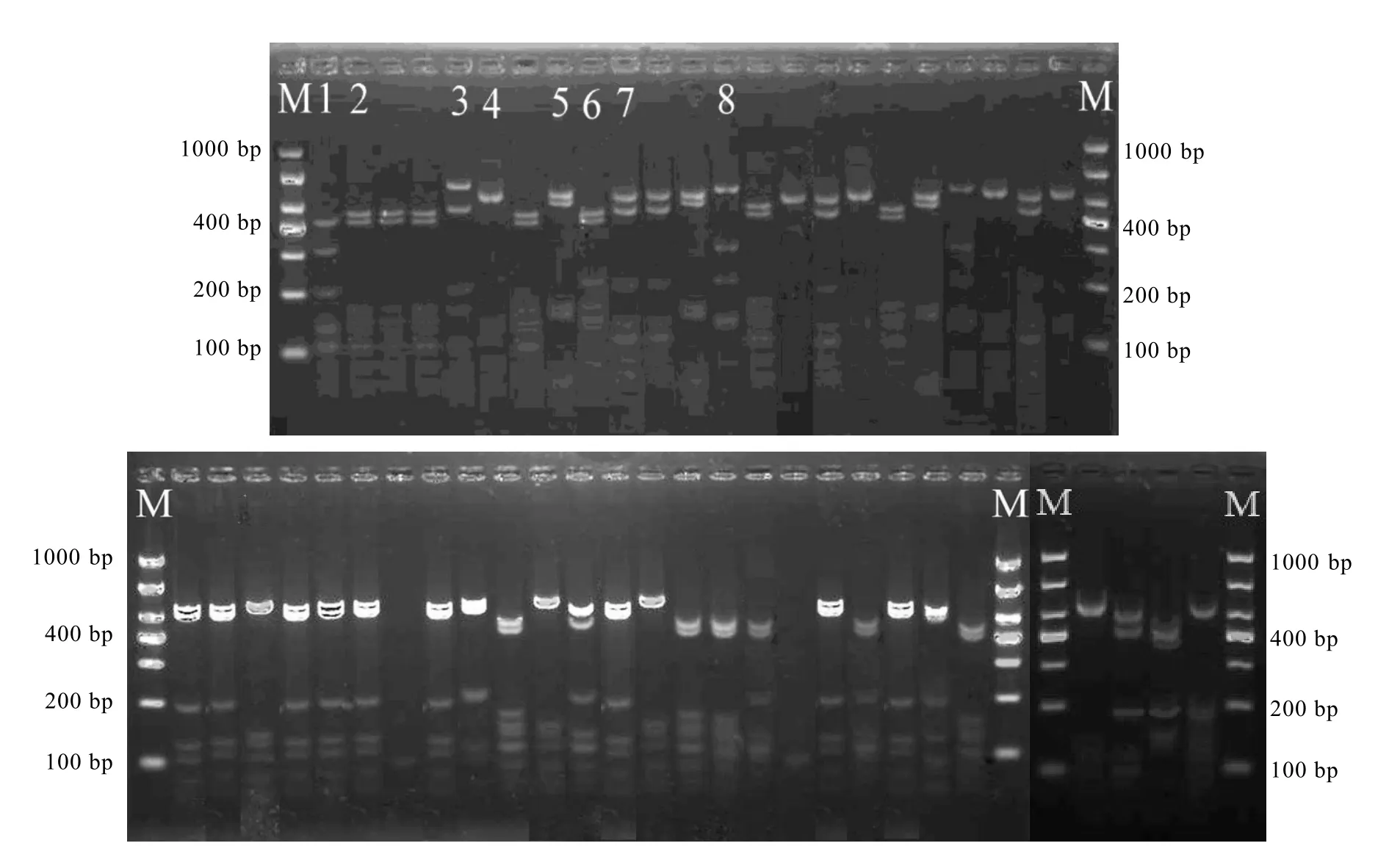
图4 L20文库RFLP酶切图谱Fig. 4 RFLP restriction patterns of L20 library
将各文库中不同分型的克隆子测序,并将测序得到的16 S rDNA序列用blastn比对NCBI的核酸数据库,对比后的结果见表1。由表1可知,L0文库的细菌种类较丰富,15种RFLP分型中含量最多的是气单胞菌属(Aeromonas sp.),主要为Aeromonas sp.和Uncultured Aeromonas sp.,所占比例为 40%。腐败末期,对照组样品(L20)的菌相有 8种,其中假单胞菌属(Pseudomonas)和希瓦氏菌(Shewanella)占绝对优势,分别为43.7%和39.6%,认为假单胞菌和希瓦氏菌是对照组的特定腐败菌(SSO);茶多酚处理组(LTP24)腐败终点的菌相有7种,假单胞菌属(Pseudomonas)所占比例最高,为 76.8%,表明假单胞菌属是茶多酚处理样的SSO。当达到货架终点期时,由于茶多酚的杀菌抑菌作用,茶多酚处理组比对照组菌相单一。因此,大黄鱼在冰藏条件下,对照组的SSO是假单胞菌和希瓦氏菌,这与Gram等[5]的研究结果一致;而茶多酚处理样的SSO是假单胞菌属。

图5 LTP24文库RFLP 酶切图谱Fig. 5 RFLP restriction patterns of LTP24 library
3 结论
由本实验结果分析可知,经茶多酚处理后的大黄鱼,在冰藏条件下,其感官评分值下降缓慢,鱼肉的细菌总数、pH值、TVB-N值、TBA值明显低于对照组,有效延长货架期4~8 d,该结果与陈晓眠等[30]对罗非鱼冷藏保鲜的研究结果一致。16 S rDNA克隆文库及RFLP技术可以准确地确定水产品的特定腐败菌种,研究结果显示,新鲜大黄鱼肉中细菌种类丰富;在冰藏末期,对照组未处理样的优势腐败菌是假单胞菌和希瓦氏菌;0.2%茶多酚处理样的特定腐败菌为假单胞菌属。这也进一步证明了茶多酚对水产品中腐败菌的生长有较好的抑制作用,进而能延长水产品的货架期。
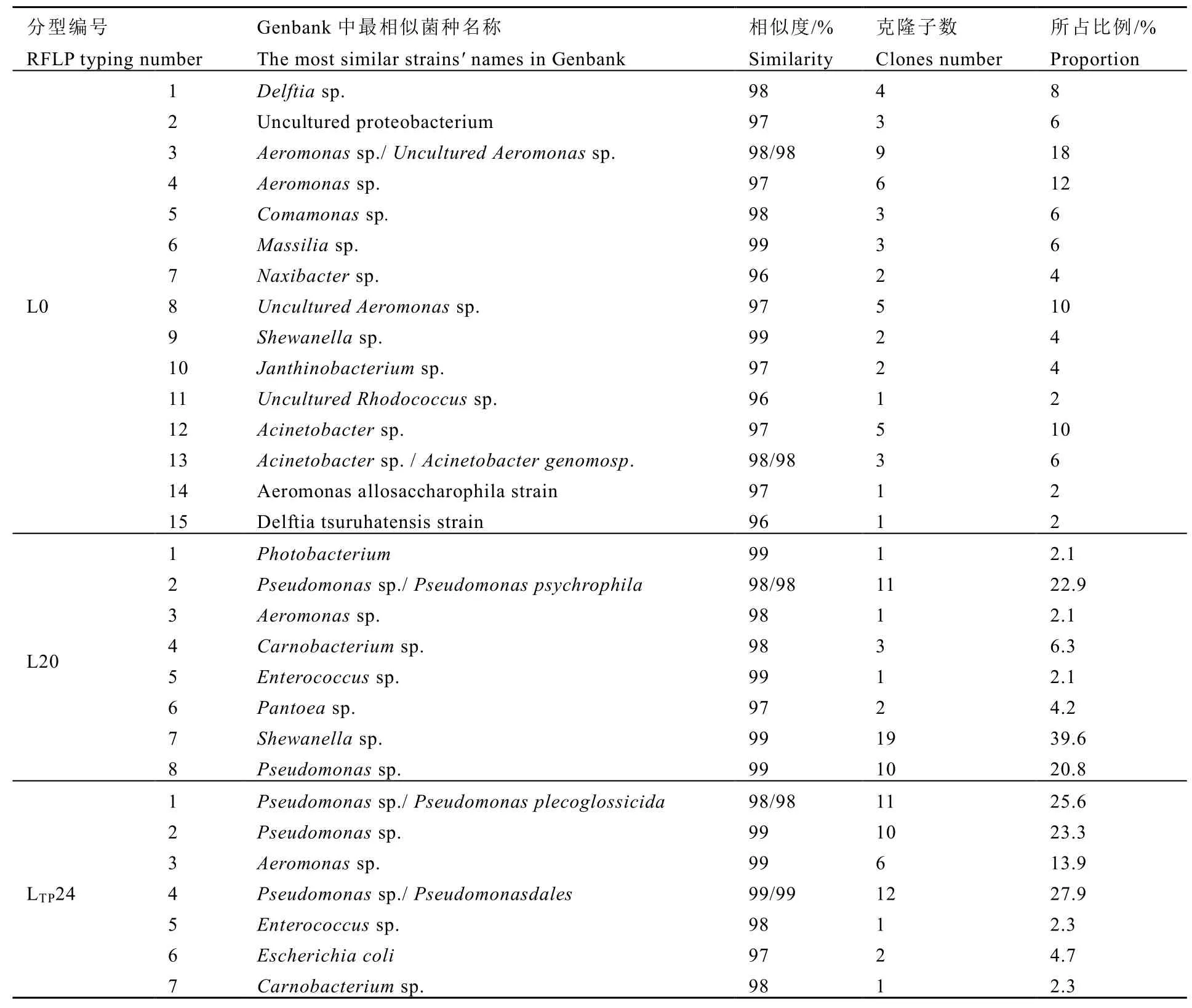
表1 各RFLP分型所含克隆子数及16S rDNA序列比对分析Table 1 Comparison of the number of clones and the sequence alignment of 16S rDNA in each RFLP typing
[1]张旭光, 李婷婷, 朱军莉, 等. 茶多酚处理对冷藏养殖大黄鱼品质的影响[J]. 茶叶科学, 2011, 31(2): 105-111.
[2]杨华, 陆森超, 张慧恩, 等. 超高压处理对养殖大黄鱼风味及品质的影响[J]. 食品科学, 2014, 35(16): 244-249.
[3]李婷婷, 励建荣, Jinru Chen, 等. 迷迭香提取物对大黄鱼货架期的影响[J]. 食品工业科技, 2013, 34(16): 313-317.
[4]Hozbor MC, Saiz AI, Yeannes MI, et al. Microbiological changes and its correlation with quality indices during aerobic iced storage of sea salmon (Pseudopercis semifasciata) [J]. Food Science and Technology, 2006, 39(2): 99-104.
[5]Gram L, Huss H H. Microbiological spoilage of fish and fish products [J]. International Journal of Food Microbiology, 1996, 33(1): 121-137.
[6]Dalgaard P. Qualitative and quantitative characterization of spoilage bacterium from packed fish [J]. International Journal Food Microbiology, 1995, 26: 319-333.
[7]蒋慧亮, 李学英, 杨宪时, 等. 生物保鲜剂对鱼类腐败菌抑菌效果比较及抑菌机理研究[J]. 食品科学, 2012, 33(23): 31-35.
[8]宋冠群, 林金明. 茶多酚分析方法研究与最新进展[J]. 世界科技研究与发展, 2004, 26(1): 41-51.
[9]覃思, 吴卫国. 茶多酚对蛋白质功能特性影响研究初探[J].中国食物与营养, 2005(5): 32-33.
[10]Qin Yuyue, Yang Jiyi, Lu Hongbo, et al. Effect of chitosan film incorporated with tea polyphenol on quality and shelf life of pork meat patties [J]. International Journal of Biological Macromolecules, 2013, 61(10): 312-316.
[11]Juste A, Thomma B P, Lievens B. Recent advances in molecular techniques to study microbial communities in food-associated matrices and processes [J]. Food Microbiology, 2008, 25(6): 745-61.
[12]赵进, 汪金林, 励建荣, 等. 茶多酚浸泡大黄鱼片真空包装 0℃贮藏期间品质变化特性[J]. 茶叶科学, 2012, 32(4): 297-304.
[13]Tingting Li, Wenzhong Hu, Jianrong Li, et al. Coating effects of tea polyphenol and rosemary extract combined with chitosan on the storage quality of large yellow croaker (Pseudosciaena crocea) [J]. Food Control, 2012, 25(1): 101-106.
[14]Williams S K, Rodrick G E, West R L. Sodium lactate affects shelf life and consumer acceptance of fresh catfish (Ictalurus nebulosus, marmoratus) fillets under simulated retail conditions [J]. Journal of Food Science, 2010, 60(3): 636-639.
[15]MH Lee. Official and standardized methods of analysis [J]. The Royal Society, 1995, 15(2): 5-6.
[16]中华人民共和国卫生部. GB 4789.2—2010 食品微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2010: 1-5.
[17]中华人民共和国卫生部. 中国国家标准化管理委员会. GB/T 5009.45—2003 水产品卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003: 362-363.
[18]中华人民共和国农业部. SC/T 3032—2007 水产品中挥发性盐基氮的测定[S]. 北京: 中国农业出版社, 2007: 1-5.
[19]Shin H, Shintaro U. lsao E. Succession of bacterial and fungal communities during a traditional pot fermentation of rice vinegar assessed by PCR-mediated denaturing gradient gel electrophoresis [J]. Food Microbiology, 2006, 109(1): 79-57.
[20]滕齐辉, 曹慧, 崔中利, 等. 太湖地区典型菜地土壤微生物16S rDNA的PCR-RFLP分析[J]. 生物多样性, 2006, 14 (4): 345-351.
[21]ARORA A, NAIR M G, STRASBURG G M. Structure-activity relationship for antioxidant activities of a series of flavonoids in a liposomal system [J]. Free Radical Biology & Medicine, 1998, 24(9): 1355-1363.
[22]中华人民共和国农牧渔业部. SC 127—1984 中华人民共和国农牧渔业部标准 鲜大黄鱼 鲜小黄鱼[S]. 北京: 中国标准出版社, 1984: 1-2.
[23]杨贤强. 茶多酚化学[M]. 上海: 上海科学技术出版社, 2003: 22-23.
[24]王慧敏, 王庆丽, 朱军莉. 鲈鱼在微冻贮藏下品质及优势腐败菌的变化[J]. 食品工业科技, 2013, 34(20): 330-335.
[25]Duan J, Jiang Y, Cherian G, et al. Effect of combined chitosan-krill oil coating and modified atmosphere packaging on the storability of cold-stored lingcod (Ophiodon elongates) fillets [J]. Food Chemistry, 2010, 122(4): 1035-1042.
[26]杨文鸽, 薛长湖, 徐大伦, 等. 大黄鱼冰藏期间 ATP关联物含量变化及其鲜度评价[J]. 农业工程学报, 2007, 23(6): 217-222.
[27]Ocañ o-Higuera V M, Marquez-Rí os E, Canizales-Dá vila M, et al. Postmortem changes in cazon fish muscle stored on ice [J]. Food Chemistry, 2009, 116(4): 933-938.
[28]Alasalvar C, Taylor K D A, Oksuz A, et al. Freshness assessment of cultured sea bream (Sparusaurata) by chemical, physical and sensory methods [J]. Food Chemistry, 2001, 72(1): 33-40.
[29]杜荣茂, 刘梅森, 何唯平. 天然功能性食品添加剂茶多酚[J]. 中国食品添加剂, 2004(2): 56-60.
[30]陈晓眠, 吴晓萍, 邓楚津, 等. 壳聚糖和茶多酚对罗非鱼冷藏保鲜效果比较[J]. 现代食品科技, 2011, 27(3): 279-320.
Effects of Tea Polyphenols on Quality and Microorganisms of Pseudosciaena crocea during Iced Storage
LEI Liping1, ZHU Yuehua1, ZHANG Jian1, YANG Wenge1, LI Puyou2, LIU Yanjie1, QIAN Yunxia1*
1. College of Marine Science, Ningbo University, Ningbo 315211, China; 2. Zhejiang Haiweixian Marine Sci-tech. Development Co. Ltd, Taizhou 318000, China
The quality and microorganisms changes of large yellow croaker (Pseudosciaena crocea) during iced storage were studied using tea polyphenols as bio-preservatives in this study. The sensory evaluation values, total bacteria, pH value, total volatile base nitrogen (TVB-N value) and thiobarbituric acid (TBA value) were measured to evaluate the quality change of Pseudosciaena crocea. The 16 S rDNA clone library and restriction fragment length polymorphism (RFLP) were used to analyze the spoilage bacteria under iced storage condition. The results indicated that the total bacteria, pH value, TVB-N value and TBA value of the dipping group were significantly lower than those of the control group, and the sensory evaluation values of large yellow croaker were better than that of the control group. The shelf-life of dipping group extended from 12-16 days to 20-24 days at iced storage. So the dipping group had better preservation effect. The bacterial species of fresh pseudosciaen a crocea were abundant, reaching 15 types. And the species of bacteria in the spoilage fish decreased obviously. At the end of spoilage period, there were 8 species of bacteria in the control group (20 d), among which Pseudomonas and Shewanella were the dominant species, occupying 43.7% and 39.6% of the total microorganisms. And bacterial species in tea polyphenol dippingsample (24 d) were less than the control group. The dominant spoilage bacteria of dipping samples was Pseudomonas, taking a percentage of 76.8%.
Pseudosciaena crocea, tea polyphenols, iced storage, RFLP, spoilage organism
Q946.84+1;Q939.1
A
1000-369X(2017)05-523-09
2017-03-31
2017-05-24
国家自然科学基金资助项目(31371793)、台州市椒江区科技计划项目(No.142035)
雷丽萍,女,硕士研究生,主要从事食品加工与安全方面的研究,E-mail:leiliping0810@163.com。*通讯作者:qianyunxia@nbu.edu.cn

