牙龈卟啉单胞菌脂多糖对树突状细胞成熟及功能影响的体外研究
苏 寒,毛 钊,陈 伟,郭 婷,闫 翔
·论 著·
牙龈卟啉单胞菌脂多糖对树突状细胞成熟及功能影响的体外研究
苏 寒1,毛 钊1,陈 伟1,郭 婷1,闫 翔2
目的研究牙龈卟啉单胞菌脂多糖(P. gingivalis-LPS)的刺激对大鼠树突状细胞(DCs)成熟及功能的影响,为探索DCs在牙周炎的发生发展中的作用机制提供实验依据。方法采用流式细胞学方法检测P. gingivalis-LPS和大肠杆菌脂多糖(E.coli-LPS)刺激下,CD11c+MHCⅡ+、CD11c+CD80+、CD11c+CD86+和CD11c+CD40+DCs的比率;采用ELISA法检测DCs分泌白介素-12(IL-12)、干扰素-γ(IFN-γ)、白介素-10(IL-10)和白介素-13(IL-13)的量。采用CCK8法检测与上述DCs共培养的CD4+T细胞的增殖;采用ELISA法检测T细胞分泌IL-2、IFN-γ、IL-10和IL-13的量。在上述的培养系统中加入Toll样受体4(TLR4)抑制剂(polymyxin B, PmB)或TLR2/TLR4抑制剂(oxidation of 1-palmitoyl-2-arachidonyl-sn- glycero-3-phosphorylcholine ,OxPAPC),观察TLR抑制剂对上述DCs成熟及功能的影响。结果P.gingivalis-LPS与E.coli-LPS均能刺激DCs成熟。TLR4抑制剂明显抑制E.coli-LPS组DCs成熟和抗原提呈功能,对P.gingivalis-LPS组DCs成熟和抗原提呈功能没有显著抑制。TLR2/TLR4抑制剂对P.gingivalis-LPS组DCs成熟和抗原提呈功能显著抑制。P.gingivalis-LPS组DCs分泌IL-12和IFN-γ的量低于E.coli-LPS组(P<0.05);P.gingivalis-LPS组DCs分泌IL-10 和IL-13的量高于E.coli-LPS组(P<0.05)。与P.gingivalis-LPS和E.coli-LPS共培养的DCs均能促进CD4+T细胞增殖。与P.gingivalis-LPS组DCs共培养的T细胞分泌IL-2和IFN-γ的量低于E.coli-LPS组(P<0.05);其分泌IL-10的量高于E.coli-LPS组(P<0.05)。结论P.gingivalis-LPS能促进DCs的成熟和抗原提呈功能。P.gingivalis-LPS刺激下的DCs促进Th2型免疫应答;E.coli-LPS刺激下的DCs促进Th1型免疫应答。P.gingivalis- LPS通过TLR2通路刺激DCs成熟;E.coli-LPS通过TLR4通路刺激DCs成熟。
树突状细胞;牙龈卟啉单胞菌脂多糖;大肠杆菌脂多糖;细胞表型;抗原提呈
牙龈卟啉单胞菌(Porphyromonas gingivalis,P.gingivalis)是慢性牙周炎发生发展的病原微生物,其致病成分包括脂多糖(lipopolysaccharide,LPS)、荚膜多糖、菌毛蛋白和牙龈素。P.gingivalis-LPS是牙周炎的主要致病因素之一,在牙周炎的病程中可引起不同类型的免疫和炎症反应[1]。树突状细胞(dendritic cells,DCs)广泛分布于组织和器官,是体内的专效抗原提呈细胞。未成熟DCs 摄取抗原,成熟DCs向naïve T淋巴细胞提呈抗原并刺激naïve T细胞分化为效应性T细胞。因此,DCs是先天性免疫应答和获得性免疫应答之间的重要桥梁[2]。微生物成分对DCs的刺激可上调DCs表面共刺激分子的表达并促进DCs分泌炎性细胞因子,促使辅助性T细胞(Th细胞)分化为Th1或Th2细胞[3-4]。上述过程始于DCs通过其表面的模式识别受体(pattern recognition receptors,PRRs)识别不同的抗原物质(包括病原微生物成分),因此PRRs及它们的配体在DCs成熟和发挥抗原提呈功能的过程中具有重要作用。目前已知牙周炎的发病机制为宿主对牙周病原体感染的免疫反应,宿主免疫系统在此过程中发挥重要作用。有研究发现牙周炎患者的牙龈上皮组织中存在着DCs,然而,这些DCs在牙周炎的发展过程中的确切作用机制还不清楚[5]。本研究拟对P. gingivalis-LPS对SD大鼠骨髓源性DCs成熟及功能的影响进行研究,为探索DCs在牙周炎病程中的可能作用机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 24只6~8周龄雄性SD大鼠(实验动物合格证号:SCXK2012-0014),体重200~220 g,养育在南京总医院医学实验动物中心无特定病原体(specific pathogen-free,SPF)环境中。动物实验的所有步骤均得到了南京大学动物使用和保护委员会的批准。
1.1.2实验试剂 RPMI 1640培养基、热灭活胎牛血清(FBS)、青链霉素 (均购自 HyClone公司);重组大鼠粒细胞-巨噬细胞集落刺激因子(rrGM-CSF)、重组大鼠IL-4(rrIL-4),IFN-γ、IL-12、IL-2、IL-10、IL-13大鼠ELISA试剂盒(均购自R&D公司);牙龈卟啉单胞菌脂多糖(P.gingivalis-LPS ,standard LPS from P. gingivalis)、TLR4信号抑制剂—Polymyxin B (PmB)、TLR2/TLR4 信号抑制剂—OxPAPC (均购自Invivogen公司);大肠杆菌脂多糖(E.coli-LPS,standard LPS from E.coli 0111:B4) (购自Sigma-Aldrich公司);anti-CD11c-PE,anti-MHCⅡ-APC,anti-CD86-FITC,anti-CD80-APC,anti-CD40-FITC抗大鼠单克隆流式抗体(均购自eBioscience公司);CD4抗大鼠单克隆抗体磁珠(购自Miltenyi公司);CCK8试剂盒(购自Dojindo公司)。
1.2 方法1.2.1 细胞培养 从SD大鼠的胫骨、股骨和肱骨新鲜收集全骨髓细胞,将细胞培养于加入了10%FBS、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基,并在其中加入10 ng/mL rrGM-CSF和1 ng/mL rrIL-4以促进DCs的生成。细胞培养于37 ℃饱和湿度、5%CO2的细胞孵育箱内,每隔1 d进行半量换液并保持所有的试剂浓度不变,收集悬浮的细胞。 培养6 d后,将收获的细胞以2×106/孔的密度培养于6孔细胞培养板中。将这些细胞随机分为7组:对照组、E.coli-LPS组、P.gingivalis-LPS组、E.coli-LPS+PmB组、E.coli-LPS+OxPAPC组、P.gingivalis- LPS+PmB组和P.gingivalis-LPS+OxPAPC组。依据分组将试剂按以下浓度加入培养基:E.coli-LPS 100 ng/mL;P.gingivalis-LPS 100 ng/mL;PmB 30 μg/mL;OxPAPC 30 μg/mL。其中,PmB和OxPAPC作为TLR抑制剂,均于E.coli-LPS和P.gingivalis-LPS加入培养基30 min前被添加到培养基中。培养48 h后,收集细胞悬浮液和粘附松散的细胞,采用流式细胞术检测细胞表面CD11c的表达,结果显示CD11c+细胞比例高于90%,这些细胞可被认为是DCs。
1.2.2细胞表型分析 细胞培养的第8天,收集、计数并用PBS冲洗各组细胞,将其再悬浮后以5×105/mL转至流式管。根据制造商的说明书分别将anti-CD11c-PE,anti-MHCⅡ-APC,anti-CD86-FITC,anti-CD80-APC,anti-CD40-FITC抗大鼠单克隆抗体加入流式管,阴性对照管加入同型对照抗体,在4 ℃黑暗环境中孵育细胞30 min,用PBS冲洗2次使细胞充分悬浮。采用流式细胞仪检测DCs表面分子的表达,采用flowjo7.6.1软件处理实验中获得的原始数据,分析各组双标CD11c+MHCⅡ+、CD11c+CD80+、CD11c+CD86+、CD11c+CD40+细胞的百分比。所有检测均一式3份进行独立实验。1.2.3细胞因子检测 DCs分泌的细胞因子可影响DCs的后续功能,采用ELISA法检测各组细胞培养上清液中干扰素-γ(IFN-γ)、白介素-12(IL-12)、IL-10和IL-13的含量,以研究E.coli-LPS和P.gingivalis-LPS刺激DCs分泌细胞因子的能力。细胞培养的第8天,收集各组细胞培养上清液以检测DCs分泌的细胞因子。采用大鼠IFN-γ、IL-12、IL-10和IL-13 ELISA试剂盒,按照制造商的说明,在酶标仪上采用450 nm波长测量各孔上清液的吸光值(A450),判定结果。所有检测均一式3份进行独立实验。
1.2.4混合淋巴细胞反应 取SD大鼠脾细胞,按照制造商的说明书,采用CD4+T细胞磁珠分选系统获取纯化的CD4+T细胞。采用PE-CD4抗体经流式细胞学检测,获得的CD4+T细胞纯度为90%~95%。将前述实验所获得的各组DCs与密度为2×106/mL的CD4+T细胞按照1∶10的比例在96孔培养板中共培养。每孔加入含有10%胎牛血清、100 U/mL青霉素 和100 μg/mL链霉素的RPMI-1640培养液200 μL,轻吹吸、混匀细胞悬液以保证DCs和T细胞充分有效的接触。将培养板放置于37 ℃饱和湿度、5% CO2的细胞孵育箱内培育72 h。细胞培育结束前4 h,按照制造商的说明书,在培养板的每孔内加入10 μL CCK-8。孵育4 h后,采用酶标仪测定A450 nm值,以确定T细胞的增殖。测定重复3次,取其平均值为最终结果。
如前所述,每一组的DCs均与CD4+T细胞按照1∶10的比例共培养72 h。采用ELISA试剂盒按照制造商的说明测定上清液中细胞因子IFN-γ、IL-2、IL-10和IL-13 A450 nm值,判定结果。所有检测均一式3份进行独立实验。

2 结 果
2.1E.coli-LPS和P. gingivalis-LPS促进DCs表面MHCⅡ、CD80、CD86和CD40分子的表达 各组CD11c+MHCⅡ+、CD11c+CD80+、CD11c+CD86+和CD11c+CD40+DCs比率如图1~4所示。将结果以直方图的形式表示如图5所示,与对照组相比,相同浓度的P.gingivalis-LPS和E.coli-LPS(100 ng/mL)均能显著上调DCs MHCⅡ、CD80、CD86、CD40的表达水平(P<0.05)。P. gingivalis-LPS和E.coli-LPS组间差异无统计学意义(P>0.05)。上述结果表明,P. gingivalis-LPS和E.coli-LPS均能刺激DCs成熟。

图1 各组 CD11c+MHCⅡ+ DCs流式细胞学结果

图2 各组 CD11c+CD80+ DCs 流式细胞学结果
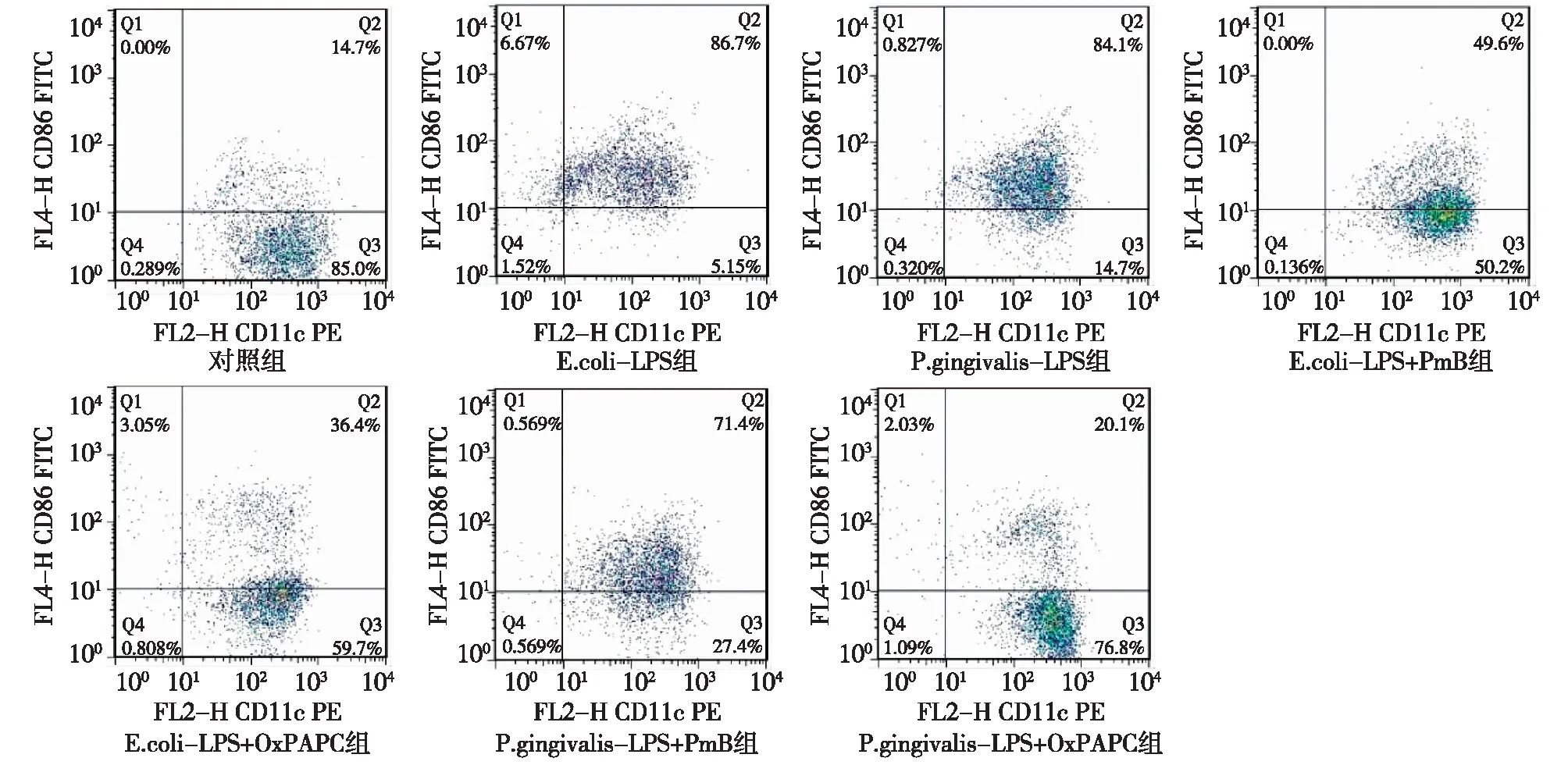
图3 各组 CD11c+CD86+ DCs 流式细胞学结果
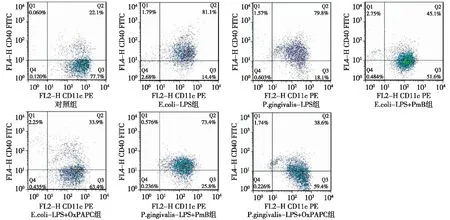
图4 各组 CD11c+CD40+ DCs 流式细胞学结果

E.coli-LPS和P. gingivalis-LPS均能促进DCs的成熟;PmB抑制E.coli-LPS的作用;OxPAPC抑制P. gingivalis-LPS的作用;*P<0.05图5 各组CD11c+MHCⅡ+、CD11c+CD80+、CD11c+CD86+ 和CD11c+CD40+ DCs流式细胞学结果直方图比较
2.2E.coli-LPS和P. gingivalis-LPS通过不同的TLRs通路刺激DCs成熟 E.coli-LPS+PmB组和E.coli-LPS+OxPAPC 组DCs MHCⅡ、CD80、CD86和 CD40表达均明显低于E.coli-LPS组(P<0.05);E.coli-LPS+PmB组和E.coli-LPS+ OxPAPC 组间差异无统计学意义(P>0.05)。这些结果表明,在E.coli-LPS培养系统中加入TLR4抑制剂后,DCs 表达MHCⅡ、CD80、CD86和 CD40能力下降,即TLR4抑制剂可以抑制E.coli-LPS诱导的DCs成熟。P.gingivalis-LPS+PmB组与P.gingivalis-LPS组相比,DCs MHCⅡ、CD80、CD86和CD40表达未见明显下降(P>0.05)。P.gingivalis-LPS+ OxPAPC 组DCs MHCⅡ、CD80、CD86和CD40表达明显低于P.gingivalis-LPS组与P.gingivalis-LPS+PmB组(P<0.05)。这些结果表明,TLR4信号抑制剂不能抑制P.gingivalis-LPS刺激DCs成熟,而TLR2/TLR4信号通路抑制剂可明显抑制P.gingivalis-LPS刺激DCs成熟。以上结果表明,E.coli-LPS对DCs的刺激依赖TLR4信号通路而P.gingivalis-LPS对DCs的刺激依赖TLR2信号通路。见图5。
2.3E.coli-LPS和P.gingivalis-LPS刺激DCs分泌不同类型的细胞因子 P.gingivalis-LPS组DCs分泌IL-12和IFN-γ的能力低于E.coli-LPS组(P<0.05),同时,P.gingivalis-LPS组DCs分泌IL-10和IL-13的能力高于E.coli-LPS组(P<0.05)。这些结果表明,E.coli-LPS刺激下的DCs诱导Th1型免疫反应,P.gingivalis-LPS刺激下的DCs诱导Th2型免疫反应。TLR4抑制剂(PmB)和TLR2/TLR4抑制剂(OxPAPC)的加入都可使E.coli-LPS组DCs IL-12、IFN-γ,IL-10和IL-13的分泌明显降低(P<0.05);E.coli-LPS+PmB组和E.coli-LPS+OxPAPC组间差异无统计学意义(P>0.05)。P.gingivalis-LPS组加入PmB后,DCs分泌IL-12、IFN-γ,IL-10和IL-13的量未见明显下降(P>0.05);P.gingivalis-LPS组加入OxPAPC后,DCs分泌IL-12、IFN-γ,IL-10和IL-13的量均显著下降(P<0.05);P.gingivalis-LPS+OxPAPC组这些细胞因子的量也明显低于P.gingivalis-LPS+PmB组。这些结果与前述流式细胞学结果相一致,即E.coli-LPS通过TLR4信号通路刺激DCs而P.gingivalis-LPS通过TLR2信号通路刺激DCs。见图6。

E.coli-LPS促进DCs分泌IL-12和IFN-γ, P.gingivalis-LPS促进DCs分泌IL-10和IL-13; PmB抑制E.coli-LPS的作用;OxPAPC抑制P. gingivalis-LPS的作用;*P<0.05图6 各组DCs分泌的细胞因子结果比较
2.4E.coli-LPS和P.gingivalis-LPS刺激后的DCs触发不同类型的T细胞反应 各组DCs与CD4+T细胞共培养后的CCK8法细胞计数实验结果见图7。在促进CD4+T细胞增殖方面,E.coli-LPS组DCs和P.gingivalis-LPS组DCs差异无统计学意义(P>0.05)。E.coli-LPS+PmB组DCs和E.coli-LPS+OxPAPC组DCs较E.coli-LPS组T细胞增殖均有明显下降(P<0.05),E.coli-LPS+PmB组和E.coli-LPS+OxPAPC组间差异无统计学意义(P>0.05)。P.gingivalis-LPS+PmB组DCs刺激T细胞增殖与P.gingivalis-LPS组相较未见明显下降(P>0.05)。P.gingivalis-LPS+OxPAPC组DCs刺激T细胞增殖较P.gingivalis-LPS组和P.gingivalis-LPS+PmB组可见明显下降(P<0.05)。
与各组DCs共培养的CD4+T细胞分泌细胞因子的定量分析结果见图8。P.gingivalis-LPS组T细胞分泌IL-2和IFN-γ的量低于E.coli-LPS组(P< 0.05),P. gingivalis-LPS组T细胞分泌IL-10的量高于E. coli-LPS组(P<0.05),2组T细胞分泌IL-13的量差异无统计学意义(P>0.05)。这些结果与E.coli-LPS或P. gingivalis-LPS刺激DCs分泌不同类型细胞因子的结果相一致,说明受E.coli-LPS刺激的DCs具有激发Th0细胞向Th1细胞转化的趋势;受P.gingivalis-LPS刺激的DCs具有激发Th0细胞向Th2细胞转化的能力。与E.coli-LPS+PmB组DCs和E.coli-LPS+OxPAPC组DCs共培养的T细胞分泌的IL-2、IFN-γ、IL-10和IL-13与E.coli-LPS组相比均明显下降,E.coli-LPS+PmB组和E.coli-LPS+OxPAPC组之间差异无统计学意义(P>0.05)。与P.gingivalis-LPS+ PmB组DCs共培养的T细胞分泌的IL-2、IFN-γ、IL-10和IL-13与P.gingivalis-LPS组相比差异无统计学意义(P>0.05)。P.gingivalis-LPS+OxPAPC组T细胞分泌的IL-2、IFN-γ、IL-10和IL-13明显低于P.gingivalis-LPS组和P.gingivalis-LPS+PmB组(P<0.05)。这些结果与前述结果相一致,表明E.coli-LPS通过TLR4信号通路刺激DCs而P.gingivalis- LPS通过TLR2信号通路刺激DCs。
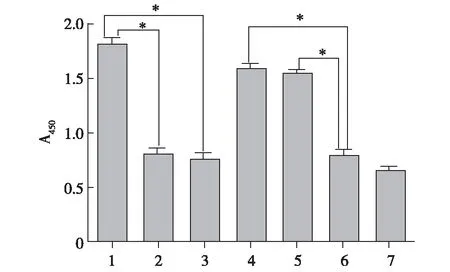
1:E.coli-LPS组;2:E.coli-LPS+PmB组;3:E.coli-LPS+OxPAPC组;4:P.gingivalis-LPS组;5:P.gingivalis-LPS+PmB组;6:P.gingivalis-LPS+OxPAPC;7:对照组 E.coli-LPS和P.gingivalis-LPS均可促进CD4+T细胞增殖;PmB抑制E.coli-LPS的作用;OxPAPC抑制P. gingivalis-LPS的作用;*P<0.05
图7 CCK-8法检测各组DCs与CD4+T细胞共培养的T细胞增殖结果

E.coli-LPS促进与DCs共培养的T细胞分泌IL-2和IFN-γ, P.gingivalis-LPS促进与DCs共培养的T细胞分泌IL-10; PmB抑制E.coli-LPS的作用;OxPAPC抑制P. gingivalis-LPS的作用;*P<0.05
图8与各组DCs共培养的CD4+T细胞分泌的细胞因子结果比较
3 讨 论
P.gingivalis-LPS是牙周炎的主要致病因素之一,其对于牙周组织细胞的作用一直是研究的热点[6]。E.coli-LPS和P.gingivalis-LPS虽然同为LPS,其两者对于不同细胞系的作用途径和作用结果不尽相同。Kirikae等[7]研究表明,P.gingivalis-LPS能够刺激TLR4缺失的C3H/HeJ小鼠巨噬细胞发挥抗炎作用。Jones等[8]研究指出,E.coli-LPS刺激大鼠牙龈成纤维细胞分泌更多的IL-6、iNOS和MCP-1而P.gingivalis-LPS刺激大鼠巨噬细胞分泌更多的IL-6、IL-1和MCP-1。Barksby等[9]研究表明,E.coli-LPS通过TLR4通路激活单核细胞而P.gingivalis-LPS通过TLR2通路激活单核细胞。Jotwani等[10]研究指出,P.gingivalis-LPS刺激单核细胞来源DCs成熟需要TLR2和TLR4双通路。Diya等[11]研究表明,E.coli-LPS和P.gingivalis-LPS通过不同的信号通路刺激THP-1细胞,TLR2-JNK通路在P.gingivalis-LPS引起的慢性牙周炎病程中起重要作用。Sun等[12]研究指出,P.gingivalis-LPS通过TLR2通路刺激THP-1细胞产生内毒素耐受而E.coli-LPS通过TLR4通路刺激THP-1细胞产生内毒素耐受。这些差异产生的原因可能在于P.gingivalis-LPS和E.coli-LPS脂质A的亲水性二磷酸盐构架不同导致P.gingivalis-LPS和E.coli-LPS的化学结构有所不同,致使P.gingivalis-LPS和E.coli-LPS对TLR的亲和力产生差异[13]。
有研究证实,健康牙龈、牙龈炎牙龈和牙周炎牙龈的上皮和结缔组织中都存在着朗格汉斯细胞(Langerhans cells,LCs)和DCs[14]。DCs作为先天性免疫和获得性免疫之间的桥梁在抗微生物感染方面发挥着至关重要的作用,在牙周病的病程中,DCs的分布和表型的变化调节着牙周免疫应答[15]。P.gingivalis-LPS是公认的牙周主要致病成分,为了研究在牙周病的发生、发展过程中,P.gingivalis-LPS和DCs的相互作用,我们进行了本研究。
近期已发表的研究中,学者们普遍采用浓度为10~200 ng/mL的LPS以研究其对于不同细胞系的作用[16-17]。本研究中,我们采用100 ng/mL的P.gingivalis-LPS及100 ng/mL的E.coli-LPS在体外与DCs共培养,以评价P.gingivalis-LPS和E.coli-LPS在促进DCs成熟和发挥抗原提呈功能方面的作用。
Polymyxin B (PmB)是由类芽孢杆菌polymixa产生的环状阳离子抗生素肽,PmB已经被证实可阻断TLR4通路从而抑制LPS的作用[18]。LPS是G-细菌细胞壁的主要成分,脂质A是其有效致病成分。阳离子属性的PmB与阴离子属性的脂质A相结合,从而抑制LPS生物学效应的发挥[19]。OxPAPC由1-棕榈酰-2-花生四烯-sn-甘油-3-磷酰胆碱(phosphorylcholine,PAPC)氧化而来,是含有sn-2全长的氧化磷脂及其残留碎片的混合物。OxPAPC可同时抑制细菌脂肽和LPS的信号通路,已经被证实为TLR2和TLR4的抑制剂[20]。细胞上的CD14、LPS结合蛋白(LPS-binding protein,LBP)和髓样分化蛋白2(myeloid differential protein 2,MD2)可与细菌脂质相结合,这些蛋白与TLR共同构成LPS受体复合物,被称为TLR辅助蛋白。OxPAPC通过与这些TLR辅助蛋白相结合,导致LPS无法与LPS受体复合物相结合,从而抑制TLR2和TLR4信号转导[21]。
本研究结果显示,在E.coli-LPS培养系中加入PmB后,DCs成熟、分泌细胞因子及其与CD4+T共培养后T细胞增殖、分泌炎症因子均被明显抑制,这些结果表明,对于DCs,E.coli-LPS是其TLR4配体。在P.gingivalis-LPS培养系中加入PmB后,DCs成熟、分泌细胞因子及其与CD4+T共培养后T细胞增殖、分泌炎症因子均未见明显下降;而在P.gingivalis-LPS培养系中加入OxPAPC后,DCs成熟、分泌细胞因子及其与CD4+T共培养后T细胞增殖、分泌炎症因子均被明显抑制,这些结果表明,对于DCs,P.gingivalis-LPS是其TLR2配体。
在DCs抗原提呈功能方面,本研究结果显示,P.gingivalis-LPS组DCs分泌的IFN-γ和IL-12较E.coli-LPS组少,P.gingivalis-LPS组DCs分泌的IL-10和IL-13较E.coli-LPS组多。其后的混合淋巴细胞反应结果显示,与P.gingivalis-LPS组DCs共培养的T细胞分泌IFN-γ和IL-2的量少于与E.coli-LPS组DCs共培养的T细胞,与P.gingivalis-LPS组DCs共培养的T细胞分泌IL-10的量多于与E.coli-LPS组DCs共培养的T细胞。这些结果表明,较之E.coli-LPS,P.gingivalis-LPS刺激下的DCs具有更强的促进Th2型免疫反应的能力。
本研究通过体外实验揭示了P.gingivalis-LPS和E.coli-LPS在促进DCs成熟和抗原提呈功能方面的不同作用途径。同时,本研究阐释了P.gingivalis-LPS刺激下DCs的免疫反应,其结果提示P.gingivalis-LPS刺激导致的DCs成熟和抗原提呈并促进Th2型免疫反应可能是牙周炎病程中细胞免疫和体液免疫共同发生的重要发病机制。这些实验结果有助于进一步阐明DCs在牙周炎的发生、发展过程中的可能作用机制。
[1] Marchesan JT,Morelli T,Lundy SK,etal. Divergence of the systemic immune response following oral infection with distinct strains of Porphyromonas gingivalis[J]. Mol Oral Microbiol,2012,27(6): 483-495.
[2] Vroman H,van den Blink B,Kool M. Mode of dendritic cell activation: the decisive hand in Th2/Th17 cell differentiation. Implications in asthma severity? [J] Immunobiology,2015,220(2): 254-261.
[3] 陈 哲,胡明道,田大广,等.重组腺病毒介导人类白细胞抗原-G基因转染恒河猴树突状细胞对T细胞的增殖作用[J]. 医学研究生学报,2017,30(1):5-9.
[4] 周建光,杨 梅,曹海涛,等.淋巴细胞亚群的检测在临床的应用[J]. 东南国防医药,2015,17(3):298-300,321.
[5] Hajishengallis G,Tapping RI,Harokopakis E,etal. Differential interactions of fimbriae and lipopolysaccharide from Porphyromonas gingivalis with the Toll-like receptor 2-centred pattern recognition apparatus[J]. Cellular Microbiol, 2006,8(10): 1557-1570.
[6] Kocgozlu L,Elkaim R,Tenenbaum H,etal. Variable Cell Responses to P-gingivalis Lipopolysaccharide[J]. J Dent Res,2009,88(8): 741-745.
[7] Kirikae T,Nitta T,Kirikae F,etal.Lipopolysaccharides (LPS) of oral black-pigmented bacteria induce tumor necrosis factor production by LPS-refractory C3H/HeJ macrophages in a way different from that of Salmonella LPS[J]. Infect Immun,1999,67(4): 1736-1742.
[8] Jones KJ,Ekhlassi S,Montufar-Solis D,etal. Differential cytokine patterns in mouse macrophages and gingival fibroblasts after stimulation with porphyromonas gingivalis or Escherichia coli lipopolysaccharide[J]. J Periodontol,2010,81(12): 1850-1857.
[9] Barksby HE,Nile CJ,Jaedicke KM,etal. Differential expression of immunoregulatory genes in monocytes in response to Porphyromonas gingivalis and Escherichia coli lipopolysaccharide[J]. Clin Exp Immunol,2009,156(3): 479-487.
[10] Jotwani R,Moonga BS,Gupta S,etal. Nuclear factor-kappa B p50 subunits in chronic periodontitis and Porphyromonas gingivalis lipopolysaccharide-pulsed dendritic cells[J]. Ann N Y Acad Sci,2010,1192: 278-285.
[11] Diya Z,Lili C,Shenglai L,etal. Lipopolysaccharide (LPS) of Porphyromonas gingivalis induces IL-1beta,TNF-alpha and IL-6 production by THP-1 cells in a way different from that of Escherichia coli LPS[J]. Innate Immun, 2008,14(2): 99-107.
[12] Sun Y,Li H,Sun MJ,etal. Endotoxin tolerance induced by lipopolysaccharides derived from Porphyromonas gingivalis and Escherichia coli: alternations in Toll-like receptor 2 and 4 signaling pathway[J]. Inflammation,2014,37(1): 268-276.
[13] Andrukhov O,Ertlschweiger S,Moritz A,etal. Different effects of P. gingivalis LPS and E.coli LPS on the expression of interleukin-6 in human gingival fibroblasts[J]. Acta Odontol Scand,2014,72(5): 337-345.
[14] Cutler CW,Jotwani R. Dendritic cells at the oral mucosal interface[J]. J Dent Res,2006,85(8):678-689.
[15] Cury PR,Furuse C,Rodrigues AE,etal. Interstitial and Langerhans' dendritic cells in chronic periodontitis and gingivitis[J]. Braz Oral Res,2008,22(3): 258-263.
[16] Kowsar R,Hambruch N,Marey MA,etal. Evidence for a novel,local acute-phase response in the bovine oviduct: progesterone and lipopolysaccharide up-regulate alpha 1-acid-glycoprotein expression in epithelial cells in vitro[J]. Mol Reprod Dev, 2014,81(9): 861-870.
[17] Padial-Molina M,Volk SL,Rios HF. Periostin increases migration and proliferation of human periodontal ligament fibroblasts challenged by tumor necrosis factor -alpha and Porphyromonas gingivalis lipopolysaccharides[J]. J Periodontal Res,2014,49(3): 405-414.
[18] Knobloch J,Feldmann M,Wahl C,etal. Endothelin receptor antagonists attenuate the inflammatory response of human pulmonary vascular smooth muscle cells to bacterial endotoxin[J]. J Pharmacol Exp Ther,2013,346(2): 290-299.
[19] Dadaglio G,Fayolle C,Zhang X,etal. Antigen Targeting to CD11b(+) Dendritic Cells in Association with TLR4/TRIF Signaling Promotes Strong CD8(+) T Cell Responses[J]. J Immunol,2014,193(4): 1787-1798.
[20] von Schlieffen E,Oskolkova OV,Schabbauer G,etal. Multi-Hit Inhibition of Circulating and Cell-Associated Components of the Toll-Like Receptor 4 Pathway by Oxidized Phospholipids[J]. Arterioscler Thromb Vasc Biol,2009,29(3): 356-362.
[21] Erridge C,Kennedy S,Spickett CM,etal. Oxidized phospholipid inhibition of Toll-like receptor (TLR) signaling is restricted to TLR2 and TLR4 - Roles for CD14,LPS-binding protein,and MD2 as targets for specificity of inhibition[J]. J Biol Chem, 2008,283(36): 24748-24759.
EffectsofPorphyromonasgingivalis-lipopolysaccharideonthematurationandfunctionsofdendriticcells
SU Han1,MAO Zhao1,CHEN Wei1,GUO Ting1,YAN Xiang2
( 1.DepartmentofStomatology,NanjingGeneralHospitalofNanjingMilitaryRegion,PLA,Nanjing210002,Jiangsu,China; 2.DepartmentofOrthodontics,NanjingStomatologicalHospital,MedicalSchoolofNanjingUniversity,Nanjing210008,Jiangsu,China)
AbstractObjectivedy the roles of P.gingivalis-LPS on the maturation and functions of DCs to provide experimental evidences to explore the possible mechanism of DCs in periodontitis.MethodsFlow cytometry was used to detect CD11c, MHCⅡ, CD80, CD86 and CD40 expression on DCs which were stimulated by P.gingivalis-LPS or E.coli-LPS and ELISA was used to detect IL-12, IFN-γ, IL-10 and IL-13 secreted by DCs. CCK8 was used to assay CD4+T cells proliferation after co-cultured with DCs stimulated by P.gingivalis-LPS or E.coli-LPS and ELISA was used to detect IL-2, IFN-γ, IL-10 and IL-13 secreted by T cells. TLR4 inhibitor (polymyxin B) or TLR2 and TLR4 inhibitor (OxPAPC) was added to P.gingivalis-LPS group and E.coli-LPS group to observe the effects of these two TLR inhibitors on the maturation and antigen-presenting functions of DCs.ResultsThe capacity of P.gingivalis-
LPS to stimulate DCs maturation was similar to that of E.coli-LPS. When TLR4 inhibitor was added to E.coli-LPS group, maturation and antigen-presenting functions of DCs were significantly inhibited. When TLR4 inhibitor was added to P.gingivalis-LPS group, maturation and antigen-presenting functions of DCs were not significantly inhibited. When TLR2 and TLR4 inhibitor was added to P.gingivalis-LPS group,maturation and antigen-presenting functions of DCs were significantly inhibited.The level of IL-12 and IFN-γ secreted by DCs in P.gingivalis-LPS group was significantly lower than that of E.coli-LPS group (P<0.05), meanwhile, IL-10 and IL-13 secreted by DCs in P.gingivalis-LPS group was significantly higher than that of E.coli-LPS group (P<0.05). DCs stimulated by both P.gingivalis-LPS and E.coli-LPS could promote the proliferation of CD4+T cells. The amount of IL-2 and IFN-γ secreted by T cells stimulated by DCs in P.gingivalis-LPS group was significantly lower than that of E.coli-LPS group (P<0.05), meanwhile, IL-10 secreted by T cells stimulated by DCs in P.gingivalis-LPS group was significantly higher than that of E.coli-LPS group (P<0.05).ConclusionP.gingivalis-LPS could promote DCs maturation and antigen-presenting functions. DCs stimulated by P.gingivalis-LPS are prone to induce a stronger Th2 cell responses while DCs stimulated by E.coli-LPS are prone to induce a stronger Th1 cell responses. P.gingivalis-LPS triggers DCs through TLR2 pathway while E.coli-LPS triggers DCs through TLR4 pathway.
Dendritic cells; P.gingivalis-LPS; E.coli-LPS; Phenotype; Antigen-presenting
R780.2
A
1672-271X(2017)05-0465-08
10.3969/j.issn.1672-271X.2017.05.005
2017-03-12;
2017-08-08)
(本文编辑:叶华珍; 英文编辑:王建东)
南京市医学科技发展重点项目(zkx15035);南京市第七批科技发展计划项目(201507043)
1.210002 南京,南京军区南京总医院口腔科;2.210008 南京,南京大学医学院附属口腔医院正畸科
闫 翔,E-mail: nj12345@126.com
苏 寒,毛 钊,陈 伟,等.牙龈卟啉单胞菌脂多糖对树突状细胞成熟及功能影响的体外研究[J].东南国防医药,2017,19(5):465-472.

