不伴基底动脉狭窄的脑桥旁正中梗死部位与发病机制的关系
郭婷婷, 田 英, 辛 岳, 王 健, 王玉洁
不伴基底动脉狭窄的脑桥旁正中梗死部位与发病机制的关系
郭婷婷1, 田 英2, 辛 岳1, 王 健1, 王玉洁1
目的探讨不伴基底动脉狭窄的脑桥旁正中梗死(PPI-BAS)部位与发病机制的关系。方法回顾性分析脑桥旁正中梗死(PPI)患者150例,将PPI-BAS按梗死部位分为累及脑桥腹侧表面组(vPPI-BAS)及未累及脑桥腹侧表面组(dPPI-BAS),以伴基底动脉狭窄的脑桥旁正中梗死(PPI+BAS)为对照,比较其年龄、性别、吸烟、饮酒、高脂血症、高同型半胱氨酸血症、冠心病、糖尿病、颅内颈内动脉系狭窄(ICAS)、颅外动脉粥样硬化(EAAS)、基底动脉高信号、梗死灶层面数≥2层、早期神经功能恶化(END)、高血压、腔隙性脑梗死(LI)和脑白质疏松(LA)是否有差异。结果150例患者中dPPI-BAS 组41例(27.3%),vPPI-BAS 组65例(43.3%),PPI+BAS组44例(29.3%),三组之间年龄、性别、吸烟、饮酒、高脂血症、高同型半胱氨酸血症差异无统计学意义(P>0.05),三组之间冠心病、糖尿病、高血压、LA分级、LI分级、ICAS、EAAS、基底动脉高信号、梗死灶层面数≥2层及END的差异有统计学差异(P<0.05)。vPPI-BAS组与PPI+BAS组各因素之间差异均无统计学差异(P>0.05)。与PPI+BAS组比较,dPPI-BAS组冠心病、糖尿病、ICAS 、EAAS、基底动脉高信号、梗死灶层面数≥2和END的发生率低,而高血压、LA 、LI 的发生率高(P<0.05)。vPPI-BAS组与dPPI-BAS组比较,vPPI-BAS组ICAS、EAAS、梗死灶层面数≥2层和END发生率高,dPPI-BAS组高血压、LA和LI发生率高(P<0.05)。多因素logistic回归分析结果显示:LA分级是dPPI-BAS的独立危险因素。结论vPPI-BAS多由动脉粥样硬化机制引起,dPPI-BAS多由小血管病机制引起。
脑桥旁正中梗死; 动脉粥样硬化; 小血管病
Abstract:ObjectiveTo analyze the correlation between the location of infarctions and pathogenesis among patients of paramedian pontine infarction without basilar artery stenosis.MethodsWe selected 150 patients with acute phase paramedian pontine infarction (PPI),the patients without basilar artery stenosis were divided into two groups: dPPI-BAS and vPPI-BAS. PPI+BAS were chosen as control group. Age,sex,smoking,alcohol drinking,hyperlipidaemia,hyperhomocysteinemia,coronary atherosclerotic heart disease,diabetes,ICAS,EAAS,basal artery high signal,infarcts level ≥2 layers,END,hypertension,lacunars cerebral infarction and leukoaraiosis were compared between groups.Results150 patients were enrolled,among them 41 patients with dPPI-BAS (27.3%),65 patients with vPPI-BAS (43.3%),44 patients with PPI+BAS (29.3%). Age,sex,smoking,alcohol drinking,hyperlipidaemia and hyperhomocysteinemia weren’t have statistically significant differences between groups(P>0.05),coronary atherosclerotic heart disease,diabetes,hypertension,LA scales,ICAS,EAAS,basal artery high signal,Infarcts level ≥2 layers and END had statistically significant differences(P<0.05). All the factors weren’t have statistically significant between vPPI-BAS group and PPI+BAS group(P>0.05). Compared to PPI + BAS group,the dPPI-BAS group had lower prevalences of coronary atherosclerotic heart disease,diabetes,ICAS,EAAS,basal artery high signal,infarcts level ≥2 layers and END,but had higher prevalences of hypertension,LA and LI(P<0.05). Between vPPI-BAS group and dPPI-BAS group,vPPI-BAS group had higher prevalences of ICAS,EAAS,Infarcts level ≥2 layers and END,while dPPI-BAS group had higher prevalences of hypertension,LA and LI (P<0.05). Multi-factor Logistic regression analysis shows: LA scales was independent prognostic factor for dPPI-BAS.ConclusionThe mechanism of vPPI-BAS was more likely atherosclerosis,and the mechanism of dPPI-BAS was more likely small vessel disease.
Keywords: Paramedian pontine infarction; Atherosclerosis; Small vessel disease
脑桥旁正中梗死(PPI)为脑桥旁正中动脉(基底动脉的穿支动脉-前内侧动脉[1])的供血区域发生的梗死,在脑桥梗死中占有绝大部分比例[2]。PPI的发病机制主要分以下三种:基底动脉粥样硬化,脑桥旁正中动脉开口粥样硬化,脑桥旁正中动脉纤维玻璃样变(即小血管病)[3~5]。根据TOAST分型,伴基底动脉狭窄的脑桥旁正中梗死(PPI+BAS)多由基底动脉粥样硬化引起[6]。由于目前MRI等影像不能显示脑桥旁正中动脉,所以不能直接准确的判断不伴基底动脉狭窄的脑桥旁正中梗死(PPI-BAS)的发病机制。然而不同发病机制的PPI-BAS在治疗上有明显的差异,所以临床上区分发病机制又尤为重要。既往研究证实,冠心病、颅内或颅外非责任动脉动脉粥样硬化和糖尿病等因素多与动脉粥样硬化机制相关[7,8],高血压、腔隙性脑梗死(LI)和脑白质疏松(LA)等因素多与小血管病机制相关[9]。本研究按梗死部位是否累及脑桥腹侧表面将PPI分为:病灶累及脑桥腹侧表面的PPI(vPPI-BAS)和病灶未累及脑桥腹侧表面PPI(dPPI-BAS),以PPI+BAS为对照,比较上述相关因素是否有差异,从而探讨不同梗死部位的PPI-BAS的发病机制。
1 资料与方法
1.1 一般资料 收集2014年4月~2015年11月辽宁省人民医院神经内科住院的病例资料150例。纳入标准:(1)按中国急性缺血性脑卒中诊治指南2014版的标准诊断为急性PPI;(2)所有病例均经磁共振平扫+MRA+DWI辅助诊断,所有病例DWI上均显示病灶;(3)所有病例均完成心电图、心脏超声、颈部血管超声、经颅多普勒检查;(4)所有患者均按中国急性缺血性脑卒中诊治指南2014版进行规范抗栓治疗。排除标准:(1)资料不完整的病例;(2)椎动脉、锁骨下动脉近端狭窄和其他原因导致的基底动脉主干狭窄的病例,如动脉夹层、血管炎;(3)可疑心源性栓塞(如房颤、扩张型心肌病、近期心肌梗死、感染性心内膜炎或瓣膜性心脏病)的病例、原因不明或其它原因脑梗死(如患有红细胞增多症,系统性红斑狼疮、高凝状态)的病例;(4)伴有感染或严重心、肺、肝、肾脏等系统性疾病的病例;(5)接受溶栓或介入治疗的患者。
记录所有患者的年龄、性别、吸烟史、饮酒史、高血压病史、糖尿病史、冠心病史,入院化验并记录血脂及血同型半胱氨酸。
记录入院时及入院后1 d、2 d、3 d的美国国立卫生研究院卒中量表(NIHSS)评分,由同一位神经专科医师每天上午及下午评定2次,早期神经功能恶化(END)定义为复评NIHSS最高分较入院时增加2分或2分以上[10]。
1.2 影像学采集方法 颅外动脉粥样硬化(EAAS)情况判断:应用PHILIPS-IU22超声诊断仪,检查部位包括两侧颈总动脉、颈内动脉、颈外动脉及其分叉部、椎动脉和锁骨下动脉。测量动脉壁的内膜中膜厚度,以内膜中膜厚度>1.3 mm定为动脉粥样硬化斑块[11]。应用美国GE公司SIGNA EXCITE 1.5T磁共振成像仪进行头部MRI检查,其中序列包括:T1WI:TR 2082 ms,TE 11 ms,层厚/层间距7 mm;T2WI:TR 5000 ms,TE 123 ms,层厚/层间距7 mm;FLAIR:TR 8602 ms,TE 1267 ms,层厚/层间距7 mm;DWI:TR 6000 ms,TE 102 ms,层厚/层间距7 mm;MRA:TR 20 ms,TE 3 ms,层厚/间距1 mm。
在DWI轴位上观察梗死灶累及层面数,将其分为一层、两层及两层以上。
采用Fazekas 评分方法对脑白质疏松程度分级,共分为4级,分别为0~3级(0级:0分;1级:1~2分;2级:3~4分;4级:5~6分)[12]。
计数LI个数(MRI表现为大脑半球深部结构、脑干等中线部位直径<1.5 cm的腔隙灶[13]),根据其严重程度分为0~3级(0级:无腔隙性脑梗死病灶;1级:1~2个梗死灶;2级:3~5个梗死灶;3级:>5个梗死灶)[14]。
应用MRA检查判断颅内动脉狭窄程度,按照华法林-阿司匹林症状性颅内动脉病变(WASID)测量方法[15],狭窄率=(1-AS/AN)×100%(AS:动脉狭窄处管腔直径;AN:正常处管腔直径),测3次基底动脉狭窄率取平均值,弥漫性斑块形成或多处狭窄者选择最严重的部位测量。(1)以狭窄率≥50%为界将基底动脉分为无狭窄、有狭窄[6](见图1)。(2)同样方法测量颅内颈内动脉系统有无狭窄,如有则定义为颅内颈内动脉系狭窄(ICAS)。
在T1-WI序列、FLAIR序列上观察基底动脉管壁信号强度,基底动脉信号高于正常脑桥信号定义为基底动脉管壁高信号[16~18]。在我们的研究中发现基底动脉管壁高信号可表现为略高信号、点状高信号、环形高信号(见图2)。
所有影像学图像均由2名神经专科医师进行评估,如有分歧由第三名专科医师进行评估。
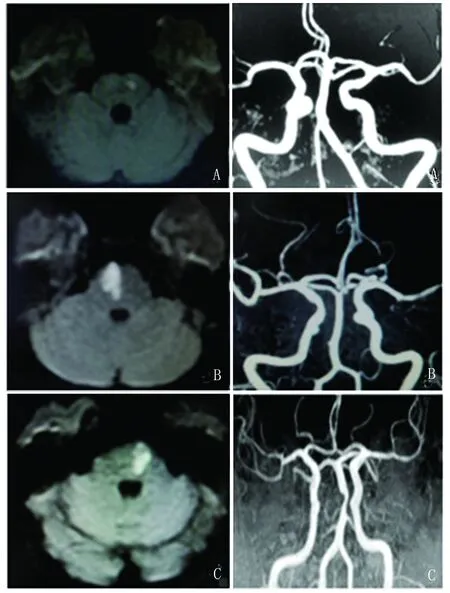
图1 A:不伴基底动脉狭窄的未累及脑桥腹侧表面的脑桥旁正中梗死(dPPI-BAS);B:不伴基底动脉狭窄的累及脑桥腹侧表面的脑桥旁正中梗死(vPPI-BAS);C:伴有基底动脉狭窄的脑桥旁正中梗死(PPI+BAS)

图2 基底动脉T1-WI高信号表现:A:基底动脉无高信号;B:略增高信号;C:点状高信号;D:环形高信号

2 结 果
2.1 PPI-BAS部位与发病机制的单因素分析 150例患者中dPPI-BAS 组41例(27.3%),vPPI-BAS 组65例(43.3%),PPI+BAS组44例(29.3%)。3组之间年龄、性别、吸烟、饮酒、高脂血症、高同型半胱氨酸血症差异无统计学意义(P>0.05),冠心病、糖尿病、高血压、LA分级中位数、LI分级中位数、ICAS、EAAS、基底动脉高信号及END的差异有统计学差异(P<0.05)(见表1)。
vPPI-BAS组与PPI+BAS组各因素之间差异均无统计学差异(P>0.05)。
与PPI+BAS组比较,dPPI-BAS组冠心病(χ2=7.735,P=0.005)、糖尿病(χ2=6.175,P=0.013)、ICAS (χ2=18.093,P=0.001)、EAAS(χ2=15.389,P=0.001)、基底动脉高信号(χ2=7.231,P=0.018)梗死灶层面数≥2层(χ2=13.995,P=0.002)、END(χ2=12.017,P=0.013)的发生率低,而高血压(χ2=11.580,P=0.005)、LA (Z=-5.956,P=0.000)、LI (Z=-5.535,P=0.000)的发生率高。
vPPI-BAS组与dPPI-BAS组比较,vPPI-BAS组ICAS(χ2=10908,P=0.000)、EAAS(χ2=11.565,P=0.001)、梗死灶层面数≥2层(χ2=9.395,P=0.002)、END (χ2=6.155,P=0.013)发生率高,dPPI-BAS组高血压(χ2=5.935,P=0.005)、LA (Z=-6.215,P=0.000)、LI分级中位数(Z=-6.203,P=0.000)发生率高。
2.2 PPI-BAS部位与发病机制的多因素分析 以dPPI-BAS为因变量,以单因素分析中P<0.05的因素(冠心病、糖尿病、高血压、LA、LI、ICAS、EAAS、基底动脉高信号、梗死灶层面数≥2层和END)为自变量进行多因素logistic回归分析,结果显示:LA分级是dPPI-BAS的独立危险因素(P<0.05)(见表2)。
3 讨 论
年龄、性别、吸烟、饮酒、高脂血症和高同型半胱氨酸血症在各组间均未见明显差异,提示它们作为PPI的危险因素,在动脉粥样硬化机制和小血管病机制所致脑梗死中起到同样的作用。
从既往研究可知血糖增高可导致血管内皮及平滑肌细胞功能紊乱,最终导致动脉粥样硬化的形成[7];因为动脉粥样硬化是全身性疾病,所以冠心病、颈部颈动脉、椎动脉及锁骨下动脉粥样硬化、颅内颈内动脉系统粥样硬化的存在可以为基底动脉动脉粥样硬化性脑梗死提供依据[8];目前经高分辨磁共振证实动脉粥样硬化斑块内出血在T1WI序列上呈现高信号,出血会引起斑块进一步扩大,从而成为脑梗死的高危因素[19~21],且有研究证实在常规磁共振T1WI或FLAIR 序列上动脉管壁内高信号提示动脉粥样硬化的存在[17,22],但是否是斑块内出血尚有待证实;理论上,与小血管病比较,动脉粥样硬化性脑梗死病灶应较大,有研究发现基底动脉粥样硬化性PPI的梗死灶层面数多≥2层[23],但目前基底动脉穿支动脉粥样硬化所致脑梗死的大小尚未明确;众所周知,大动脉粥样硬化性脑梗死易发生早期神经功能恶化(END),目前研究显示,与小血管病相比,END在穿支动脉粥样硬化脑梗死中更常见,发生率波动于17%~75%[24,25]。综上所述,糖尿病、冠心病、ICAS、EAAS、基底动脉高信号、梗死灶层面数≥2层和END是支持动脉粥样硬化的因素。

表1 PPI-BAS部位与发病机制的单因素分析
IQR 表示四分位数区间,a表示F值,b表示χ2值,c表示H值

表2 dPPI-BAS发病机制的多因素Logistic回归分析
高血压会引起小血管壁的透明脂肪样变性或纤维素样坏死从而导致血管闭塞,脑小血管病变在影像学中的主要表现有LA、LI和微出血[26,27]。由于条件所限,本研究没有观察入组病例的微出血情况,本研究认为高血压、LA、LI是支持小管病的因素。
本研究中,vPPI-BAS组与PPI+BAS组各因素之间均无统计学差异,提示vPPI-BAS的发病机制是动脉粥样硬化;与PPI+BAS组比较,dPPI-BAS组中,与动脉粥样硬化相关的因素(冠心病、糖尿病、ICAS、EAAS、基底动脉高信号、梗死灶层面数≥2层和END)发生率低(P<0.05),与小血管病相关的因素(高血压、LA、LI)发生率高(P<0.05),提示dPPI-BAS多由小血管病机制引起。vPPI-BAS组与dPPI-BAS组比较的结果及多因素分析的结果进一步证实了上述结论。
本研究认为,vPPI-BAS的发病机制其可能是脑桥旁正中动脉开口粥样硬化,脑桥旁正中动脉起始部发生的微小粥样硬化斑块可堵塞穿支动脉口[16,28],这种微小斑块不会引起基底动脉的狭窄;也可能是基底动脉粥样硬化斑块阻塞或延伸至穿支动脉口导致脑桥旁正中梗死[17],而此时可能由于正性重构导致斑块向外扩张而不引起基底动脉管腔的明显狭窄[29]。由此可见单纯从基底动脉有无狭窄来判断PPI的发病机制是欠妥的,还要结合PPI病灶的具体部位(是否累及脑桥腹侧)来进一步判断。
在脑梗死的诊断上磁共振作为一种无创而又准确的方法早已被医学界所认可。近年来随着影像学的发展,在诊断早期脑梗死尤其是脑干梗死中,DWI序列已被认为是目前最敏感而且准确的影像学方法[30],因此在本研究中采用DWI序列来辅助确诊脑桥旁正中梗死。
本研究也有不足之处:首先,在我们的研究中没有与之相对应的病理学、DSA及高分辨磁共振结果,因此不能确切地判断其结果的准确性,但是我们尽可能的将支持动脉粥样硬化机制的因素和支持小血管病变的因素都进行比较;其次,PPI+BAS的发病机制也可能是小血管病,但是这样的患者比较少,预计对最终结果的影响不大。最后,在我们收集病例过程中不能完全排除栓塞机制引起的PPI,但是我们尽可能排除心源性栓塞和动脉(锁骨下动脉和椎动脉)到动脉(基底动脉及其穿支动脉)栓塞的病例。
总之,vPPI-BAS组动脉粥样硬化相关因素的发生率较高,dPPI-BAS组小血管病相关因素的发生率较高,提示vPPI-BAS多由动脉粥样硬化机制引起,dPPI-BAS多由小血管病机制引起。
[1]Kataoka S,Hori A,Shirakawa T,et al. Paramedian infarction. Neurological topographical correlation [J]. Stroke,1997,28(4):809-815.
[2]Field TS,Benavente OR. Penetrating artery territory pontine infarction[J]. Rev Neurol Dis,2011,8(1/2):30-38.
[3]陈珂楠. 脑桥旁正中梗死研究进展[J]. 中国临床神经科学,2012,20(1):104-108.
[4]Gallego CJ,Erro Aguirre ME. Basilar branch occlusion[J]. Current Treatment Options Cardiovascular Med,2011,13(3):247-260.
[5]刘 扬,高旭光. 脑桥梗死与基底动脉分支病[J]. 中华老年心血管病杂志,2009,11(1):77-78.
[6]Adams HP,Bendixen BH,Kappelle LJ,et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke,1993,24(1):35-41.
[7]Li L,Yu H,Zhu J. The combination of carotid and lower extremity ultrasonography increases the detection of atherosclerosis in type 2 diabetes patients[J]. J Diabetes Complications,2012,26(1):23-28.
[8]Han SW,Kim SH,Lee JY,et al. A new subtype classification of ischemic stroke based on treatment and etiologic mechanism[J]. Eur Neurol,2007,57(2):96-102.
[9]脑小血管病诊治专家共识组. 脑小血管病的诊治专家共识[J]. 中华内科杂志,2013,52(10):893-896.
[10]Hallevi HL,Chernyshev OY,El Khoury R,et al. Intracranial atherosclerosis is associated with progression of neurological deficit in subcortical stroke[J]. Cerebrovasc Dis,2012,33(1):64-68.
[11]王卓亚. 老年正常高值血压就诊人群颈动脉粥样硬化斑块状况[J]. 中国老年学杂志,2015,35(17):4821-4823.
[12]Fazekas F,Chawluk JB,Alavi A,et al. MR signal abnormalities at 1.5 T in Alzheimer’s dementia and normal aging[J]. AJR Am J Roentgenol,1987,149(2):351-356.
[13]高 波,奉 立. 脑小血管病的神经影像学研究进展[J]. 国际医学放射学杂志,2011,34(61):518-521.
[14]Kövari E,Gold G,Herrmann FR,et al. Cortical microinfarcts and demyelination significantly affect cognition in brain aging[J]. Stroke,2004,35(2):410-414.
[15]Khan A,Kasner SE,Lynn MJ,et al. Warfarin Aspirin Symptomatic Intracranial Disease (WASID) Trial Investigators. Risk factors and outcome of patients with symptomatic intracranial stenosis presenting with lacunar stroke[J]. Stroke,2012,43(5):1230-1233.
[16]Klein IF,Lavallée PC,Mazighi M,et al. Basilar artery atherosclerotic plaques in paramedian and lacunar pontine infarctions a high-resolution MRI Study[J]. Stroke,2010,41(7):1405-1409.
[17]Toyoda K,Ida M,Fukuda K. Fluid-attenuated inversion recovery intraarterial ignal:an early sign of hyperacute cerebral ischemia[J]. AJNR Am J Neuroradiol,2001,22(6):1021-1029.
[18]Bodle JD,Feldmann E,Swartz RH,et al. High-resolution magnetic resonance imaging an emerging tool for evaluating intracranial arterial disease[J]. Stroke,2013,44(1):287-292.
[19]Kurosaki Y,Yoshida K,Endo H,et al. Association between carotid atherosclerosis plaque with high signal intensity on T1 weighted imaging and subsequent ipsilatera1 ischemic events[J]. Neurosurgery,2011,68(1):62-67.
[20]李 娟,刘宏斌,戴艳丽,等. 易损斑块的生理学特征及无创影像学检方法[J]. 中华年心脑血管病杂志,2014,16(7):776-778.
[21]Saam T,Ferguson MS,Yarnykh VL,et al. Quantitative evaluation of carotid plaque composition by In Vivo MRI[J]. Arterioscler Thromb Vasc Biol,2005,25(1):234-239.
[22]徐子奇,罗本燕,梁 辉,等. 急性缺血性卒中常规磁共振成像血管内高信号回顾性研究[J]. 中华神经科杂志,2011,44(10):685-688.
[23]田 英,辛 岳,王 健,等. 脑桥旁正中梗死层面数与基底动脉粥样硬化和早期进展关系[J]. 中风与神经疾病杂志,2016,33(2):117-119.
[24]Kumral E,Afsar N,Kirbas D,et aI. SpectnIm of medial medullary infarction:clinical and magnetic resonance imaging findings[J]. J Neuml,2002,249(1):85-93.
[25]Deguchi I,Hayashi T,Kato Y,et al. Treatment outcomes of tissue plasminogen activator infusion for branch atheromatous disease[J]. J stroke Cerebrovasc Dis,2013,22(7):168-172.
[26]Kester MI,Goos JD,Teunissen CE,et al. Associations between cerebral small-vessel disease and Alzheimer disease pathology as measured by cerebrospinal fluid biomarkers[J]. JAMA Neurol,2014,71(7):855-862.
[27]Schilling S,Tzourio C,Dufouil C,et al. Plasmalipids and cerebral small vessel disease[J]. Neurology,2014,83(20):1844-1852.
[28]Erro ME,Gállego J,Herrera M,et al. Isolated pontine infarcts:etiopatho genic mechanisms[J]. Eur J of Neurol,2005,12(12):984-988.
[29]Feng C,Hua T. Arterial remodeling of basilar atherosclerosis in isolated pontine infarction[J]. Neurol Sci,2015,36(4):547-551.
[30]Wintermark M,Sanelli PC,Albers GW,et al. Imaging recommendations for acute stroke and transient ischemic attack patients[J]. J Am Coll Radiol,2013,10(11):828-832.
Correlationbetweenthelocationofinfarctionsandpathogenesisamongpatientsofparamedianpontineinfarctionwithoutbasilararterystenosis
GUOTingting,TIANYing,XINYue,etal.
(DepartmentofNeurology,LiaoningProvincePeople’sHospital,LiaoningProvince,Shenyang110016,China)
1003-2754(2017)09-0830-05
2017-05-20;
2017-07-18
(1.辽宁省人民医院神经内科,辽宁 沈阳 110016;2.大连医科大学神经病学系,辽宁 大连 116000)
王玉洁,E-mail:wangyuejie196508@163.com
R743
A

