对亚甲基苯醌不对称催化反应的研究进展
范亚静,李 珅
(天津大学理学院,天津 300350)
对亚甲基苯醌不对称催化反应的研究进展
范亚静,李 珅*
(天津大学理学院,天津 300350)
对亚甲基苯醌是一类重要的醌类衍生物,具有较高的反应活性,很容易受到亲核试剂的进攻发生不对称加成反应。综述了对亚甲基苯醌参与的不对称催化反应研究进展,介绍了对亚甲基苯醌在不同催化体系下发生的不对称1,6-共轭加成反应。
对亚甲基苯醌;不对称催化;不对称1,6-共轭加成反应
Abstract:p-Quinone methides are a kind of important quinone derivatives,which possess high reaction activities,and easily promote the occurrence of asymmetric addition reactions with nucleophilic reagents.We review the research progress in asymmetric catalytic reaction ofp-quinone methides,and introduce the asymmetric 1,6-conjugate addition reaction ofp-quinone methides under different catalytic systems.
Keywords:p-quinone methide;asymmetric catalysis;asymmetric 1,6-conjugate addition reaction
在有机化学中,对亚甲基苯醌[1-2]是一类重要的醌类衍生物,其含有的独特结构单元在天然产物以及具有生物活性的有机分子中广泛存在,如萜烯、植物色素等。由于对亚甲基苯醌很容易发生极化,同时极化后以两性离子的形式存在,所以其表现得相当活泼,容易受到亲核试剂进攻发生1,6-共轭加成反应。近年来,对亚甲基苯醌的不对称催化反应受到广大研究者的青睐,成为不对称催化领域的研究热点。作者综述了近年来对亚甲基苯醌参与的不对称1,6-共轭加成反应的研究进展。
1 有机分子催化对亚甲基苯醌的不对称1,6-共轭加成反应
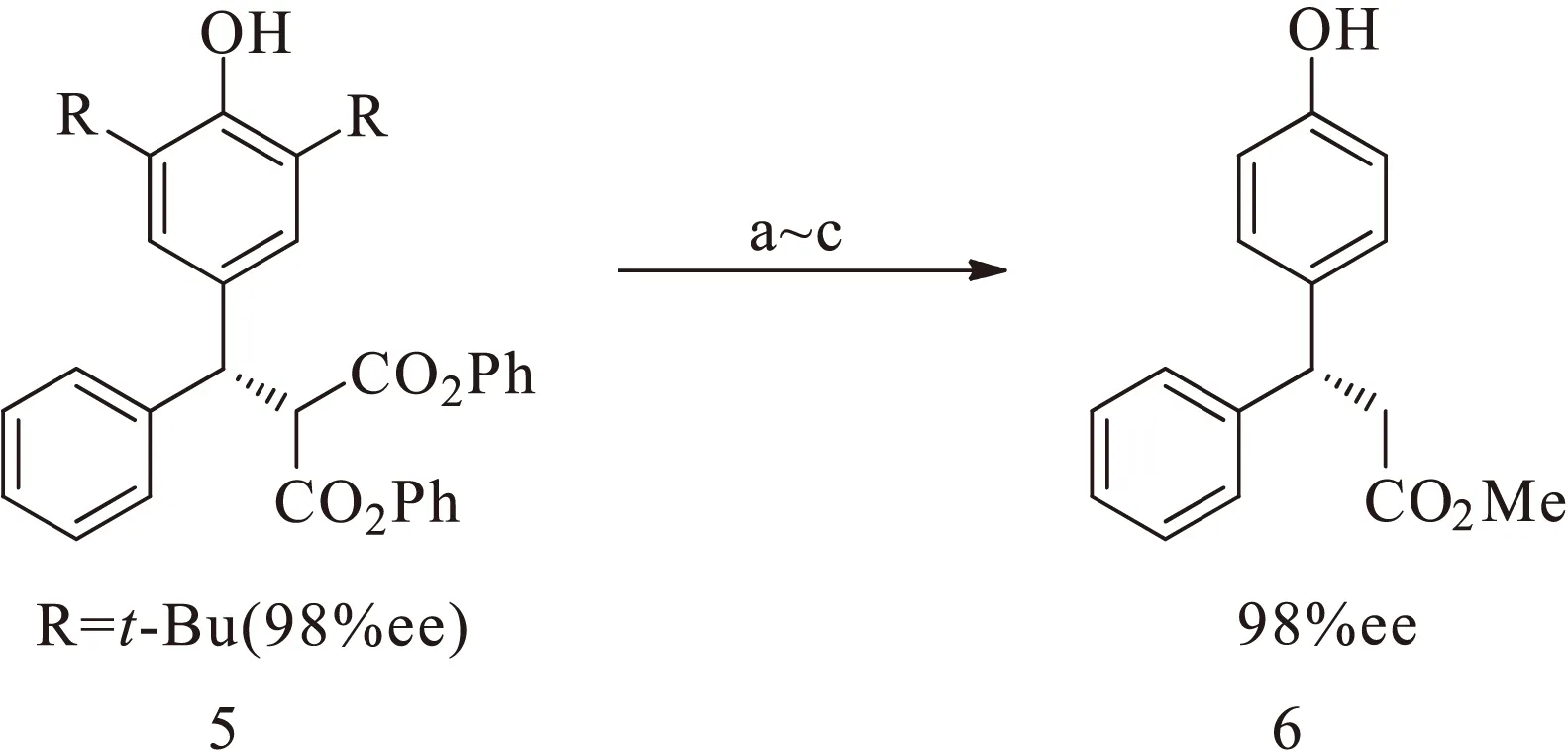
2013年,樊春安课题组[3]首次实现了对亚甲基苯醌的不对称催化反应,在相转移催化剂1的作用下,对亚甲基苯醌化合物2与丙二酸酯3能够发生不对称1,6-共轭加成反应,以高达98%的收率和高达99%的对映选择性合成了一系列加成产物4,如图 1所示。当R1和R2为甲基、异丙基等位阻比较小的取代基时,反应速率明显加快,同样也可以取得很高的收率和对映选择性。值得注意的是,在对亚甲基苯醌羰基的邻位引入叔丁基是为了增强化合物的稳定性,以防其发生二聚反应。为了脱除叔丁基,该课题组将化合物5中的苯酯转化成甲酯、通过Krapcho去烷氧羰基化反应脱掉单边酯基、再经过逆傅-克烷基化反应得到化合物6[4],如图2所示,其光学纯度没有受到影响,成功地实现了叔丁基的脱除。该反应为合成一系列手性二芳基甲烷衍生物提供了一种新的方法。
2014年,Johansen课题组[5]报道了有机小分子催化的醛的不对称α-烷基化反应,如图3所示。他们使用对亚甲基苯醌2作为烷基化试剂,手性二级胺7作为催化剂,与醛8反应生成具有2个手性中心的化合物9,取得较高的收率(40%~90%)、对映选择性(up to 99%)和非对映选择性(>11∶1 dr)。在该反应中,同样需要向对亚甲基苯醌羰基的邻位引入叔丁基以起到稳定作用。为了脱除叔丁基,该课题组经过醛基还原、乙酰基保护和三氯化铝催化的逆傅-克烷基化3步反应,获得了对映选择性保持的产物11,如图4所示,而且都能很好地保持其立体选择性。

图1 相转移催化对亚甲基苯醌的不对称1,6-共轭加成反应Fig.1 Asymmetric 1,6-conjugate addition reaction of p-quinone methides catalyzed by phase transfer catalyst
a.KOH/MeOH(0.1 mol·L-1),THF,rt,99%yield;b.NaI,H2O,DMSO,160 ℃,70%yield;c.AlCl3,benzene,60 ℃,85%yield,98%ee
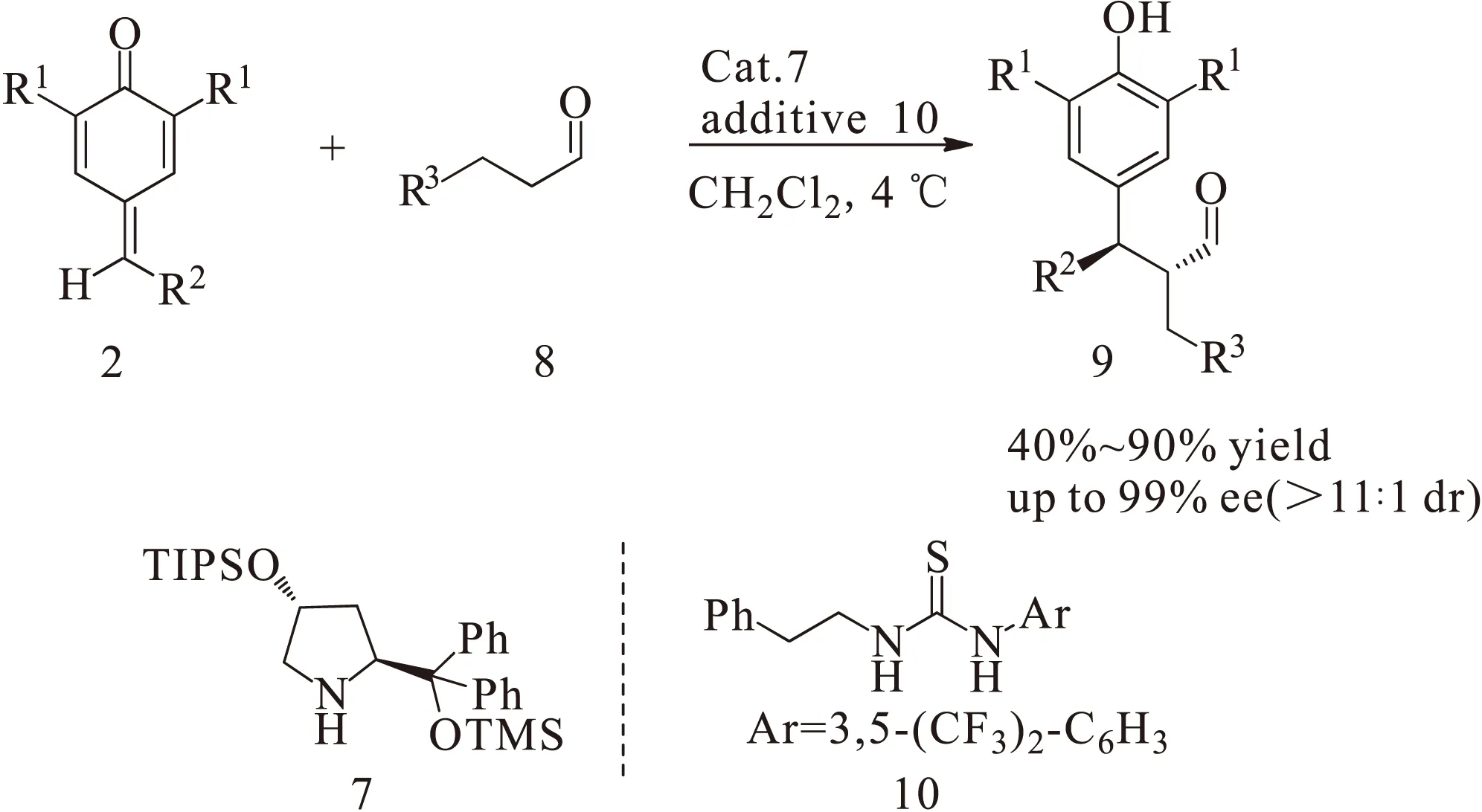
图3 醛的不对称α-烷基化反应Fig.3 Asymmetric α-alkylation reaction of aldehydes
上述报道的2例工作都是利用手性催化剂对亲核试剂进行活化,而对对亚甲基苯醌没有起到活化作用。2015年,Enders课题组[6]利用双官能团催化剂12实现了N-Boc保护氧化吲哚衍生物13与对亚甲基苯醌2的不对称1,6-共轭加成反应,以较高的收率、非对映选择性和对映选择性合成了一系列3-二芳基甲基取代的氧化吲哚化合物14,如图5所示。
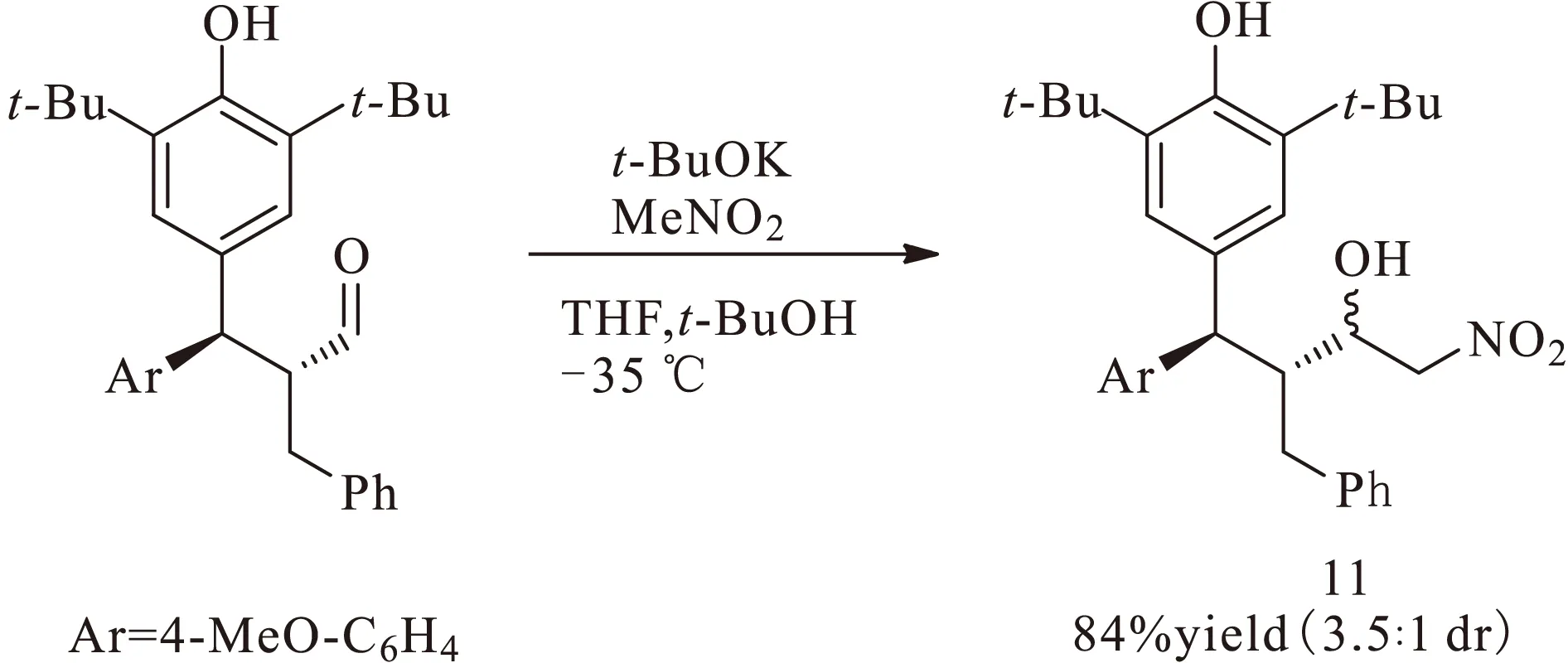
图4 烷基化醛的官能团化反应Fig.4 Functionalization reaction of alkylated aldehyde
在之前的报道中,对亚甲基苯醌都需要预先合成和分离,由于这类分子稳定性较差,通常需要向其羰基邻位引入位阻较大的叔丁基以增强分子的稳定性,这样就限制了对亚甲基苯醌分子的底物范围。2015年,孙建伟课题组[7]报道了原位生成对亚甲基苯醌并实现不对称催化的全新策略,扩展了对亚甲基苯醌在不对称催化反应中的应用范围,如图6所示。他们使用对羟基苄醇15作为底物前体,在手性磷酸16的催化下原位生成对亚甲基苯醌,随后与吡咯衍生物17进行1,6-共轭加成反应,合成了一系列具有季碳手性中心的化合物18,产物收率和对映选择性都很高。更加重要的是,由于生成的对亚甲基苯醌不需要分离而直接进行下一步反应,分子中不再需要叔丁基进行保护,扩大了反应底物的适用范围。在机理的探究中将酚羟基保护起来,最终没有检测到加成产物的出现,进一步说明该反应经过了对亚甲基苯醌中间体形成的过程。

图5 对亚甲基苯醌不对称1,6-共轭加成合成3-二芳基甲基取代的氧化吲哚
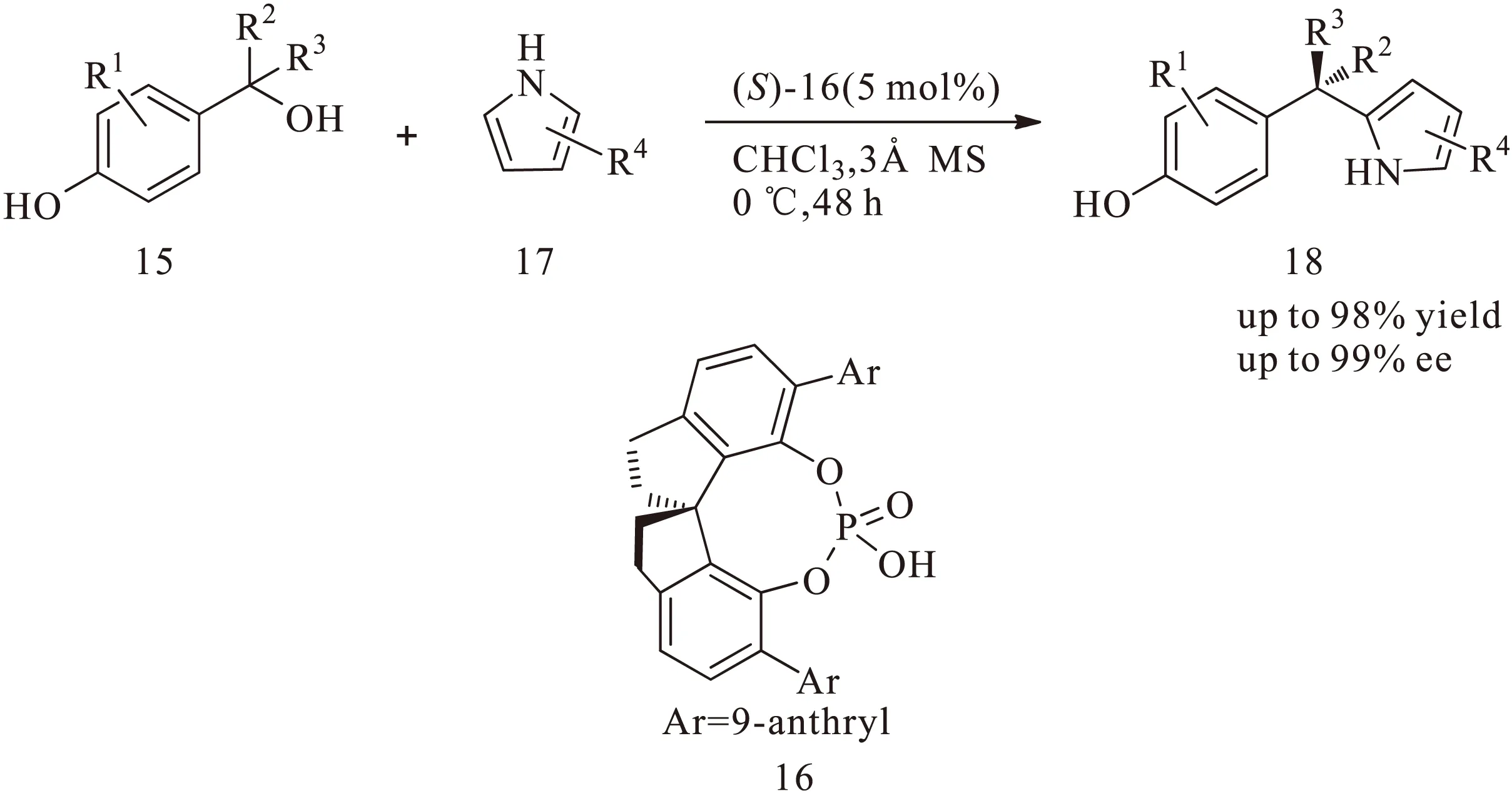
图6 手性布朗斯酸催化对亚甲基苯醌的不对称1,6-共轭加成反应Fig.6 Asymmetric 1,6-conjugate addition reaction of p-quinone methides catalyzed by chiral Brønsted acid
姚和权课题组[8]进一步对对亚甲基苯醌2与二氰基烯烃化合物19的不对称1,6-共轭加成反应进行了研究,利用手性硫脲衍生的催化剂20用有机催化的方法得到对映选择性的化合物21,如图7所示。取得较高的收率(up to 99%)、非对映选择性(>20∶1 dr)和对映选择性(up to 99% ee)。为合成手性的二芳基甲基骨架结构提供了一种高效的合成路径。但是该研究中对亚甲基苯醌底物2仅局限于羰基两边是叔丁基的结构。
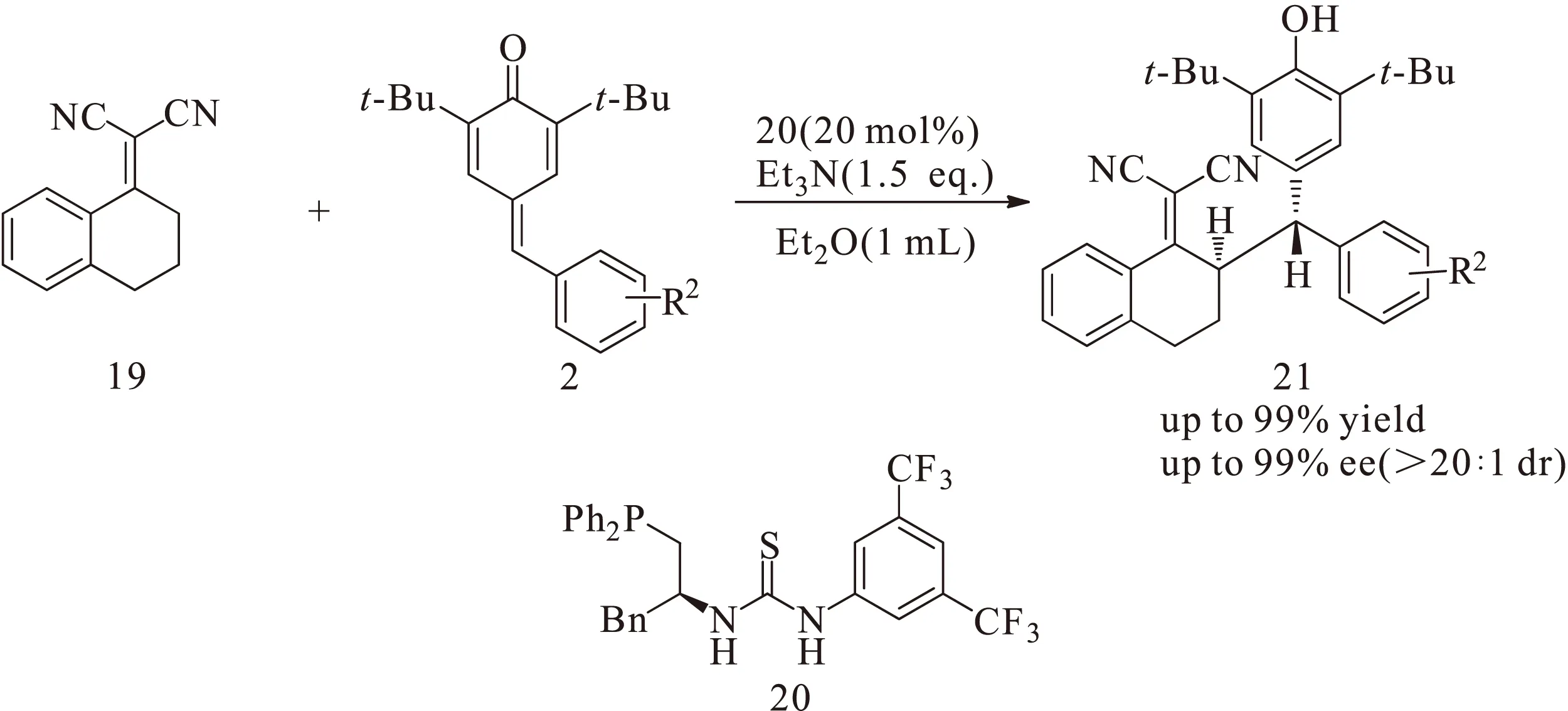
图7 手性硫脲催化对亚甲基苯醌与二氰基烯烃的不对称1,6-共轭加成反应Fig.7 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with dicyanoolefin catalyzed by chiral thiourea
手性含硫化合物在有机化学中构成了一类重要的手性配体[9-12],许多手性含硫化合物也表现出了药物活性。2016年,程津培课题组[13]报道了手性磷酸衍生的催化剂22催化对亚甲基苯醌2与乙酰硫醇的不对称1,6-共轭加成反应,以高收率和高对映选择性合成了含杂原子硫的芳基衍生物23,如图8所示。但是该反应仅对羰基两边是叔丁基结构的效果好,当R1为甲基、R2为叔丁基时效果比较差。

图8 手性磷酸催化对亚甲基苯醌与乙酰硫醇的不对称1,6-共轭加成反应Fig.8 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with acetylthiol catalyzed by chiral phosphoric acid
基于硫脲和方酰胺双功能团有机催化反应,2016年,樊春安课题组[14]合成了一种叔胺衍生的双功能方酰胺有机催化剂24,并将其成功应用于对亚甲基苯醌2与3-苯基氧化吲哚25的不对称1,6-共轭加成反应,以较高的收率、较高的非对映选择性(>20∶1 dr)和高达99%的对映选择性得到一系列化合物26,如图9所示。该催化体系同时丰富了对亚甲基苯醌在不对称有机催化反应中方法论的探究。
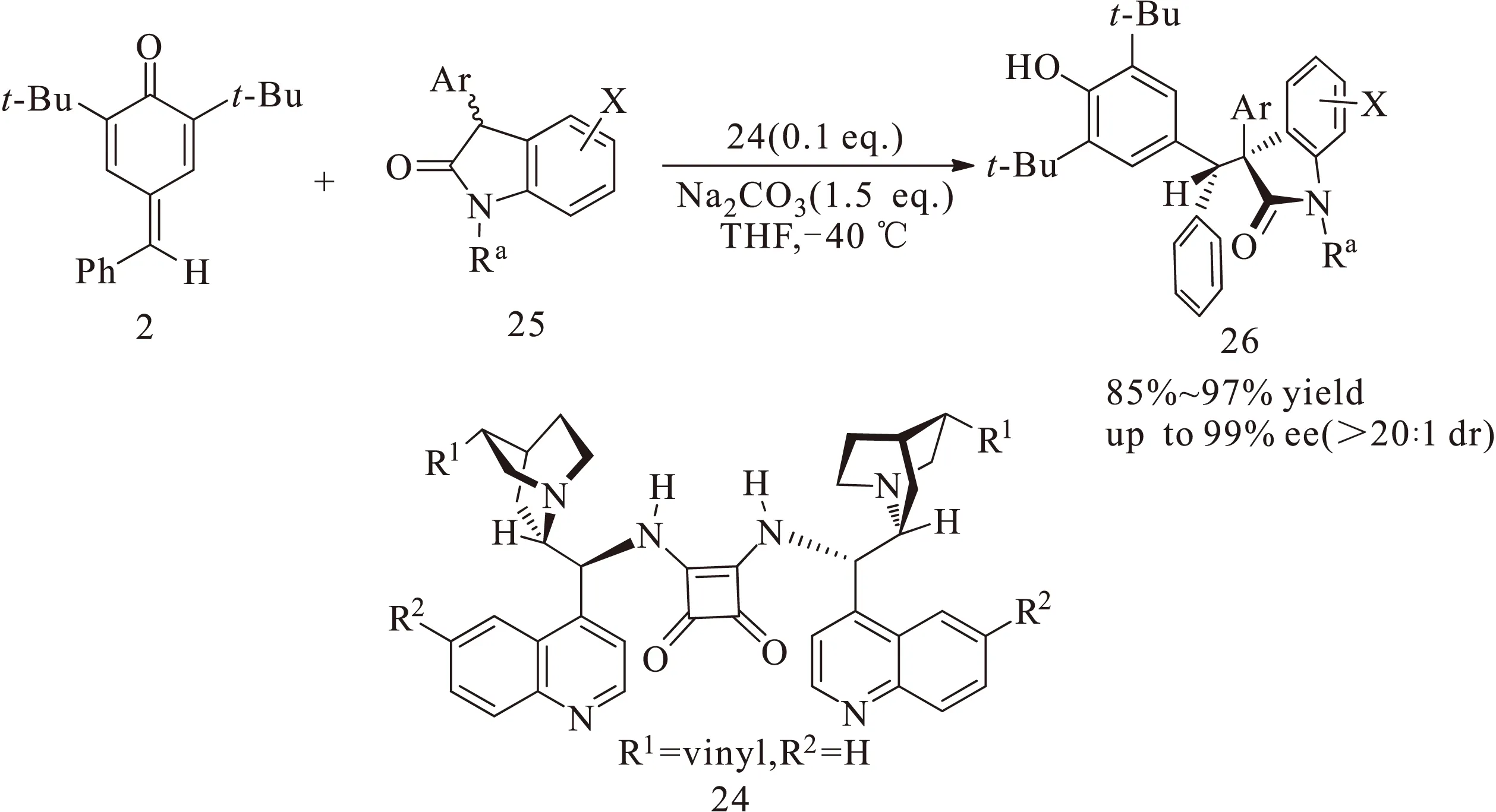
图9 双功能方酰胺催化对亚甲基苯醌与3-苯基氧化吲哚的不对称1,6-共轭加成反应Fig.9 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with 3-phenyl oxindoles catalyzed by bifunctional tertiaryamine-squaramide
双功能有机催化剂已经成功应用于对亚甲基苯醌的不对称1,6-共轭加成反应。鉴于樊春安课题组在对亚甲基苯醌相转移催化条件下的工作,2016年,赵刚课题组[15]报道了一种基于酰胺和膦盐的相转移催化剂27,并将其应用于对亚甲基苯醌2与丙二酸二苯酯的不对称1,6-共轭加成反应,以高达99%的收率和97%的对映选择性得到光学活性化合物28,如图10所示。
同年,樊春安课题组[16]又进一步对甘氨酸的衍生物29与对亚甲基苯醌2的不对称1,6-共轭加成反应进行了探索,利用金鸡纳碱衍生的相转移催化剂30催化合成了具有2个手性中心的β,β-二芳基-α-氨基酸化合物31,如图11所示。并且取得较高的收率以及较高的对映选择性和非对映选择性。
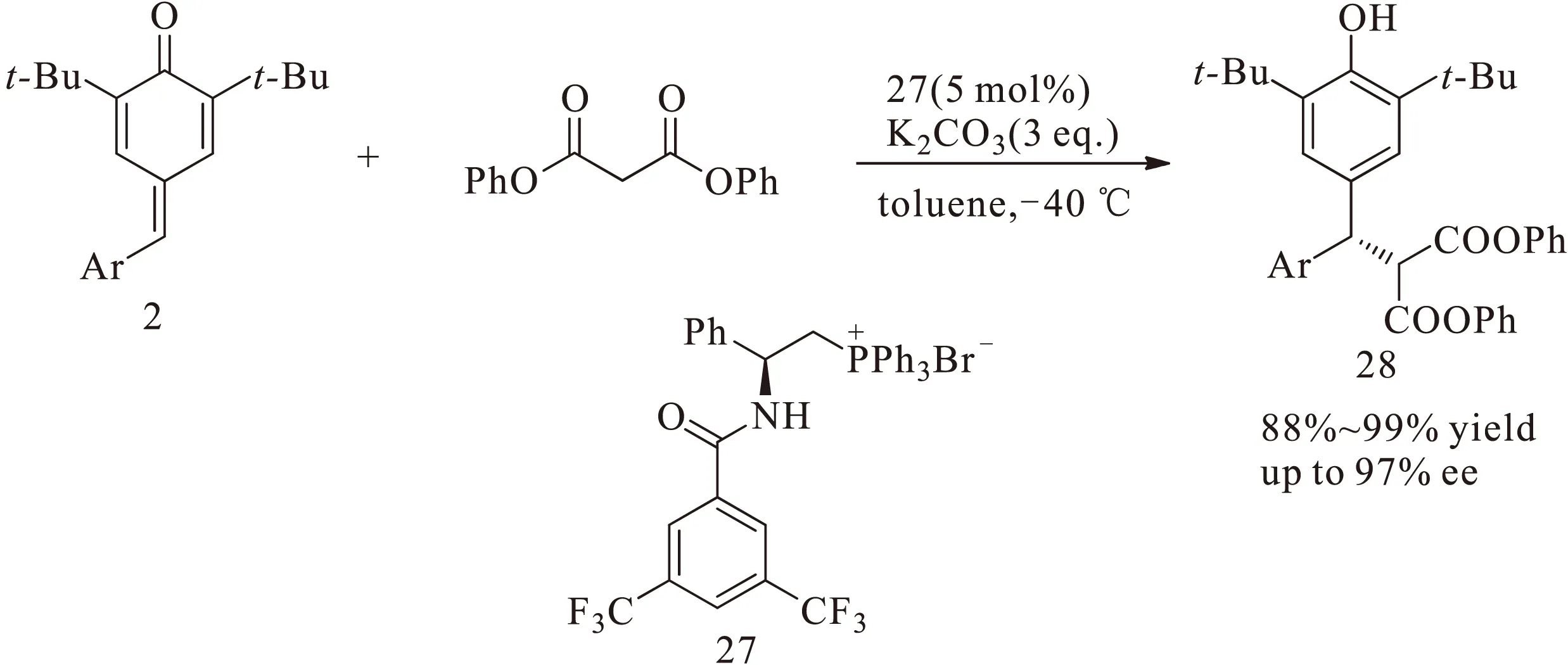
图10 双功能相转移催化剂酰胺膦盐催化对亚甲基苯醌与丙二酸二苯酯的不对称1,6-共轭加成反应Fig.10 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with diphenyl malonate catalyzed by amide-phosphoniumsalt as bifunctional phase transfer catalyst
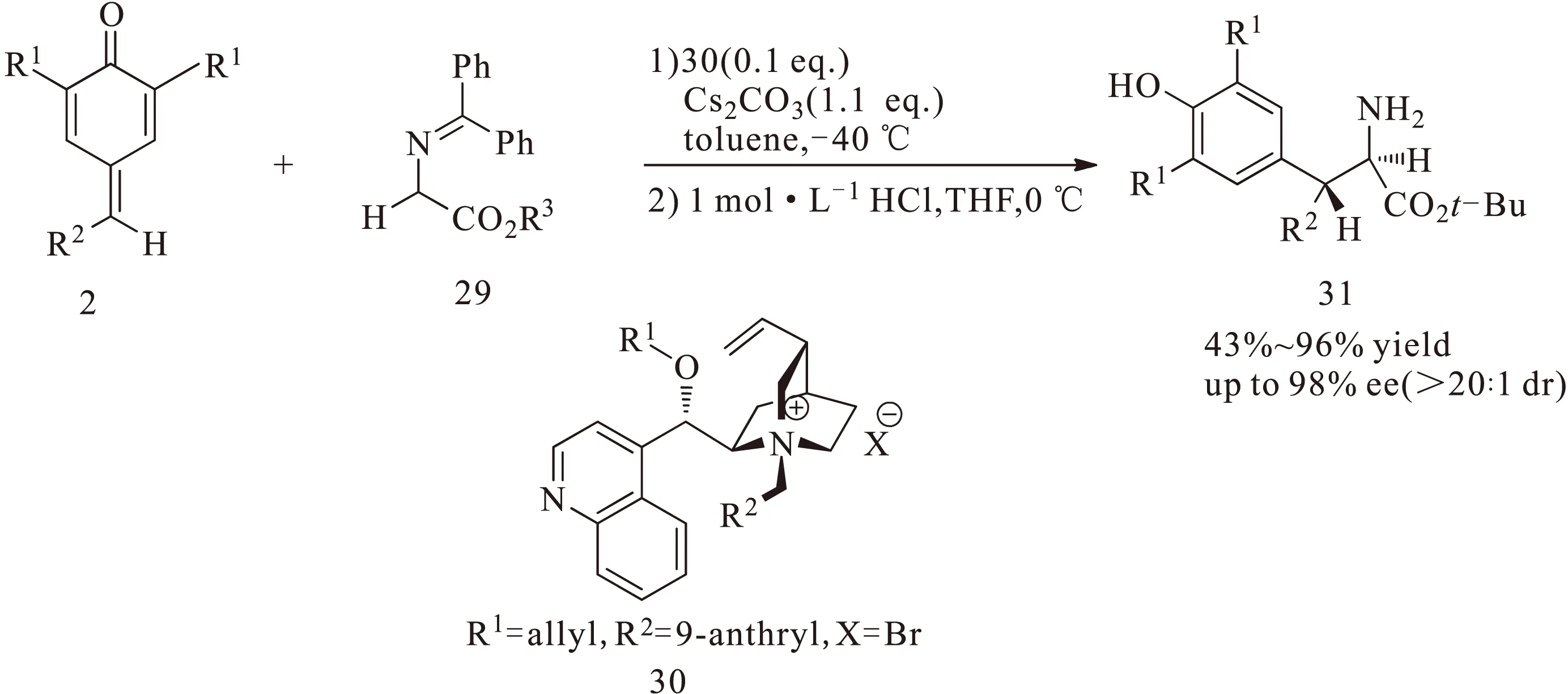
图11 相转移催化对亚甲基苯醌与甘氨酸衍生物的不对称1,6-共轭加成反应Fig.11 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with glycine derivatives catalyzed by phase transfer catalyst
多米诺反应为有机合成提供了一种高效的合成方法[17-18]。2016年,Enders课题组[19]首次将多米诺反应应用于对亚甲基苯醌衍生物的不对称有机催化反应,通过双功能的硫脲衍生物32催化对亚甲基苯醌33与烯基的氧化吲哚化合物34,通过分子内的1,6-加成反应得到产物35,如图12所示。取得了较高的收率(up to 98%)、较高的对映选择性(up to 99%)以及非对映选择性(>20∶1 dr)。在底物的拓展中发现:改变氧化吲哚氮原子上的保护基Boc基团为甲基酯、苯基酯或Cbz基团时,仍然有较高的对映选择性。
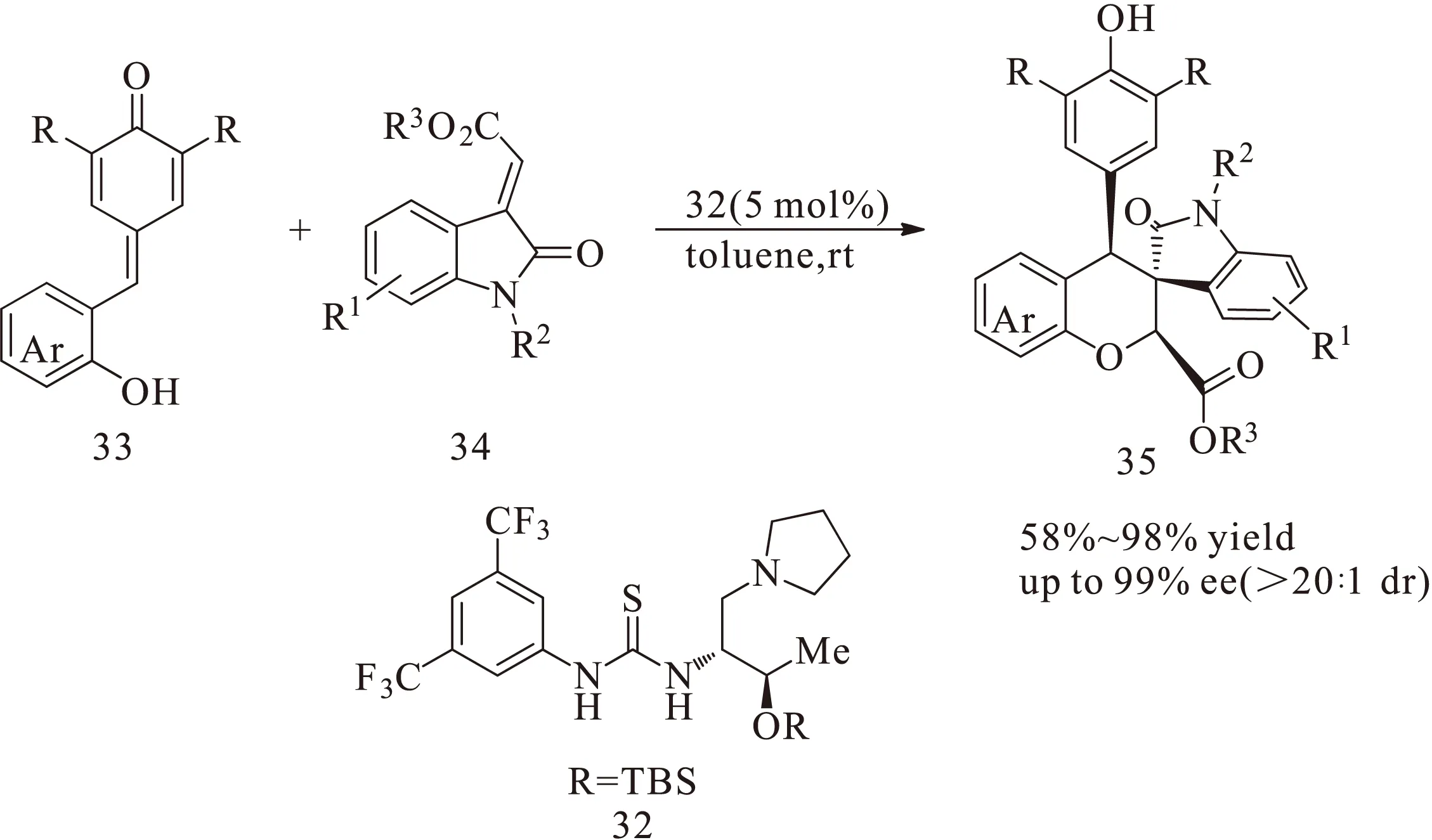
图12 双功能硫脲衍生物催化的邻羟基苯基取代的对亚甲基苯醌和靛红衍生的烯酸酯的多米诺氧杂-迈克尔/1,6-加成反应Fig.12 Domino oxa-Michael/1,6-addition reaction of ortho-hydroxyphenyl-substituted p-quinone methides and isatin-derived enoates catalyzed by bifunctional thiourea derivative
2 金属催化对亚甲基苯醌的不对称1,6-共轭加成反应
富电子的硼酸化合物在有机合成中是一类重要的中间体,是合成手性醇、手性胺以及三芳基甲烷的前体。2015年,廖健课题组[20]首次报道了金属催化对亚甲基苯醌的不对称1,6-共轭加成反应,该课题组将金属铜与L6形成的络合物应用于频哪醇联硼酸酯36与对亚甲基苯醌2的不对称1,6-共轭加成反应,以高达97%的收率和高达97%的对映选择性得到光学活性化合物37,如图13所示。随后该课题组又将化合物37进行了一系列衍生化,以中等的收率和较高的对映选择性生成一系列三芳基衍生物38,如图14所示。

图13 铜催化对亚甲基苯醌与双(频哪醇)二硼的不对称1,6-共轭加成反应Fig.13 Copper-catalyzed asymmetric 1,6-conjugate additionreaction of bis(pinacolato) diboron with p-quinone methides

图14 钯催化下二芳基三氟硼酸盐与芳基三氟甲磺酸盐的交叉偶联反应Fig.14 Palladium-catalyzed cross-coupling reaction of gem-diarylmethinetrifluoroborates with ArOTf
2015年,Tortosa课题组[21]进一步对频哪醇联硼酸酯与对亚甲基苯醌的不对称1,6-共轭加成反应进行了研究,并将金属铜与L6形成的络合物应用于双(频哪醇)二硼与对亚甲基苯醌2的不对称1,6-共轭加成反应,以较高的收率和对映选择性得到光学活性化合物39,如图15所示。
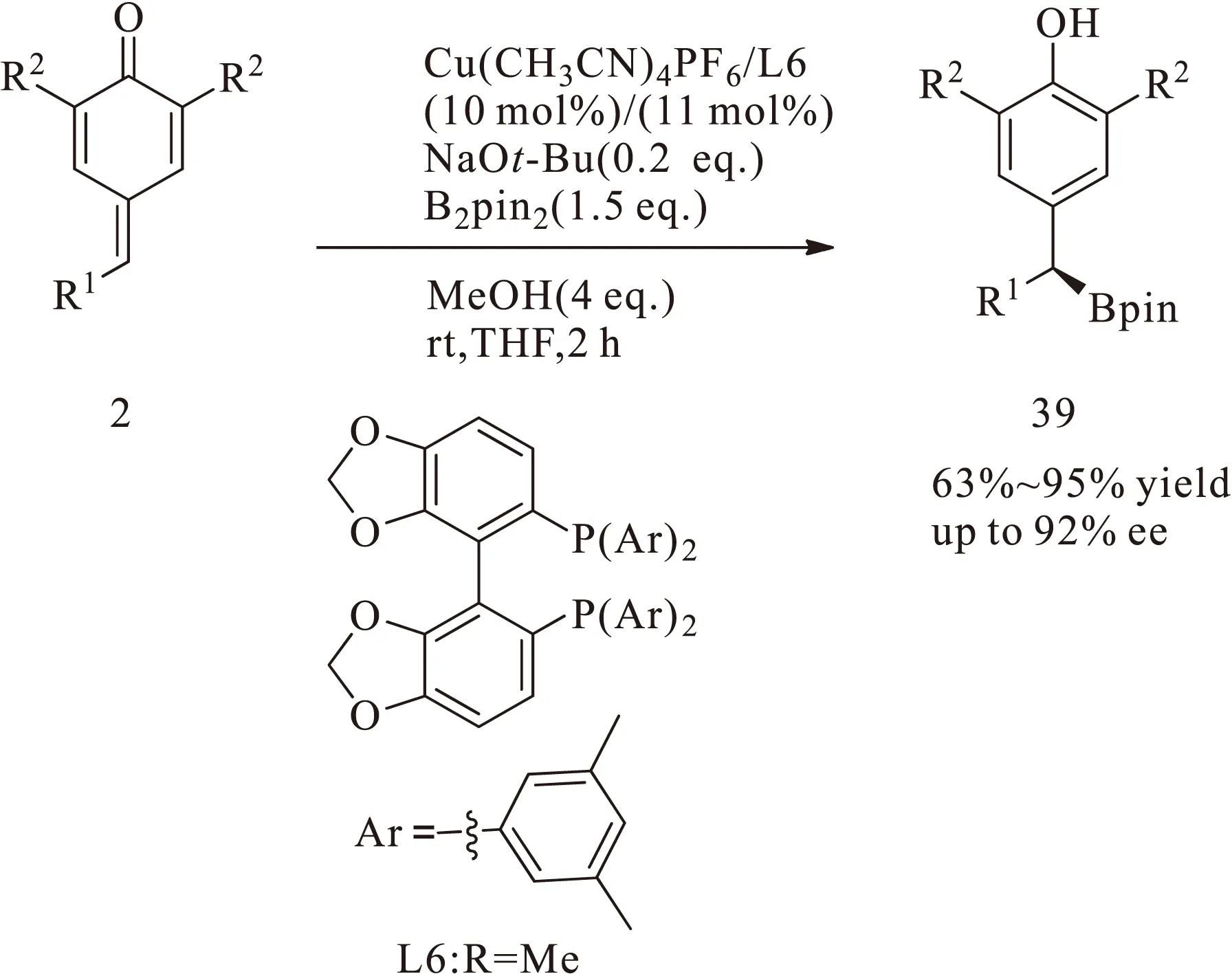
图15 手性的DM-Segphos与铜络合催化对亚甲基苯醌与双(频哪醇)二硼合成二芳基硼酸酯Fig.15 Synthesis of diarylbenzylicboronates through 1,6-addition reaction of p-quinone methides with bis(pinacolato)diboron catalyzed by chiral DM-Segphos-copper complex
2015年,邓伟平课题组[22]同样将金属铜应用于对亚甲基苯醌的不对称催化,该课题组设计了Cu(CH3CN)4BF4/Ph-Foxap(L3配体)催化体系,催化甘氨酸席夫碱40与对亚甲基苯醌2的不对称1,6-共轭加成反应,以很高的收率、非对映选择性和对映选择性得到具有2个连续手性中心的化合物41,如图16所示。同时,该反应也适用于克级以上的应用,但是该反应中的对亚甲基苯醌底物2是预先合成的。
2016年,赵宇课题组[23]对金属催化对亚甲基苯醌2与烯丙基环氧化物42的分子内不对称 [3+2]环加成反应进行了探究,并将钯与配体L8络合的手性催化剂应用于该反应,以91%的收率、99%的对映选择性以及较高的非对映选择性(>20∶1 dr)得到一系列光学活性物质43,如图17所示。随后该课题组又设计了L15与钯络合的手性催化剂,将其应用于乙烯基环丙烷衍生物44与对亚甲基苯醌2的分子内不对称[3+2]环加成反应,同样以较高的收率、较高的对映选择性和非对映选择性得到一系列光学活性物质45,如图18所示。该反应中的对亚甲基苯醌底物2也是预先合成的。

图16 Cu(CH3CN)4BF4/Ph-Foxap催化体系催化对亚甲基苯醌与甘氨酸席夫碱的不对称1,6-共轭加成反应Fig.16 Asymmetric 1,6-conjugate addition reaction of p-quinone methides with glycine Schiff bases catalyzed by Cu(CH3CN)4BF4/Ph-Foxap catalytic system
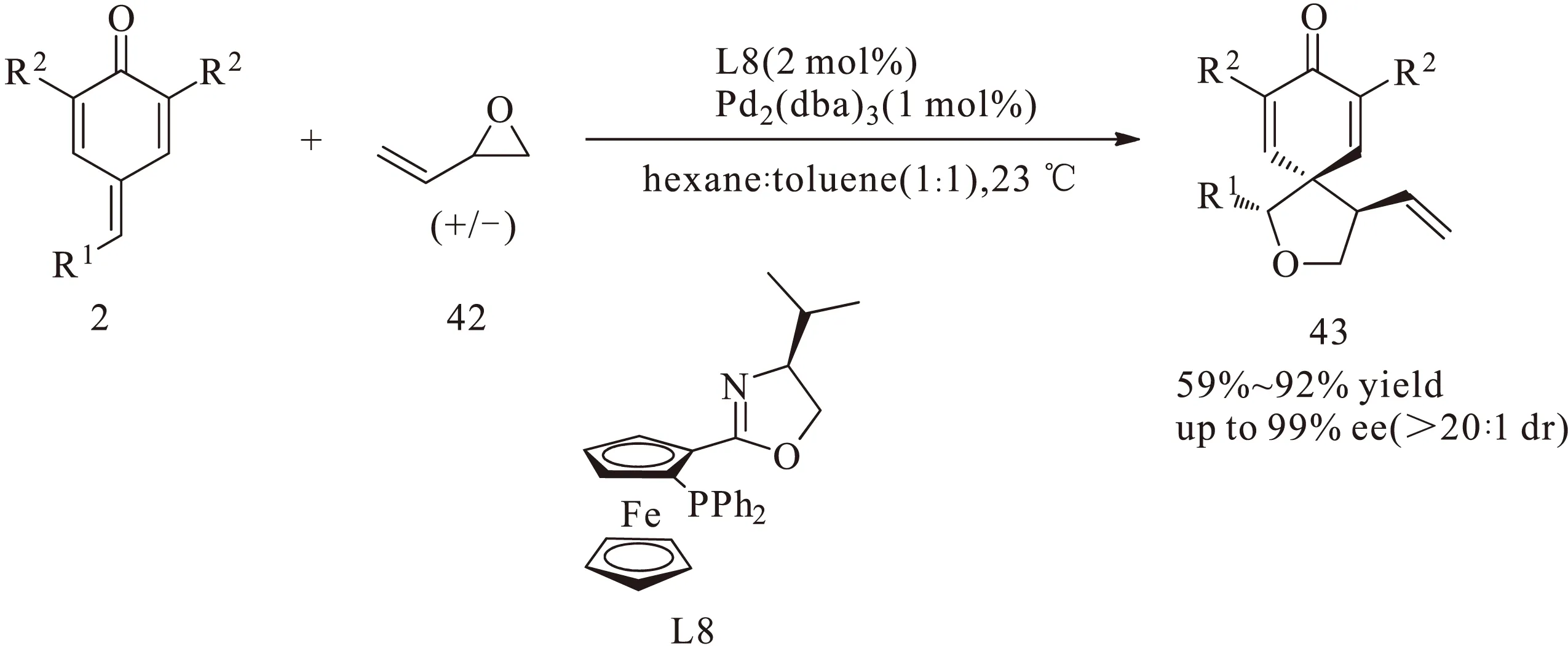
图 17 二茂铁叔膦配体(L8)-钯络合的催化剂催化对亚甲基苯醌与烯丙基环氧化物的分子内不对称[3+2]环加成反应Fig.17 Intramolecular asymmetric[3+2] cycloaddition reaction of p-quinone methides with allyl epoxides catalyzed by ferrocenylphosphine ligand(L8)-Pd2(dba)3 complex
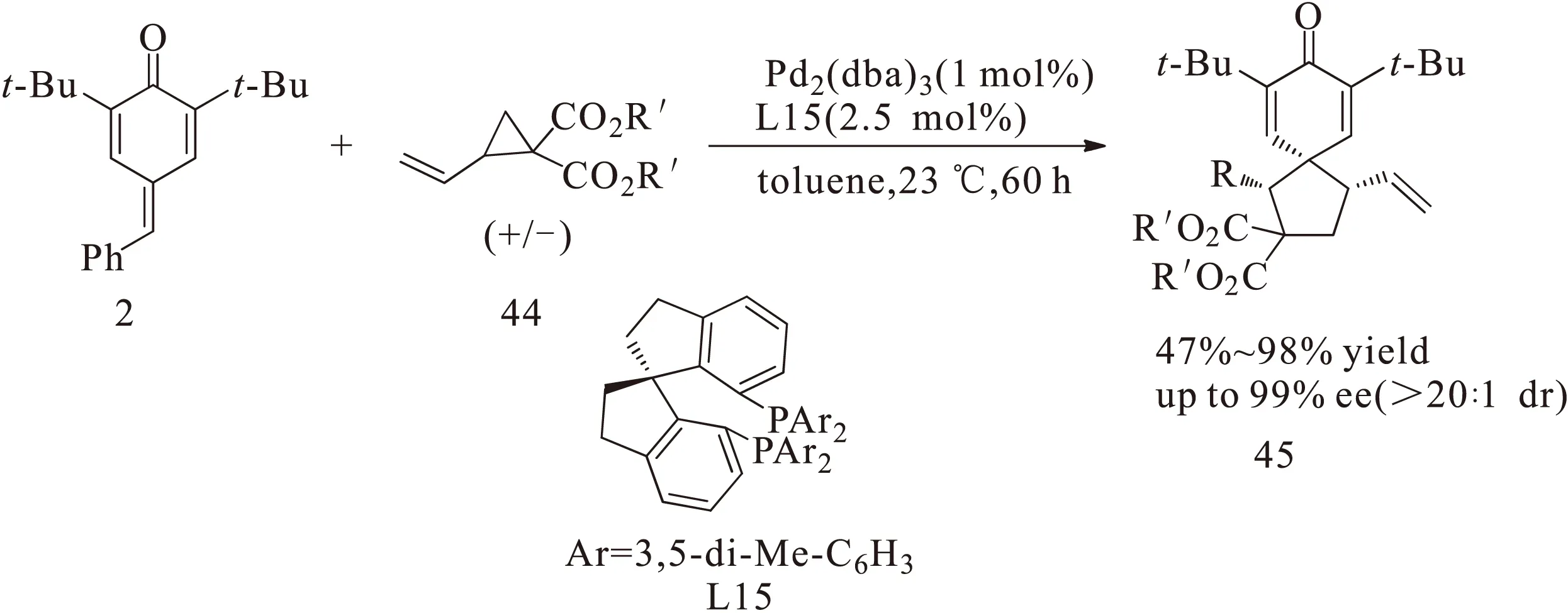
图18 配体L15-钯络合的催化剂催化对亚甲基苯醌与乙烯基环丙烷衍生物的分子内不对称[3+2]环加成反应Fig.18 Intramolecular asymmetric[3+2] cycloaddition reaction of p-quinone methides with vinyl cyclopropane derivatives catalyzed by ligand L15-Pd2(dba)3 complex
3 结语
近年来,对亚甲基苯醌分子作为亲电试剂在不对称催化中的应用越来越广泛。但是,由于对亚甲基苯醌分子具有较高的活性,稳定性较差,通常需要向羰基邻位引入位阻较大的叔丁基以增强分子的稳定性,这样就限制了对亚甲基苯醌分子的底物范围。很多不含有稳定基团的对亚甲基苯醌无法长期保存,将其成功应用于不对称催化反应中仍然是巨大的挑战,相信随着研究的深入该难点终会被克服。
[1] PETER M G.Chemical modifications of biopolymers by quinones and quinone methides[J].Angewandte Chemie International Edition,1989,28(5):555-570.
[2] TOTEVA M M,RICHARD J P.The generation and reactions of quinone methides[J].Advances in Physical Organic Chemistry,2011,45(23):39-91.
[3] CHU W D,ZHANG L F,BAO X,et al.Asymmetric catalytic 1,6-conjugate addition/aromatization of para-quinone methides:enantioselective introduction of functionalized diarylmethine stereogenic centers[J].Angewandte Chemie International Edition,2013,52(35):9229-9233.
[4] SALEH S A,TASHTOUSH H I.De-tert-butylation of substituted arenes[J].Tetrahedron,1998,54(47):14157-14177.
[5] CARUANA L,KNIEP F,JOHANSEN T K,et al.A new organocatalytic concept for asymmetricα-alkylation of aldehydes[J].Journal of the American Chemical Society,2014,136(45):15929-15932.
[6] ZHAO K,ZHI Y,WANG A,et al.Asymmetric organocatalytic synthesis of 3-diarylmethine-substituted oxindoles bearing a quaternary stereocentervia1,6-conjugate addition to para-quinone methides[J].ACS Catalysis,2015,6(2):657-660.
[7] WANG Z B,WONG Y F,SUN J W.Catalytic asymmetric 1,6-conjugate addition of para-quinone methides:formation of all-carbon quaternary stereocenters[J].Angewandte Chemie International Edition,2015,54(46):13711-13714.
[8] LI X Y,XU X Y,WEI W W,et al.Organocatalyzed asymmetric 1,6-conjugate addition of para-quinone methides with dicyanoolefins[J].Organic Letters,2016,18(3):428-431.
[9] CREMLYN R J.An Introduction to Organosulfur Chemistry[M].John Wiley & Sons Ltd.,1996.
[10] KONDO T,MITSUDO T A.Metal-catalyzed carbon-sulfur bond formation[J].Chemical Reviews,2000,100:3205-3220.
[11] CLAYDEN J,MACLELLAN P.Asymmetric synthesis of tertiary thiols and thioethers[J].Beilstein Journal of Organic Chemistry,2011,7(1):582-595.
[12] PACHAMUTHU K,SCHMIDT R R.Synthetic routes to thiooligosaccharides and thioglycopeptides[J].Cheminform,2016,37(18):160-187.
[13] DONG N,ZHANG Z P,XUE X S,et al.Phosphoric acid catalyzed asymmetric 1,6-conjugate addition of thioacetic acid to para-quinone methides[J].Angewandte Chemie International Edition,2015,55(4):1460-1464.
[14] DENG Y H,ZHANG X Z,YU K Y,et al.Bifunctional tertiary amine-squaramide catalyzed asymmetric catalytic 1,6-conjugate addition/aromatization of para-quinonemethides with oxindoles[J].Chemical Communications,2016,52(22):4183-4186.
[15] GE L,LU X,CHENG C,et al.Amide-phosphonium salt as bifunctional phase transfer catalyst for asymmetric 1,6-addition of malonate esters to para-quinone methides[J].The Journal of Organic Chemistry,2016,81(19):9315-9325.
[16] ZHANG X Z,DENG Y H,YAN X,et al.Diastereoselective and enantioselective synthesis of unsymmetricβ,β-diaryl-α-amino acid estersviaorganocatalytic 1,6-conjugate addition of para-quinone methides[J].The Journal of Organic Chemistry,2016,81(13):5655-5662.
[17] GRONDAL C,JEANTY M,ENDERS D.Organocatalytic cascade reactions as a new tool in total synthesis[J].Nature Chemistry,2010,2(3):167-178.
[18] PELLISSIER H.Stereocontrolled domino reactions[J].Chemical Reviews,2012,113(1):442-524.
[19] ZHAO K,ZHI Y,SHU T,et al.Organocatalytic domino oxa-Michael/1,6-addition reactions:asymmetric synthesis of chromans bearing oxindole scaffolds[J].Angewandte Chemie International Edition,2016,55(39):12104-12108.
[20] LOU Y,CAO P,JIA T,et al.Copper-catalyzed enantioselective 1,6-boration of para-quinone methides and efficient transformation of gem-diarylmethine boronates to triarylmethanes[J].Angewandte Chemie International Edition,2015,54(41):12134-12138.
[21] JARAVA-BARRERA C,PARRA A,LOPEZ A,et al.Copper-catalyzed borylative aromatization ofp-quinone methides:enantioselective synthesis of dibenzylic boronates[J].ACS Catalysis,2015,6(1):442-446.
[22] HE F S,JIN J H,YANG Z T,et al.Direct asymmetric synthesis ofβ-bis-aryl-α-amino acid estersviaenantioselective copper-catalyzed addition ofp-quinone methides[J].ACS Catalysis,2015,6(2):652-656.
[23] MA C,HUANG Y,ZHAO Y.Stereoselective 1,6-conjugate addition/annulation of para-quinone methides with vinyl epoxides/cyclopropanes[J].ACS Catalysis,2016,6(10):6408-6412.
ResearchProgressinAsymmetricCatalyticReactionofp-QuinoneMethides
FAN Ya-jing,LI Shen*
(SchoolofScience,TianjinUniversity,Tianjin300350,China)
O621.256
A
1672-5425(2017)09-0007-08
2017-05-15
范亚静(1988-),女,河北邢台人,硕士研究生,研究方向:手性有机化学,E-mail:yajing1001@tju.edu.cn;通讯作者:李珅,副教授,E-mail:shenli@tju.edu.cn。
10.3969/j.issn.1672-5425.2017.09.002
范亚静,李珅.对亚甲基苯醌不对称催化反应的研究进展[J].化学与生物工程,2017,34(9):7-14.

