石墨烯类纳米材料作为药物载体的研究进展及其潜在风险
孙小艳, 卢坤, 李奥, 高士祥, 毛亮, 叶新华, *
1. 南京医科大学第一附属医院,南京 2100292. 南京市栖霞区医院,南京 2100333. 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210046
石墨烯类纳米材料作为药物载体的研究进展及其潜在风险
孙小艳1,2, 卢坤3, 李奥1, 高士祥3, 毛亮3, 叶新华1, *
1. 南京医科大学第一附属医院,南京 2100292. 南京市栖霞区医院,南京 2100333. 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210046
石墨烯作为一种新兴的二维碳纳米材料,近年来受到了医学领域科学家的高度关注。由于石墨烯类纳米材料具有较大的比表面积,易于表面修饰等优点,目前在药物载体方面的研究发展迅速。随着纳米技术的发展,除了氧化石墨烯外,进一步将还原氧化石墨烯、石墨烯量子点、石墨烯纳米带等石墨烯类纳米材料作为药物载体应用到医学领域。本文综述了石墨烯类纳米材料作为药物载体在医学领域的研究进展,并从石墨烯类纳米材料的相关毒性研究角度,提醒了人们负载药物前后石墨烯类纳米材料的迁移规律对其潜在风险研究的重要性。
氧化石墨烯;石墨烯量子点;石墨烯纳米带;药物载体;迁移途径;潜在风险
Received12 January 2017accepted10 March 2017
Abstract: In the realm of drug delivery, graphene family materials have gained tremendous attention as promising nanocarriers, owing to their distinct characteristics, such as high surface area, enhanced cellular uptake and the possibility to be easily conjugated with many therapeutics, including both small molecules and biologics. Specially, reduced graphene oxide (rGO), graphene quantum dots (GQDs) and graphene nanoribbons (GNRs) are being widely studied as drug carriers. This paper reviews the latest development of graphene-based materials as drug carriers in biomedical research fields and discusses emphatically their translocation pathways and in vivo toxicities, which remind researcher the potential risks of the graphene-based materials as the drugs carrier.
Keywords: graphene oxide; graphene quantum dots; graphene nanoribbons; drug carriers; translocation behaviors; potential risks
随着世界经济的快速发展,人们生活水平的不断提高,健康将成为人们日益关心的问题。21世纪,癌症(肿瘤)已成为威胁人类生命健康的世界性问题[1-2]。目前治疗肿瘤的主要方法之一就是药物化学治疗(化疗)。对于传统的化疗方法,药物无法针对性的对肿瘤细胞发生作用,从而不可避免地产生全身毒副作用[3-4]。因此为了能够有效地避免化疗所产生的毒副作用,寻找具有靶向性的高效新型药物传递系统已成为肿瘤治疗领域的亟需解决的重大问题。对于癌症治疗而言,优良的药物传递系统不仅要具有良好的体内动力学代谢特征和靶向功能,而且还应具备可控的药物释放能力以及增强癌细胞对药物吸收的能力。这样才能够更加高效,更加专一的治疗癌症并且降低其产生的副作用。近年来,随着纳米技术的发展,科学家们已经开发出一些基于纳米粒子的药物传递系统[5-7],如Ladewig K等[8]研究发现层状双氢氧化物(layered double hydroxide, LDH)纳米粒子可以有效的负载药物以及一些具有治疗作用的生物小分子。
与其他纳米粒子相比,石墨烯作为一种典型的二维碳纳米材料,由于其具有独特的物理、化学及光学等优良特性,自2004年发现以来,已经逐渐引起各个领域科学家的高度关注,如电子设备、传导器、能源材料、催化工艺等[9-12]。近年来,石墨烯类纳米材料在生物医学领域的应用正逐渐引起科学家们的重视,例如在生物传感器、细胞影像、传递药物等方面[13-17]。石墨烯具有较大的比表面积(~2 630 m2g-1),并且能够通过π-π作用负载芳香类的药物[18]。Liu等[19]是最早开展将石墨烯类纳米材料用于药物传递的研究,他们发现氧化石墨烯能够有效地吸附难溶解的芳香类抗癌药物如喜树碱类似物SN38等。除了氧化石墨烯外,其他与石墨烯相关的材料,例如还原氧化石墨烯、石墨烯量子点、石墨烯纳米带等也被用于药物传递[20]。但是目前面临的一个挑战是石墨烯类纳米材料在生理学环境下(例如缓冲溶液以及细胞培养液等)容易发生团聚,这样会不可避免的影响其负载药物的能力并且减少细胞对药物的摄取量[14,20]。目前已经有文献报道可以通过对石墨烯类纳米材料进行功能化来解决其容易团聚的缺点。如利用聚乙二醇、聚乙烯亚胺,明胶、壳聚糖以及磺酸基等对石墨烯类纳米材料进行共价或者非共价修饰,修饰后的材料在生理学环境下其分散性和稳定性都得到了改善[21-24]。此外,为了实现石墨烯类纳米材料负载药物后的靶向功能,可以通过在材料表面负载一些特异性的生物分子,例如叶酸、透明质酸以及一些抗体等[22,25-26]。最后一旦将石墨烯类纳米材料作为药物载体应用于临床治疗,需要考虑到当药物从载体上释放后,残留的石墨烯在生物体内的迁移、转化、毒性效应以及对生物体自身行为(学习和记忆能力等)的影响。
本文结合最近的文献报道重点讨论了不同功能化后的石墨烯类纳米材料作为药物载体在生物医学上的应用以及药物释放后残留的石墨烯材料在生物体内的行为以及潜在风险,最后对石墨烯类纳米材料作为药物载体的应用前景进行了展望。
1 石墨烯类纳米材料作为药物载体在医学领域的应用(Applications of graphene-based materials as drug carrier materials in medical fields)
1.1 氧化石墨烯(graphene oxide, GO)
目前氧化石墨烯是石墨烯纳米材料作为药物载体中最常用的一种。由于氧化石墨烯表面富含大量的含氧官能团(如羧基、羟基、环氧基等)使得其在水溶液中具有很好的分散性。氧化石墨烯层内C原子共同形成一个大的π键,能够通过非共价π-π作用与芳香类化合物相互结合,因而是这类药物分子中非常出色的药物载体[15,17]。此外,氧化石墨烯表面有着良好的近红外波段的吸收、较大的比表面积、反应活性,因此也越来越多的被应用到生物传感器、药物以及基因载体、光热疗法介体等方面[14-16]。
由于氧化石墨烯在生理学环境下容易发生聚集,这将会影响其负载药物的能力,因此需要对其进行功能化修饰来解决其容易团聚的问题。在众多的聚合物以及表面活性剂中,聚乙二醇(PEG)是最常使用的一种。原因是其具有良好生物相容性、无毒且容易被肾脏或者肝脏代谢清除掉[13,27-28]。Liu等[19]利用PEG修饰GO后,PEG-GO在生理学环境具有良好的稳定性。同样具有高度亲水性和生物相容性的聚乙烯醇(PVA)也被用于功能化GO,通过π-π相互作用在其表面装载喜树碱(CPT)等抗癌药物,用于人类乳腺癌和皮肤癌细胞的研究[29]。以明胶作为还原剂和防止聚集的稳定剂也可制备功能化石墨烯薄片[30]。这种薄片在血清等生理液体中稳定性高,且在高浓度(0.2 mg·mL-1)下对 MCF-7细胞基本没有毒性。负载阿霉素后,它能高效杀伤 MCF-7 细胞。同时明胶介导其体外持续释放,进一步提高疗效,为细胞成像和药物输送等生物医学应用奠定基础。同样,壳聚糖(CS)也是一种具有优良性能的物材料,可作为肿瘤给药载体[2]。Bao等[2]通过简单的酰胺化反应完成CS在GO上的共价接枝,制备了含约 64% (质量比) CS 的GO-CS复合物。GO-CS可通过π-π堆叠和疏水相互作用大量携载水溶性差的抗癌药物喜树碱。该载药复合物与HepG2肝癌细胞和HeLa细胞作用时的细胞毒性较单纯药物有明显提高。 GO-CS还能与质粒DNA复合形成稳定的纳米复合物转染HeLa细胞,其转染效率较为理想。Fan等[31]用海藻酸钠(SA)来修GO制备出一种新的药物载体。GO-SA能够高效的负载DOX,其负载量高达1.843 mgmg-1,并且在癌细胞的酸性环境下,DOX能够有效的从GO-SA上释放出来。MTT实验结果显示,GO-SA对HeLa细胞没有明显的毒性作用,但是GO-SA-DOX却表现出显著的毒性作用。类似地,Lei等[24]利用静电作用将壳聚糖和海藻酸钠以自组装的方式负载到氧化石墨烯的表面。通过这种方式修饰后的氧化石墨烯具有较高的水溶解性以及稳定性,并且在生理学环境下具有较低的非特异性蛋白吸附能力,修饰后的氧化石墨烯能够有效地负载DOX。
近年来,研究发现利用金属化合物修饰GO,同样可以实现GO的多功能化并且用于药物传递的研究。例如,Shi 等[32]通过简单的水热法将银纳米粒子(Ag nanoparticle)沉积在GO的表面从而形成GO@Ag纳米复合物,其研究结果发现DOX的负载率高达82%(重量比),肿瘤细胞对GO@Ag-DOX的摄取量是DOX的8倍,并且被摄入的GO@Ag-DOX能够较快地得到释放以达到杀死癌细胞的效果。Ma等[33]将GO包裹在金纳米颗粒表面形成Au@NGO纳米复合物,该纳米复合物可以通过非共价作用与DOX结合,并且将DOX运输到HeLa细胞中。Khatamian等[34]将锌-斜发沸石(Zn-Clin)复合物加载到GO的表面形成了Zn-Clin-GO复合物用于载药的研究,结果发现该纳米复合物对DOX的负载效率要略高于GO,并且负载药物后的Zn-Clin-GO能够被细胞所摄取,而进入到细胞后DOX能够从Zn-Clin-GO上缓慢释放,因此制备出的这个纳米复合物能够用于药物传递。Qin等[35]利用自组装的方式,将GO与仿生膜-介孔二氧化硅组装到一起。研究发现,该石墨烯基复合物能够携带7倍的DOX到达肿瘤细胞,然后通过近红外光照的照射,进入到细胞内的GO能够将光能转化为热能杀死一部分细胞。同时,过热情况下能够使得DOX从该石墨烯基复合物上释放出来进一步将癌细胞杀死。
此外,近年来研究发现可以利用一些其他的生物大分子或者聚合物来修饰氧化石墨烯以提高其在生理学环境环境下的稳定性及药物负载量,此外在其表面装载一些特异性分子以达到靶向作用。例如,Guo等[36]带有氨基基团的树枝状大分子(Dendrimers capped with amino groups, DEN)对GO进行修饰,然后将钆而亚乙基三胺五乙酸酯(Gd-DTPA)和前列腺干细胞抗原单克隆的抗体(mAb)嫁接到GO-DEN(Gd-DTPA)上形成GO-DEN(Gd-DTPA)-mAb,其研究结果发现该纳米复合物具有低毒性,并且能够有效地负载DOX。由于具有前列腺干细胞抗原单克隆的抗体,所以能够特异性地与前列腺癌细胞发生作用。Zhou 等[37]利用邻菲罗啉(HPIP)负载在GO表面以形成GO-HPIP,然后通过静电作用与PEI相结合,最后再负载转铁蛋白(transferrin, Tf)后能够针对性激活p38和JNK通路并且抑制ERK和AKT通路,从而使癌细胞凋亡。
1.2 还原氧化石墨烯(reduced graphene oxide, rGO)
还原氧化石墨烯是将氧化石墨烯上的官能团去掉以形成类似单层结构的石墨烯纳米片。 具有平面结构的还原氧化石墨烯可以通过疏水作用与一些功能分子相结合,但是在生理学环境下容易发生聚集[38]。因此需要利用合成聚合物或者生物聚合物进行表面来提高其稳定性以达到纳米载药的目的。已有研究报道PEG修饰的rGO对RNA具有很强的负载能力,并且负载后的rGO能够有效地被细胞所吞噬[39]。一些具有生物相容性的聚合物,例如透明质酸胆固醇酯(cholesteryl hyaluronic acid, CHA)、右旋糖酐以及肝磷脂等也可以用来修饰rGO。例如,Miao等[40]将利用CHA修饰rGO后,rGO在生理学环境的胶体稳定性以及在生物体内的安全性显著增强。CHA-rGO对DOX的负载能力也提高了4倍,并且负载药物后的CHA-rGO能够被KB细胞有效地摄取。通过对有肿瘤的小鼠进行尾部静脉注射发现,CHA-rGO-DOX更容易被肿瘤细胞所富集。此外,研究发现基于rGO的一些纳米复合物也可以用来传递药物。例如,He等[41]将烷基链嫁接到介孔二氧化硅上,然后将rGO通过非共价作用结合到烷基链上形成rGO纳米复合物用做药物载体。研究发现该纳米复合物能够有效地负载DOX,并且在近红外光照下DOX能够得到有效地释放。通过MTT试验确定了该纳米复合物负载药物后能够有效地杀死SMMC-7721细胞,且其效率要高于DOX本身。但是这些物质不具有抗癌活性,因此急需寻找一些物质既能够通过修饰以增强rGO的水溶性和抗癌效果。最近,Zheng 等[42]利用聚合L-赖氨酸(PLL)修饰rGO后,再将抗表皮生长因子的抗体(anti-HER2)嫁接到PLL-rGO用来负载DOX,结果发现anti-HER2-PLL-rGO同样可以负载大量的DOX并且负载后rGO可以选择性地与MCF/HER2Z肿瘤细胞发生特异性的结合。
研究报道小分子肝素(low-molecular-weight heparin, LMWH)的衍生物具有潜在的抗癌作用[43]。例如,在这些衍生物中牛黄胆酸盐(LMWH-LHT7)可以显著增强抗血管生成的活性并减低抗凝剂的活性[44]。此外有报道表明LMWH-LHT7与抗癌药物具有协同作用[45]。Shim等[46]将LHT7负载到rGO的表面以增强其分散性和稳定性,并且可以促进其携带抗癌药物后的抗癌效果。LHT7-rGO对DOX的负载量高达5 mgmg-1,远远高于rGO对DOX的负载量。负载DOX后的LHT7-rGO同样可以有效的被KB细胞所摄取。对肿瘤细胞暴露后发现1 h内就在可以在肿瘤细胞内发现大量的LHT7-rGO,在暴露48 h后,肿瘤细胞内LHT7-rGO含量依然是rGO含量的7倍。为了评价LHT7-rGO-DOX的抗癌效果,将处理过的肿瘤细胞进行移植,结果发现在第25天时,与其他对照组相比,LHT7-rGO-DOX处理过的肿瘤最小,并且其重量减少了92.5%。此外,LHT7-rGO-DOX暴露后,凋亡的肿瘤细胞的数目是与单独暴露DOX的2.4倍,这说明LHT7-rGO显著增强了DOX的抗癌活性。
研究发现癌症患者单独服用某种抗癌药物不仅具有很强的副作用同时还会产生癌细胞的抗药性,因此,近年来开始使用联合化疗法来实现治疗癌症的同时使得可能产生的副作用降低的最小范围[47-48]。Thapa等[47]首先用泊洛沙姆407(P407)修饰rGO,然后将叶酸受体装载到P407-rGO上用来负载2种药物伊立替康(irinotecan,IRI)和多西他赛(docetaxel,DOC)。结果发现P407修饰后的rGO在生理学环境下依然具有良好的分散性,并且能够有效地负载2种药物,且负载后能够通过pH值控制其释放速率。由于叶酸(folate)受体在人类乳腺癌细胞(MCF-7)中大量表达,但是在肝癌细胞(HepG2)中并不会大量表达。因此,FA装载到rGO上,可以特异性地被MCF-7细胞所摄取。当进入到癌细胞中后,2种药物释放后能够分别与拓扑异构酶 I(IRI)和微管(DOC)发生作用是的癌细胞凋亡。
1.3 石墨烯量子点(graphene quantum dots, GQDs)
石墨烯量子点是由碳原子组成的石墨烯家族的最新成员。一些研究报道表明可以用高分辨电子束、化学、电化学、水热法等技术来制备石墨烯量子点[49-50]。制备出的石墨烯量子点是具有零维结构的碳纳米材料。作为一种新型碳纳米材料量子点,它具有许多优良的特性,例如较大的比表面积、无毒性、化学惰性、较低的制备成本、优良的水溶性、可变的能量带隙、有很强的近红外吸收,较高的光电转化效率、优良的导热性能[7, 51-52]。此外,石墨烯量子点还具有量子限制效应和边效应,因此可以诱导自身发出荧光[53-54]。利用含氧活性基团化学反应性不同,可以与多种有特定化学和生物性能的化学基团和功能分子进行共价反应,对石墨烯进行表面功能化修饰,达到超高的载药量、靶向输送和药物的可控释放的目的。在生物医药领域作为药物载体[55]、细胞组织成像[56-57]、荧光探针[58]等已得到广泛应用。
在药物传递系统中,通常使用有机荧光染料或者半导体量子点来修饰GO以实现细胞摄取药物的可视化过程[59-62]。但是,像罗丹明B和荧光素异硫氰酸酯等与GO结合后其荧光效应容易被GO淬灭[22,63-64]。而较大尺寸的重金属半导体量子点装饰到GO上容易改变其药物传递的功能[51]。由于石墨烯量子点(GQDs)本身尺寸较小且具有自发荧光的功能,因此可以用来传递药物并且能够进行实时观测细胞对药物的摄取过程。
Wang等[55]研究发现将GQDs与叶酸(FA)形成的GQD-FA用于负载抗癌药物阿霉素(DOX)。由于单原子层的GQDs表面有大量的芳香环能够与DOX发生π-π作用,所以其负载效率高达68%±9% (wt)。利用HeLa细胞对其选择性摄取进行了研究,发现负载药物后细胞对GQDs-FA的选择性维持不变。由于GQDs本身具有自发荧光的功能,因此可以分别利用GQDs和DOX的荧光性来实时监测细胞对DOX-GQDs-FA的摄取过程以及摄取后药物在细胞内的释放。研究发现在30 min内,HeLa细胞就可以将DOX-GQDs-FA摄入到体内,并且摄入后的DOX-GQDs-FA主要分布在细胞质部分,但是无法观察到DOX的荧光信号,这说明DOX依然被GQDs-FA所吸附,导致其荧光信号被GQDs-FA淬灭。培养8 h后,可以观察到GQDs-FA依然停留在细胞质部分,但是在细胞质和细胞核部分可以明显的看到荧光的信号,这说明在酸性的核内体环境下,DOX已经从GQDs-FA上释放出来,并且进入细胞核内。荧光信号在时间尺度上的不同,说明了GQDs-FA-DOX能够迅速被细胞所摄入,而DOX能够缓慢的从GQDs-FA上释放出来,这正是纳米粒子作为药物载体所应具有的特征。
1.4 石墨烯纳米带(graphene nanoribbons, GNRs)
最近,Kosynkin等[65]将多壁碳纳米管径向拉开成功制备出了石墨烯纳米带。Sayan等[66]利用4种典型的细胞(宫颈癌细胞(HeLa)、鼠纤维原细胞(NIH-3T3)以及2种乳腺癌细胞SKBR3和MCF7)对新制备出的GNRs进行了细胞毒性的评价,研究发现石墨烯纳米带对4种细胞的活性都呈现出剂量-效应关系(10~400 μgmL-1)与时间-效应关系(12~48 h)。但是GNRs对4种细胞的毒性程度具有显著性的差异。例如暴露于10 μgmL-1的剂量下,SKBR3和MCF7在48 h后的存活率为100%。当暴露浓度增加到400 μgmL-1时,相同时间下其存活率约为78%。对HeLa细胞来说,当暴露浓度为10 μgmL-1时,在不同时间下其细胞死亡率为5%~25%。此外利用透射电子显微镜观察到HeLa细胞内的GNR含量要远远高于其他几种细胞,这说明GNR具有异构特异性细胞毒性,因此GNRs可以作为药物载体来对特异性细胞传递药物。
Sayan等[67]利用PEG-DSPE对GNRs进行表面修饰以增强其在水溶液中的稳定性。GNR-PEG-DSPE对抗肿瘤药物甲硫蒽酮(lucanthone)的负载量高达310 μmolmg-1,并且能够有效地将该药物传递至恶性胶质瘤细胞内。但是仍需进一步研究药物在GNRs上的释放动力学以及在不同类型细胞的摄取机制。此外,可以用不同的抗体对GNRs进行表面修饰以达到传递不同的药物到不同类型肿瘤细胞的目的。这种特异性的修饰主要是基于GNRs表面的抗体或者官能团能够与肿瘤细胞中过量表达的目标受体发生特异性结合。例如,GNRs表面负载能够与表皮生长因子受体相结合的抗体后,可以增强GNRs对这些肿瘤细胞的定位[68]。
2 石墨烯类纳米材料作为药物载体的潜在风险(Potential risks of graphene-based materials as drug carrier materials)
通常情况下,石墨烯类纳米材料负载药物后,通过静脉注射、口服等方式进入生物体内,将药物传递至病变部位以达到治疗疾病的效果。尽管可以在载体材料上通过嫁接一些特异性分子,例如抗体、叶酸等实现其靶向功能,但是当药物释放后残留的药物载体石墨烯在生物体内的迁移、转化规律、潜在的毒性效应甚至对生物体自身的行为(例如学习和记忆能力)的影响应当引起足够的重视。
目前,关于石墨烯类纳米材料对生物体的毒性研究较多[69-79]。根据石墨烯类纳米材料的尺寸以及不同的修饰类型进行总结如表1所示。从表中可以看出石墨烯类纳米材料通过静脉注射进入小鼠体内主要分布在肝脏、脾、肺、肾等部位,并且根据材料的类型以及材料自身尺寸的不同其在生物体内存留的有较大差异,从而引起的毒性也有明显的差异。根据表1中的结果可以看出,经过修饰过的GO其毒性效应明显减弱,尤其是经过PEG修饰后的GO可以通过肾脏排尿迅速从体内排出,从而不会引起组织器官明显的毒性。与GO相比,GQDs在生物体内的富集以及毒性则有较大的减弱,其主要原因可能与材料本身的尺寸有关。此外,石墨烯类纳米材料对生物体器官的毒性还取决于暴露浓度,一般在较低浓度下没有显著的毒性,但是随着暴露浓度的增加会显著增加其毒性,例如肝脏毒性、肺毒性以及炎症反应、肉芽肿等现象。但目前关于石墨烯及载药后的石墨烯在生物体内的迁移和转化研究较少。Mao等[79]利用14C标记的石墨烯(14C-FLG) 来研究通过气管滴注的方式暴露小鼠后石墨烯在其体内的分布规律以及毒性效应,结果发现暴露1 d后14C-FLG主要分布在小鼠的肺部,累积量高达85%,并且肺部的FLG能进入吞噬细胞;其余FLG主要分布在粪便、肠道和胃中。随着时间的推移,在暴露后的第7天,小鼠各器官的FLG都在减少,但粪便中的FLG增加,且在肝脏中也检测到了14C-FLG,说明14C-FLG可以通过肠道排出,少部分FLG也可能通过血液等途径传输;暴露4周后,依然残留47%的14C-FLG在肺部。Wen等[78]研究发现用对苯乙烯磺酸钠(poly sodium 4-styrenesulfonate, PSS)修饰的GO(16 mgkg-1) 通过静脉注射的方式进入到小鼠体内,发现GO-PSS能够在小鼠的肺、肝和脾中存留长达6个月,并且会引起相应器官的急性损伤和炎症。Yang等[69]将PEG修饰后的GO(20 mgkg-1) 通过静脉注射到小鼠体内,结果发现PEG-GO主要累积在网状内皮组织系统中,如肝脏和脾脏等部位。暴露时间3个月后并没有发现PEG-GO对小鼠的器官有明显的毒性效应。以上研究结果表明,对石墨烯进行不同的功能化修饰,能够改变其生物体内的毒性效应。
一项有趣的研究[81]表明,通过尾部静脉注射方式将2种不同尺寸的rGO(25 mgkg-1)注入到成年母鼠的体内,结果发现rGO并不会影响母鼠体内的性激素水平。在怀孕早期(6 d)时,将rGO注射到母鼠体内,结果发现母鼠体内有畸形的胎儿。当在怀孕后期(20 d)时,将rGO注射到母鼠体内,结果发现在低剂量(6.25 mgkg-1)和中剂量(12.5 mgkg-1)下就能够导致所有的母鼠流产。进一步的研究发现在高剂量(25 mgkg-1)暴露组下的大多数母鼠会死掉,但是能够存活下来的母鼠却能够产生健康的下一代小鼠。此外,Zhang等[80]的研究表明将高剂量的rGO(60 mgkg-1)经口暴露的方式对小鼠进行暴露,结果发现rGO能够被肠道吸收,从而进入到血液循环将rGO传递至肝脏、肾、胃、肺等器官,暴露15 d后,器官中rGO含量大大减少;60 d后在一些主要的器官如肝脏、肾和脑中几乎检测不到rGO。由于在脑中能够检测到rGO,因此推测rGO能够穿透血脑屏障,但是由于进入到脑中的rGO含量极低,并且很容易从脑中得到清除,因此rGO对脑部并没有明显的毒性效应。此外,通过测定脊椎部位的AchE和ChAT的活性,发现与空白组没有显著性差异,因此推断通过口服高剂量的rGO并不会损伤小鼠的中枢神经系统,所以对小鼠的学习和记忆行为也就没有明显的影响。由于rGO并不是小鼠自身所必需的营养物质,因此大剂量的rGO富集在小鼠的肾、胃和肺部等导致一些不适的症状,所以小鼠会表现出运动能力下降等行为。但是,rGO能够在短时间(<60 d)从器官中排泄出去,因此小鼠又会恢复到正常状态。
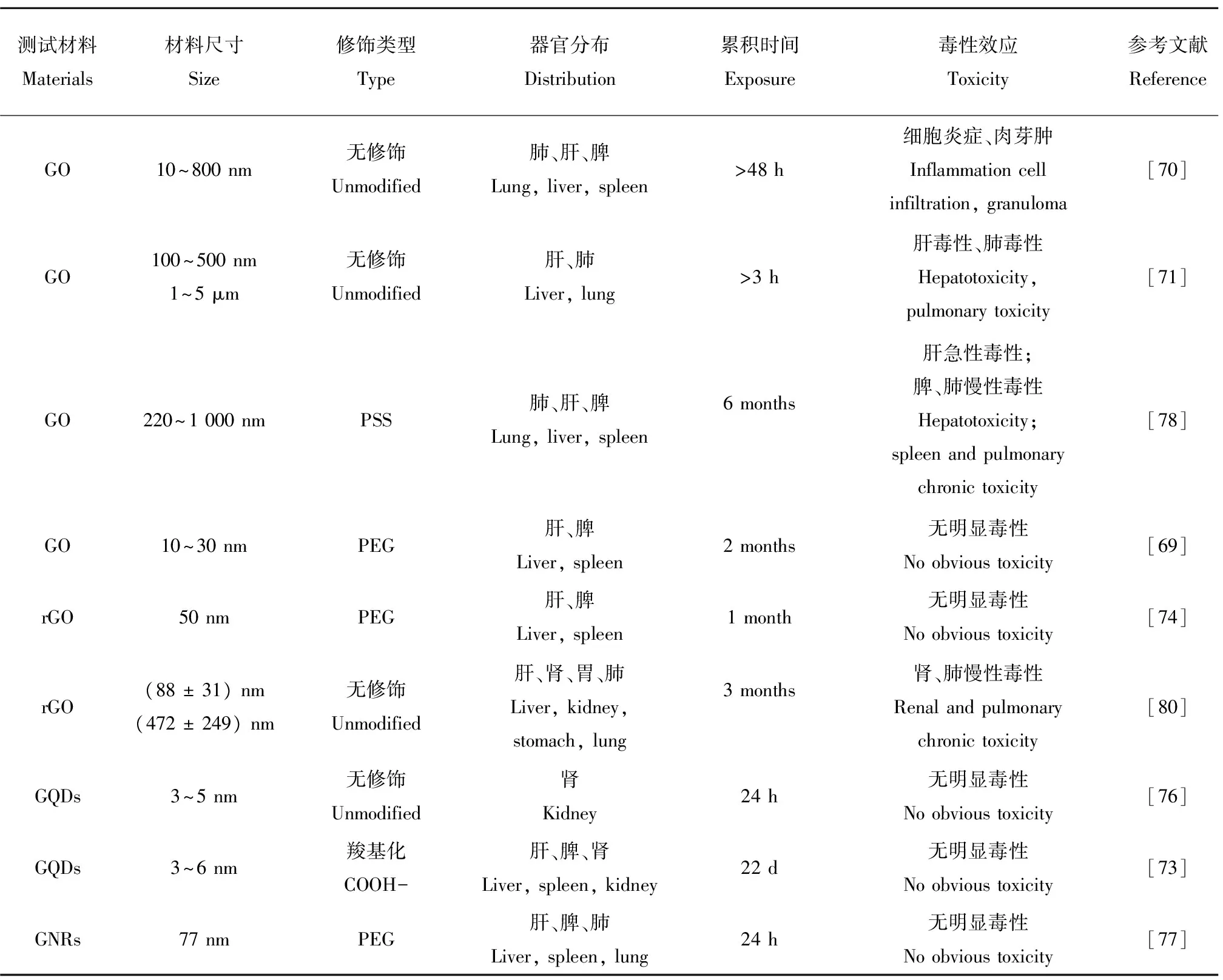
表1 石墨烯类纳米材料在生物体内的器官分布及毒性效应Table 1 Distribution and toxicity of graphene-based materials in vivo
Chong等[76]将石墨烯量子点分别以静脉注射和腹腔注射的方式注入小鼠体内,结果发现GQDs不会在小鼠器官中大量累积,并且会很快通过肾脏排出体外,因此不会对小鼠器官造成明显的器官毒性。主要原因是石墨烯量子点具有超小尺寸(3~5 nm)以及表面的超高含氧量。为了进一步探索GQD-PEG的生物安全性,根据临床用药的方式将GQD-PEG和GO-PEG每隔一天注入小鼠体内,每次的给药量为20 mgkg-1,持续给药14 d。结果发现GQD-PEG暴露组的小鼠与对照组相比没有明显的不同,但是GO-PEG暴露组的小鼠死亡率为25%。对死亡小鼠解剖观察发现,其肝脏和脾脏都呈现出明显的黑色,主要是由于GO累积在该器官,无法迅速的从器官中排出体外所致。而GQD由于具有超小尺寸,所以能够从体内迅速排出,因此不会长期在体内存留。综合考虑,具有超小尺寸和高含氧量的GQD更适合作为药物载体用于传递药物到达靶向位点。
由于GNRs的结构介于一维碳纳米管与二维石墨烯结构之间,因此GNRs在生物体内的分布和迁移规律与其他2类纳米材料都有所不同[70,82-83]。Lu等[77]磷脂-聚乙二醇(PL-PEG)对GNRs进行修饰,并Na[99mTcO4]进行标记以进行定量分析,然后将其以静脉注射的方式注入小鼠体内,结果发现在0.5 h内(84.37%±2.40%)的GNRs分布在肝脏部位,其次(2.18%±0.26%) 的GNRs分布在脾脏,剩下的依次是分布在血液和肺部((0.79%±0.08%)、(0.37%±0.14%)),在其他器官中机会检测不到GNRs。注射24 h后发现,肝脏中的GNRs明显减少,只剩下(7.49%±0.9%),而脾脏和肾脏中的GNRs的含量显著增加,其含量依次为(7.77%±0.51%)、(0.23%±0.01%)。研究结果表明,GNRs在小鼠体内的富集分布规律与其他碳纳米材料有着显著的差异。此外,尽管GNRs也同样大量的分布在肝脏部位,但是其在该部位的排泄速率要远远高于GO[82]以及多壁碳纳米管(MWCNTs)[84-85]。这说明GNRs的体内风险较低,适合作为药物载体用于传递药物。
3 结论与展望(Conclusion and prospect)
近年来,由于石墨烯类纳米材料本身具有优良的物理化学性能,使得其在药物传递系统中得到了广泛的应用空间。但是石墨烯类纳米材料在生理学环境下容易团聚,阻碍了其作为药物载体的应用,目前的研究结果表明可以利用一些生物小分子等对石墨烯纳米材料进行表面修饰来提高其生理稳定性以及生物相容性。然而,石墨烯类纳米材料作为药物载体在医学领域的应用仍然存在一些急需探索的问题,首先是可负载的药物比较单一,多为小分子药物;其次是目前的研究过于集中在体外的细胞实验而很少探索负载药物后石墨烯能否真正的到达肿瘤部位;最后,急需进一步增强载药后石墨烯的靶向功能以达到选择性的攻击癌症细胞并且对正常细胞无毒副作用的效果。此外,当石墨烯类纳米材料作为药物载体用于传递药物至生物体内,药物材料释放出来后,残留的石墨烯在生物体内的迁移、代谢、毒性以及对生物体自身行为的影响也是我们未来必需要考虑的问题。针对以上问题,首先需要根据癌细胞的类型以及所具有特异性的抗原来对石墨烯类纳米材料进行针对性的修饰以提高其靶向功能;其次可以从材料自身的角度来考虑,例如通过有效的方法来控制其尺寸大小以及表面的官能团含量以使得石墨烯注入体内后迅速的通过肾脏排尿等代谢方式排出体外。但就目前而言,仍需各科学研究团队加强多学科交叉融合,团结协作以共同解决所面临的问题。
[1] Fidler M M, Soerjomataram I, Bray F. A global view on cancer incidence and national levels of the human development index [J]. International Journal of Cancer, 2016, 139(11): 2436-2446
[2] Bao H Q, Pan Y Z, Ping Y, et al. Chitosan-functionalized graphene oxide as a nanocarrier for drug and gene delivery [J]. Small, 2011, 7(11): 1569-1578
[3] Arias J L. Drug targeting strategies in cancer treatment: An overview [J]. Mini-Reviews in Medicinal Chemistry, 2011, 11(1): 1-17
[4] Mohanty C, Das M, Kanwar J R. Receptor mediated tumor targeting: An emerging approach for cancer therapy [J]. Current Drug Delivery, 2011, 8(1): 45-58
[5] Ho Y T, Poinard B, Kah J C Y. Nanoparticle drug delivery systems and their use in cardiac tissue therapy [J]. Nanomedicine (London, England), 2016, 11(6): 693-714
[6] Johnstone T C, Suntharalingam K, Lippard S J. The next generation of platinum drugs: Targeted Pt(II) agents, nanoparticle delivery, and Pt(IV) prodrugs [J]. Chemical Reviews, 2016, 116(5): 3436-3486
[7] Yao X X, Niu X X, Ma K X, et al. Graphene quantum dots-capped magnetic mesoporous silica nanoparticles as a multifunctional platform for controlled drug delivery, magnetic hyperthermia, and photothermal therapy[J]. Small, 2016, 13(2): 1-11
[8] Ladewig K, Niebert M, Xu Z P, et al. Controlled preparation of layered double hydroxide nanoparticles and their application as gene delivery vehicles [J]. Applied Clay Science, 2010, 48(1-2): 280-289
[9] Geim A K, Novoselov K S. The rise of graphene [J]. Nature Materials, 2007, 6(3): 183-191
[10] Loh K P, Bao Q, Eda G, et al. Graphene oxide as a chemically tunable platform for optical applications [J]. Nature Chemistry, 2010, 2(12): 1015-1024
[11] Wang H L, Liang Y Y, Mirfakhrai T, et al. Advanced asymmetrical supercapacitors based on graphene hybrid materials [J]. Nano Research, 2011, 4(8): 729-736
[12] Huang X, Qi X Y, Boey F, et al. Graphene-based composites [J]. Chemical Society Reviews, 2012, 41(2): 666-686
[13] Sun X M, Liu Z, Welsher K, et al. Nano-graphene oxide for cellular imaging and drug delivery [J]. Nano Research, 2008, 1(3): 203-212
[14] Feng L, Liu Z. Graphene in biomedicine: Opportunities and challenges [J]. Nanomedicine, 2011, 6(2): 317-324
[15] Yang K, Feng L, Shi X, et al. Nano-graphene in biomedicine: Theranostic applications [J]. Chemical Society Reviews, 2013, 42(2): 530-547
[16] Lu C H, Yang H H, Zhu C L, et al. A graphene platform for sensing biomolecules [J]. Angewandte Chemie-International Edition, 2009, 48(26): 4785-4787
[17] Goenka S, Sant V, Sant S. Graphene-based nanomaterials for drug delivery and tissue engineering [J]. Journal of Controlled Release, 2014, 173: 75-88
[18] Wang Y, Li Z H, Wang J, et al. Graphene and graphene oxide: Biofunctionalization and applications in biotechnology [J]. Trends in Biotechnology, 2011, 29(5): 205-212
[19] Liu Z, Robinson J T, Sun X M, et al. PEGylated nanographene oxide for delivery of water-insoluble cancer drugs [J]. Journal of the American Chemical Society, 2008, 130(33): 10876-10877
[20] Yang K, Feng L Z, Liu Z. Stimuli responsive drug delivery systems based on nano-graphene for cancer therapy [J]. Advanced Drug Delivery Reviews, 2016, 105(Pt B): 228-241
[21] Ma X X, Tao H Q, Yang K, et al. A functionalized graphene oxide-iron oxide nanocomposite for magnetically targeted drug delivery, photothermal therapy, and magnetic resonance imaging [J]. Nano Research, 2012, 5(3): 199-212
[22] Zhang L M, Xia J G, Zhao Q H, et al. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs [J]. Small, 2010, 6(4): 537-544
[23] Yang X Y, Wang Y S, Huang X, et al. Multi-functionalized graphene oxide based anticancer drug-carrier with dual-targeting function and pH-sensitivity [J]. Journal of Materials Chemistry, 2011, 21(10): 3448-3454
[24] Lei H L, Xie M, Zhao Y W, et al. Chitosan/sodium alginate modificated graphene oxide-based nanocomposite as a carrier for drug delivery [J]. Ceramics International, 2016, 42(15): 17798-17805
[25] Huang Y P, Hung C M, Hsu Y C, et al. Suppression of breast cancer cell migration by small interfering RNA delivered by polyethylenimine-functionalized graphene oxide [J]. Nanoscale Research Letters, 2016, 11(1): 247
[26] Yang D Z, Feng L Z, Dougherty C A, et al. A. In vivo targeting of metastatic breast cancer via tumor vasculature-specific nano-graphene oxide [J]. Biomaterials, 2016, 104: 361-371
[27] Zhang W, Guo Z Y, Huang D Q, et al. Synergistic effect of chemo-photothermal therapy using PEGylated graphene oxide [J]. Biomaterials, 2011, 32(33): 8555-8561
[28] Jiang T Y, Sun W J, Zhu Q W, et al. Furin-mediated sequential delivery of anticancer cytokine and small-molecule drug shuttled by graphene [J]. Advanced Materials, 2015, 27(6): 1021-1028
[29] Sahoo N G, Bao H Q, Pan Y Z, et al. Functionalized carbon nanomaterials as nanocarriers for loading and delivery of a poorly water-soluble anticancer drug: A comparative study [J]. Chemical Communications, 2011, 47(18): 5235-5237
[30] Liu K, Zhang J J, Cheng F F, et al. Green and facile synthesis of highly biocompatible graphene nanosheets and its application for cellular imaging and drug delivery [J]. Journal of Materials Chemistry, 2011, 21(32): 12034-12040
[31] Fan L H, Ge H Y, Zou S Q, et al. Sodium alginate conjugated graphene oxide as a new carrier for drug delivery system [J]. International Journal of Biological Macromolecules, 2016, 93(Pt A): 582-590
[32] Shi J J, Wang L, Zhang J, et al. A tumor-targeting near-infrared laser-triggered drug delivery system based on GO@Ag nanoparticles for chemo-photothermal therapy and X-ray imaging [J]. Biomaterials, 2014, 35(22): 5847-5861
[33] Ma X, Qu Q Y, Zhao Y, et al. Graphene oxide wrapped gold nanoparticles for intracellular Raman imaging and drug delivery [J]. Journal of Materials Chemistry B, 2013, 1: 6495-6500
[34] Khatamian M, Divband B, Farahmand-Zahed F. Synthesis and characterization of Zinc (II)-loaded zeolite/graphene oxide nanocomposite as a new drug carrier [J]. Materials Science and Enginerring C Materials for Biological Applications, 2016, 66: 251-258
[35] Qin C C, Fei J B, Cai P, et al. Biomimetic membrane-conjugated graphene nanoarchitecture for light-manipulating combined cancer treatment in vitro [J]. Journal of Colloid and Interface Science, 2016, 482: 121-130
[36] Guo L L, Shi H L, Wu H X, et al. Prostate cancer targeted multifunctionalized graphene oxide formagnetic resonance imaging and drug delivery [J]. Carbon, 2016, 107: 87-99
[37] Zhou B W, Huang Y Y, Yang F, et al. Dual-functional nanographene oxide as cancer-targeted drug-delivery system to selectively induce cancer-cell apoptosis [J]. Chemistry-An Asian Journal, 2016, 11(7): 1008-1019
[38] Hou C, Quan H, Duan Y, et al. Facile synthesis of water-dispersible Cu2O nanocrystal-reduced graphene oxide hybrid as a promising cancer therapeutic agent [J]. Nanoscale, 2013, 5(3): 1227-1232
[39] Zhang L M, Wang Z L, Lu Z X, et al. PEGylated reduced graphene oxide as a superior ssRNA delivery system [J]. Journal of Materials Chemistry B, 2013, 1(6): 749-755
[40] Miao W, Shim G, Kang C M, et al. Cholesteryl hyaluronic acid-coated, reduced graphene oxide nanosheets for anti-cancer drug delivery [J]. Biomaterials, 2013, 34(37): 9638-9647
[41] He D G, Li X C, He X X, et al. Noncovalent assembly of reduced graphene oxide and alkyl-grafted mesoporous silica: An effective drug carrier for near-infrared light-responsive controlled drug release [J]. Jouranl of Materials Chemistry B, 2015, 3: 5588-5594
[42] Zheng X T, Ma X Q, Li C M. Highly efficient nuclear delivery of anti-cancer drugs using a bio-functionalized reduced graphene oxide [J]. Journal of Colloid and Interface Science, 2016, 467: 35-42
[43] Lee E, Kim Y S, Bae S M, et al. Polyproline-type helical-structured low-molecular weight heparin (LMWH)-taurocholate conjugate as a new angiogenesis inhibitor[J]. International Journal of Cancer, 2009, 124(12): 2755-2765
[44] Chung S W, Lee M, Bae S M, et al. Potentiation of anti-angiogenic activity of heparin by blocking the ATIII-interacting pentasaccharide unit and increasing net anionic charge [J]. Biomaterials, 2012, 33(35): 9070-9079
[45] Kim J Y, Shim G, Choi H W, et al. Tumor vasculature targeting following co-delivery of heparin-taurocholate conjugate and suberoylanilide hydroxamic acid using cationic nanolipoplex [J]. Biomaterials, 2012, 33(17): 4424-4430
[46] Shim G, Kim J Y, Han J, et al. Reduced graphene oxide nanosheets coated with an anti-angiogenic anticancer low-molecular-weight heparin derivative for delivery of anticancer drugs [J]. Journal of Controlled Release, 2014, 189: 80-89
[47] Thapa R K, Choi Y, Jeong J H, et al. Folate-mediated targeted delivery of combination chemotherapeutics loaded reduced graphene oxide for synergistic chemo-photothermal therapy of cancers [J]. Pharmaceutical Research, 2016, 33(11): 2815-2827
[48] Badr M, Kopp C, Theison S, et al. Methotrexate-gelonin conjugate - An inhibitor of MCF-7 cells expressing the dihydrofolate receptor[J]. Biological Chemistry, 2014, 395(12): 1461-1466
[49] Dong Y Q, Li G L, Zhou N N, et al. Graphene quantum dot as a green and facile sensor for sree chlorine in drinking water [J]. Analytical Chemistry, 2012, 84(19): 8378-8382
[50] Shin Y H, Lee J, Yang J H, et al. Mass production of graphene quantum dots by one- pot synthesis directly from graphite in high yield [J]. Small, 2014, 10(5): 866-870
[51] Zhu S J, Zhang J H, Qiao C Y, et al. Strongly green-photoluminescent graphene quantum dots for bioimaging applications [J]. Chemical Communications (Camb), 2011, 47(24): 6858-6860
[52] Sun H J, Wu L, Wei W L, et al. Recent advances in graphene quantum dots for sensing [J]. Materials Today, 2013, 16(11): 433-442
[53] Zheng X T, He H L, Li C M. Multifunctional graphene quantum dots-conjugated titanate nanoflowers for fluorescence-trackable targeted drug delivery [J]. RSC Advances, 2013, 3(47): 24853-24857
[54] Qiu J C, Zhang R B, Li J H, et al. Fluorescent graphene quantum dots as traceable, pH-sensitive drug delivery systems [J]. International Journal of Nanomedicine, 2015, 10: 6709-6724
[55] Wang X J, Sun X, Lao J, et al. Multifunctional graphene quantum dots for simultaneous targeted cellular imaging and drug delivery [J]. Colloids and Surfaces B, Biointerfaces, 2014, 122: 638-644
[56] Wu X, Tian F, Wang W X, et al. Fabrication of highly fluorescent graphene quantum dots using L-glutamic acid for in vitro/in vivo imaging and sensing [J]. Journal of Materials Chemistry C Materials for Optical, Magnetic and Electronic Devices, 2013, 1(31): 4676-4684
[57] Tetsuka H, Asahi R, Nagoya A, et al. Optically tunable amino-functionalized graphene quantum dots [J]. Advanced Materials, 2012, 24(39): 5333-5338
[58] Ryu J, Lee E, Lee K, et al. A graphene quantum dots based fluorescent sensor for anthrax biomarker detection and its size dependence [J]. Journal of Materials Chemistry B, 2015, 3(24): 4865-4870
[59] Basuki J S, Duong H T T, Macmillan A, et al. Using fluorescence lifetime imaging microscopy to monitor theranostic nanoparticle uptake and intracellular doxorubicin release [J]. ACS Nano, 2013, 7(11): 10175-10189
[60] Jana A, Devi K S P, Maiti T K, et al. Perylene-3-ylmethanol: Fluorescent organic nanoparticles as a single-component photoresponsive nanocarrier with real-time monitoring of anticancer drug release [J]. Journal of the American Chemical Society, 2012, 134(18): 7656-7659
[61] Chen M L, He Y J, Chen X W, et al. Quantum-dot-conjugated graphene as a probe for simultaneous cancer-targeted fluorescent imaging, tracking, and monitoring drug delivery [J]. Bioconjugate Chemistry, 2013, 24(3): 387-397
[62] Wang Y, Chen J T, Yan X P. Fabrication of transferrin functionalized gold nanoclusters/graphene oxide nanocomposite for turn-on near-infrared fluorescent bioimaging of cancer cells and small animals [J]. Analytical Chemistry, 2013, 85(4): 2529-2535
[63] He Y, Lin Y, Tang H W, et al. A graphene oxide-based fluorescent aptasensor for the turn-on detection of epithelial tumor marker mucin 1 [J]. Nanoscale, 2012, 4(6): 2054-2059
[64] Zhang C L, Xu J, Zhang S M, et al. One-pot synthesized DNA-CdTe quantum dots applied in a biosensor for the detection of sequence-specific oligonucleotides [J]. Chemistry-A European Journal, 2012, 18(27): 8296-8300
[65] Kosynkin D V, Higginbotham A L, Sinitskii A, et al. Longitudinal unzipping of carbon nanotubes to form graphene nanoribbons [J]. Nature, 2009, 458(7240): 872-876
[66] Mullick Chowdhury S, Lalwani G, Zhang K, et al. Cell specific cytotoxicity and uptake of graphene nanoribbons [J]. Biomaterials, 2013, 34(1): 283-293
[67] Chowdhury S M, Surhland C, Sanchez Z, et al. Graphene nanoribbons as a drug delivery agent for lucanthone mediated therapy of glioblastoma multiforme [J]. Nanomedicine, 2015, 11(1): 109-118
[68] Heimberger A B, Hlatky R, Suki D, et al. Prognostic effect of epidermal growth factor receptor and EGFRvIII in glioblastoma multiforme patients [J]. Clinical Cancer Research, 2005, 11(4): 1462-1466
[69] Yang K, Wan J M, Zhang S, et al. In vivo pharmacokinetics, long-term biodistribution, and toxicology of PEGylated graphene in mice [J]. ACS Nano, 2011, 5(1): 516-522
[70] Zhang X Y, Yin J L, Peng C, et al. Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration [J]. Carbon, 2011, 49(3): 986-995
[71] Liu J H, Yang S T, Wang H F, et al. Effect of size and dose on the biodistribution of graphene oxide in mice [J]. Nanomedicine, 2012, 7(12): 1801-1812
[72] Li B, Yang J Z, Huang Q, et al. Biodistribution and pulmonary toxicity of intratracheally instilled graphene oxide in mice [J]. NPG Asia Materials, 2013, 5: e44
[73] Nurunnabi M, Khatun Z, Huh K M, et al. In vivo biodistribution and toxicology of carboxylated graphene quantum dots [J]. ACS Nano, 2013, 7(8): 6858-6867
[74] Yang K, Gong H, Shi X Z, et al. In vivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administration [J]. Biomaterials, 2013, 34(11): 2787-2795
[75] 胡茂杰,潘丙才,毛亮. 石墨烯及其衍生物在小鼠体内的分布与毒性效应[J]. 南京大学学报, 2014, 50(4): 431-439
Hu M J, Pan B C, Mao L. Biodistribution and toxicity of graphene and functionalized graphene in rats[J]. Journal of Nanjing University, 2014, 50(4): 431-439 (in Chinese)
[76] Chong Y, Ma Y F, Shen H, et al. The in vitro and in vivo toxicity of graphene quantum dots [J]. Biomaterials, 2014, 35(19): 5041-5048
[77] Lu Y J, Lin C W, Yang H W, et al. Biodistribution of PEGylated graphene oxide nanoribbons and their application in cancer chemo-photothermal therapy [J]. Carbon, 2014, 74: 83-95
[78] Wen K P, Chen Y C, Chuang C H, et al. Accumulation and toxicity of intravenously-injected functionalized graphene oxide in mice [J]. Journal of Applied Toxicology, 2015, 35(10): 1211-1218
[79] Mao L, Hu M J, Pan B C, et al. Biodistribution and toxicity of radio-labeled few layer graphene in mice after intratracheal instillation [J]. Particle and Fibre Toxicology, 2016, 13: 7
[80] Zhang D, Zhang Z Y, Liu Y Y, et al. The short- and long-term effects of orally administered high-dose reduced graphene oxide nanosheets on mouse behaviors [J]. Biomaterials, 2015, 68: 100-113
[81] Xu S, Zhang Z Y, Chu M Q. Long-term toxicity of reduced graphene oxide nanosheets: Effects on female mouse reproductive ability and offspring development [J]. Biomaterials, 2015, 54: 188-200
[82] Liu Z, Cai W B, He L N, et al. In vivo biodistribution and highly efficient tumour targeting of carbon nanotubes in mice [J]. Nature Nanotechnology, 2007, 2(1): 47-52
[83] Liu Z, Davis C, Cai W B, et al. Circulation and long-term fate of functionalized, biocompatible single-walled carbon nanotubes in mice probed by Raman spectroscopy [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(5): 1410-1415
[84] Yang S T, Luo J B, Zhou Q H, et al. Pharmacokinetics, metabolism and toxicity of carbon nanotubes for biomedical purposes [J]. Theranostics, 2012, 2(3): 271-282
[85] Yang S T, Wang Y W, Liu J H, et al. Biodistribution of multi-walled carbon nanotubes functionalized by hydroxyl terminated poly(ethylene glycol) in mice [J]. Journal of Radioanalytical and Nuclear Chemistry, 2013, 295(2): 1181-1186
◆
ApplicationofGraphene-basedMaterialsasDrugCarrierMaterialsandTheirPotentialRisks:AReview
Sun Xiaoyan1,2, Lu Kun3, Li Ao1, Gao Shixiang3, Mao Liang3, Ye Xinhua1, *
1. The First Affiliated Hospital with Nanjing Medical University, Nanjing 210029, China2. Nanjing Qixia District Hospital, Nanjing 210033, China3. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210046, China
10.7524/AJE.1673-5897.20170112005
2017-01-12录用日期2017-03-10
1673-5897(2017)3-027-11
X171.5
A
叶新华(1968—),男,主任医师、副教授,擅长超声造影、超声引导下穿刺活检、肿瘤微波治疗及各类囊肿的介入治疗等技术,腹部疑难疾病、外周血管及甲状腺、乳腺等表浅小器官疾病的超声诊断。
2014年国家自然科学基金青年项目 (相变型多功能分子探针显像及治疗肝癌射频消融后残余灶,81401427)
孙小艳(1983-),女,硕士研究生、主治医师,研究方向为超声诊断在纳米材料负载药物治疗乳腺癌研究中的应用,E-mail:mlnju@163.com
*通讯作者(Corresponding author), E-mail: yexh-0125@163.com
孙小艳, 卢坤, 李奥, 等. 石墨烯类纳米材料作为药物载体的研究进展及其潜在风险[J]. 生态毒理学报,2017, 12(3): 27-37
Sun X Y, Lu K, Li A, et al. Application of graphene-based materials as drug carrier materials and their potential risks: A review [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 27-37 (in Chinese)

