东乡野生稻重要耐逆性状及其分子机制研究进展
邱在辉 胡标林 肖叶青 李霞 彭志勤 万勇
(江西省农业科学院水稻研究所,南昌330200;*通讯作者:wanyong025@163.com)
东乡野生稻重要耐逆性状及其分子机制研究进展
邱在辉 胡标林 肖叶青 李霞 彭志勤 万勇*
(江西省农业科学院水稻研究所,南昌330200;*通讯作者:wanyong025@163.com)
东乡野生稻是全球分布最北的普通野生稻,具有丰富的抗逆性状,其育种利用价值高。本文综述了近年来东乡野生稻在耐冷、耐旱及抗虫等重要耐逆性状及其分子机制研究方面取得的进展,以期为水稻耐逆性的进一步研究提供依据。
东乡野生稻;耐逆性;研究进展
水稻是我国最重要的粮食作物之一。自第一次绿色革命以来,我国的水稻育种取得了长足发展,新品种(组合)不断涌现,单产不断提高,但达到较高的水平后,产量已长期徘徊不前,同时也有部分性状如抗性和对环境的适应性出现逐渐弱化的现象。其主要原因可能是过度的人工定向选择导致现代水稻品种大量潜在优良基因丢失,遗传背景日趋狭窄所致。因此,提高现有水稻品种的高产潜力和抗性能力必须通过多种途径发掘新的优异基因资源,增加遗传多样性,而增加遗传多样性的一个有效途径就是从野生稻资源中发掘有用基因。
东乡野生稻于1978年在江西省东乡县东源乡首次被发现,主要分布在东乡县岗上积镇的坎下垄、庵家山、樟塘、水桃树下一带[1-2],被认为是中国乃至世界纬度最北(东经 116°36ˊ,北纬 28°14ˊ)的普通野生稻。东乡野生稻的栖息地为低丘、沼泽、水沟和水塘等偏僻地,在长期的野生状态中,土壤贫瘠,生态条件恶劣,经受了各种灾害和不良环境的自然选择,形成了极其丰富的遗传多样性,从而保存了许多栽培稻不具有的或已消失的优良基因,特别是抗病虫基因和耐非生物胁迫基因,是极其珍稀的稻种资源。而在东乡野生稻的众多抗逆特性中,以强耐冷性和抗旱性最为突出[2-3],受到水稻育种学家和生物学家所重视,因此,我国将东乡野生稻列为国家二级保护野生植物。研究东乡野生稻耐逆性的遗传机制,进一步定位并克隆其耐逆性基因,把东乡野生稻优异等位基因导入栽培稻中,可以有效促进水稻耐逆性育种研究。近年来,随着水稻分子生物学的快速发展,东乡野生稻耐冷、耐旱及抗虫等耐逆性状分子机制研究取得了较大进展。
1 耐冷基因定位与克隆
冷害是指作物在生长发育期间,遭遇其生长所需的适温以下至冰点以上的低温,引起作物生长停滞或生育障碍,导致显著减产的现象。我国每年冷害损失稻谷达30~50亿kg,严重冷害发生的频率为3~4年1次,局部区域几乎每年发生。水稻生长的最低温度为8℃~10℃,最高温度为40℃~50℃,适宜温度为15℃~30℃(粳稻)、18℃~33℃(籼稻),粳稻遇到15℃、籼稻遇到18℃以下低温会发生冷寒。而东乡野生稻不仅在气温连续低于20℃条件下仍能正常开花结实,而且在气温-12.8℃~0℃的低温条件下能安全越冬[1],耐冷性极强,是水稻耐冷基因研究的特异材料。
1.1 东乡野生稻苗期耐冷性QTL
水稻从种子萌发到成熟的整个生长发育期间都可能遭遇低温冷害,其中芽期、苗期、孕穗期和开花灌浆期是低温敏感期。苗期冷害主要对水稻叶片和根系造成损伤,导致秧苗失绿、分蘖减少、秧苗枯萎甚至死苗,时常在我国长江中下游的早稻种植区和东北、西北稻区及云贵高原的一季稻区发生,是这些稻区水稻减产的主要原因之一。
应用5个栽培稻品种与东乡野生稻杂交的野栽交后代,考察1叶1心期(5±1)℃处理6 d、常温下恢复10d后的活苗率,对东乡野生稻苗期耐冷性的经典遗传分析结果表明,东乡野生稻苗期耐冷性主要受2对重复基因控制,为完全显性,同时其细胞质对耐冷性有影响[2]。张成良等[4]利用沙培法对东乡野生稻与栽培稻(早籼1504和晚籼926)杂交组合的6个世代的2叶1心期秧苗进行10℃(昼)/6℃(夜)低温处理7 d后,考查秧苗的最长不定根长和不定根数,应用主基因多基因混合遗传模型分析了苗期根性状的耐冷遗传,结果表明,东乡野生稻最长不定根长的遗传属于1对加性主基因+加性-显性多基因遗传,不定根数则为2对显性-加性-上位性主基因遗传。最近,简水溶等[5]利用228份协青早B/东乡野生稻回交重组自交系群体开展东乡野生稻苗期耐冷性研究,结果表明,东乡野生稻苗期耐冷性表现为质量-数量性状遗传特征,受主基因-多基因控制。这些耐冷性研究均表明,东乡野生稻耐冷性是多基因控制的数量性状。
上述的耐冷性经典遗传研究为东乡野生稻耐冷基因研究打下了很好的基础,但不能明确东乡野生稻耐冷基因的对数、效应以及基因互作方式。近年利用DNA分子标记开展的东乡野生稻苗期耐冷基因定位表明,东乡野生稻苗期耐冷性是多基因控制的数量性状。应用213份协青早B/东乡野生稻BC1F1株系为材料,以1叶1心期秧苗6℃处理2 d下的死苗率为苗期耐冷性指标进行QTL定位,陈大洲等[6]分别在第3和第8染色体检测到耐冷性连锁标记RM280和RM337,表型贡献率为3.6%和2.7%。Mao等[7]等利用协青早B/东乡野生稻BC1F7群体和1504/东乡野生稻F7群体等2套遗传群体,分别考察10℃处理8 d、8℃处理4 d和8℃处理6 d等3种低温处理下的耐冷指数和活苗率进行QTL分析,结果在协青早B/东乡野生稻群体和1504/东乡野生稻群体中分别检测到15个和14个耐冷QTL,这些QTL增效等位基因均来自东乡野生稻,其 中 qCTS3.1、qCTS7.2、qCTS8、qCTS11.1 和 qCTS11.2等5个QTL在2套群体和不同低温处理中均被稳定检测到,是主效耐冷QTL。左佳等[8]利用9311/东乡野生稻F2群体为材料,以4(±1)℃处理2 d后苗期分蘖叶片相对电导率为耐冷指标进行QTL定位分析,检测到2个耐冷QTL qSCR3和qSCR11,其表型贡献率分别为16.3%和19.2%。夏瑞祥等[9]利用南京11和东乡野生稻构建的144份BC2F1单株为材料,以(4±1)℃处理2 d后的根系电导率为耐冷性状,在第10染色体上检测到2个QTL——qRC10-1和qRC10-2,位于标记RM171附近,其表型贡献率分别为34.13%和37.02%。后来,Xiao等[10]继续利用151份南京11/东乡野生稻BC2F1单株为研究材料,以2叶期秧苗4(±1)℃处理2 d后根系电导率为耐冷指标进行进一步QTL分析,再次检测到qRC10-1和qRC10-2,接着利用13 342份BC5F2次级定位群体,将qRC10-2染色体区间缩小至48.5kb区间(qc45-qc48),该区域内的2个候选基因Os10g0489500和Os10g0490100可提高水稻苗期和成熟期的耐冷性。同时,该研究团队利用同一套南京11/东乡野生稻BC2F1遗传群体,以2叶期秧苗4(±1)℃处理2 d后的叶片渗透势和死苗率为耐冷指标,共检测到7个耐冷相关QTL,包括3个叶片渗透势QTL和4个死苗率QTL,其中qLOP2和qPSR2-1为主效QTL;同时利用11 326份BC4F2和8 642份BC4F3等2套次级定位群体将2个QTL界定于39.3 kb区间(RM221-RS8)内;基因表达和序列分析表明,Os02g0677300是该位点的冷诱导基因[11]。Liu等[12]利用桂朝2号和东乡野生稻的回交后代群体为材料,萌芽7 d后进行4℃~5℃低温处理,开展苗期耐冷基因的QTL分析,共定位到7个耐冷 QTL,分别分布在第 1、2、5、6、7 和 10 号染色体上,并发现基因LTT7可提高幼苗的耐冷性(表1)。
1.2 东乡野生稻孕穗开花期的耐冷QTL
孕穗开花期冷害是指水稻进入生殖生长到开始抽穗开花期间受到低温的影响,导致花粉发育不正常继而影响正常开花授粉形成空壳的冷害现象。这种冷害常在我国东北、云贵高原粳稻区及长江中下游地区的晚稻中发生。与苗期低温相比,孕穗开花期低温对水稻结实率的影响更大,特别是从四分体到早期小孢子阶段,主要是由花药发育不完全和花粉败育导致小穗授粉失败,孕穗期低温还会引起小穗退化。在水稻开花期,低温主要影响花药开裂、花粉活力和花粉萌发,直接影响受精结实,进而导致不育小穗的增加。
以桂朝2号/东乡野生稻组合产生的284份BC4F2群体为遗传材料,采用冷水灌溉法进行孕穗开花期耐冷鉴定,以常温和低温条件下水稻单株的结实率差值作为孕穗开花期的耐冷性状,Liu等[13]检测到qRLT1-1、qRLT6-1和qRLT11-1等3个耐冷相关QTL,分别位于第 1、6与 11号染色体上,其中 qRLT1-1和qRLT6-1等2个QTL加性效应值分别为26.6%和14.0%,其东乡野生稻等位基因提高了回交群体孕穗开花期的耐冷性。Zhao等[14]利用159份BC4F4代桂朝2号/东乡野生稻衍生渐渗系开展孕穗期耐冷QTL分析,定位到7个微效耐冷QTL,并筛选到1个苗期、孕穗期及开花期强耐冷株系SIL157,该株系的耐冷QTL qLTTB3.1区域中有6个候选基因在苗期和孕穗期耐冷胁迫下上调表达。这些耐冷QTL为水稻孕穗期耐冷分子育种提供了重要候选基因。
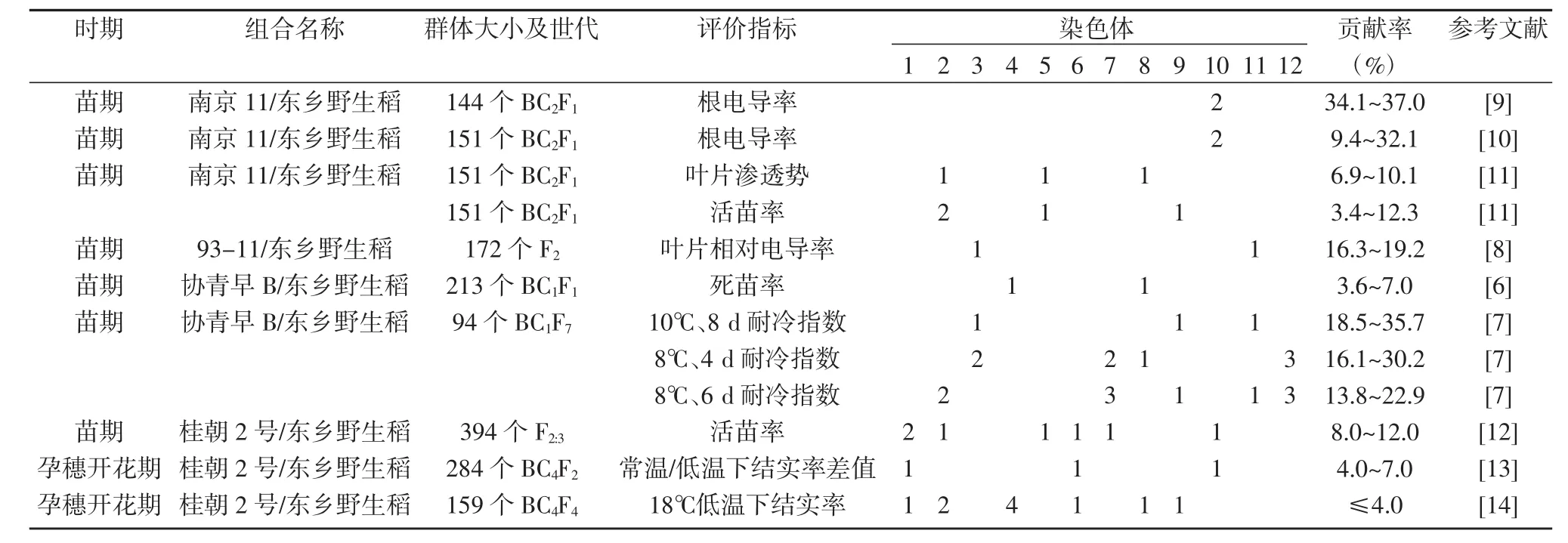
表1 不同群体中检测到的水稻耐冷QTL
1.3 东乡野生稻耐冷基因克隆
低温诱导驯化能提高水稻抗逆相关酶的活性,增强水稻的耐冷性[15]。冷诱导基因表达的产物可分为2类:一类是与植物耐冷性的提高直接相关的功能性蛋白,如抗冻蛋白(AFP)、冰冻脱水保护蛋白(LEA蛋白基因、COR基因家簇、分子伴侣基因)[16],另一类是调控性蛋白,可调控寒冷信号传导、耐冷基因表达和抗寒蛋白活性,包括各种转录因子和蛋白激酶,如CBF转录因子、Ca2+依赖性蛋白激酶、细胞分裂蛋白激酶等。如CBF/DREB1转录调节子被证明在低温驯化中发挥了关键作用[17],低温胁迫条件下,CBF基因的诱导蛋白ICE1受到泛素化修饰,结合到CBF基因启动子序列中的MYC元件,诱导CBF基因的表达[18],其表达产物特异性地结合到含有CRT/DRE顺式作用元件的启动子上,启动下游功能基因的表达,从而提高植物的耐冷性。因此,水稻耐冷机制涉及到非常复杂的信号传导和基因调控等复杂机制,决定了克隆耐冷相关基因的复杂性和困难程度。
迄今,水稻耐冷基因克隆报道还较少。Saito等[19]将耐冷QTL Ctb1定位到17 kb的范围内,其中包含2个候选基因,分别编码F-box蛋白和丝氨酸/苏氨酸蛋白激酶。其中F-box蛋白基因主要在幼穗表达,丝氨酸/苏氨酸蛋白激酶基因在叶片和幼穗表达。从耐冷品种Norin-PL8中克隆到这2个基因,并进行耐冷转基因试验,结果表明,F-box蛋白基因是耐冷基因。F-box蛋白和E3泛素连接酶亚基Skp1互作,表明泛素-蛋白酶体途径可能参与了孕穗期的冷耐受过程。Ma等[20]分离到控制粳稻耐冷性数量性状位点COLD1,过表达COLD1可显著提高耐冷性;COLD1主要编码位于质膜和内质网上的G蛋白信号调控因子,它与G-蛋白α亚基互作激活了Ca2+通道,由此感知低温并提高了G-蛋白GTP酶活性。在COLD1中鉴别出的来自中国野生稻一个SNP位点,SNP2,涉及COLDjap/ind的水稻耐寒能力。上述耐冷基因的克隆对水稻耐冷研究具有重要意义。
近年来,对耐冷的普通野生稻(Oryza rufipogon Griff.)资源进行耐冷相关基因定位与克隆,是一些研究者所采用的克隆水稻耐冷相关基因的方法之一。虽然东乡野生稻的强耐冷性已有大量有关经典遗传学分析及耐冷相关QTL定位研究报道,但其耐冷基因克隆方面的研究报道不多。申国安[21]以东乡野生稻为材料,利用抑制差减杂交法(Suppression subtractive hybridization,SSH)构建了东乡野生稻低温诱导表达基因的SSH文库,测序后发现部分EST序列可能与耐冷有关,并克隆到了编码完整胆碱激酶、富含甘氨酸与脯氨酸的蛋白和类脯氨酸伸展蛋白受体激酶的3个基因序列,根据基因序列特征和基因表达分析,表明它们可能对水稻耐冷发挥重要作用。Li等[22]从东乡野生稻中分离了碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)蛋白基因OrbHLH001,在拟南芥中过表达该基因可以提高转基因植株的耐寒性和耐盐性。
2 抗旱基因定位
我国是一个水资源短缺的国家。据统计,20世纪90年代以来,我国每年平均受旱面积达2 667万hm2,由此造成粮食减产700~800亿kg[23]。干旱已成为影响水稻生产的主要环境因子之一。因此,培育抗旱水稻品种进而提高水稻在干旱条件下的产量,对减小干旱对水稻生产的影响极其重要。
2.1 水稻抗旱性及其抗旱机制
水稻抗旱性是水稻在大气和土壤干旱条件下能正常生长、结实并能获得足够产量的能力,是基因遗传及其与生长环境因子(如胁迫发生时期、强度、持续时间、土壤等)相互作用,致使细胞在形态结构等方面发生适应性改变后的综合表现,是一个极其复杂性状。水稻的抗旱适应机制可分为干旱逃逸机制(drought escaping,DE)、耐旱机制 (drought tolerance,DT)、避旱机制(drought avoidance,DA)和复原抗旱性(drought recovery,DR)。其中,干旱逃逸机制(DE)是指水稻在水分敏感时期避开干旱胁迫的能力,如水稻品种提前抽穗扬花可以避开后期干旱胁迫,从而降低干旱造成的损失[24-25];耐旱机制(DT)是指稻株忍受较长时期轻度或在某一生育期忍耐短时期严重缺水的能力;避旱机制(DA)指水稻在干旱条件下通过发达的根系来吸取水分或关闭气孔来减低水分损失以保持高水势的能力;复原抗旱机制(DR)是指水稻在经过短期干旱胁迫后的恢复能力,Kamoshita等[26]认为,这是水稻早期抗旱适应性的有效策略。尽管不同抗旱机制的内涵各不相同,而水稻在受到干旱胁迫并产生相应的干旱响应过程中,即从干旱胁迫信号的感应到基因的适应性表达过程,这些不同抗旱机制通常共同抵御干旱[27],以最大限度地降低干旱胁迫造成的伤害;而其中以避旱机制最为重要,耐旱机制是仅次于避旱机制的第二防御机制[28-29]。同时由于水稻的抗旱机制不同,其抗旱遗传机理也相应不同,如Yue等[30]通过QTL分析认为,水稻的耐旱机制(DT)和避旱机制(DA)具有不同的遗传基础,仅有部分QTL发生重叠。因此,随着分子生物学的不断发展,从更深层次来解析水稻不同抗旱机制的差异,可促进水稻抗旱遗传改良育种,提高水稻的抗旱能力。
2.2 东乡野生稻抗旱性鉴定
水稻抗旱性是多基因与环境互作的复杂性状,通过各种形态及理化性状得以表达。研究水稻抗旱最为关键的是对水稻遗传资源的抗旱性进行科学、准确、系统的评价,即鉴定其抗旱能力的大小,这有赖于研究者选用的抗旱鉴定方法和指标等评价体系。近年来,许多学者运用不同鉴定方法从不同生育时期多种性状等方面入手,就水稻抗旱性开展了大量研究。目前抗旱性鉴定方法主要有田间自然环境鉴定法、人工模拟环境法(盆钵栽法、旱棚水泥池法、生长箱或人工气候箱法及高渗液法)和分子生物学法[31]。而基于抗旱鉴定方法基础上,广大研究者筛选到形态及理化性状等众多水稻抗旱鉴定指标。
谢建坤等[3]应用盆栽反复干旱法对4份不同居群的东乡野生稻和15份栽培稻进行抗旱性鉴定评价,结果表明,4份东乡野生稻的抗旱性存在很大差异,其中水桃树下居群东乡野生稻抗旱性最强,可能与东乡野生稻原生境协同进化有关。胡标林等[32]利用R974//东乡野生稻/R974回交重组自交系群体,设水分胁迫和非水分胁迫2种处理,对株高、单株分蘖数、有效穗数、穗长、实粒数、总粒数、着粒密度、千粒重、结实率、单株产量、叶片相对含水量和卷叶级别等12个性状进行抗旱性评价,结果表明,叶片相对含水量、单株分蘖数、实粒数、千粒重、株高和有效穗数等6个性状相对值可作为全生育期抗旱性鉴定的综合指标,筛选综合表现较好的抗旱优良株系。Hu等[33]应用R974//东乡野生稻/R974回交重组自交系群体,测定了水分胁迫下最大根长、根基数、茎长、根干质量、根鲜质量、根系相对含水量、叶片相对含水量、卷叶级别及干旱反复存活率等9个性状,开展苗期抗旱性鉴定,结果表明,最大根长、根数、根鲜质量和根系相对含水量可作为苗期抗旱性鉴定综合指标,并筛选到抗旱性强的株系用于水稻抗旱性遗传改良。上述研究为发掘和利用东乡野生稻抗旱基因奠定了基础。
2.3 东乡野生稻抗旱性QTL
Hu等[33]设水分胁迫和正常水分2种不同处理,对R974/东乡野生稻产生的重组自交系群体开展苗期抗旱性遗传分析,结果表明,东乡野生稻苗期抗旱性为质量-数量性状,由主基因+多基因控制。经典数量遗传分析只能将控制一种数量性状的所有基因作为一个整体,但无法区别单个基因对数量性状的效应大小、在相应的染色体上位置及其与其他基因间的关系,因此QTL分析被应用于水稻抗旱性研究。Zhou等[34]以桂朝2号/东乡野生稻产生的染色体片段渗入系(BC4F5、BC4F6)为材料,利用30%PEG人工模拟干旱环境,对渗入系苗期(2叶1心)进行抗旱鉴定,共检测到12个抗旱相关QTL,其中在第2、6和12染色体上的4个QTL的东乡野生稻等位基因能提高渗入系抗旱性,特别是位于第12染色体RM17附近的qSDT12-2在多次重复中均被检测到,在PEG处理后1~8 d能稳定表达。通过对抗旱性QTL的动态分析,发现不同QTL的表达时间不同。Zhang等[35]利用159份桂朝2号/东乡野生稻产生的BC4F4渗入系进行苗期抗旱QTL定位,检测到12个抗旱相关 QTL,其中 qSDT2-1、qSDT6-1、qSDT6-2 和qSDT12-2等4个QTL的增效等位基因来自东乡野生稻;同时鉴定到1个强抗旱株系IL23,基因型检测发现该株系在qSDT2-1和qSDT12-2等2个QTL位点渗入东乡野生稻片段,为水稻抗旱分子育种和东乡野生稻抗旱基因克隆奠定了基础。Zhang等[36]以协青早B/东乡野生稻产生的BC5F10渗入系为材料,以干旱复水后幼苗存活率为耐旱鉴定指标进行苗期抗旱性研究,结果表明,在第10染色体RM171-RM590位点和第12染色体上RM239位点携带东乡野生稻片段,提高了渗入系苗期的耐旱性。
3 抗虫基因定位
水稻是虫害最多的粮食作物之一,据《中国稻作害虫名录》记载,稻作害虫达624种,其中以飞虱、螟虫和叶蝉的危害最为严重,造成的产量损失可高达32%,是我国各主要稻区的三大害虫,虫害的防治和抗性品种育种是水稻研究的重点之一。
稻飞虱是水稻生产上的主要害虫,广泛分布于亚洲热带、亚热带地区,属于大范围迁飞性害虫,包括褐飞虱、白背飞虱和灰飞虱3种,属同翅目、飞虱科。其中褐飞虱和白背飞虱主要以直接刺吸汁液为害,自上世纪70年代以来,这2种害虫对水稻生产的危害日趋严重,多次暴发成灾,给我国水稻生产造成了巨大的损失。长期以来,施用化学农药是防治稻飞虱最常用的手段,然而这不仅导致了环境污染、天敌误杀和稻飞虱种群抗药性增强等一系列问题,且防治效果并不理想[37]。实践表明,培育和利用抗性品种是防治稻飞虱最经济、最安全有效的措施[38],而抗性遗传研究是抗虫育种的基础。
3.1 抗褐飞虱基因定位
褐飞虱是我国及其他亚洲国家水稻上的一种主要迁飞性害虫,该虫以刺吸式口器取食水稻茎叶组织汁液,轻则引起水稻减产,重则植株枯死,呈“虱烧”状,导致绝收。近年来,褐飞虱在我国有加重的趋势,在1998-2008年间,每年因褐飞虱的危害致使水稻减产达277万t[39]。如2006年全国稻飞虱大爆发,危害面积达1 733万hm2,其中以湖南、浙江和江西等省最为严重[40]。
不同的褐飞虱类群可分为不同生物型,目前发现已超过20种[41]。但通常情况下人们结合不同的致害性和发生区域将它们划分为4种,分别为东亚和东南亚种群的生物型Ⅰ、生物型Ⅱ、生物型Ⅲ(孟加拉型)和南亚种群的生物型Ⅳ。在我国稻区褐飞虱表现为生物型Ⅰ、生物型Ⅱ和生物型Ⅲ混合发生,以生物型Ⅱ为主,但致害力强的生物型Ⅲ比例在上升。此外,褐飞虱田间种群的致害性可发生转化,产生新致害性的种群,从而导致原来抗虫品种失去抗性,如携带抗性基因Bph1水稻品种的抗性丧失。可见,抗褐飞虱遗传研究十分复杂,需结合生物学和分子遗传学等学科的技术手段来阐明水稻褐飞虱抗性的遗传机制。
自抗褐飞虱基因Bph1成功鉴定以来,目前国内外学者开展大量有关发掘褐飞虱抗性基因研究。迄今报道抗褐飞虱基因达31个,显性18个、隐性13个[41-42],其中Bph3、Bph14和Bph26等3个基因已被克隆[43-45]。这31个基因均是在籼稻和野生稻中发现,其中有16个来自野生稻,可见野生稻是褐飞虱抗性育种和遗传研究的重要资源。
黄得润等[46]应用协青早B//协青早B/东乡野生稻BC1F5群体为研究材料,利用生物型Ⅰ、生物型Ⅱ和生物型Ⅲ褐飞虱对2叶1心秧苗进行抗虫鉴定,检测到抗褐飞虱QTL qBph2和qBph7,分别位于第2染色体RM29~RG157区间和第7染色体RM11~RM234区间,使死苗率分别降低22.2%和43.7%;并利用BC3F3群体验证了2个QTL的抗褐飞虱效应,其中qBph2抗褐飞虱生物型Ⅰ和生物型Ⅱ,qBph7抗褐飞虱生物型Ⅰ和生物型Ⅲ,这对水稻抗褐飞虱育种具有重要应用价值。
3.2 抗白背飞虱基因定位
白背飞虱属同翅目(Homoptera)、飞虱科(Delphacidae),广泛分布于南亚、东南亚、太平洋岛屿、日本、朝鲜、澳大利亚北部、埃及及中国,是我国最主要的水稻害虫之一。白背飞虱成、若虫直接刺吸稻株的韧皮部汁液,致使水稻生长缓慢,分蘖延迟,瘪粒增加;为害严重可导致稻株枯死,呈“虱烧”状[47]。近年来,白背飞虱的危害呈逐年加重的趋势[48]。
国际水稻研究所自1976年开始对白背飞虱的抗性材料进行遗传分析,目前已鉴定并命名了9个水稻抗白背飞虱的主效基因,即Wbph1、Wbph2、Wbph3、wbph4、Wbph5、Wbph6、Wbph7(t)、Wbph8(t)和 Ovc[37]。其中,Wbph6是由我国学者发现并定位的[49],该研究结果填补了我国抗白背飞虱基因定位研究的空白。
Chen等[50]利用早B//协青早B/东乡野生稻BC1F5群体对2叶1心期秧苗进行抗白背飞虱鉴定,检测到qWph2、qWph5和qWph9等3个白背飞虱抗性QTL,东乡野生稻等位基因分别使水稻死苗率降低9.1%、11.1%和10.9%;并利用14染色体片段代换系对qW-ph9的效应进行验证,结果表明,东乡野生稻等位基因使死苗率降低了55.2%,提高了对水稻白背飞虱的抗性。
4 展望
东乡野生稻是栽培稻的祖先种,其优良性状基因的转移相对较为容易。野生稻有利基因的转移虽然已经取得了不少进展,但耐逆性状属于受多基因控制的数量性状,传统的育种方法在改良作物的抗逆性方面鲜有成功案例。然而,生物技术为实现东乡野生稻有利基因向栽培稻的定向转移开辟了道路,但仍存在一些遗传累赘现象,如导入有利基因的同时,不可避免地带进一些不良性状,固定优良性状剔除不良性状还需做大量的工作。采用分子标记辅助与传统选育技术相结合,极大地发挥和利用了东乡野生稻抗逆性好的特点。此外,由于东乡野生稻的不同个体间的耐逆性状存在差异(如耐旱性等[3]),因此针对某个耐逆性状开展发掘与利用时,应加大耐逆性状鉴定的东乡野生稻个体的数量,以确定耐逆性较强的个体,减少科研工作的盲目性。可见,加强对复杂性状的鉴定、转移和利用研究将是今后东乡野生稻基因资源发掘和种质创新的重点。
[1]陈大洲,陈泰林,邹宏海,等.东乡野生稻的研究与利用[J].江西农业学报,2002,14(4):51-58.
[2]陈大洲,肖叶青,赵社香,等.东乡野生稻苗期耐寒性的遗传研究[J].江西农业大学学报,1997,19(4):56-59.
[3]谢建坤,胡标林,万勇,等.东乡普通野生稻与栽培稻苗期抗旱性的比较研究[J].生态学报,2010,30(6):1 665-1 674.
[4]张成良,陈大洲,肖叶青.东乡野生稻苗期根系形态性状耐冷性遗传分析[J].江西农业学报,2010,22(2):1-3.
[5]简水溶,万勇,罗向东,等.东乡野生稻苗期耐冷性的遗传分析[J].植物学报,2011,46(1):21-27.
[6]陈大洲,钟平安,肖叶青,等.利用SSR标记定位东乡野生稻苗期耐冷性基因[J].江西农业大学学报,2002,24(6):753-756.
[7]Mao D H,Yu L,Chen D Z,et al.Multiple cold resistance loci confer the high cold tolerance adaptation of Dongxiang wild rice(Oryza rufipogon)to its high-latitude habitat[J].Theor Appl Genet,2015,128:1 359-1 371.
[8]左佳,高婧,贺荣华,等.东乡野生稻苗期抗寒性QTL的初步定位[J].杂交水稻,2012,27(3):56-59.
[9]夏瑞祥,肖宁,洪义欢,等.东乡野生稻苗期耐冷性的QTL定位[J].中国农业科学,2010,43(3):443-451.
[10]Xiao N,Huang W N,Zhang X X,et al.Fine mapping of qRC10-2,a quantitative trait locus for cold tolerance of rice roots at seedling and mature stages[J].PLoS One,doi:10.1371/journal.pone.0096046.
[11]Xiao N,Huang W N,Li A H,et al.Fine mapping of the qLOP2 and qPSR-1 loci associated with chilling stress tolerance of wild rice seedlings[J].Theor Appl Genet,2015,128:173-185.
[12]Liu F X,Xu W Y,Song Q,et al.Microarray-assisted fine-mapping of quantitative trait loci for cold tolerance in rice [J].Mol Plant,2013,6(3):757-767.
[13]Liu F X,Sun C Q,Tan L B,et al.Identification and mapping of quantitative trait loci controlling cold-tolerance of Chinese common wild rice(O.rufipogon Griff.)at booting to flowering stages[J].Chinese Sci Bull,2003,48(19):2 068-2 071.
[14]Zhao J,Qin J J,Song Q,et al.Combining QTL mapping and expression profile analysis to identify candidate genes of cold tolerance from Dongxiang common wild rice(Oryza rufipogon Griff.)[J].J Inter Agr,2016,15(9):1 933-1 943.
[15]Kuk Y I,Shin J S,Burgos N R,et al.Antioxidative enzymes offer protection from chilling damage in rice plants[J].Crop Sci,2003,43(6):2 109-2 117.
[16]Wang Y,Hua J.A moderate decrease in temperature induces COR15a expression through the CBF signaling cascade and enhances freezing tolerance[J].Plant J,2009,60(2):340-349.
[17]Thomashow M F.Molecular basis of plant cold acclimation:Insights gained from studying the CBF cold response pathway[J].Plant Physiol,2010,154(2):571-577.
[18]Miura K,Jin J,Lee J,et al.SIZ1-mediated sumoylation of ICE1 controls CBF3/DREB1A expression and freezing tolerance in Arabidopsis[J].Plant Cell,2007,19(4):1 403-1 414.
[19]Saito K,Hayano-S Yuriko,Kuroki M,et al.Map-based cloning of the rice cold tolerance gene Ctb1[J].Plant Sci,2010,179:97-102.
[20]MaY,D X Y,Xu Y Y,et al.COLD1 confers chilling tolerance in rice[J].Cell,2015,160(6):1 209-1 221.
[21]申国安.东乡野生稻耐冷基因和水稻ClpD基因的克隆与表达研究[D].上海:复旦大学,2003.
[22]Li F,Guo S Y,Zhao Y,et al.Overexpression of a homopeptide repeat-containing bHLH protein gene(OrbHLH001)from Dongxiang wild rice confers freezing and salt tolerance in transgenic Arabidopsis[J].Plant Cell Rep,2010,29:977-986.
[23]景蕊莲.作物抗旱节水研究进展 [J].中国农业科技导报,2007,9(1):1-5.
[24]Kamoshita A,Chandra B R,Manikanda B N,et al.Phenotypic and genotypic analysis of drought-resistance traits for development of rice cultivars adapted to rainfed environments[J].Field Crop Res,2008,109:1-23.
[25]Bernier J,Atlin G N,Serraj R,et al.Breeding upland rice for drought resistance[J].J Sci Food Agr,2008,88(6):927-939.
[26]Kamoshita A,Rodriguez R,Yamauki A,et al.Genotypic variation in response of rainfed lowland rice to drought and rewatering[J].Plant Prod Sci,2004,7(4):406-420.
[27]Mitra J.Genetics and genetic improvement of drought resistance in crop plants[J].Curr Sci,2001,80(6):758-763.
[28]Blum A.Drought resistance,water-use efficiency,and yield potential:are they compatible,dissonant,or mutually exclusive?[J].Aus J Agr Res,2005,56:1 159-1 168.
[29]Luo L J.Breeding for water-saving and drought-resistance rice(WDR)in China[J].J Exp Bot,2010,61(13):3 509-3 517.
[30]Yue B,Xue W Y,Xiong L Z,et al.Genetic basis of drought resistance at reproductive stage in rice:separation of drought tolerance from drought avoidance[J].Genetics,2006,172:1 213-1 228.
[31]胡标林,李名迪,万勇,等.我国水稻抗旱性鉴定方法与指标研究进展[J].江西农业学报,2005,17(2):56-60.
[32]胡标林,余守武,万勇,等.东乡野生稻全生育期抗旱性鉴定[J].作物学报,2007,33(3):425-432.
[33]Hu B L,Fu X Q,Wan Y,et al.Genetic analysis on characteristics to measure drought resistance using Dongxiang wild rice(Oryza rufipogon Griff.)and its derived backcross inbred lines population at seedling stage[J].J Integr Agr,2011,10(11):1 653-1 664.
[34]Zhou S X,Tian F,Zhou Z F,et al.Identification of quantitative trait loci controlling drought tolerance at seedling stage in Chinese Dongxiang common wild rice(Oryza rufipogon Griff.)[J].Acta Genetics Sinica,2006,33(6):551-558.
[35]Zhang X,Zhou S X,Fu Y C,et al.Identification of a drought tolerant introgression line derived from Dongxiang common wild rice(O.rufipogon Griff.)[J].Plant Mol Biol,2006,62:247-259.
[36]Zhang F T,Cui F L,Zhang L X,et al.Development and identification of a introgression line with strong drought resistance at seedling stage derived from Oryza sativa L.mating with Oryza rufipogon Griff[J].E-uphytica,2014,200(1):1-7.
[37]余娇娇,段灿星,李万昌,等.水稻抗稻飞虱基因遗传与定位研究进展[J].植物遗传资源学报,2011,12(5):750-756.
[38]王建军,俞晓平,吕仲贤,等.籼型杂交水稻抗褐飞虱育种研究[J].中国水稻科学,1999,13(4):242-244.
[39]Normile Dennis.Reinventing rice to feed the world[J].Science,2008,321(5887):330-333
[40]国家统计局.中国农业年鉴(2006)[M].北京:中国农业出版社,2007.
[41]范峰峰,邱颖波,刘行丹,等.水稻抗褐飞虱基因及其育种应用研究进展[J].中国农学通报,2014,30(6):13-19.
[42]Wu H,Liu Y Q,He J,et al.Fine mapping of brown planthopper(Nilaparvata lugensresistance gene Bph28(t)in rice(Oryza sativa L.)[J].Mol Breed,2014,33(4):909-918.
[43]Du B,Zhang W L,Liu B F,et al.Identification and characterization of Bph14,a gene conferring resistance to brown planthopper in rice[J].P Natl Acad Sci USA,2009,106(52):22 163-22 168.
[44]Liu Y Q,Wu H,Chen H,et al.A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice[J].Nat Biotechnol,2015,33(3):301-305.
[45]Tamura Y,Hattori M,Yoshioka H,et al.Map-based cloning and characterization of a brown planthopper resistance gene BPH26 from Oryza sativa L.ssp.indica cultivar ADR52 [J].Sci Rep,2014,4:5 872.
[46]黄得润,陈洁,赖凤香,等.东乡野生稻抗褐飞虱QTL分析[J].作物学报,2012,38(2):210-214.
[47]沈君辉,尚金梅,刘光杰.中国的白背飞虱研究概况[J].中国水稻科学,2003,17(S):7-22.
[48]黄凤宽,黄所生,吴碧球,等.抗褐飞虱兼抗白背飞虱水稻种质资源发掘[J].植物保护,2012,38(4):152-155.
[49]李西明,熊振民,闵绍楷,等.四个云南水稻品种对白背飞虱的抗性遗传分析[J].中国水稻科学,1990,4(3):113-116.
[50]Chen J,Huang D R,Wang L,et al.Identification of quantitative trait loci for resistance to whitebacked planthopper,Sogatella furcifera,from an interspecific cross Oryza sativa×O.rufipogon [J].Breeding Sci,2010,60:153-159.
Abstract:Dongxiang wild rice(Oryza rufipogon Griff.)is the northernmost common wild rice worldwide,has abundant stress tolerant traits and high breeding value.Recent research on the stress tolerant traits,such as cold tolerance,drought tolerance and insect resistance of Dongxiang wild rice and its corresponding molecular mechanisms have been summarized in this paper,which would provide the foundation for the further study of stress tolerance of rice.
Key words:Dongxiang wild rice;stress tolerance;research advance
Research Advances on Important Stress Tolerant Traits and Its Molecular Mechanisms in Dongxiang Wild Rice
QIU Zaihui,HU Biaolin,XIAO Yeqing,LI Xia,Peng Zhiqing,WAN Yong*
(Rice Research Institute,Jiangxi Academy of Agricultural Sciences,Nanchang 330200,China;*Corresponding author:wanyong025@163.com)
S511
A
1006-8082(2017)05-0012-07
2017-06-20
江西现代农业科研协同创新专项(JXXTCX2015001-002);江西省科技厅重点研发计划重大项目(2016AF60022);江西省农业科学院科技创新及成果转化基金项目(2015CJJ002)
——东乡三中发展掠记

