镍钼矿酸浸液中磷钼存在形态的热力学计算
邵 康,李青刚,周 钦,张贵清,曹佐英,曾 理,关文娟
镍钼矿酸浸液中磷钼存在形态的热力学计算
邵 康,李青刚,周 钦,张贵清,曹佐英,曾 理,关文娟
(中南大学冶金与环境学院,长沙410083)
通过热力学计算25℃时体系在水溶液中的离子形态并绘制其随pH、磷浓度变化的关系图。为了模拟镍钼矿硫酸浸出液的液相环境,控制模拟料液中钼的浓度在0.1mol/L左右,分析磷钼摩尔比((P):(Mo))为1:1、1:9、1:12、1:50时其热力学平衡图的变化规律。结果表面:随着pH值的降低,钼的存在形态分别是钼酸根离子、磷钼杂多酸根离子和同多钼酸根离子。当氢离子浓度在0.1mol/L左右,随着溶液中磷浓度的降低,钼的存在形态由Dawson结构的转变成Keggin结构的。
系;磷钼杂多酸;热力学平衡;镍钼矿;萃取
镍钼矿是我国特有的一种多金属复合矿。镍钼矿中金属钼的提取工艺概括来讲分为碱法和酸法处理工艺。碱法处理工艺通常是将镍钼矿中MoS2氧化成MoO3,在碱溶液中MoO3以浸入溶液,而矿中的镍进入渣中。如李青刚[1]提出的次氯酸钠和氢氧化钠浸出镍钼矿的工艺,该工艺使用次氯酸钠作为氧化剂,氢氧化钠浸出钼,浸出率为94%,并已经工业化应用。相比于碱法处理工艺,酸法处理工艺中可以将镍钼一同浸入浸出液,且得到越来越多研究者的关注。如朱薇等[2]提出的加钙固硫焙烧硫酸浸出工艺,该工艺镍钼浸出率高,而且可控制焙烧中SO2烟气的排放。彭俊等[3]提出的硫酸化焙烧−水浸工艺本质上也是一种酸法浸出工艺,钼的浸出率可达97.33%。本实验中即以酸法浸出工艺获得的高酸镍钼矿浸出液为研究对象。
本实验研究了高酸镍钼矿浸出液中钼的理论存在形态,并推算了钼的萃取机理。影响水溶液中钼形态的因素有氢离子的浓度(pH)、钼的浓度、矿物酸的种类、磷砷硅等杂多原子的种类和浓度等因素[4−6]。在无杂多原子存在时,水溶液中钼离子的存在形态主要受pH值的影响,溶液pH值在6.5以上时,钼主要以形态存在于水溶液中,随着pH值的降低单钼酸根离子聚合生成多钼酸根阴离子,当pH值低于5.8高于3.5时钼主要以七钼酸盐存在于水溶液中,随着进一步酸化钼的离子形态的会逐渐变成三钼酸盐、八钼酸盐、三十六钼酸盐、二钼酸盐等[7−9]。HIMENO等[10−11]通过研究指出当水溶液中钼的浓度小于8×10−5mol/L时,钼在水溶液中主要以单钼酸根离子存在,存在形态有、,若溶液中有大量HCl或者H2SO4等矿物酸时,则会改变原有离子形态变成或,但该研究中只涉及了同多钼酸盐的研究,没有考虑杂多原子磷砷硅存在的情况。如果溶液中存在磷砷硅等杂多原子时则会和钼生成杂多酸阴离子。无论是磷钼杂多酸、砷钼杂多酸还是硅钼杂多酸,其在水溶液中具体的离子形态是多种类、与溶液pH密切相关的。PETTERSSON等[12]介绍了摩尔比((P):(Mo))为2:5、1:9、2:18、1:11和1:12的磷钼杂多酸以及该系列杂多酸的热力学数据,但本实验中没有考虑到溶液中少量同多钼酸盐的存在。综合考虑溶液中钼的同多酸和杂多酸同时存在的情况,本文作者梳理了前人钼同多酸和磷钼杂多酸的热力学数据,建立了更加完善的数据模型。根据张家靓等[13]研究,溶液中如果存在钨元素也会和钼同多酸生成复杂的钨钼杂多酸。而经对比研究,从镍钼矿的高硫酸浸出液中萃取的钼主要以磷钼杂多酸形态被萃入,且溶液中几乎没有钨的存在,所以本实验主要研究水溶液中磷钼杂多酸的存在形态。
同时,钼的萃取研究中,比如肖朝龙等[14]对N235从镍钼矿的盐酸金属液中钼的回收进行了研究,钼的萃取率达98%,但会有磷砷硅铁的等部分杂质被萃入。比如廖小丽等[15]使用了一种新型萃取剂HBL101,钼的萃取率可达96.8%,该研究可以实现对钼的有效富集。虽然前人对钼的萃取工艺进行了大量的研究,但钼的萃取机理研究相对较少,尤其对于复杂的磷钼杂多酸的萃取机理的研究。
本实验中基于镍钼矿的硫酸浸出液的液相环境,结合浸出液中最重要的两种元素磷和钼的水溶液热力学数据,应用数学软件MATLAB绘制出体系在水溶液中的离子形态热力学平衡图。确定相应酸度下的磷钼杂多酸和钼同多酸的形态,并理论上推算出了N235萃取该磷钼杂多酸的反应机理。同时配制模拟料液进行萃取实验验证。
1 水溶液中体系热力学数据及计算
1.1 热力学数据
在水溶液中磷钼杂多酸总的反应方程式可总结为如下:

上述反应中系数、、的改变会导致具体的磷钼杂多酸形态的变化。具体的磷钼杂多酸(同多酸)的形态以及反映热力学数据可见表1[12, 16−17],其中为由、反应生成对应化学式的平衡常数。由于镍钼矿的硫酸浸出液中,钼的浓度约0.1~0.16 mol/L,磷的浓度约0.1~0.15 mol/L。经对比实验验证,浸出液中的钼主要与磷形成磷钼杂多酸,而仅有少量钼与砷、硅形成砷、硅钼杂多酸。所以,本研究只考虑磷钼杂多酸的形态以及其萃取行为。反应(1)与(2)是磷酸加氢反应不涉及钼,反应(17)~(30)是钼的同多酸聚合反应不涉及磷,其余的反应均有磷钼的参与。反应(6)~(9)尚未确定其具体化学式,所以均以系数代替。另由于缺乏活度因子数据,所以计算中所有的离子活度均由离子浓度代替。
1.2 利用MATLAB软件计算及绘图过程
设[Mo]T、[P]T分别为溶液中钼和磷的总浓度,“[]”为溶液中某形态游离组分的浓度,根据物质守恒原理,在体系中可以得到如下的方程(其中有部分物质没有被合成出,用化学计量数表示如(14,9,1)):



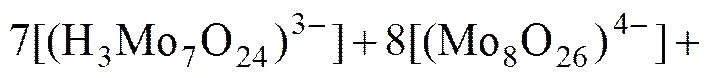
(31)
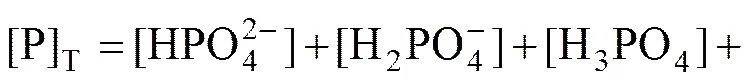

(32)
如果给定了钼、磷的总浓度和固定的pH值,则将表1中30个等式代入上述两等式,联立上述两等式即可得到以、为未知数的高次非线性方程组。
应用数学软件MATLAB可以应用两种方法来求解出每个组分的浓度。方法一是利用fsolve函数解上述二元非齐次方程组,得出特定pH下、,而后求出对应的其他组分的浓度;方法二是通过MATLAB编程应用逐步逼近的方法来求解。为了提高数据运算的效率,本实验采用第二种方法。计算出的数据可直接调用plot命令进行绘图,也可以导出*.txt格式的数据通过其他绘图软件出图。由于plot命令对图像呈现不够美观,所以采用第二种绘图方法,用Origin调用MATLAB数据进行绘图。

表1 磷钼杂多酸和钼同多酸的形态以及反应的平衡常数
2 结果与讨论
在钼磷水溶液体系中,pH值以0.1个单位为间隔从pH=8到pH=−0.4共有85个pH点。每点对应不同的离子含钼的摩尔分数。图1所示为不同pH值下各种钼磷杂多酸或者钼同多酸离子中含钼占总钼的摩尔分数曲线图。并且始终控制钼的浓度为0.1 mol/L。
如图1(a)所示,当(P):(Mo)=1:1时,由于该体系中很有大量的磷元素,所以体系中的钼多以磷钼杂多酸的形态存在,仅在pH=8附近有单钼酸根离子和pH=8附近有单钼和双钼阳离子存在,其余部分几乎都以磷钼杂多酸形态存在。而且随着酸度的增加,单钼和双钼阳离子的比例将增大。在pH=−0.4~0的高酸度条件下,是磷钼杂多酸阴离子和阳离子共存。如图1(b)所示,当(P):(Mo)=1:9时,体系中磷元素有所降低,所以整个pH值范围内,同多酸的含量相比图1(a)中的情况有所增加,但仍是杂多酸占多数且高酸下仍是磷钼杂多酸阴离子和阳离子共存。如图1(c)所示,当(P):(Mo)=1:12,仍是以磷钼杂多酸为主,同多酸含量明显。同时,高酸度条件下除了杂多酸阴离子,也出现了大量的杂多酸阴离子与阳离子共存。如图1(d)所示,当(P):(Mo)=1:50,钼在整个pH值范围内主要以同多酸离子存在,杂多酸离子较前三类情形有所降低。且在高酸度的条件下主要以等同多酸阳离子存在,含量比较明显的磷钼杂多酸阴离子是,而仅少量存在。
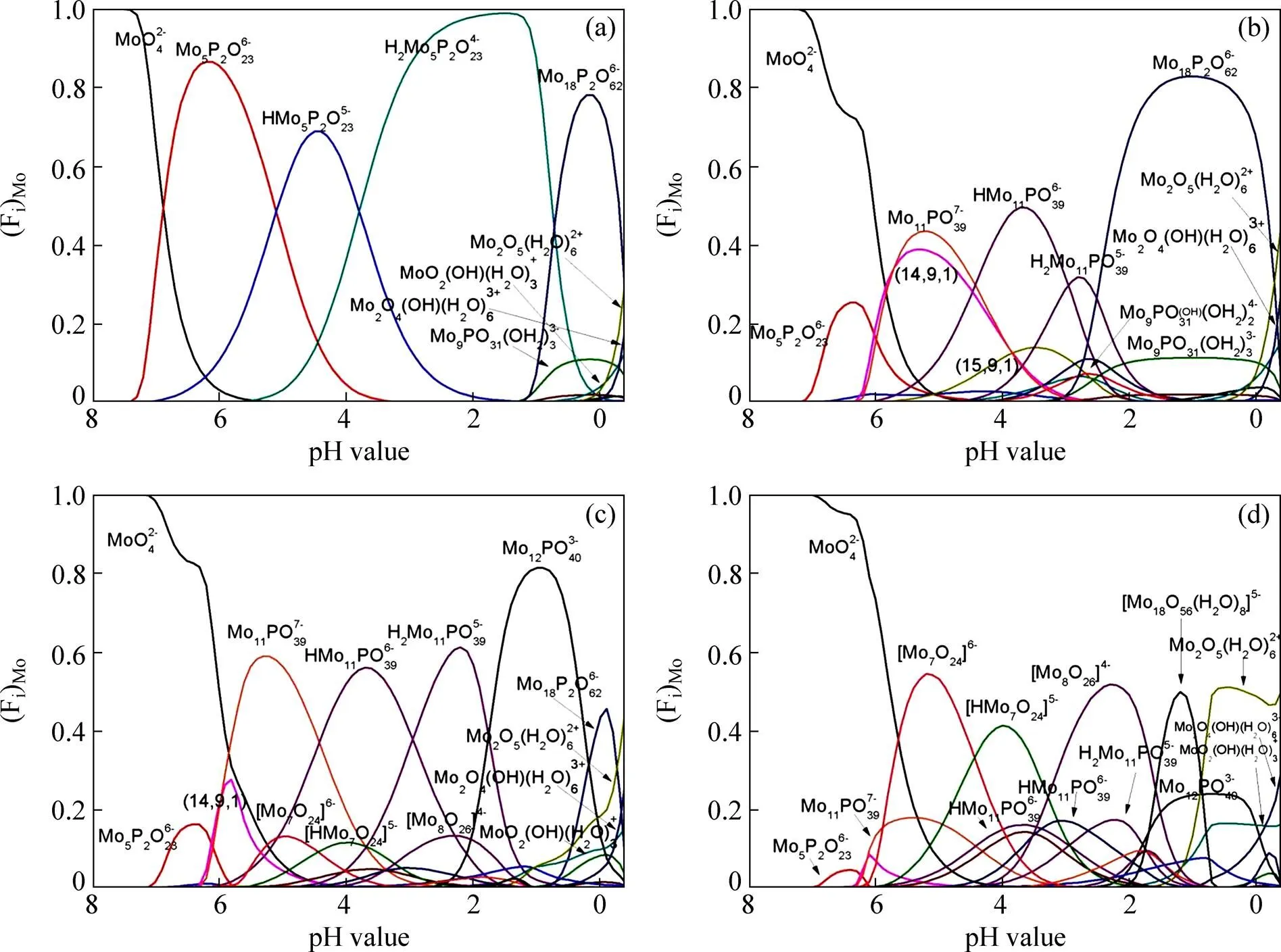
图1 不同磷钼摩尔比下体系中主要存在的离子所含钼的摩尔分数与pH值的关系
观察图1(a)~(d)可知,体系中钼的含量保持恒定,而磷元素的浓度逐渐降低。体系中的主要成分由磷钼杂多酸逐渐变成钼同多酸。且主要的杂多酸的种类随着磷浓度的变化而有所改变,比如在高酸度下主要的杂多酸种类便由逐渐变成了,该结论和HIMENO等[18]实验结论是一致的。
在实际的萃取实践中,除了上述图1所涉及影响因素(pH值、钼浓度、磷浓度)之外,还有一个重要的影响因素就是矿物酸的种类。图1中酸碱环境是通过控制的,而镍钼矿的酸浸液是硫酸体系的,所以在探索期萃取原理的过程中需将硫酸根和钼氧阳离子的络合作用考虑进去。HIMENO等[11]介绍过和反应生成络阴离子,所以在高酸度硫酸浸出液中钼的主要存在形态是磷钼杂多酸阴离子和钼同多酸根与硫酸根的络合阴离子,而杂多酸阴离子在萃取过程中比单钼或双钼络合阴离子更容易被萃取。由此可知,高硫酸酸度下胺类萃取剂N235萃取磷钼水系中的钼的萃取原理可以总结如下:

(33)

(35)
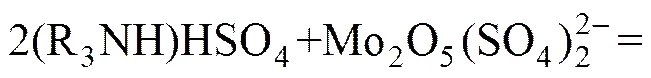
(36)
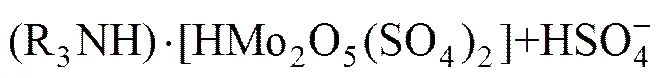
(38)
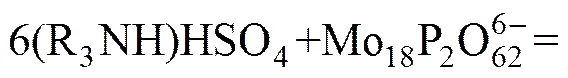
(39)
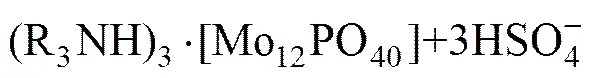
(41)
由图1可知,在高酸度条件下(pH<0)萃取过程主要有(36)~(40)这6个反应。反应(33)、(34)、(35)是钼同多酸和硫酸根的络合反应,这3个络合反应来自文献[5,11]。反应(36)~(38)中钼是以同多酸和硫酸根的络合阴离子形态被萃入有机相。反应(39)~(41)中钼以磷钼杂多酸形态被萃入有机相。上述6个主要的萃取反应之间还存在竞争关系,通常离子半径比较大的磷钼杂多酸根阴离子优先被萃取。上述6个主要萃取反应过程是阴离子交换的过程。
2.2 N235对料液中钼的萃取
在实际浸出料液中,可滴定出其中全硫酸浓度为2 mol/L。而硫酸溶液不会将其中的氢全部电离。根据25 ℃下硫酸的解离常数K1=103、K2=10−1.99可求得当硫酸浓度为2 mol/L时对应的游离氢离子浓度为2 mol/L。
配制5%N235+25%TBP+煤油(体积分数)作为有机相,萃取磷钼摩尔比为1:1、1:9、1:12、1:50和纯钼(钼酸钠溶液,不含磷)料液,且保持钼浓度不变。水相为硫酸体系其中游离氢离子浓度为2 mol/L。萃取后的有机相颜色见图2。实际的萃取条件是,相比O:A=1:1,温度为30 ℃,萃取时间为5 min。由图2可知,含磷的萃合物显黄色而不含磷的萃合物为淡蓝色,此现象可对比图2(a)和其余图片明显得知。且在图2(b)中当磷钼的摩尔比为1:50时,明显观察有两种颜色的混合,说明既有磷钼杂多酸又有单钼或双钼络合阴离子被萃取。
在表2中给出了同样钼浓度下不同磷钼摩尔比的单级萃取率。由表2 可得出结论水相中含磷越多则单级萃取率越高。因为磷浓度高则有助于形成磷钼杂多酸,对比钼同多酸和磷钼杂多酸的离子势(/)可知,钼同多酸的离子水化作用要强于磷钼杂多酸的离子水化作用,所以,在钼同多酸和磷钼杂多酸共存的料液中,磷钼杂多酸比钼同多酸更容易被萃取,且在钼被萃入有机相过程中,半径小的即被半径大的钼同多酸和钼杂多酸替代。根据此萃取规律可以解释表2中,当料液中的钼浓度保持不变,改变单变量因素磷的浓度钼萃取率会发生明显变化。

图2 有机相5%N235+25%TBP+煤油萃取不同磷钼摩尔比的料液后有机相的颜色变化

表2 有机相 5%N235+25%TBP+煤油 萃取不同磷钼摩尔比的料液中的钼单级萃取率
3 结论
1) 综合考虑了钼在水溶液中的同多酸聚合反应和加入杂多原子磷后的杂多酸聚合反应,将该两类反应一起进行热力学计算并绘制热力学平衡图。
2) 在碱性条件下钼通常以单钼酸根阴离子的形态存在,随着pH值降低会有磷钼杂多酸根离子形成,高酸度条件下钼会以二聚同多钼酸根阳离子形态存在。随着水溶液中磷浓度降低,钼的存在形态从分解成,并最终主要以钼同多酸根离子存在。
REFERENCES
[1] 李青刚. 从镍钼矿中制取钼酸铵的研究[D]. 长沙: 中南大学, 2010: 1−100. LI Qing-gang. Study of production ammonium molybdate from Ni-Mo ore[D]. Changsha: Central South University, 2010: 1−100.
[2] 朱 薇, 肖连生, 肖 超, 龚柏凡. N235萃取镍钼矿硫酸浸出液中钼的研究[J]. 稀有金属与硬质合金, 2010, 38(1): 1−4, 29. ZHU Wei, XIAO Lian-sheng, XIAO Chao, GONG Bai-fan. Molybdenum extraction with N235 from the sulphric acid leach liquor in Ni-Mo ore[J]. Rare Metals and Cemented Carbides, 2010, 38(1): 1−4, 29
[3] 彭 俊, 王学文, 王明玉, 肖彩霞, 施丽华. 从镍钼矿中提取镍钼的工艺[J]. 中国有色金属学报, 2012, 22(2): 553−559.PENG Jun, WANG Xue-wen, WANG Ming-yu, XIAO Cai-xia, SHI Li-hua. Extraction process of molybdenum and nickel from Ni-Mo ore[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(2): 553−559.
[4] PALANT A A, LATSENKO N A, PETROVA V A. Solvent extraction of molybdenum (VI) by diisododecylamine from sulphuric acid solution[J]. Hydrometallurgy, 1998, 48(1): 83−90.
[5] KASPRZAK M S, CROUCH S R, LEROI G E. A raman spectroscopic investigation of heteropolymolybdate species in aqueous solution[J]. Applied Spectroscopy, 1978, 32(6): 537−540.
[6] WANG M Y, JIANG C J, WANG X W, XIAN P F, WANG H G, YANG Y. Existing form of Mo (VI) in acidic sulfate solution[J]. Rare Metals, 2017, 36(7): 612−616.
[7] PENG J, WANG X W, JIANG C J, WANG M Y, MA Y Q, XIANG X Y. Separation of Mo (VI) and Fe (III) from the acid leaching solution of carbonaceous Ni-Mo ore by ion exchange[J]. Hydrometallurgy, 2014, 142: 116−120.
[8] WANG M Y, WANG X W, JIANG C J, TAO C F. Solvent extraction of molybdenum from acidic leach solution of Ni-Mo ore[J]. Rare Metals, 2014, 33(1): 107−110.
[9] GRIFFITH W P, LESNIAK P J B. Raman studies on species in aqueous solutions. Part III. Vanadates, molybdates, and tungstates[J]. Journal of the Chemical Society A: Inorganic, Physical, Theoretical, 1969, 7(7): 1066−1071.
[10] HIMENO S, UEDA Y, HASEGAWA M. Spectrophotometric investigation on the equilibration of monomeric forms of Mo(VI) in aqueous sulfuric acid[J]. Inorganica Chimica Acta, 1983, 70: 53−57.
[11] HIMENO S, NIIYA H, UEDA T. Raman studies on the identification of isopolymolybdates in aqueous solution[J]. Bulletin of the Chemical Society of Japan, 1997, 70(3): 631−637.
[12] PETTERSSON L, ANDERSSON I, OEHMAN L O. Multicomponent polyanions. 39. Speciation in the aqueous hydrogen ion-molybdate(MoO42−)-hydrogenphosphate(HPO42−) system as deduced from a combined emf-phosphorus-31 NMR study[J]. Inorganic Chemistry, 1986, 25(26): 4726−4733.
[13] 张家靓, 赵中伟, 陈星宇, 刘旭恒. W-Mo-H2O体系钨钼分离的热力学分析[J]. 中国有色金属学报, 2013, 23(5): 1463−1470.ZHANG Jia-liang, ZHAO Zhong-wei, CHEN Xing-yu, LIU Xu-heng. Thermodynamic analysis for separation of tungsten and molybdenum in W-Mo-H2O sstem[J]. The The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1463−1470.
[14] 肖朝龙, 肖连生, 龚柏凡. 采用N235从镍钼矿盐酸浸出液中萃取钼的研究[J]. 中国钼业, 2011, 35(2): 7−11. XIAO Chao-long, XIAO Lian-sheng, GONG Bai-fan. A study of extracting molybdenum from hydrochloric acid leach liquor of Ni-Mo ore using N235[J]. China Molybdenum Industry, 2011, 35(2): 7−11.
[15] 廖小丽, 肖连生, 孙亚辉, 曾 理. HBL101从镍钼矿焙烧料高酸浸出液中直接萃取钼的研究[J]. 有色金属(冶炼部分), 2014(1): 40−44, 53. LIAO Xiao-li, XIAO Lian-sheng, SUN Ya-hui, ZENG Li. Study on molybdenum extraction with HBL101 from high acid leaching solution of Ni-Mo ore after roasting[J]. Nonferrous Metals (Extractive Metallurgy), 2014(1): 40−44, 53.
[16] CRUYWAGEN J J, HEYNS J B B. Molybdenum(VI) equilibria at high perchloric acid concentration[J]. Polyhedron, 2000, 19(8): 907−911.
[17] CRUYWAGEN J J. Molybdenum(VI) equilibria in different ionic media. Formation constants and thermodynamic quantities[J]. Inorganica Chimica Acta, 2002, 331(1): 322−329.
[18] HIMENO S, HASHIMOTO M, UEDA T. Formation and conversion of molybdophosphate and arsenate complexes in aqueous solution[J]. Inorganica Chimica Acta, 1999, 284(2): 237−245.
(编辑 何学锋)
Thermodynamic analysis for species of molybdenum and phosphorus in Ni-Mo ore acidic leaching solution
SHAO Kang, LI Qing-gang, ZHOU Qin, ZHANG Gui-qing, CAO Zuo-ying, ZENG Li, GUAN Wen-juan
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Thethermodynamic diagrams of the ionic species were plotted at different pH values and phosphorus concentration insystem at 25 ℃. To simulate the liquid phase environment of Ni-Mo ore leaching solution, the diagrams were plotted with different phosphorus-molybdenum molar ratios of 1:1, 1:9, 1:12 and 1:50 at certain molybdenum concentration of 0.1 mol/L. The results show that, as the pH value decreases, the species of molybdenum are molybdate anion, molybdophosphate anion and isopolymolybdate ion. As the phosphorus concentration decreases, the species of molybdenum is converted into Keggin-typefrom Dawson-typeat certain hydrogen ion concentration 1 mol/L.
system; molybdophosphate; thermodynamic equilibrium; Ni-Mo ore; extraction
Project (2012BAB07B05) supported by the National Science & Technology Pillar Program During the Thirteenth Five-year Plan Period, China
2016-01-25; Accepted date:2017-01-12
LI Qing-gang; Tel: +86-13873168326; E-mail: xlslqg@csu.edu.cn
10.19476/j.ysxb.1004.0609.2017.07.23
1004-0609(2017)-07-1513-07
TF801
A
国家“十三五”科技支撑计划资助项目(2012BAB07B05)
2016-01-25;
2017-01-12
李青刚,教授,博士;电话:13873168326;E-mail:xlshlqg@csu.edu.cn

