阿卡波糖联合二甲双胍对2型糖尿病患者相关指标的影响Δ
庞宁,陈科,彭皓均,郑碧波(1.广州市东升医院西医内科,广州51010;.广州市东升医院检验科,广州 51010;.广州中医药大学第一附属医院脑病科,广州 51005;.广州市东升医院治疗科,广州51010)
·基本药物应用·
阿卡波糖联合二甲双胍对2型糖尿病患者相关指标的影响Δ
庞宁1*,陈科2,彭皓均3,郑碧波4(1.广州市东升医院西医内科,广州510120;2.广州市东升医院检验科,广州 510120;3.广州中医药大学第一附属医院脑病科,广州 510405;4.广州市东升医院治疗科,广州510120)
目的:探讨阿卡波糖联合二甲双胍对2型糖尿病患者相关指标的影响。方法:100例2型糖尿病患者随机分为对照组(50例)和观察组(50例)。对照组患者给予阿卡波糖片50 mg,口服,每日3次;观察组患者在对照组治疗的基础上给予盐酸二甲双胍片0.5 g,口服,每日3次。两组疗程均为12周。观察两组患者治疗前后空腹血糖(FPG)、空腹血浆胰岛素(FINS)、糖化血红蛋白(HbA1c)、餐后2 h血糖(2 hPG)、餐后2 h胰岛素(2 hFINS)、胰岛素抵抗指数(HOMA-IR)、CD4+T细胞中各Th细胞亚群比例、白细胞介素22(IL-22)、IL-17A、干扰素-γ(IFN-γ)水平及IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平,并记录不良反应发生情况。结果:治疗后,两组患者FPG、FINS、HbA1c、2 hPG、2 hFINS、HOMA-IR、CD4+T细胞中各Th细胞亚群比例、IL-22、IL-17A、IFN-γ水平及IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平均显著低于同组治疗前,差异均有统计学意义(P<0.05);两组间除CD4+T细胞中Th1细胞亚群比例比较差异无统计学意义(P>0.05)外,其他指标均为观察组显著低于对照组,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:阿卡波糖联合二甲双胍可有效控制2型糖尿病患者的血糖,改善胰岛抵抗状态,平衡Th细胞亚群,降低炎性细胞因子水平,且未增加不良反应的发生。
阿卡波糖;二甲双胍;2型糖尿病;CD4+T细胞亚群;炎性细胞因子;胰岛素抵抗;血糖
ABSTRACTOBJECTIVE:To investigate the effects of acarbose combined with metformin on related indexes of patients with type 2 diabetes mellitus.METHODS:A total of 100 patients with type 2 diabetes mellitus were randomly divided into control group(50 cases)and observation group(50 cases).Control group was given Acrbose tablet 50 mg orally,3 times a day.Observation group was additionally given Metformin hydrochloride tablet 0.5 g orally,3 times a day,on the basis of control group.Both groups were treated for 12 weeks.The levels of fasting plasma glucose(FPG),fasting plasma insulin(FINS),glycosylated hemoglobin(HbA1c),2 h postprandial plasma glucose(2 hPG),postprandial 2 h insulin(2 hFINS),insulin resistance index(HOMA-IR),the proportion of Th cell subsets in CD4+T cells,IL-22,IL-17A and IFN-γ,mRNA expression of IL-22,IL-17A and IFN-γ were observed in 2 groups before and after treatment.The occurrence of ADR was recorded.RESULTS:After treatment,FPG,FINS,HbA1c,2 hPG,2 hFINS,HOMA-IR,the proportion of Th cell subsets in CD4+T cells,the concentrations of IL-22,IL-17A and IFN-γ,expression of IL-22 mRNA,IL-17A mRNA and IFN-γ mRNA in 2 groups were significantly lower than before treatment,with statistical significance(P<0.05);there was no significant difference in the proportion of Th1 in T cells between 2 groups(P>0.05).Other indexes of observation group were significantly lower than those of control group,with statistical significance (P<0.05).There wasno statisticalsignificancein theincidenceof ADR between 2 groups (P>0.05).CONCLUSIONS:For patients with type 2 diabetes mellitus,acarbose combined with metformin can effectively control the level of blood glucose,improve insulin resistance,balance Th cell subsets,reduce inflammatory factors levels but don’t increase the occurrence of ADR.
KEYWORDSAcarbose; Metformin; Type2 diabetes mellitus;CD4+T cell subset;Inflammatory factors;Insulin resistance;Blood glucose2014年,全球范围内成人糖尿病患病率高达9%,而其中90%的患者为2型糖尿病[1]。有研究表明,2型糖尿病显著的病理生理学特征为胰岛素抵抗、胰岛B细胞功能缺陷所导致的胰岛素分泌减少[2]。2型糖尿病呈现出一种全身的、低度的慢性炎症状态,且与天然免疫系统的激活密切相关。目前,临床上多采用双胍类、α-糖苷酶抑制剂等药物来降低血糖。阿卡波糖可通过延缓碳水化合物在肠道内的消化吸收而起到降糖作用。二甲双胍主要的药理作用是通过减少肝脏葡萄糖的输出而降低血糖。在本研究中,笔者探讨了阿卡波糖联合二甲双胍对2型糖尿病患者相关指标的影响,旨在为临床提供参考。
1 资料与方法
1.1 研究对象
选择2014年9月-2015年12月广州市东升医院收治的100例2型糖尿病患者,其中男性52例,女性48例。按随机数字表法将所有患者分为观察组(50例)和对照组(50例)。观察组男性24例,女性26例;年龄(43.60±13.81)岁;病程(4.81±3.50)年。 对照组男性28例,女性22例;年龄(46.50±15.31)岁;病程(4.60±3.81)年。两组患者性别、年龄、病程等基本资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,所有患者均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:(1)均符合1999年世界卫生组织(WHO)公布的2型糖尿病诊断标准[3],空腹血糖(FPG)7~15 mmol/L且餐后2 h血糖(2 hPG)>11.1 mmol/L;(2)均未接受过药物治疗;(3)年龄20~70岁。排除标准:(1)1型糖尿病;(2)有严重的器质性病变及慢性并发症,如心、肝、肾功能不全;(3)其他内分泌系统疾病;(4)妊娠期糖尿病。
1.3 治疗方法
所有患者均接受饮食控制,加强锻炼。在此基础上,对照组患者给予阿卡波糖片(杭州中美华东制药有限公司,规格:50 mg/片,批准文号:国药准字H20020202)50 mg,口服,每日3次;观察组患者在对照组治疗的基础上给予盐酸二甲双胍片(中美上海施贵宝制药有限公司,规格:0.5 g/片,批准文号:国药准字H20023370)0.5 g,口服,每日3次。两组疗程均为12周。
1.4 观察指标
观察两组患者治疗前后FPG、空腹血浆胰岛素(FINS)、糖化血红蛋白(HbA1c)、2 hPG、餐后2 h胰岛素(2 hFINS)、胰岛素抵抗指数(HOMA-IR)、CD4+T细胞中各Th细胞亚群比例、白细胞介素22(IL-22)、IL-17A、干扰素-γ(IFN-γ)水平及IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平,并记录不良反应发生情况。HOMA-IR=FPG×FINS/22.5。采用日立7600-020型全自动生化分析仪(株式会社日立高新技术提供)测定FPG、2 hPG;采用放射性免疫法(试剂盒由北京北方生物技术研究所有限公司提供)测定FINS、2 hFINS;采用Bio-Rad离子交换HPLC法检测HbA1c;采用AccuriC6流式细胞仪(美国BD公司)检测CD4+T细胞中各Th1、Th17、Th22细胞亚群的比例;采用酶联免疫吸附(ELISA)法(试剂盒由武汉博士德生物工程有限公司提供)和反转录-聚合酶链反应(RT-PCR)法(试剂盒为美国BIO-RAD CFX96 PCR试剂盒)检测IL-22、IL-17A、IFN-γ水平及IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平。RT-PCR引物序列见表1。

表1RT-PCR引物序列Tab 1 Real-time RT-PCR primers
1.5 统计学方法
采用SPSS 19.0统计软件对数据进行分析。计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后血糖相关指标比较
治疗前,两组患者FPG、FINS、HbA1c、2 hPG、2 hFINS、HOMA-IR比较,差异均无统计学意义(P>0.05)。治疗后,两组患者FPG、FINS、HbA1c、2 hPG、2 hFINS、HOMA-IR均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后血糖相关指标比较(±s)Tab 2 Comparison of related indexes of plasma glucose between 2 groups before and after treatment(±s)
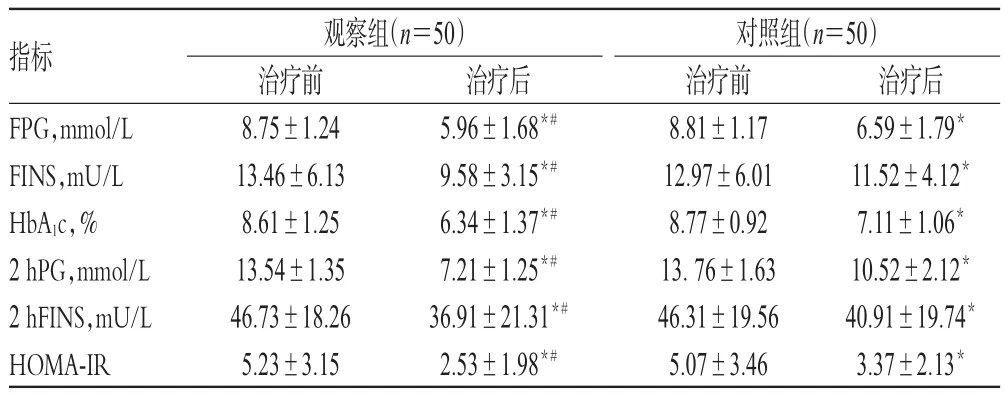
表2 两组患者治疗前后血糖相关指标比较(±s)Tab 2 Comparison of related indexes of plasma glucose between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
指标FPG,mmol/L FINS,mU/L HbA1c,%2 hPG,mmol/L 2 hFINS,mU/L HOMA-IR治疗后6.59±1.79*11.52±4.12*7.11±1.06*10.52±2.12*40.91±19.74*3.37±2.13*观察组(n=50)治疗前8.75±1.24 13.46±6.13 8.61±1.25 13.54±1.35 46.73±18.26 5.23±3.15治疗后5.96±1.68*#9.58±3.15*#6.34±1.37*#7.21±1.25*#36.91±21.31*#2.53±1.98*#对照组(n=50)治疗前8.81±1.17 12.97±6.01 8.77±0.92 13.76±1.63 46.31±19.56 5.07±3.46
2.2 两组患者治疗前后CD4+T细胞中各Th细胞亚群比例比较
治疗前,两组患者CD4+T细胞中各Th细胞亚群比例比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD4+T细胞中各Th细胞亚群比例均显著低于同组治疗前,且观察组CD4+T细胞中Th17、Th22细胞亚群比例显著低于对照组,差异均有统计学意义(P<0.05);但两组间CD4+T细胞中Th1细胞亚群比例比较,差异无统计学意义(P>0.05),详见表3。
表3 两组患者治疗前后CD4+T细胞中各Th细胞亚群比例比较(±s)Tab 3 Comparison of the proportion of Th cell subsets in CD4+T cell between 2 groups before and after treatment(±s)

表3 两组患者治疗前后CD4+T细胞中各Th细胞亚群比例比较(±s)Tab 3 Comparison of the proportion of Th cell subsets in CD4+T cell between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组对照组Th1,%Th17,%n Th22,%治疗后1.04±0.05*#1.56±0.08*50 50治疗前17.60±0.21 17.80±0.19治疗后12.52±0.24*13.06±0.18*治疗前2.05±0.09 2.03±0.11治疗后1.08±0.06*#1.38±0.15*治疗前2.08±0.13 2.13±0.11
2.3 两组患者治疗前后IL-22、IL-17A、IFN-γ水平比较
治疗前,两组患者IL-22、IL-17A、IFN-γ水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-22、IL-17A、IFN-γ水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表4。
表4 两组患者治疗前后IL-22、IL-17A、IFN-γ水平比较(±s)Tab 4 Comparison of the levels of IL-22,IL-17Aand IFN-γ between 2 groups before and after treatment(±s)

表4 两组患者治疗前后IL-22、IL-17A、IFN-γ水平比较(±s)Tab 4 Comparison of the levels of IL-22,IL-17Aand IFN-γ between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组对照组IL-22,pg/mL IFN-γ,pg/mL n治疗后1.28±1.39*#2.08±1.53*50 50治疗前57.82±21.67 56.32±23.67治疗后34.56±8.27*#39.26±7.34*IL-17A,pg/mL治疗前4.82±3.67 4.93±3.26治疗后2.31±1.94*#3.15±2.47*治疗前2.53±1.56 2.64±1.41
2.4 两组患者治疗前后IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平比较
治疗前,两组患者IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表5。
表5 两组患者治疗前后IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平比较(±s)Tab 5 Comparison of expression of IL-22 mRNA IL-17A mRNA and IFN-γ mRNA between 2 groups before and after treatment(±s)

表5 两组患者治疗前后IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平比较(±s)Tab 5 Comparison of expression of IL-22 mRNA IL-17A mRNA and IFN-γ mRNA between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组对照组治疗后0.62±0.34*#0.83±0.28*n 50 50 IL-22 mRNA治疗前1.00±0.32 1.00±0.31治疗后0.58±0.26*#0.74±0.28*IL-17A mRNA治疗前1.00±0.42 1.00±0.45治疗后0.68±0.26*#0.81±0.28*IFN-γ mRNA治疗前1.00±0.37 1.00±0.31
2.5 不良反应
观察组患者出现腹泻3例,腹胀4例,恶心1例,不良反应发生率为16.00%;对照组患者出现腹泻5例,腹胀3例,恶心1例,不良反应发生率为18.00%。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。出现不良反应的患者经对症处理后均得到缓解,未影响治疗。
3 讨论
炎性细胞因子介导的炎症反应参与了2型糖尿病的发病机制,其的异常表达会导致巨噬细胞向脂肪组织迁移、浸润,而阻断胰岛素作用的信号传导通路,造成胰岛素抵抗[4]。近年来有研究表明,T细胞介导的免疫病理作用在2型糖尿病慢性炎症的上游启动和维持过程中发挥了重要的作用[5-7]。CD4+T细胞是一种辅助性T细胞,可协调免疫细胞相互作用,维持免疫稳态,其可分化为Th1、Th2、Th17、调节性T细胞(Treg)和Th22等细胞亚群。CD4+T细胞主要通过自身或调节其他免疫细胞释放多种炎性细胞因子如IFN-γ、IL-6、肿瘤坏死因子α(TNF-α)等,这些因子与胰岛B细胞功能损伤、抑制胰岛素分泌、增加胰岛素抵抗及2型糖尿病血管并发症密切相关[8-9]。研究发现,2型糖尿病患者外周血中各促炎Th细胞占CD4+T细胞的比例均有不同程度的升高,各细胞亚群对应的炎性细胞因子存在不同水平的上调,提示Th细胞亚群失衡是引起免疫失衡并造成慢性炎症状态的关键,Th22细胞及其细胞因子在胰岛素抵抗及胰岛B细胞功能损伤中扮演重要角色[10]。
IL-22为Th17和Th22细胞分泌的主要炎性细胞因子。IL-22在胰岛B细胞中表达丰富,过度表达的IL-22可通过与IL-22R结合,引起信号转导,进而影响胰岛B细胞功能[11]。IL-17是一种促炎细胞因子,主要由激活的CD4+T细胞中的Th17细胞分泌。IL-17能够刺激T细胞和单核细胞产生IL-6、IL-8、TNF-α等其他炎性细胞因子,并能促进补体C3等急性期反应蛋白的产生,诱导炎症反应。在2型糖尿病大鼠模型中,拮抗IL-17可有效减轻胰岛素抵抗,提示IL-17参与了胰岛B细胞功能的损伤过程[12]。Th1细胞亚群分泌的IFN-γ可通过直接促进细胞凋亡和上调选择性黏附分子的表达,来引起胰岛B细胞功能的损伤[13]。
目前,一些广泛应用于2型糖尿病的临床药物已被证实具有免疫调节作用,如多沙唑嗪、二肽基肽酶Ⅳ、吡格列酮等药物,这些药物均具有抑制T淋巴细胞增殖及免疫调节作用[14-15]。阿卡波糖和二甲双胍均为治疗2型糖尿病的一线药物。阿卡波糖在肠道内可竞争性抑制葡萄糖苷水解酶,延缓碳水化合物的降解,从而使肠道葡萄糖的吸收缓慢,降低餐后血糖。二甲双胍通过抑制肝糖原异生,来增加外周葡萄糖的利用,抑制肠壁细胞摄取葡萄糖,改善外周胰岛素抵抗而降低血糖。Su B[16]等研究发现,阿卡波糖可有效控制中国2型糖尿病患者血糖,增加患者粪便中的长双歧杆菌水平,降低部分炎性细胞因子水平,减轻炎症反应。Lee SY等[17]研究发现,在炎症性肠病小鼠模型中,二甲双胍通过抑制IL-17、磷酸化信号转导与转录激活因子3的表达,来增加蛋白激酶和叉头样转录因子的表达水平,减轻炎症反应,提示二甲双胍可通过调节Th17与Treg的比例平衡来参与抗炎反应。
本研究结果显示,治疗后,两组患者FPG、FINS、HbA1c、2 hPG、2 hFINS、HOMA-IR、CD4+T细胞中各Th细胞亚群比例、IL-22、IL-17A、IFN-γ 水平及 IL-22 mRNA、IL-17A mRNA、IFN-γ mRNA表达水平均显著低于同组治疗前,差异均有统计学意义;两组间除CD4+T细胞中Th1细胞亚群比例比较差异无统计学意义外,其他指标均为观察组显著低于对照组,差异均有统计学意义。两组患者不良反应发生率比较,差异无统计学意义。这表明,Th细胞亚群的失衡和炎症反应可使2型糖尿病患者的免疫功能受损,阿卡波糖联合二甲双胍可弥补单一用药的局限性,并在多方面发挥协同作用,有效控制血糖,平衡Th细胞,降低IL-17A、IL-22、IFN-γ等相关炎性细胞因子水平,减轻炎症反应,改善患者免疫状态,且未增加不良反应的发生。
综上所述,阿卡波糖联合二甲双胍可有效控制2型糖尿病患者的血糖,改善胰岛抵抗状态,平衡Th细胞亚群,降低炎性细胞因子水平,且未增加不良反应的发生。由于本研究纳入的样本量较小,且为探索性临床研究,故此结论有待大样本、多中心研究进一步证实。
[1]廖涌.中国糖尿病的流行病学现状及展望[J].重庆医科大学学报,2015,40(7):1042-1045.
[2]中华医学会糖尿病学分会.中国2型糖尿病防治指南:2013年版[J].中华内分泌代谢杂志,2014,30(10):893-896.
[3]钱荣立.关于糖尿病的新诊断标准与分型[J].中国糖尿病杂志,2000,8(1):5-6.
[4]Zatalia SR,Sanusi H.The role of antioxidants in the pathophysiology,complications,and management of diabetes mellitus[J].Acta Med Indones,2013,45(2):141-147.
[5]Guzmán-Flores JM,López-Briones S.Cells of innate and adaptive immunity in type 2 diabetes and obesity[J].Gac Med Mex,2012,148(4):381-389.
[6]Jagannathan-Bogdan M,McDonnell ME,Shin H,et al.Elevated proinflammatory cytokine production by a skewed T cell compartment requires monocytes and promotes inflammation in type 2 diabetes[J].J Immunol,2011,186(2):1162-1172.
[7]Zeng C,Shi X,Zhang B,et al.The imbalance of Th17/Th1/Tregs in patients with type 2 diabetes:relationship with metabolic factors and complications[J].J Mol Med(Berl),2012,90(2):175-186.
[8]曾维伟,胡玲.2型糖尿病与CD4+、CD8+T细胞的相关性研究[J].实用临床医学,2014,15(9):136-138.
[9]迟林,李昊淼,许晓风.2型糖尿病患者外周血淋巴细胞亚群及Treg细胞检测及临床应用[J].山东医药,2011,51(40):87-89.
[10]Zhao R,Tang D,Yi S,et al.Elevated peripheral frequencies of Th22 cells:a novel potent participant in obesity and type 2 diabetes[J].PLoS One,2014,doi:10.1371/journal.pone.0085770.eCollection 2014.
[11]Dalmas E,Venteclef N,Caer C,et al.T Cell-derived IL-22 amplifies IL-1β-driven inflammation in human adipose tissue:relevance to obesity and type 2 diabetes[J].Diabetes,2014,63(6):1966-1977.
[12]Ohshima K,Mogi M,Jing F,et al.Roles of Interleukin 17 in angiotensinⅡType 1 receptor-mediated insulin resistance[J].Hypertension,2012,59(2):493-499.
[13]Cnop M,Welsh N,Jonas JC,et al.Mechanisms of pancreatic β-cell death in type 1 and type 2 diabetes many differences,few similarities[J].Diabetes,2005,54(suppl 2):S97-107.
[14]Mácsai E,Cseh A,Budai G,et al.Effect of 3 months of doxazosin therapy on T-cell subsets in type 2 diabetic patients[J].J Int Med Res,2009,37(6):1982-1987.
[15]毛焕东.二甲双胍联合吡格列酮治疗2型糖尿病免疫损伤的临床观察[J].现代预防医学,2012,39(2):527-528.
[16]Su B,Liu H,Li J,et al.Acarbose treatment affects the serum levels of inflammatory cytokines and the gut content of bifidobacteria in Chinese patients with type 2 diabetes mellitus[J].J Diabetes,2015,7(5):729-739.
[17]Lee SY,Lee SH,Yang EJ,et al.Metformin ameliorates inflammatory bowel disease by suppression of the STAT3 signaling pathway and regulation of the between Th17/Treg balance[J].PloS One,2015,doi:10.1371/journal.pone.0135858.eCollection 2015.
Effects of Acarbose Combined with Metformin on Related Indexes of Patients with Type 2 Diabetes
PANG Ning1,CHEN Ke2,PENG Haojun3,ZHENG Bibo4(1.Dept.of Internal Western Medicine,Guangzhou Dongsheng Hospital,Guangzhou 510120,China;2.Dept.of Clinical Laboratory,Guangzhou Dongsheng Hospital,Guangzhou 510120,China;3.Dept.of Encephalopathy,the First Affiliated Hospital of Guangdong University of TCM,Guangzhou 510405,China;4.Dept.of Treatment,Guangzhou Dongsheng Hospital,Guangzhou 510120,China)
R587.1
A
1001-0408(2017)27-3774-04
2016-12-01
2017-07-17)
(编辑:陈 宏)
广东省中医药局科研课题(No.20142062)
*主治医师。研究方向:代谢综合征。电话:020-81911115-8103。E-mail:wspn998@163.com
DOI 10.6039/j.issn.1001-0408.2017.27.08

