锂硫电池硫基复合正极材料发展综述
唐泽勋,叶红齐,韩 凯,王治安
锂硫电池硫基复合正极材料发展综述
唐泽勋,叶红齐,韩 凯,王治安
(中南大学 化学化工学院,湖南 长沙 410083)
硫正极材料具有比容量高、资源丰富、环境友好等特点,由它与锂金属负极组成锂硫电池是一种极具应用前景的高能量密度的电池体系,在市场上有着极大的发展空间。硫基正极材料作为锂硫电池的重要组成部分,是提高电池性能的关键之一,也是目前的研究重点。然而锂硫电池还存在着一些比较严重的问题,如硫的导电性差、“穿梭效应”和锂晶枝等。本文综述了近几年国内外锂硫电池硫正极材料在单质硫、金属硫化物和有机硫化物三个方面的最新研究进展,并展望了锂硫电池硫正极材料的发展方向。
硫正极;锂硫电池;综述;金属硫化物;有机硫化物;研究进展
进入21世纪,能源危机和环境污染问题日益凸显,人们对以锂离子电池为代表的可循环利用的绿色能源充满期待。锂离子电池由索尼公司于1991年[1-2]首次商业化,具有输出电压高、能量密度大、自放电率低、使用寿命长、绿色无污染等优点。锂离子电池的应用已遍及各个领域,从手机到笔记本电脑,从电动自行车到电动汽车,从太阳能储能板到无人飞机等,已成为人们日常生活不可或缺的能源供应系统[3-6]。
锂离子电池主要由正极材料、负极材料、隔膜和电解液组成,其中正极材料是决定锂离子电池性能和成本的关键,目前市场主流正极材料有钴酸锂(LiCoO2)、锰酸锂(LiMn2O4)、镍钴锰三元(LiNi1–x–yCoMnO2)、磷酸铁锂(LiFePO4)等。其中LiCoO2是最早商业化的正极材料,具有制备工艺简单、材料性能稳定、能量密度高等优点,但其热稳定性不佳,存在一定的安全隐患[7-11]。LiMn2O4的锰源丰富,价格便宜,安全性能出色,但能量密度不高,高温下晶体结构稳定性差,易发生歧化反应,高温存储和循环性能不佳。LiNi1–x–yCoMnO2综合了钴酸锂、锰酸锂和镍酸锂三种材料的优势,具有比容量高、循环性能稳定、价格适中等特点,但由于镍占主要组分,合成时二价镍难以氧化,材料表面稳定性差[12-13]。磷酸铁锂循环性能好,安全性能出色,但电子和离子的导电率低,能量密度低,倍率和低温性能不佳[14-15]。部分锂离子电池正极材料的主要指标如表1。
表1 锂离子电池正极材料主要指标对照表
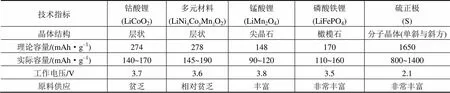
Tab.1 Comparison of different cathode materials for Li-ion batteries
随着科技发展,便携式电子产品、电动交通工具、航天军工领域都期待体积更小、能量密度更高、工作寿命更长的能量供应系统。然而现有材料体系的能量密度已达极限,2016年三星NOTE7的爆炸事件就已经给人们敲响警钟,即过度攫取高能量密度势必会导致各种安全问题的发生。因此,开发新一代高容量电池材料已经迫在眉睫。由表1可见,传统的锂离子电池正极材料可利用容量不超过200 mAh·g–1,而硫基正极材料则可达到800~1400 mAh·g–1,开发潜力巨大。
单质硫,自然状态下多以8个S原子组成的环状(S8)结构而存在,作为世界上储量最丰富的元素之一,它具有价格低廉、环境友好等特点[16-18]。以单质硫作为电池正极,锂金属作为负极组成锂硫电池,电池工作电压为1.9~2.3 V,电极充放电主要反应式为:
正极:S8+ 16Li++ 16e–8Li2S
总反应式:S8+ 16Li8Li2S
由于一个S能与两个Li+反应生成硫化锂(Li2S),自然态下的S8能与16个Li+反应,故硫正极的理论比容量高达1675 mAh·g–1,质量比能量则高达2600 Wh·kg–1{Bruce, 2012 #69}。硫正极作为锂硫电池体系的核心,其合成方法主要分为物理固硫法和化学固硫法[19-20]。顾名思义,物理固硫法即通过物理方法将单质硫固载在导电材料上,主要过程包括:先将单质硫与相应的材料混合,再经长时间研磨使硫原子进入到材料中而不轻易脱出,或者利用单质硫的熔点低(约155℃)这一性质,将多孔材料与单质硫置于加热装置下加热至硫熔化,使液态的硫流入多孔材料内部而达到固硫的目的。物理固硫方法简单,缺点是硫与材料的作用力不强,活性组分硫损失较快,组成的电池容量衰减较快[21]。化学固硫法即氧化还原法固硫,主要是应用单质硫或硫化物与金属或有机聚合物在一定条件下反应生成金属硫化物、硫化聚合物或聚合硫化物[22-23],通过金属原子或其他原子与硫形成化学键而达到固硫的目的。化学固硫法可使硫与材料稳定结合,合成的材料经过多次充放电后,硫仍然能较好地固载在材料内部,主要缺点为合成材料需要经过多次化学处理,过程复杂。在锂硫电池中,由于正极材料硫和负极材料锂金属的分子量小,该电池质量小、体积小、质量比能量高,成为电动汽车、航天器等高尖端领域的理想储能装置。
尽管锂硫电池被寄予厚望,但由于其存在的一些缺陷而阻碍了其大规模使用。首先,硫正极材料的导电性非常差,单质硫在常温下为电子和离子的绝缘体(导电率为5×10–30S/cm),导致电池在大电流下放电十分困难。其次,在充放电过程中正极会生成多硫化物,多硫化物能溶解在电解液中,并穿过隔膜聚集到负极,与负极上的锂金属反应导致容量损失和循环衰减,造成“穿梭效应”[24-27]。此外,以金属锂作为负极容易生成锂晶枝,易刺穿隔膜而短路,存在安全隐患。
为了解决上述问题,研究者们做了大量工作,改善方案主要集中在提高硫基正极材料的导电性和稳定性、抑制活性组分硫损失、阻止多硫化物在电解液中的溶解、防止负极锂晶枝的生长等几个方面,包括合成许多新型的含硫正极材料、隔膜材料和电解质等,为锂硫二次电池商业化奠定了坚实的基础。本文综述了近年来国内外硫正极复合材料的研究报道,从三个方面介绍了目前锂硫电池硫基正极材料的结构设计、合成及电化学性能,最后总结了目前锂硫电池正极复合材料的特点,并对未来锂硫电池正极材料的研究方向进行了展望。
1 单质S为活性组分复合正极材料
1.1 S/C复合正极材料
1.1.1 S/多孔碳复合正极材料
多孔碳具有高比表面积、高孔容和高孔径等优点,常作为骨架和导电材料应用于锂硫电池正极材料中,其主要分为大孔碳材料、介孔碳材料和微孔碳材料等。大孔碳材料作为最早被认识和开发的碳材料,其孔径最大,能吸附大量的硫。2011年,Tachikawa等[28]制备了有序的蛋白石状硫/大孔碳材料,采用低粘度的[Li(glyme)]+和TFSI–组成类离子液体代替高粘度的甘醇锂,电化学结果表明:以电流密度为139 mA·g–1进行充放电,循环50次后其比容量为700 mAh·g–1,库伦效率保持在97%。Strubel等[29]以氧化锌为模板合成了具有大孔-介孔分级结构的多孔碳材料,其孔容达3.9 cm3·g–1,比表面积为3060 m2·g–1,将此材料应用于锂硫电池中,当硫固载量为3×10–3g·cm–2时,电池首次放电比容量超过1200 mAh·g–1。虽然大孔碳材料在锂硫电池中应用最早,但其存在一些比较大的缺陷,如S/大孔碳复合材料在充放电过程中产生的多硫化物容易从大孔碳材料中脱出,“穿梭效应”较严重;电解液对材料影响也非常大,电解液的粘度越高,容量损失越严重,这些都制约了其进一步应用。
介孔碳是一类新型的非硅基介孔材料,近年来在锂硫电池正极材料中的应用逐渐增多。介孔碳的孔径在2~50 nm,比表面积高达2500 m2·g–1,孔容可达2.25 cm3·g–1,作为锂硫电池正极基体时,负载的硫含量可达质量分数70%。介孔碳材料对聚硫离子具有很强的吸附作用,能有效抑制聚硫离子溶出,同时,介孔孔道可以限制硫颗粒的长大,保持硫的纳米级结构,而纳米尺寸的硫能表现出更高的电化学活性。2009年,Ji等[30]成功地将硫复合到介孔碳CMK-3上,合成了S/CMK-3复合正极材料,该材料的首次放电比容量达1320 mAh·g–1,20次循环后容量维持在800 mAh·g–1。Qu等[31]合成了氮富集的高度有序介孔碳材料HNMC,并通过热熔融法将单质硫固载在该材料上,合成了S-HNMC复合材料,该正极材料的硫固载量达质量分数53.3%,首次放电比容量为1209 mAh·g–1,在1C下循环200周后比容量仍高达600 mAh·g–1,作者将该材料优异的电性能归因于氮富集提高了单质硫在材料上的分散性,减少了硫的损失。2015年Ma等[32]以三维骨架介孔CMK-8为原料合成了PPY@CMK-8/S正极材料,在这种材料中,CMK-8提供一个导电网络,该材料在0.2C下循环100次后可逆容量稳定在860 mAh·g–1。2016年Hu等[33]通过模板法合成了三态介孔碳TMC,具体制备过程如图1所示,通过物理吸附方法将单质硫固载在TMC内合成了TMC/S纳米复合物,该材料比表面积高达2371 m2·g–1,其孔径呈2.5,9,5 nm三种不同分布,这种孔径分布能满足电解液的浸润、多硫化物的吸附和导电等不同功能,硫吸附高达质量分数70%,该材料分别在1C,2C和3C下循环300周,其比容量均超过700 mAh·g–1。虽然介孔碳材料具有上述诸多优点,但由于S/介孔碳复合材料结构复杂,制备周期长,工业化应用难度较大。

图1 TMC合成流程图
微孔碳也被应用于锂硫电池中,Yeon等[34]通过硫沉淀和硫高温熔化双重固硫法将硫固载在微孔碳MIP材料中制备了S-MIP复合材料,硫含量为质量分数40%~50%,材料在0.1C下循环50周后可逆容量保持在680 mAh·g–1。Li等[35]通过简单的热处理方法将S固载在微孔碳上,分别制备了硫含量为质量分数50%,60%和70%的S/MC复合材料,实验结果表明含有质量分数50%硫的S/MC材料呈现出最好的电化学性能:在50 mA·g–1的电流密度下,其初始放电容量为1624.6 mAh·g–1;在800 mA·g–1的电流密度下,其初始放电容量为1288.6 mAh·g–1,循环180周后其容量保持在522.8 mAh·g–1。Gu等[36]采用价格更低廉且简单易得的竹炭为原料,通过KOH活化法等简单处理制备了微孔竹炭BC,并将单质硫固载在竹炭上制备了BC-S正极材料,该材料首次放电比容量为1295 mAh·g–1,在160 mA·g–1的电流密度下循环150周后容量保持在550 mAh·g–1。以微孔碳为基体的硫基复合材料电化学性能表现良好,如能将其制备过程进一步简化,将具有很好的应用前景。
1.1.2 S/多壁碳纳米管和碳纳米纤维复合正极材料
多壁碳纳米管(MWCNTs)于1985年由英国和美国科学家合作发现,它具有优良的导电性能,是硫的理想结构支架,将其应用于锂硫电池正极材料,一方面有利于提高单质硫的导电性能,另一方面有利于控制电解液与活性物质的副反应,抑制多硫化锂的溶解流失,提高活性物质的利用率,从而提高电池的倍率性能和循环性能。2014年,Cheng等[37]以碳纳米管(CNTs)与单质硫为原料制备了CNT@S复合材料,实验结果表明此复合材料具有优异的循环稳定性,在1C下放电比容量达1053 mAh·g–1,循环1000周后容量仍稳定在535 mAh·g–1,周容量平均衰减率仅0.049%。Xie等[38]采用多壁碳纳米管(MWCNTs-W)与还原氧化石墨烯(RGO)制备了具有三维混合纳米网状结构的RGO@MWCNTs -W/S复合材料,在0.2C下放电比容量达1164.5 mAh·g–1,循环200周后容量稳定在891.5 mAh·g–1;在5C下循环200周后容量高达620 mAh·g–1。作者认为RGO@MWCNTs-W/S复合材料的独特结构可以提供一个三维导电网络,能促进阴极电荷转移反应快速进行;此外,表面粗糙和多孔结构的多壁碳纳米管经KOH活化,并与RGO结合后具有特殊的吸附能力,可将多硫化物吸附在材料周围,抑制“穿梭效应”,提高材料的循环性能。2015年,Li等[39]将硫固载在多壁碳纳米管上,并在其外层包覆一层聚苯胺,成功合成了硫基正极材料MWCNTs-S@PANI,该材料呈现出较好的循环性能和倍率性能。Yu等[40]以改善硫导电性为突破点,合成了一种既能捕获硫又能提供电子转移通道的碳纳米管,该材料比容量和库伦效率分别高达1739 mAh·g–1和87.6%。Wu等[41]通过对碳纳米管进行嫁接羟基改性,提高了材料吸附硫的能力,同时,为抑制多硫化物溶解,通过对正极材料进行聚多巴胺包覆得到的PD-S-HCNTs复合材料循环寿命达到3000次,且倍率性能良好。多壁碳纳米管导电性能优异,为进一步增加导电面积,一般需要对其进行化学活化来增加比表面积,以促进电子和Li+的扩散,提高循环性能和库伦效率。
纳米碳纤维(Carbon Nanofibers,-CNF),是一种新型的碳材料,直径一般在10~500 nm,具有良好的导电性和吸附能力。Gui等[42]合成了一种碳纤维材料并将硫负载在该材料上,硫的负载量可达质量分数75%,组装成电池后,在0.2C下放电,比容量高达1670 mAh·g–1,硫的利用率超过95%,循环150次后容量仍高达730 mAh·g–1。Bilotti等[43]提出了一种“转绕式”合成新方法,该方法将碳纳米纤维和单质硫经过转绕作用形成类双层壁的圆筒结构,单质硫固载在内壁与外壁之间,即“CNF-S-CNF”,该方法合成的碳纳米纤维新材料,可作为正极材料或隔膜材料,相比于之前研究人员合成的碳纳米纤维,该材料的结构和形貌更有利于提高活性组分硫的导电性和抑制“穿梭效应”。Singhal等[44]合成了层状碳纳米纤维,通过层层包覆将单质硫固载在碳纳米纤维层中间,该方法能很好地固定硫和多硫化物,防止其在充放电过程中移动,比容量高达1549 mAh·g–1,循环100次后容量保持率为83%。Wu等[45]以聚丙烯腈(PAN)和聚甲基丙烯酸甲酯(PMMA)为原料,采用同轴静电纺丝技术制备了中空微孔碳纳米纤维(MhMpCFs)材料,然后通过物理固硫法将单质硫固载在碳纳米纤维上,该复合材料首次容量达815 mAh·g–1,循环70周后容量为715 mAh·g–1,容量保持率为88%。碳纳米纤维虽然导电性好,硫利用率高,但其结构稳定性还需进一步提高,以减少活性组分硫的损失,从而提高电池的使用寿命。
1.1.3 S/石墨烯复合正极材料
石墨烯(Graphene)是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体,2004年由英国科学家首次发现。石墨烯具有超薄、高强度、高韧性、高比表面积、高导电性等特点,热力学和电化学性能优异。S/石墨烯复合材料可以吸附较多的多硫化物,增加电池的循环寿命。
现阶段将硫固载在石墨烯材料中主要有两种方法:第一种是用石墨烯或氧化石墨烯包覆硫分子,使硫分子固定在石墨烯中(如图2所示)。Wang等[46]用石墨烯包覆硫,并在其表面加入活性剂PEG作为硫粒子的封端剂,以防止充放电过程中硫和多硫化物的溶出。Zheng等[47]合成了石墨烯包覆硫的正极材料,和单质硫相比,该复合材料的电荷传递阻抗大大降低,质量比容量和循环寿命大幅提高,但硫的负载量较低(质量分数20%左右),在0.03C小电流下充放电,循环40次后容量由1100 mAh·g–1衰减至600 mAh·g–1。Wang等[48]合成出石墨烯包覆纳米硫颗粒正极材料,纳米S/石墨烯复合材料中活性物质硫的负载量达质量分数70%,1C循环100次后的容量为500 mAh·g–1。Scott等[49]运用一步法合成了S/石墨烯复合材料,硫的负载量达质量分数87%,材料经过50次循环后容量保持率为93%。

图2 S/石墨烯复合材料合成流程图
第二种石墨烯固硫方法称为双层膜固载硫,由于石墨烯是二维网状结构,可以将硫固载在两层石墨烯之间或石墨烯与其他膜之间,可以有效地限制活性组分硫的损失和多硫化物的溶出,常使用的载体为石墨烯和全氟磺酸。Zhao等[50]将石墨烯和单壁碳纳米管混合使用,合成了G/SWCNT-S正极材料,该材料导电性能优异,在5C下循环100周后容量保持在650 mAh·g–1。通过石墨烯双层固载单质硫,电化学性能优势明显,但该方法制备过程复杂且石墨烯价格昂贵,批量化生产难度大。
1.1.4 S/其他碳正极材料
空心碳材料比表面积大,材料内部空心能容纳大量的硫以及硫与锂反应生成的多硫化锂,无需其他特殊的隔膜来隔离多硫化物,这些结构特点使得其成为极具潜力的硫正极复合材料。Jayaprakash等[51]合成了一种直径为200~300 nm的空心碳微球,该材料能容纳的硫含量达到质量分数70%以上,在0.5C下循环100周后比容量仍达974 mAh·g–1。Wu等[52]采用模板法成功合成了S/多孔球形碳-碳纳米管复合材料,该材料的比表面积高达1014 m2·g–1,硫的含量控制在质量分数75%左右,材料在2.8×10–3A·cm–2的电流密度下循环200周后比容量仍维持在700 mAh·g–1以上。Rehman等[53]设计了交错的Si/SiO2与分级多孔碳微球交联的Si/SiO2@C-S正极材料,该材料具有极大的比表面积和孔径,能固载大量的硫,同时能增强锂离子在正极的嵌入与脱出能力,从而提升倍率性能;此外,交错的Si/SiO2结构在循环过程中能够提供非常稳定的氧化还原活性,使材料具有非常稳定的循环性能,材料在2C下循环500周后,周循环容量衰减不到0.063%。空心碳材料由于其诸多优势已成为锂硫电池中的研究热点。

图3 CVD法制备G/SWCNT复合材料流程图
提高碳硫正极材料导电性的另一研究方向是改性碳材料,而元素掺杂作为改性碳的主要方法,分为原子掺杂改性和化合物掺杂改性,其基本思路是通过掺杂改善碳材料的孔道,增强锂离子的穿越能力,提高孔道对多硫化物的吸附能力。Fan等[54]通过掺杂NiFe2O4至CNT中成功制备了CNT/NiFe2O4-S复合材料,该材料在1C下循环500周后比容量维持在850 mAh·g–1,周循环容量损失率仅为0.009%,库伦效率高达99.2%,电化学性能优越。Cao等[55]制备了氮掺杂的S/石墨烯复合材料分别在1 A·g–1和2 A·g–1下循环200周后,该材料比容量均超过800 mAh·g–1,而未掺杂材料仅为620 mAh·g–1。Liu等[56]合成了一种氮、氧共掺杂的层状石墨烯材料OCN,氧和氮的含量能达到质量分数20%,通过层状包覆硫获得S/OCN正极材料,该材料在0.05C下首次放电比容量为1407.6 mAh·g–1,实验表明氮和氧原子的掺杂能有效地增加材料吸附多硫化物的能力,有利于材料寿命的提高。Zu等[57]通过氧掺杂和氮掺杂改性多孔碳,以聚硫化物为活性组分,同时加入高导电的三维石墨烯以阻止多硫化物在电池中的溶解合成出正极材料,通过分析材料的价键变化来研究材料的导电性,取得了较好的结果。根据以上实验研究结果,可见改性碳材料能改善原材料体系缺陷,提升材料性能,这对于S/C复合正极材料开发具有重要意义。
泡沫碳基材料是近几年新兴的一类碳材料,由于具有特殊的热力学和物理学性质而得到广泛的研究,主要包括泡沫碳、泡沫石墨烯、碳纳米管-石墨烯泡沫复合物等材料。Tao等[58]通过模板法合成了高介孔泡沫碳材料,材料的比表面积高达1478.55 m2·g–1,经过固硫处理后,当复合材料的硫含量为质量分数57.22%时,首次放电比容量为1285 mAh·g–1,循环50周后比容量仍高达878 mAh·g–1,并且作者预测应用无机金属材料和有机溶剂处理的介孔泡沫碳将会拥有更好的电化学性能。Xi等[59]合成了一种超轻的三维网状石墨烯泡沫材料,该材料能分级固硫并拥有快速的离子通道,以此为正极材料不需额外添加胶粘剂、导电剂和集流体,极大地减轻了正极材料的质量,该材料循环400周后,周容量损失率小于0.064%。Zhou等[60]通过应用化学方法合成了可折叠的石墨烯泡沫材料,经过固载单质硫后合成泡沫石墨烯-S正极材料,该材料能折叠使用,导电性能优异,材料循环1000次后比容量仍保持在450 mAh·g–1。目前,人们对泡沫碳基材料的认识有限,对其结构变化机理尚不清楚,但它已表现出较大的工业应用价值,以泡沫碳基材料为基体的硫基正极材料为锂硫电池发展提供了一种新思路。
1.2 S/导电聚合物复合正极材料
导电聚合物由于具有一定的导电性和较高的比表面积,且其能与单质硫较好地接触发生物理吸附或化学反应生成S/导电聚合物而被广泛研究。S/导电聚合物复合材料主要是通过吸附的硫单质与锂离子反应来实现材料的充放电,常用的导电聚合物主要有聚吡咯、聚苯胺、聚噻吩和聚丙烯腈等。S/导电聚合物在充放电过程中容易发生体积效应,为避免该效应带来的结构破坏,改善该材料的循环性能,一般在材料中加入碳材料、分子筛或金属氧化物等作为骨架材料以支撑整个结构,从而增加材料的使用次数。Zhang等[61]通过将纳米级单质S与聚合物超声均匀混合制备了S/PPy复合材料,该材料由于其特殊的孔道结构能吸附多硫化物,减少充放电过程中体积效应的影响而表现出较好的电化学性能。尹利超[24]以MWCNT、苯胺和单质硫为原料,通过简单的热复合方法合成了S-ANI/MWCNT复合材料,该硫基材料拥有特殊的管壳结构,在4C下材料经过多次充放电循环容量保持在450 mAh·g–1。Wu等[62]通过化学氧化聚合方法合成了核壳结构的S/聚噻吩复合材料,该材料将单质硫包覆在导电剂聚合物内,当硫的含量为质量分数71.9%时,材料循环100次后比容量保持在811 mAh·g–1。Sohn等[63]合成了多孔微球结构的S-聚丙烯腈/碳复合材料,该材料的比表面积高达727.2 m2·g–1,孔容为1.42 cm3·g–1,具有非常强的吸附多硫化物的能力,当材料中硫含量超过质量分数72%时,在0.5C下循环100次后其可逆比容量稳定在513 mAh·g–1,库伦效率超过99%。导电聚合物在硫基正极材料中起着导电剂、分散剂和吸附剂等多重作用,且其与单质硫复合制备过程简单,相信S/导电聚合物将具有较好的应用前景。
1.3 S/金属氧化物复合正极材料
纳米级的导电金属氧化物具有合成工艺简单、比表面积大、吸附多硫化物能力强等特点,其作为S载体能很好地改善S正极导电性并延长使用寿命,因而备受研究人员青睐。Seh等[64]设计并合成了一种中空蛋黄壳纳米结构的TiO2,将硫固载在纳米壳中,避免了在充放电过程中硫引起的体积膨胀,同时降低了多硫化物溶解的影响,材料在0.5C下初始比容量为1030 mAh·g–1,1000次循环后周容量衰减小于0.033%,具有非常大的应用潜力。李心勇[65]采用加热介孔MoO2和单质硫制备了介孔MoO2/S复合材料,当硫的负载量为质量分数40%时,初始比容量为1236.8 mAh·g–1,100次循环后仍有683.8 mAh·g–1;5C下循环100次后比容量仍高达543.5 mAh·g–1。马国强等[66]以Ce(OH)4为原料,采用热分解法制备得到粒径小于10 nm的CeO2纳米晶并将其应用于锂硫电池硫正极材料,含有质量分数5%CeO2纳米晶的锂硫电池硫基正极材料分别在0.1C和0.5C的倍率下充放电,100周后容量分别达750和598 mAh·g–1,远高于不含有CeO2纳米晶的523和395 mAh·g–1,且循环前后电池的阻抗也明显降低。金属氧化物在锂硫电池正极材料中表现出较好的载体作用,但纳米级的金属氧化物目前价格较高,且其与单质硫复合所需的操作过程较繁杂。目前,研究人员将研究重点主要集中在选择更加便宜的金属氧化物和简化S/金属氧化物复合材料的合成过程,S/金属氧化物复合材料在锂硫电池中的应用也将越来越广泛。
2 过渡金属或其他金属硫化物正极材料
金属或过渡金属硫化物的合成原理是利用硫与金属发生化学反应,生成硫化合物,最早由美国Exxon公司的Whittingham于1975年开发出来,他以硫化钛TiS2为正极材料制成了锂硫电池[67]。常用的硫化物正极材料有MoS2、CoS、NiS、FeS2、TiS2和Li2S等。厦门大学的王绪向[68]合成了Cu2S,以该材料为正极材料,在组装电池时采用铜箔集流体并在电极材料中添加铜粉制成了锂硫电池,在0.5C下首次放电比容量高达1614.1 mAh·g–1,硫的利用率高达91%,在2C下循环1000周后容量保持率为96.5%。Zhang等[69]发现FeS2对锂硫电池在充放电过程中产生的多硫化物具有极强的吸附能力,为锂硫电池正极材料发展提供一个新方向。Chen等[70]合成了以MoS2为基底的正极材料,并以锂金属为负极材料、Li6PS5Br为固体导电剂组装成锂硫电池,该电池在1C下循环700周后容量保持率为85%,表现出较好的电化学活性。金属硫化物不仅可以单独作为正极材料使用,也可以作为相应的复合材料的结构支撑来固载单质硫。邱彬[71]合成了两种类型的MoS2/S复合材料:介孔MoS2/S复合材料和管状MoS2/S复合材料,其中,采用介孔MoS2/S复合材料,硫含量为质量分数50%时,在1.0~3.0 V电压范围内,100 mA·g–1电流密度下首次放电容量达到650 mAh·g–1,循环50周后容量为350 mAh·g–1。成娟娟[72]首次采用低温热处理的方法在泡沫铜表面原位合成具有杂合结构的纯相CuS正极材料(合成示意图如图4),该材料具有泡沫金属多孔结构,吸附性极强,在0.2C倍率下充放电,经过100次循环后,比容量从首次的185.1 mAh·g–1增加到468.3 mAh·g–1,作者通过对CuS正极材料在循环过程中的微观结构变化进行分析,发现CuS正极材料在循环过程中是逐层活化的,这种反应方式提升了CuS正极材料的循环稳定性。过渡金属硫化物中,CoS、NiS等较易获得,其合成过程简单,产物分布均匀,但其实际可逆比容量较低;对于较难获得的金属硫化物,如Cu2S等,其比容量高,循环性能好,但其合成过程较复杂,且产品纯度无法保证。

图4 泡沫CuS正极材料合成示意图
Li2S直接作为一种锂离子电池正极材料,其理论比容量高达1166 mAh·g–1,由于Li2S自身带有2个锂离子,使得在负极没有或缺锂的状态下仍能配对组装成高能量、高安全的Li-S电池,因而被广泛研究。孙福根[73]采用水热碳化法和浸渍法合成了ARF/Li2S正极复合材料(如图5),以C-Si合金为负极,回避了锂晶枝带来的安全问题,该材料首次放电比容量为688.7 mAh·g–1,90次循环后比容量保持在582.6 mAh·g–1,表现出较好的循环稳定性。

图5 ARF/Li2S正极复合材料
梁初[74]合成了多孔Li2S/C正极材料,该材料硫化锂的含量高达质量分数77.5%,在1.0 A·g–1电流密度下,循环100次后比容量仍高达420 mAh·g–1。Meini等[75]以Li2S为电池正极材料,研究发现通过添加氧化还原剂可以抑制高电压下电解液的衰减,在电解液中添加了新型添加剂Fe(η5-C5Me5)2后,以Li2S为正极材料,经过150次循环后电池可逆比容量高达500 mAh·g–1,而未添加的仅为90 mAh·g–1,很明显,添加剂能有效阻止电解液的衰退和多硫化物的溶解。Kaiser等[76]运用球磨法合成了四种不同碳材料的Li2S/C,通过以泡沫镍为骨架结构,在泡沫镍毛细管作用下吸附碳硫材料,该材料Li2S的负载量达5×10–3g·cm–2,为了提高材料的物理化学性能,作者在正极材料与隔膜材料间添加了一层碳纳米管以防止多硫化物的“穿梭效应”,电化学结果表明单壁碳纳米管的加入使得硫化锂材料在充放电过程中表现出很好的循环性能。Yang等[77]发现Li2S在首次充电时,存在一个651 V的能垒,使用高电压对其进行逾越后,这个障碍能够被克服并且Li2S开始表现出活性,且在后续循环充放电过程中这一能垒不再出现,Li2S首次放电容量高达800 mAh·g–1,10个循环后容量仍保持在500~600 mAh·g–1,为以Li2S作为正极材料的锂硫电池机理研究提供重要依据。虽然硫化锂作为正极材料的应用潜力巨大,但由于其存在导电性差、循环时伴随多硫化物的产生和溶解以及明显的体积效应等缺陷,制约了硫化锂正极材料的工业化进程。目前,金属硫化物的一个研究热点是选择导电性良好的金属原子与单质硫复合,这种合成的金属硫化物不仅能提供较高的比容量,也将彻底克服单质硫绝缘等缺陷,成为锂硫电池正极材料领域一个非常有前景的研究方向。
3 有机硫化物复合正极材料
有机硫化物正极材料的研究最早起始于20世纪80年代,由于其具有比容量高、结构多变、环境友好、电池安全性好等一系列优点而受到广泛的关注。有机硫化物的充放电基本原理是运用S—S键的断裂和键合来实现储能和放能(如图6为有机硫化物的分子结构示意图),并且利用有机聚合物的导电性实现导电,包括有机二硫化物、有机多硫化物、有机聚硫化物和硫化聚合物等。金祖习等[78]通过4步反应合成了具有苯乙炔基结构的含S—S键化合物TMSEDTTA,该材料首周放电比容量达到330 mAh·g–1,并在2.6 V出现显著的S—S键正极材料放电平台,且高于以单质硫为正极材料的电压平台。厦门大学王洁琼等[79]通过理论计算预测了4类有机二硫化物体系的结构、电子亲和能、电离势及结构修饰对材料性质的影响,计算结果表明:有机共轭硫化物中的S—S键具有良好的过剩电子储存能力,过剩电子进入σs—s*反键轨道,可以形成稳定的两中心三电子[S∴S]—键,强吸电子基团—NO2的存在对低能空轨道能级有一定的影响,但σs—s*反键轨道在大多数情况下都是储存过剩电子的低能前线轨道,这为设计新型有机硫化物提供了理论指导。Wang等[80]通过加热单质硫和聚丙烯腈合成了硫化聚丙烯腈,该材料首次放电比容量为850 mAh·g–1,电池循环50周后,容量仍保持在600 mAh·g–1以上。Song等[81]合成了一种新型的有机硫化物聚(苯醌硫醚)PBQS,该材料在锂硫电池和钠硫电池中其电压平台和比容量分别为2.67 V,2.08 V和275 mAh·g–1,268 mAh·g–1,循环1000周后容量保持率分别为86%,72%,相比于其他有机硫化物优势明显。以有机硫化物作为电池正极材料,电池的工作电压和能量密度都比较高,且其电化学性能与循环性能均表现优异,具有一定的研究价值和应用前景,同时,有机硫化物也存在以下一些缺点:如S在材料中的含量难以提高;S—C键不稳固,S容易从结构中脱落;在充放电过程中S—S键断裂后只要碳骨架结构稍有错动,S—S键就很难再次在充放电过程中重新复合而导致材料失效等。因此,提高S在有机物中的稳定性,增加有机物中的硫含量是未来改善有机硫化物复合正极材料性能的研究重点,若解决了以上问题,该类材料将有望成为一类具有高比能量的正极材料,以推动高能量密度的电池发展,也将极大地提高人们的物质生活水平。
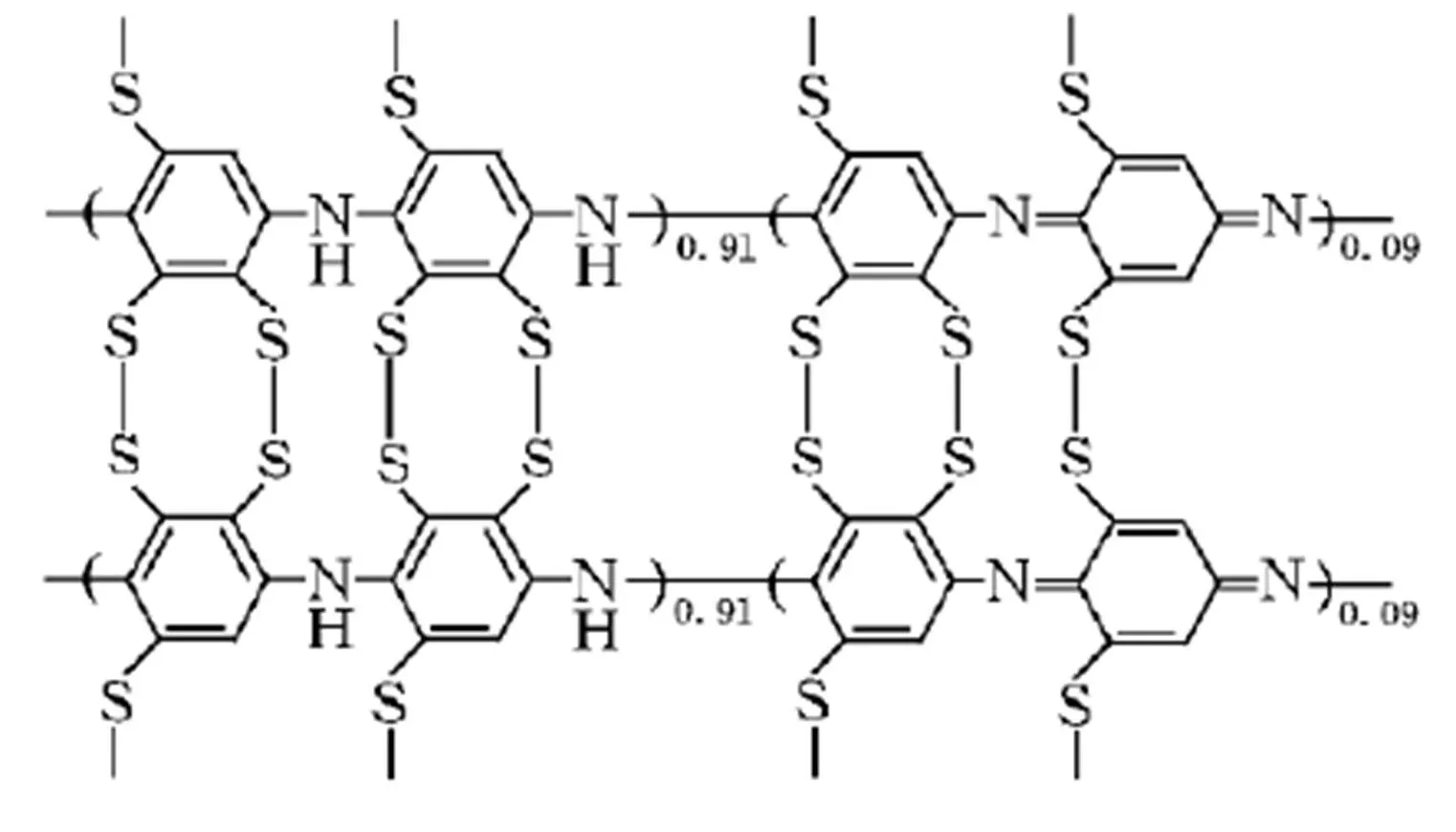
图6 有机硫化物分子结构示意图
4 结束语
单质硫具有比容量高、资源丰富、绿色环保等特点,因而备受青睐,通过引入导电基体、固硫基体,能得到电性能优异的硫复合正极材料,从而在一定程度上解决了硫导电率低、多硫化物生成和溶解等问题。目前,S/导电聚合物、S/金属氧化物等硫基正极材料均表现出一定的电化学活性,但其导电性和稳定性等仍存在问题,这些不利因素制约着材料的进一步发展。以碳为基体衍生出的各种碳材料(如石墨烯、泡沫碳、多孔碳、碳纳米纤维等)与单质硫结合而成的硫正极材料是当前研究的主流,表现出了优异的电化学性能和循环性能,由于碳材料的制备过程较复杂,且部分性能较好的碳材料价格昂贵,因而工业化应用难度较大。未来,硫基正极材料的研究中,要注重融合碳材料、导电聚合物和金属氧化物等材料的各自优势,进一步提升复合材料的硫含量、利用率,抑制充放电过程中硫的体积效应,避免循环过程中锂晶枝的产生,加速推进锂硫电池的商业化进程。
金属或过渡金属硫化物和有机硫化物作为另外两种硫正极材料,它以化学键的方式将硫与金属原子或有机导电基团结合,能很好地克服单质硫绝缘的缺陷,且活性组分硫能比较稳定地固定在材料上,在多次循环充放电过程中损失较少,能很好地保证材料的循环性能,同时通过化学反应获得的金属或过渡金属硫化物和有机硫化物,材料均一性较好,后处理简单。目前,金属或过渡金属硫化物正向着以泡沫金属为基体合成多孔金属硫化物方向发展,合成的材料具有三维多孔结构,一方面可以保证电解液的充分浸润,缩短离子和电子通道,另一方面可以限制多硫化物的流出,是硫正极材料工业化的一个重要的突破点。有机硫化物的发展更多倾向于以有机导电材料聚噻吩和聚丙烯等为基体合成有机多硫化物,在保证材料导电性的前提下尽可能增加硫含量,以提高材料的容量。
随着各种新思想和新技术在硫正极材料的应用,相信不久的将来,锂硫电池能实现商业化应用和大规模生产。
[1] 陈飞彪. 锂硫电池正极材料的制备及其电化学性能研究[D]. 北京: 北京理工大学, 2015.
[2] MIKHAYLIK Y V, AKRIDGE J R. Polysulfide shuttle study in the Li/S battery system [J]. J Electrochem Soc, 2004, 151(11): A1969-A1976.
[3] JIA X, ZHANG C, LIU J, et al. Evolution of the effect of sulfur confinement in graphene-based porous carbons for use in Li-S batteries [J]. Nanoscale, 2016, 8(8): 4447-4451.
[4] 王钊, 赵凯森, 孙宇, 等. 锂硫电池正极材料研究进展 [J]. 分子科学学报, 2016(5): 367-378.
[5] 张凯. 锂硫电池正极改性、结构设计及电化学性能研究[D]. 长沙: 中南大学, 2014.
[6] 李宛飞, 刘美男, 王健, 等. 化学改性碳在锂硫电池中的研究进展 [J]. 物理化学学报, 2017, 33(1): 165-182.
[7] CHENG W H, WANG L, ZHANG Q B, et al. Preparation and characterization of nanoscale LiFePO4cathode materials by a two-step solid-state reaction method [J]. J Mater Sci, 2017, 52(4): 2366-2372.
[8] JUNG S K, GWON H, HONG J, et al. Understanding the degradation mechanisms of LiNi0.5Co0.2Mn0.3O2cathode material in lithium ion batteries [J]. Adv Energy Mater, 2014, 4(1): 94-98.
[9] LIANG L, JIANG J, JIANG F, et al. An ordered olivine-type LiCoPO4layer grown on LiNi0.6Mn0.2Co0.2O2cathode materials applied to lithium-ion batteries [J]. J Alloys Compd, 2017, 695: 1993-1997.
[10] ZHAO E, WEI L, GUO Y, et al. Rapid hydrothermal and post-calcination synthesis of well-shaped LiNi0.5Mn1.5O4cathode materials for lithium ion batteries [J]. J Alloys Compd, 2017, 695: 3393-3401.
[11] 王蒙蒙. 锂离子电池三元正极材料的合成与改性研究[D]. 长沙:中南大学, 2014.
[12] WU H, WANG Z, LIU S, et al. Fabrication of Li+-conductive Li2ZrO3-based shell encapsulated LiNi0.5Co0.2Mn0.3O2microspheres as high-rate and long-life cathode materials for Li-ion batteries [J]. Chem Electro Chem, 2015, 2(12): 1921-1928.
[13] DU PASQUIER A, PLITZ I, MENOCAL S, et al. A comparative study of Li-ion battery, supercapacitor and nonaqueous asymmetric hybrid devices for automotive applications [J]. J Power Sources, 2003, 115(1): 171-178.
[14] 张克宇, 姚耀春. 锂离子电池磷酸铁锂正极材料的研究进展 [J]. 化工进展, 2015, 34(1): 166-172.
[15] LI Z, PENG Z, ZHANG H, et al. [100]-Oriented LiFePO4nanoflakes toward high rate Li-ion battery cathode [J]. Nano Lett, 2016.
[16] 李振华. 锂硫电池硫/碳复合正极材料的研究[D]. 哈尔滨: 哈尔滨工业大学, 2014.
[17] KANG H S, SUN Y K. Freestanding bilayer carbon-sulfur cathode with function of entrapping polysulfide for high performance Li-S batteries [J]. Adv Funct Mater, 2016, 26(8): 1225-1232.
[18] CAO R, CHEN J, HAN K S, et al. Effect of the anion activity on the stability of Li metal anodes in lithium-sulfur batteries [J]. Adv Funct Mater, 2016, 26(18): 3059-3066.
[19] 刁岩, 谢凯, 洪晓斌, 等. Li-S电池硫正极性能衰减机理分析及研究现状概述 [J]. 化学学报, 2013, 71(4): 508-518.
[20] QIAN X, JIN L, ZHAO D, et al. Ketjen black-MnO composite coated separator for high performance rechargeable lithium-sulfur battery [J]. Electrochim Acta, 2016, 192: 346-356.
[21] 陈人杰, 赵腾, 李丽, 等. 高比能锂硫电池正极材料 [J]. 中国科学: 化学, 2014(8): 1298-1312.
[22] JIN W K, OCON J D, PARK D W, et al. Enhanced reversible capacity of Li-S battery cathode based on graphene oxide [J]. J Energy Chem, 2013, 22(2): 336-340.
[23] WANG M, ZHANG H, ZHOU W, et al. Rational design of a nested pore structure sulfur host for fast Li/S batteries with a long cycle life [J]. J Mater Chem A, 2016, 4(5): 1653-1662.
[24] 尹利超. 二次锂电池用硫基复合正极材料的研究[D]. 上海: 上海交通大学, 2012.
[25] HU G, XU C, SUN Z, et al. 3D graphene-foam-reduced-graphene-oxide hybrid nested hierarchical networks for high-performance Li-S batteries [J]. Adv Mater, 2015, 28(8): 1603-1609.
[26] HE B, LI W C, YANG C, et al. Incorporating sulfur inside the pores of carbons for advanced lithium-sulfur batteries: an electrolysis approach [J]. ACS Nano, 2016, 10(1): 1633.
[27] QIAN W, GAO Q, YANG K, et al. 3D Hierarchically interconnected porous graphene containing sulfur for stable high rate Li-S batteries [J]. Energy Technol, 2016, 4(5): 625-632.
[28] TACHIKAWA N, YAMAUCHI K, TAKASHIMA E, et al. Reversibility of electrochemical reactions of sulfur supported on inverse opal carbon in glyme-Li salt molten complex electrolytes [J]. Chem Commun, 2011, 47(28): 8157-8159.
[29] STRUBEL P, THIEME S, BIEMELT T, et al. ZnO hard templating for synthesis of hierarchical porous carbons with tailored porosity and high performance in lithium-sulfur battery [J]. Adv Funct Mater, 2015, 25(2): 287-297.
[30] JI X, LEE K T, NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries [J]. Nat Mater, 2009, 8(6): 500-506.
[31] QU Y, ZHANG Z, ZHANG X, et al. Highly ordered nitrogen-rich mesoporous carbon derived from biomass waste for high-performance lithium-sulfur batteries [J]. Carbon, 2015, 84: 399-408.
[32] MA G, WEN Z, JIN J, et al. Enhanced performance of lithium sulfur battery with polypyrrole warped mesoporous carbon/sulfur composite [J]. J Power Sources, 2014, 254: 353-359.
[33] HU W, ZHANG H, WANG M, et al. Tri-modal mesoporous carbon/sulfur nanocomposite for high performance Li-S battery [J]. Electrochim Acta, 2016, 190: 322-328.
[34] YEON S H, JUNG K N, YOON S, et al. Improved electrochemical performances of sulfur-microporous carbon composite electrode for Li/S battery [J]. J Appl Electro Chem, 2013, 43(3): 245-252.
[35] LI J, GUO J, ZENG L, et al. Improving lithium–sulfur battery performance by using ternary hybrid cathode material [J]. RSC Adv, 2016, 6(32): 26630-26636.
[36] GU X, WANG Y, LAI C, et al. Microporous bamboo biochar for lithium-sulfur batteries [J]. Nano Res, 2015, 8(1): 129-139.
[37] CHENG X B, HUANG J Q, ZHANG Q, et al. Aligned carbon nanotube/sulfur composite cathodes with high sulfur content for lithium-sulfur batteries [J]. Nano Energy, 2014, 4: 65-72.
[38] XIE J, YANG J, ZHOU X, et al. Preparation of three-dimensional hybrid nanostructure-encapsulated sulfur cathode for high-rate lithium sulfur batteries [J]. J Power Sources, 2014, 253(5): 55-63.
[39] LI X, RAO M, CHEN D, et al. Sulfur supported by carbon nanotubes and coated with polyaniline: preparation and performance as cathode of lithium-sulfur cell [J]. Electrochim Acta, 2015, 166: 93-99.
[40] YU S H, XU D W, XIN S, et al. Built-in carbon nanotube network inside a biomass-derived hierarchically porous carbon to enhance the performance of the sulfur cathode in a Li-S battery [J]. Chem Nano Mat, 2016, 2(7): 712-718.
[41] WU F, YE Y, CHEN R, et al. Systematic effect for an ultralong cycle lithium-sulfur battery [J]. Nano Lett, 2015, 15(11): 7431-7439.
[42] GUI Z, ZHU H, GILLETTE E, et al. Natural cellulose fiber as substrate for supercapacitor [J]. ACS nano, 2013, 7(7): 6037-6046.
[43] BILOTTI E, FISCHER H R, PEIJS T. Polymer nanocomposites based on needle-like sepiolite clays: effect of functionalized polymers on the dispersion of nanofiller, crystallinity, and mechanical properties [J]. J Appl Polym Sci, 2008, 107(2): 1116-1123.
[44] SINGHAL R, CHUNG S H, MANTHIRAM A, et al. A free-standing carbon nanofiber interlayer for high-performance lithium-sulfur batteries [J]. J Mater Chem A, 2015, 3(8): 4530-4538.
[45] WU Y, GAO M, LI X, et al. Preparation of mesohollow and microporous carbon nanofiber and its application in cathode material for lithium-sulfur batteries [J]. J Alloys Compd, 2014, 608(10): 220-228.
[46] WANG H L, YANG Y, LIANG Y Y, et al. Graphene-wrapped sulfur particles as a rechargeable lithium-sulfur battery cathode material with high capacity and cycling stability [J]. Nano Lett, 2011, 11(7): 2644-2647.
[47] ZHENG S, WEN Y, ZHU Y, et al. In situ sulfur reduction and intercalation of graphite oxides for Li-S battery cathodes [J]. Adv Energy Mater, 2014, 4(16): 1400482.
[48] WANG L, WANG D, ZHANG F, et al. Interface chem guided long-cycle-life Li-S battery [J]. Nano Lett, 2013, 13(9): 4206-4211.
[49] SCOTT E, NAZAR L F. Graphene-enveloped sulfur in a one pot reaction: a cathode with good coulombic efficiency and high practical sulfur content [J]. Chem Commun, 2011, 48(9): 1233-1235.
[50] ZHAO M Q, LIU X F, ZHANG Q, et al. Graphene/single-walled carbon nanotube hybrids: one-step catalytic growth and applications for high-rate Li-S batteries [J]. Acs Nano, 2012, 6(12): 10759-10769.
[51] JAYAPRAKASH N, SHEN J, MOGANTY S S, et al. Porous hollow carbon@ sulfur composites for high-power lithium-sulfur batteries [J]. Angew Chem, 2011, 123(26): 6026-6030.
[52] WU F, QIAN J, CHEN R, et al. Sulfur cathode based on layered carbon matrix for high-performance Li-S batteries [J]. Nano Energy, 2015, 12: 742-749.
[53] REHMAN S, GUO S, HOU Y. Rational design of Si/SiO2@hierarchical porous carbon spheres as efficient polysulfide reservoirs for high-performance Li-S battery [J]. Adv Mater, 2016, 28(16): 3167-3172.
[54] FAN Q, LIU W, WENG Z, et al. Ternary hybrid material for high-performance lithium-sulfur battery [J]. J Am Chem Soc, 2015, 137(40): 12946-12953.
[55] CAO Y, LI X, AKSAY I A, et al. Sandwich-type functionalized graphene sheet-sulfur nanocomposite for rechargeable lithium batteries [J]. Phys Chem Chem Phys, 2011, 13(17): 7660-7665.
[56] LIU J, LI W, DUAN L, et al. A graphene-like oxygenated carbon nitride material for improved cycle-life lithium/sulfur batteries [J]. Nano Lett, 2015, 15(8): 5137-5142.
[57] ZU C, LI L, GUO J, et al. Understanding the redox obstacles in high sulfur-loading Li-S batteries and design of an advanced gel cathode [J]. J Phys Chem Lett, 2016 ,7(7):1392-1399.
[58] TAO X, CHEN X, XIA Y, et al. Highly mesoporous carbon foams synthesized by a facile, cost-effective and template-free Pechini method for advanced lithium-sulfur batteries [J]. J Mater Chem A, 2013, 1(10): 3295-3301.
[59] XI K, KIDAMBI P R, CHEN R, et al. Binder free three-dimensional sulphur/few-layer graphene foam cathode with enhanced high-rate capability for rechargeable lithium sulphur batteries [J]. Nanoscale, 2014, 6(11): 5746-5753.
[60] ZHOU G, LI L, MA C, et al. A graphene foam electrode with high sulfur loading for flexible and high energy Li-S batteries [J]. Nano Energy, 2015, 11: 356-365.
[61] ZHANG Y, ZHAO Y, KONAROV A, et al. A novel nano-sulfur/polypyrrole/graphene nanocomposite cathode with a dual-layered structure for lithium rechargeable batteries [J]. J Power Sources, 2013, 241(6): 517-521.
[62] WU F, WU S, CHEN R, et al. Sulfur-polythiophene composite cathode materials for rechargeable lithium batteries [J]. Electrochem Solid State Lett, 2010, 13(4): A29-A31.
[63] SOHN H, GORDIN M L, XU T, et al. Porous spherical carbon/sulfur nanocomposites by aerosol-assisted synthesis: the effect of pore structure and morphology on their electrochemical performance as lithium/sulfur battery cathodes [J]. ACS Appl Mater Int, 2014, 6(10): 7596-7606.
[64] SEH Z W, LI W, CHA J J, et al. Sulphur-TiO2yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries [J]. Nat Commun, 2013, 4(4): 1331.
[65] 李心勇. 导电MoO2在高功率电容器和高容量锂硫电池中的应用研究[D]. 苏州: 苏州大学, 2014.
[66] 马国强, 温兆银, 王清松, 等. CeO2纳米晶的添加对锂硫电池电化学性能的影响 [J]. 无机材料学报, 2015, 30(9): 913-918.
[67] UMRIGAR C, ELLIS D E, WANG D S, et al. Band structure, intercalation, and interlayer interactions of transition-metal dichalcogenides: TiS2and LiTiS2[J]. Phys Rev B, 1982, 26(9): 4935-4950.
[68] 王绪向. 铜硫化合物作为锂电池正极材料的性能及机理研究[D]. 厦门: 厦门大学, 2014.
[69] ZHANG D, WANG X, MAI Y, et al. Enhanced electrochemical performance of FeS2synthesized by hydrothermal method for lithium ion batteries [J]. J Appl Electro Chem, 2012, 42(4): 263-269.
[70] CHEN M, YIN X, REDDY M, et al. All-solid-state MoS2/Li6PS5Br/In-Li batteries as a novel type of Li/S battery [J]. J Mater Chem A, 2015, 3(20): 10698-10702.
[71] 邱彬. 过渡金属硫化物(MoS2,CoS2)的合成与电化学性能研究[D]. 北京: 北京工业大学, 2013.
[72] 成娟娟. 锂硫电池多孔金属基正极材料的制备及电化学性能研究[D]. 湘潭: 湘潭大学, 2015.
[73] 孙福根. 锂硫电池硫正极材料的设计、制备及性能研究[D]. 上海: 华东理工大学, 2014.
[74] 梁初. 多孔Li2S正极材料的制备与电化学储锂性能研究[C]//第七届中国储能与动力电池及其关键材料学术研讨与技术交流会. 桂林: 中国仪表材料学会储能与动力电池及其材料专业委员会, 2015.
[75] MEINI S, ELAZARI R, ROSENMAN A, et al. The use of redox mediators for enhancing utilization of Li2S cathodes for advanced Li-S battery systems [J]. J Phy Chem Lett, 2014, 5(5): 915-918.
[76] KAISER M R, LIANG X, LIU H K, et al. A methodical approach for fabrication of binder-free Li2SC composite cathode with high loading of active material for Li-S battery [J]. Carbon, 2016, 103: 163-171.
[77] YANG Y, ZHENG G, MISRA S, et al. High-capacity micrometer-sized Li2S particles as cathode materials for advanced rechargeable lithium-ion batteries [J]. J Am Chem Soc, 2016, 134(37): 15387-15394.
[78] 金祖习. 作为二次锂电池正极材料的有机含硫化合物和安全性电解液的设计、合成及性能研究[D]. 武汉: 武汉大学, 2013.
[79] 王洁琼. 有机二硫化物正极材料结构与性质的理论研究[D]. 厦门: 厦门大学, 2014.
[80] WANG L, HE X, LI J, et al. Charge/discharge characteristics of sulfurized polyacrylonitrile composite with different sulfur content in carbonate based electrolyte for lithium batteries [J]. Electrochim Acta, 2012, 72: 114-119.
[81] SONG Z, XU T, GORDIN M L, et al. Polymer-graphene nanocomposites as ultrafast-charge and discharge cathodes for rechargeable lithium batteries [J]. Nano Lett, 2012, 12(5): 2205-2211.
(编辑:陈丰)
Review of sulfur composites as cathode materialsfor lithium-sulfur batteries
TANG Zexun, YE Hongqi, HAN Kai,WANG Zhian
(College of Chemistry and Chemical Engineering,Central South University, Changsha 410083, China)
Sulfur cathode material has the advantages of high specific capacity, abundant resources and environmental benignity. Lithium-sulfur battery based on sulfur cathode and lithium metal anode is regarded as a promising battery system with high energy density, which would have a great space for development in the market. Sulfur cathode material, as one of the essential ingredients for lithium-sulfur battery, is the key to improve the battery performance, and also one of the current research focus. However, there are still some serious problems for lithium-sulfur battery, such as poor conductivity of sulfur, shuttle effect and lithium dendrite. In this review, the recent research progress at home and abroad of sulfur cathode materials, including elemental sulfur, metal sulfides and organic sulfides are introduced, and their development trend is also prospected.
sulfur cathode; lithium-sulfur battery; review; metal sulfides; organic sulfides; research progress
10.14106/j.cnki.1001-2028.2017.10.001
TM912.9
A
1001-2028(2017)10-0001-11
2017-08-02
叶红齐
叶红齐(1958-),男,安徽绩溪人,教授,博导,主要研究方向为功能粉体材料与锂离子电池,E-mail: yeslab@csu.edu.cn ;唐泽勋(1982-),男,湖南长沙人,博士,主要从事锂硫电池研究,E-mail: tangzexun@163.com 。
2017-09-27 10:57
网络出版地址:http://kns.cnki.net/kcms/detail/51.1241.TN.20170927.1057.001.html

