n-3多不饱和脂肪酸对大鼠非酒精性脂肪肝的改善作用
喻日成,罗建华,刘 倩
(贵州省人民医院内分泌科,贵阳 550000)
论著·基础研究
n-3多不饱和脂肪酸对大鼠非酒精性脂肪肝的改善作用
喻日成,罗建华,刘 倩
(贵州省人民医院内分泌科,贵阳 550000)
目的探讨n-3多不饱和脂肪酸(n-3 PUFA)对高脂诱导的 Wister大鼠非酒精性脂肪性肝(NAFLD)的改善作用。方法Wister雄性大鼠30只,分为正常组、模型组、n-3 PUFA组。采用高脂喂养建立NAFLD模型,实验20周后,每组抽出7只大鼠检测血清及肝脏总胆固醇(TG)及三酰甘油(TC);其余3只大鼠肝脏苏木精-伊红(HE)染色;应用实时定量PCR(Real time-qPCR)及Western blot检测肝脏组织单核细胞趋化蛋白-1(MCP-1)、诱导型一氧化氮合酶(iNOS)、肿瘤坏死因子-α(TNF-α) mRNA及蛋白水平。结果模型组大鼠血清及肝脏TG、TC水平明显高于对照组(P<0.01),加入n-3 PUFA后血清及肝脏的TG、TC水平明显下降(P<0.05)。HE染色能明显观察到模型组大鼠肝细胞脂肪变性,而n-3 PUFA有明显改善效果。模型组大鼠炎症分子MCP-1、iNOS、TNF-α基因表达水平明显高于对照组(P<0.05),而n-3 PUFA组与模型组比较,MCP-1、iNOS、TNF-α炎症分子的表达水平明显下降(P<0.05)。结论高脂喂养能引起大鼠肝脏严重的脂肪变性及炎性反应,而n-3 PUFA起明显的改善作用。
脂肪肝,酒精性;脂肪酸类,不饱和;n-3多不饱和脂肪酸;非酒精性脂肪肝病;单核细胞趋化蛋白-1
亚太地区的非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)患病率为12%~24%,已成为一种危害极大的公共卫生问题[1]。NAFLD是由非酒精因素引起的肝内严重的脂肪变性,与脂代谢异常、胰岛素抵抗、肥胖及代谢综合征关系密切[2]。n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acid,n-3 PUFA)能抑制脂质合成、促进脂质分解,同时也有抗炎和增加胰岛素敏感性的作用[3]。本研究对n-3 PUFA对大鼠NAFLD胰岛素抵抗及肝脏炎症的影响进行探讨,现报道如下。
1 材料与方法
1.1材料 清洁级Wister雄性大鼠30只,初始体质量(160±10)g,中南大学湘雅医学院动物中心提供。RNA提取试剂盒购自Qiagen公司;逆转录试剂盒购自Applied Biosystems公司;LightCycler®TaqMan®Master购自Roche公司;单核细胞趋化蛋白-1(MCP-1)、诱导型一氧化氮合酶(iNOS)、肿瘤坏死因子-α(TNF-α)、β-肌动蛋白(β-actin)一抗购自BD Biosciences公司;辣根过氧化物酶(HRP) 标记的二抗购自Santa Cruz公司。
1.2方法
1.2.1动物饲养及标本留取 30只Wister雄性大鼠,分为3组:正常组,模型组,n-3 PUFA组,每组10只。正常组喂基础饲料(蛋白质22%,脂肪12%,碳水化合物66%),模型组喂高脂饲料(蛋白质9%,脂肪66%,碳水化合物25%),8周后n-3 PUFA组加入1.0 g/d n-3 PUFA。喂养20周后,每周抽出3只大鼠,取肝脏同一部位经固定后行苏木精-伊红(HE)染色,其余7只大鼠断头处死后分离血清,进行相关指标的测定,肝脏取出后用液氮速冻并保存于-80 ℃,用于后续实验。

表1 Real-time PCR引物
1.2.2指标测定 采用酶法试剂盒测定血清三酰甘油(TG)、总胆固醇(TC),操作过程按说明书进行。称取肝脏100 g,加入900 μL异丙醇作为介质充分匀浆,3 000 r/min离心15 min,吸取上清液,检测TG、TC。取3只大鼠同一部位肝脏经4%多聚甲醛固定,行常规HE染色。
1.2.3实时定量PCR(Real time-qPCR)检测MCP-1、iNOS、TNF-α基因mRNA表达
1.2.3.1总RNA制备 取肝脏组织100~150 mg,匀浆,加入1 mL TRIzol,按Qiagen试剂盒说明书介绍的方法提取总RNA,采用Nanodrop ND1000 测量RNA的浓度。
1.2.3.2cDNA合成 按逆转录试剂盒说明合成cDNA,每个反应体系含:1.0 μg RNA,2.0 μL 10×RT缓冲液,0.8 μL dNTP,2.0 μL随机引物,1.0 μL逆转录酶,总反应体系20.0 μL,反应条件:25 ℃ 10 min,37 ℃ 120 min,85 ℃ 5 min,4 ℃后取出样品,-20 ℃保存。
1.2.3.3PCR扩增 PCR总反应体系为10.0 μL,含cDNA模板2.0 μL,TaqMan®Master 5.0 μL,ddH2O 2.5 μL,正、反向引物各0.5 μL(表1)。PCR 反应条件:95 ℃ 10 min;95 ℃ 5 s,60 ℃ 1 min,72 ℃ 20 s,45个循环;72 ℃ 5 min。每个qPCR重复3次,以PPIA为管家基因,目的基因的相对表达量通过公式2-ΔΔCt计算。
1.2.4Western blot检测MCP-1、iNOS、TNF-α蛋白的表达 (1)大鼠肝脏总蛋白提取:取大鼠肝脏组织100 mg,加入1 mL RIPA裂解液,充分匀浆后提取总蛋白,通过二喹啉甲酸(BCA)方法测量蛋白浓度。(2)将30 μg的蛋白样品加入10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳点样孔,100 V电压电泳2 h。(3)电泳完的凝胶转聚偏二氟乙烯(PVDF)膜,5%的脱脂牛奶封闭,MCP-1、TNF-α、iNOS及β-actin一抗4 ℃孵育过夜,TBST洗3次,加辣根过氧化物酶标记的二抗常温下30 min,TBST洗3次。(4)化学发光法显影、定影,将胶片进行扫描拍照,用凝胶图像处理系统分析目标带的相对分子质量和净光密度值。

2 结 果
2.1各组大鼠血清及肝脏TC、TG水平 模型组大鼠血清及肝脏TG、TC水平明显高于对照组(P<0.05),加入n-3 PUFA后血清及肝脏的TG、TC水平较模型组明显下降(P<0.05),见表2。
2.2各组大鼠HE染色结果 光镜下对照组大鼠肝组织结构完整,肝细胞排列紧密,肝小叶结构正常,细胞核位于细胞中央,核大而圆,无脂滴;模型组大鼠肝脏内有弥漫性肝细胞脂肪变性,脂肪浸润明显,肝细胞内可见大小不一的脂滴;n-3 PUFA组肝细胞脂肪变性较模型组明显改善,仅见轻度脂肪沉积,见图1。
表2 n-3 PUFA降低大鼠肝脏及血清TC、TG
a:P<0.01,与模型组比较
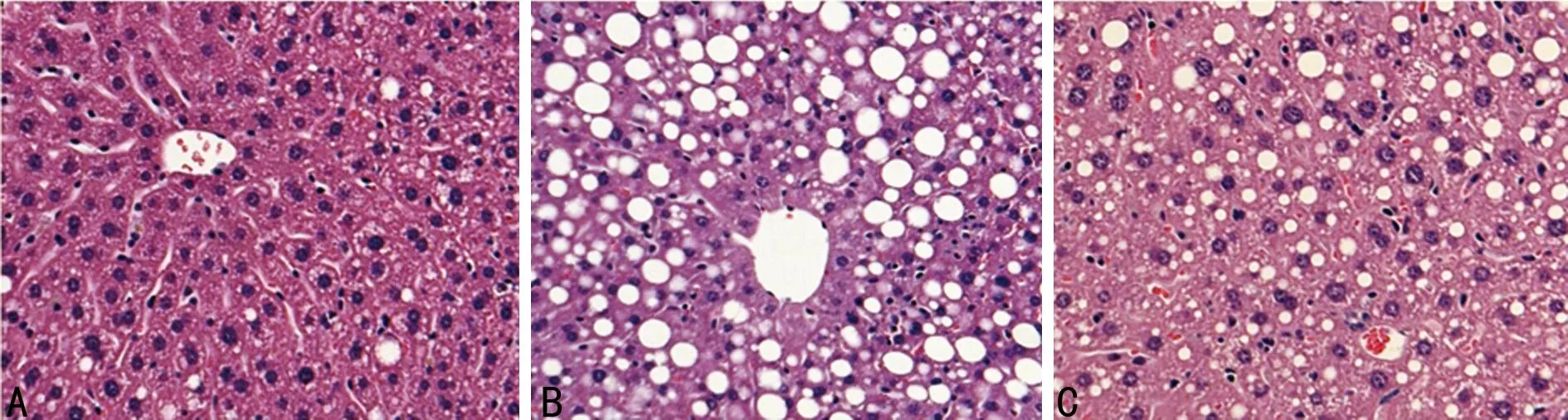
A:对照组;B:模型组;C:n-3 PUFA组
图1光镜下大鼠肝脏组织病理改变(HE,×400)
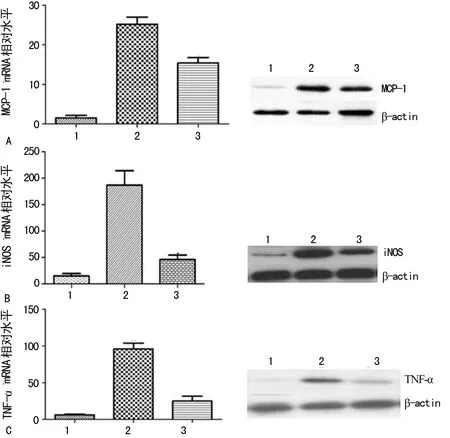
A:MCP-1;B:iNOS;C:TNF-2;1:对照组;2:模型组;3:n-3 PUFA组
图2大鼠肝脏MCP-1、iNOS、TNF-α基因表达
2.3n-3 PUFA对大鼠肝脏组织炎症分子基因表达的影响 Real time-qPCR及Western blot结果显示:模型组大鼠炎症分子MCP-1、iNOS、TNF-α mRNA及蛋白表达水平明显高于对照组(P<0.05),而n-3 PUFA组与模型组比较,MCP-1、iNOS、TNF-α炎症分子的mRNA及蛋白表达水平均明显下降(P<0.05),见图2。
3 讨 论
多个临床研究证实增加饮食中n-3 PUFA水平能降低三酰甘油水平、降低血压、减少肝脏炎症、改善胰岛素抵抗[4-5]。非酒精性肝硬化患者行肝脏活检发现n-3/n-6多不饱和脂肪酸水平降低[6]。有研究表明饮食中n-3PUFA能通过孕烷X受体(PXR)及法尼醇X受体(FXR)信号通路改善NAFLD纤维化及硬化[7]。本研究采用国内外广泛应用的方法,利用高脂喂养建立大鼠NAFLD病模型。本研究结果表明高脂喂养大鼠20周后,大鼠血清TG、TC明显高于正常对照组,肝脏组织的TG、TC亦明显高于对照组。肝脏组织的HE染色观察到高脂喂养的大鼠存在严重的脂肪变性,而对照组大鼠的肝细胞形态正常,这些结果表明通过高脂喂养成功建立了大鼠的NAFLD模型。
NAFLD的发病机制目前尚不明确,有研究表明肝脏的炎症及纤维化在NAFLD的发病环节中起重要作用,一些炎症因子如TNF-α及活性氧(ROS)通过上调肝脏转化生长因子-β(TGF-β)及α-平滑肌机动蛋白(SMA)参与NAFLD的发病过程[8-9]。本研究结果表明高脂喂养大鼠建立NAFLD模型后肝脏组织的炎症因子MCP-1、iNOS、TNF-α表达明显上调,结果与国外研究一致。TNF-α是肝脏炎症的重要标志物,在肝脏的损害及肝纤维化中起重要作用[10]。MCP-1促进巨噬细胞浸润肝脏,国外研究表明MCP-1基因敲除的小鼠肝脏巨噬细胞的浸润减少,肝脏的炎性反应减轻[11]。n-3 PUFA具有明显的抗炎及改善胰岛素抵抗作用,能减少脂肪组织及肝脏组织的炎症分子如TNF-α的表达[12]。本研究结果表明NAFLD模型组大鼠加入n-3 PUFA喂养20周后,肝脏组织脂肪变性明显改善,肝脏组织TC、TG水平明显降低,炎症分子MCP-1、iNOS、TNF-α表达明显下调。有研究表明n-3 PUFA通过激活过氧化物酶增殖活化受体-α(PPAR-α)及下调类固醇调节元件结合蛋白-1c(SREBP-1c)的基因表达增加肝脏脂肪酸氧化。n-3 PUFA亦可通过核因子kappa B通路减少肝脏及脂肪组织的炎性反应,明显减少肝脏组织TNF-α的表达[13-14]。
n-3 PUFA具有明显抗炎及改善脂代谢作用,能明显减少NAFLD大鼠肝脏脂肪变性及肝脏组织TG、TC水平,减少肝脏组织的炎性反应,为临床工作中NAFLD防治提供一定的理论依据。
[1]Farrell GC,Chitturi S,Lau GK,et al.Guidelines for the assessment and management of non-alcoholic fatty liver disease in Asia-Pacific region:executive summary[J].J Gastroenterol Hepatol,2007,22(6):775-777.
[2]Sakurai M,Takamura T,Ota T,et al.Liver steatosis,but not fibrosis,is associated with insulin resistance in nonalcoholic fatty liver disease[J].J Gastroenterol Hepatol 2007,42(4):312-317.
[3]Delarue J,Li CH,Cohen R,et al.Interaction of fish oil and a glucocorticoid on metabolic responses to an oral glucose load in healthy human subjects[J].Br J Nutr,2006,95(2):267-272.
[4]Davidson MH.Mechanisms for the hypotriglyceridemic effect of marine omega-3 fatty acids[J].Am J Cardiol,2006,98(4A):27-33.
[5]Calder PC.Polyunsaturated fatty acids and inflammation[J].OCL,2004,11(1):38-45.
[6]Elizondo A,Araya J,Rodrigo R,et al.Polyunsaturated fatty acid pattern in liver and erythrocytephospholipids from obese patients[J].Obesity,2007,15(1):24-31.
[7]Saraswathi V,Perriotte-Olson C,Ganesan M,et al.A combination of dietary N-3 fatty acids and a cyclooxygenase-1 inhibitor attenuatesnonalcoholic fatty liver disease in mice[J].J Nutr Biochem,2017,42(4):149-159.
[8]Minicis S,Seki E,Paik YH,et al.Role and cellular source of nicotinamide adenine dinucleotide phosphate oxidase in hepatic fibrosis[J].Hepatology,2010,52(4):1420-1430.
[9]Carpino G,Nobili V,Renzi A,et al.Macrophage activation in pediatric nonalcoholic fatty liver disease(NAFLD) correlates with hepatic progenitor cell response via Wnt3a pathway[J].PLoS One,2016,11(6):e0157246.
[10]Li Z,Yang S,Lin H,et al.Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease[J].Hepatology,2003,37(2):343-350.
[11]Baeck C,Wehr A,Karlmark KR,et al.Pharmacological inhibition of the chemokine CCL2(MCP-1) diminishes liver macrophage infiltration and steatohep-atitis in chronic hepatic injury[J].Gut,2012,61(3):416-426
[12]Xu H,Barnes GT,Yang Q,et al.Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance[J].J Clin Invest,2003,112(12):1821-1830.
[13]Schmitz G,Ecker J.The opposing effects of n-3 and n-6 fatty acids[J].Prog Lipid Res,2008,47(2):147-155.
[14]Yuan F,Wang H,Tian Y,et al.Fish oil alleviated high-fat diet-induced non-alcoholic fatty liver disease via regulating hepatic lipids metabolism and metaflammation:a transcriptomic study[J].Lipids Health Dis,2016,15(20):219-233.
Improvementeffectofn-3polyunsaturatedfattyacidonratnonalcoholicfattyliverdisease
YuRicheng,LuoJianhua,LiuQian
(DepartmentofEndocrinology,GuizhouProvincialPeople′sHospital,Guiyang,Guizhou550000,China)
ObjectiveTo investigate the improvement effect of n-3 polyunsaturated fatty acid (n-3 PUFA) on rat nonalcoholic fatty liver disease(NAFLD) induced by high fat diet.MethodsThirty Wister male rats were divided into the control group,model group and n-3 PUFA group.The high fat feeding was adopted to establish NAFLD model.After 20 weeks of experiment,7 cases were extracted from each group for detecting serum and liver total cholesterol (TC) and triacylglyceride(TG);other 3 cases were performed the liver HE staining,the levels of MCP-1,iNOS,TNF-α mRNA protein were detected by using the Real time quantitative PCR(qPCR) and Western blot.ResultsThe TC and TG levels in serum and livers of the model group were significantly higher than those in the control group(P<0.01),but which were evidently decreased after adding n-3 PUFA(P<0.05).The HE staining clearly observed the rat hepatic cells fatty degeneration in the model group,while polyunsaturated fatty acid had obvious improvement effect on it.The inflammatory molecule MCP-1,iNOS,TNF-α gene expression levels in the model group were significantly higher than those in the control group(P<0.05),while the expression levels of MCP-1,iNOS and TNF-α in the n-3PUFA group were significantly decreased compared with the model group.ConclusionHigh fat feeding can cause the severe fatty degeneration in rat liver,but polyunsaturated fatty acid can play obvious improvement effect.
fatty liver,alcoholic;fatty acids,unsaturated;n-3 Polyunsaturated fatty acid;nonalcoholic fatty liver disease;monocyte chemotactic protein-1
R589.2
A
1671-8348(2017)26-3620-03
2017-02-18
2017-06-06)
喻日成(1976-),副主任医师,博士,主要从事糖尿病慢性并发症及肥胖方面研究。
10.3969/j.issn.1671-8348.2017.26.007

