Fenton氧化降解2-硝基-4-甲氧基苯胺的特性和动力学特征
郭 莹, 陈鸿汉*, 张焕祯, 庞 浩, 王 晖, 王 宁, 常思淼
1.中国地质大学(北京)水资源与环境工程北京市重点实验室, 北京 100083 2.北京中地泓科环境科技有限公司, 北京 100120
Fenton氧化降解2-硝基-4-甲氧基苯胺的特性和动力学特征
郭 莹1, 陈鸿汉1*, 张焕祯1, 庞 浩2, 王 晖1, 王 宁1, 常思淼1
1.中国地质大学(北京)水资源与环境工程北京市重点实验室, 北京 100083 2.北京中地泓科环境科技有限公司, 北京 100120
为探究Fenton试剂氧化降解2-N(2-硝基- 4-甲氧基苯胺)的特性,通过实验室试验系统研究了初始pH、初始c(H2O2)、初始c(Fe2+)、初始ρ(2-N)和反应温度等因素对2-N去除率的影响以及动力学特征. 结果表明:Fenton试剂氧化降解2-N效果显著,各试验组分别在初始pH为3.0、初始c(H2O2)为10 mmolL、初始c(Fe2+)为1 mmolL、初始温度为50 ℃、ρ(2-N)为100 mgL时2-N的去除率相对最高,其降解过程均符合二级动力学模型;2-N去除率随温度的升高而增大,基于在不同温度下的速率常数,推导出了2-N降解的阿伦纽斯(Arrhenius Equation)经验表达式,得到Fenton氧化2-N的活化能为30.23 kJmol. 研究显示,经Fenton氧化后,2-N分子断链开环,生成多种小分子酸,最终降解为二氧化碳和水.
2-硝基- 4-甲氧基苯胺; Fenton氧化; 羟基自由基; 反应动力学; 阿伦纽斯方程
Abstract: A series of batch experiments were carried out to investigate the effects of temperature, initial pH, initialc(H2O2)、initialc(Fe2+)、initialρ(2-N) and the temperature on the oxidative degradation of 2-N (2-nitro- 4-methoxyaniline) by Fenton oxidation process, along with the elucidation of its kinetic characteristics. The results showed that the oxidative degradation of 2-N by Fenton reagent was remarkable. The relatively highest 2-N removal rates in each group were observed an initial pH of 3, initialc(H2O2) of 10 mmol/L, initialc(Fe2+) of 1 mmol/L, initial temperature of 50 ℃ and initialρ(2-N) of 100 mg/L respectively. The degradation process was found to follow a second-order kinetic model. The removal rate of 2-N increased with temperature. The Arrhenius Equation for the degradation of 2-N was derived from the rate constant values at different temperatures, and the activation energy of 2-N for the Fenton oxidation process was calculated to be 30.23 kJ/mol. Along the Fenton process, the chains and ring of 2-N were decomposed to produce a variety of small acid molecules, which were eventually degraded into carbon dioxide and water.
Keywords: 2-nitro- 4-methoxyaniline; Fenton oxidation process; hydroxyl radical; kinetics; Arrhenius Equathon
2-N(2-硝基- 4-甲氧基苯胺)是一种重要的有机合成中间体,被广泛应用于多种有机染料、药物、感光材料等的合成[1]. 2015年,2-N作为新增剧毒物质之一被列入《危险化学品名录(2015版)》,同时,由于具有剧毒性、潜在的致突变和致癌作用,2-N已经被多个国家列为优先污染物[2]. 由于苯环上硝基的存在提高了2-N的稳定性,使2-N很难被一般的生物作用及化学作用完全降解,而且厌氧生物降解的产物亚硝基和羟胺也属于致癌化合物[3- 4]. 因此,2-N废水的净化处理是一项艰巨的任务. 然而,国内外对于2-N 的研究较为有限,多集中于2-N的合成[5- 6]、作为药物中间体的制备[7- 8]、物理特性研究[9- 11]以及毒性试验研究[12]等,对于2-N污染地下水等的研究比较缺乏.
近年来,采用高级氧化技术处理难降解有机物已成为研究的热点[13- 14]. Fenton反应高级氧化工艺因其高效、工艺装置相对简单,具有很大的实用价值[15- 16]. 在Fenton试剂反应过程中,Fe2+和H2O2依次加入废水中,H2O2在Fe2+的催化作用下具有氧化多种有机物的能力[13]. 其实质是Fe2+和H2O2之间的链反应催化生成·OH(羟基自由基),具有较强的氧化能力,其氧化还原电位仅次于氟,高达2.80 V[17],另外,·OH具有很高的电负性或亲电性,其电子亲和能力达569.3 kJ,具有很强的加成反应特性,因而Fenton试剂可无选择地氧化水中的大多数有机物,提高废水的可生化性,特别适用于生物难降解或一般化学氧化难以奏效的有机废水的氧化处理[18- 19].
越来越多的研究尝试使用Fenton氧化法对芳香烃类有机物进行降解,并对其动力学过程进行模型拟合分析. Zazo等[20]研究了Fenton氧化降解苯酚的动力学模型和降解历程,结果表明其符合二级动力学模型. ZHANG等[21]对邻苯二甲酸乙酯在Fenton氧化过程的动力学、降解历程和毒性评价进行研究发现,其动力学过程十分符合Behnajady-Modirshahla-Ghanbery(BMG)动力学模型. Masomboon等[22]对比研究了Fenton、电-Fenton和光电-Fenton技术氧化降解2,6-二甲基苯胺的特性动力学基本规律发现,电-Fenton 和光电-Fenton对于2,6-二甲基苯胺的氧化降解遵循准一级动力学模型. SUN等[23]研究了Fenton氧化降解对硝基苯胺的动力学规律,并得到了Fenton氧化降解对硝基苯胺的最佳试验条件. SUN等[24]进行了Fenton氧化降解偶氮染料耐光橙G的特性和动力学分析,结果表明,Fenton作用下,耐光橙G的降解脱色过程符合二级动力学模型. 尽管Fenton氧化对于某些苯系染料中间体及某些染料的降解特性及动力学已有部分研究[25- 29],但是,针对2-N 这种苯环结构上既有正电性基团,又有负电性基团以及中性基团的特殊剧毒物质,采用Fenton试剂对其进行氧化降解的特性研究鲜见报道,关于Fenton降解2-N动力学的研究则更加有限,而2-N又是染料中间体使用较为广泛的原料,废水中含量相对较高,毒性更大,可见对于2-N的降解特性研究在废水处理和环境整治中是至关重要的.
因此,该研究以2-N为目标污染物,通过分析各种因素对2-N去除率的影响,确定Fenton试剂氧化降解2-N的最佳反应条件,并在不同反应条件下对2-N 的降解过程进行多种动力学过程拟合,分析其动力学过程,并根据阿伦纽斯方程(Arrhenius Equation)[30]计算Fenton降解2-N的活化能,以清楚地了解Fenton氧化工艺降解2-N的特性,以期为Fenton试剂处理2-N等染料中间体废水的实际应用提供理论参考.
1 材料与方法
1.1 试验试剂及仪器
2-N(分析纯)、H2O2(30%,分析纯)、FeSO4·7H2O(分析纯)、NaOH(分析纯)、浓硫酸(98%,分析纯)均购自国药集团化学试剂北京有限公司. 2-N的理化性质如表1所示.
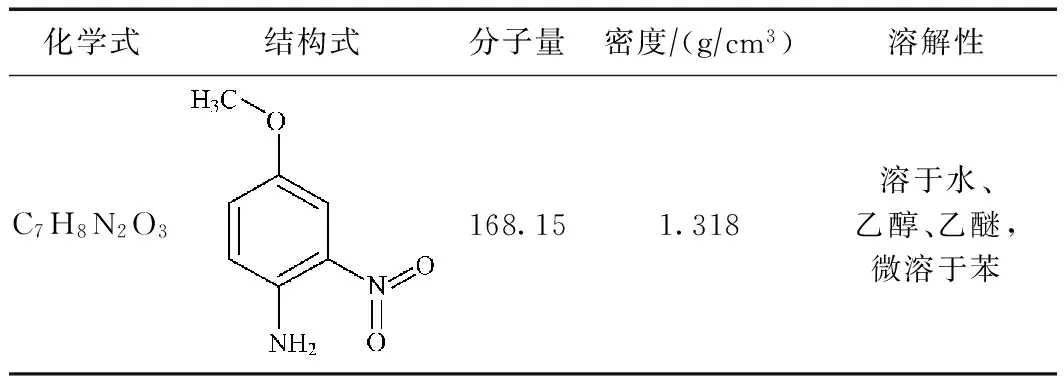
表1 2-N的理化性质
1.2 试验方法
取定量2-N粉末,充分溶解后配制成ρ(2-N)为100 mg/L的溶液. Fenton氧化装置由烧杯、温控磁力搅拌器组成. 取500 mLρ(2-N)为100 mg/L的溶液加入1 L烧杯中,用0.1 mol/L H2SO4和0.1 mol/L NaOH溶液调节pH,将烧杯放置在磁力搅拌器上方,设定所需温度,打开搅拌器,然后加入一定量的FeSO4·7H2O,待其完全溶解后加入一定量H2O2,反应从此刻开始计时,分别在反应的0.5、1、2、3、5、8、10、20、30 min取样,每次取样体积为5 mL,取样后立即加入数滴10 mol/L NaOH溶液以终止反应,静置30 min 后在 10 000 r/min下离心10 min,取上清液测定ρ(2-N)、ρ(CODCr).
1.3 分析测试
ρ(2-N)采用HPLC(高效液相色谱,SIL- 20,日本岛津)进行测定,测定条件:采用150 mm×4.6 mm、内径为5 μm的C18分析柱,甲醇流动相为0.5 ml/L,进样量为20 μL,柱温为30 ℃.ρ(CODCr)采用快速消解分光光度法测定. pH采用玻璃电极法测定. 2-N 降解过程中有机物的种类采用GC-MS(气相色谱-质谱仪,6890N-5975,美国安捷伦)测定,气相条件:进样口温度为150 ℃,HP- 5MS色谱柱(60 m×0.25 mm×0.25 m). 升温程序:初始温度40 ℃保持7 min,PostRun,150 ℃保持4 min;载气为He;柱流速为1.0 mL/min;分流比为10∶1. 质谱条件:四极杆温度为150 ℃,离子源温度为230 ℃,离子源能量为70 eV,扫描范围为45~260 Da(道尔顿),采集方式为SCAN,溶剂延迟为4 min.
2 结果与讨论
2.1 初始pH的影响
在初始ρ(2-N)为100 mg/L、c(H2O2)为10 mmol/L、c(Fe2+)为1 mmol/L、室温〔(20±1) ℃〕条件下,研究初始pH在1.0~7.0范围内时对2-N降解的影响,结果如图1所示. 同时,对各条件下的降解情况进行一级、伪一级和二级动力学拟合,二级动力学拟合的相关性最佳,根据k(二级动力学速率常数)及反应最终CODCr去除率的比较,进一步分析初始pH对该反应的影响,结果如表2所示.

pH: 1—1.0; 2—2.0; 3—3.0; 4—4.0; 5—5.0; 6—6.0; 7—7.0.图1 初始pH对2-N去除率的影响Fig.1 Effect of initial pH on 2-N removal rate


表2 初始pH影响Fenton氧化降解2-N的动力学参数
2[Fe(H2O)5OH]2+→[Fe(H2O)8(OH)2]4++2H2O
[Fe(H2O)8(OH)2]4++H2O→
[Fe2(H2O)7(OH)3]3++H3O+
[Fe2(H2O)7(OH)3]3++[Fe(H2O)5OH]2+→
Fe3(H2O)7(OH)4]5++5H2O
由以上分析可知,pH过低时会限制Fenton体系中·OH的生成,pH过高又会降低催化剂Fe2+的活性,因此该研究中,pH为3.0是Fenton试剂氧化2-N的最佳pH条件.
2.2 初始c(H2O2)的影响
固定初始pH为3.0,ρ(2-N)为100 mg/L,c(Fe2+)为1 mmol/L,室温条件下,研究初始c(H2O2)从5 mmol/L增至20 mmol/L时对2-N降解的影响,结果如图2所示. 对各种条件下的降解情况进行一级、伪一级和二级动力学拟合,二级动力学拟合的相关性最佳,结果如表3所示.
由图2及表3可看出,不同初始c(H2O2)条件下,2-N在Fenton作用下的去除效果也有较大差异,随着c(H2O2)由5 mmol/L增至20 mmol/L,反应速率常数k和CODCr去除率均在c(H2O2)为10 mmol/L时达到最大值,继续提高c(H2O2),k和CODCr去除率基本不再增大,甚至略有减小. 这种现象可以通过所谓
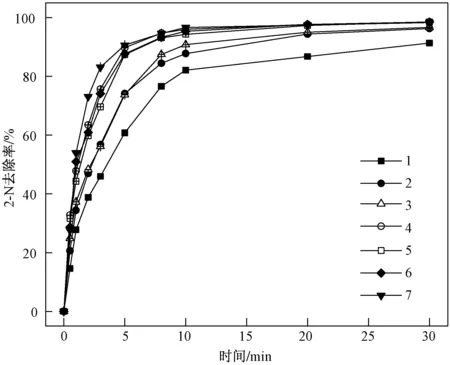
c(H2O2)/(mmol/L): 1—5.0; 2—7.5; 3—8.75; 4—10.0; 5—12.5; 6—15.0; 7—20.0.图2 初始c(H2O2) 对2-N去除率的影响Fig.2 Effect of initial c(H2O2) on 2-N removal rate
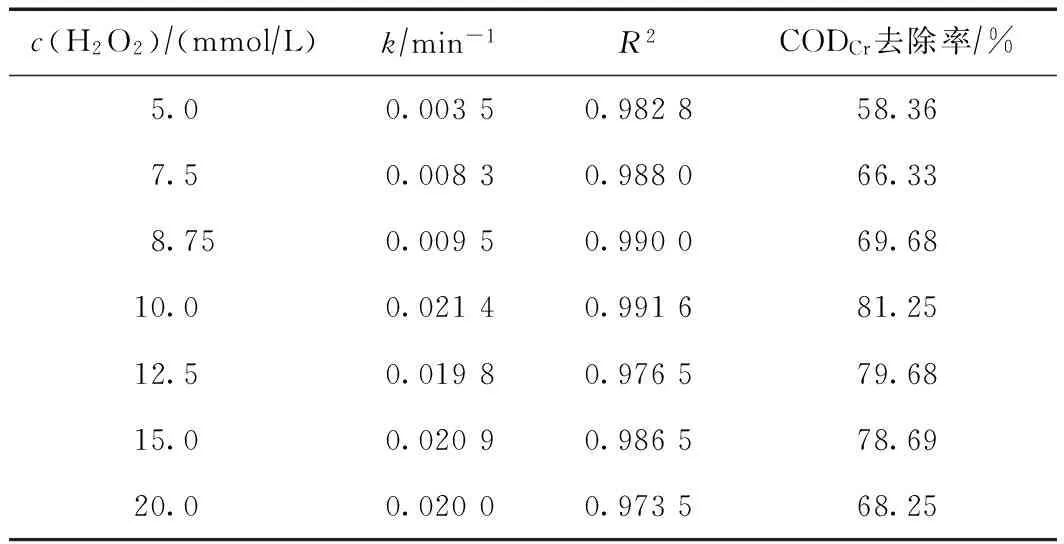
c(H2O2)∕(mmol∕L)k∕min-1R2CODCr去除率∕%5.00.00350.982858.367.50.00830.988066.338.750.00950.990069.6810.00.02140.991681.2512.50.01980.976579.6815.00.02090.986578.6920.00.02000.973568.25
的“临界浓度效应”来解释[33],在c(H2O2)低于临界浓度(10 mmol/L)时,随着c(H2O2)的增加,产生的·OH 随之增加[34],因此2-N的降解速率也逐渐增大. 一旦超过临界浓度,随c(H2O2)的继续增加,可能会发生如下反应[35]:
·OH+H2O2→ HO2·+H2O
HO2·+HO2· → H2O2+O2
使得·OH降解2-N的效率降低. 此外,若c(H2O2)过大,试验过程中发现体系会产生更多气泡,不利于铁化合物的沉降,增加了后续处理难度.
2.3 初始c(Fe2+)的影响
在初始pH为3.0、ρ(2-N)为100 mg/L、c(H2O2)为10 mmol/L、室温条件下,不同初始c(Fe2+)对2-N降解的影响结果如图3所示. 对各条件下的降解情况进行一级、伪一级和二级动力学拟合,二级动力学拟合的相关性最佳,如表4所示.

c(Fe2+)/(mmol/L): 1—0.33; 2—0.50; 3—0.67; 4—1.0; 5—2.5; 6—5.0; 7—10.0.图3 初始c(Fe2+)对2-N去除率的影响Fig.3 Effect of initial c(Fe2+) on 2-N removal rate
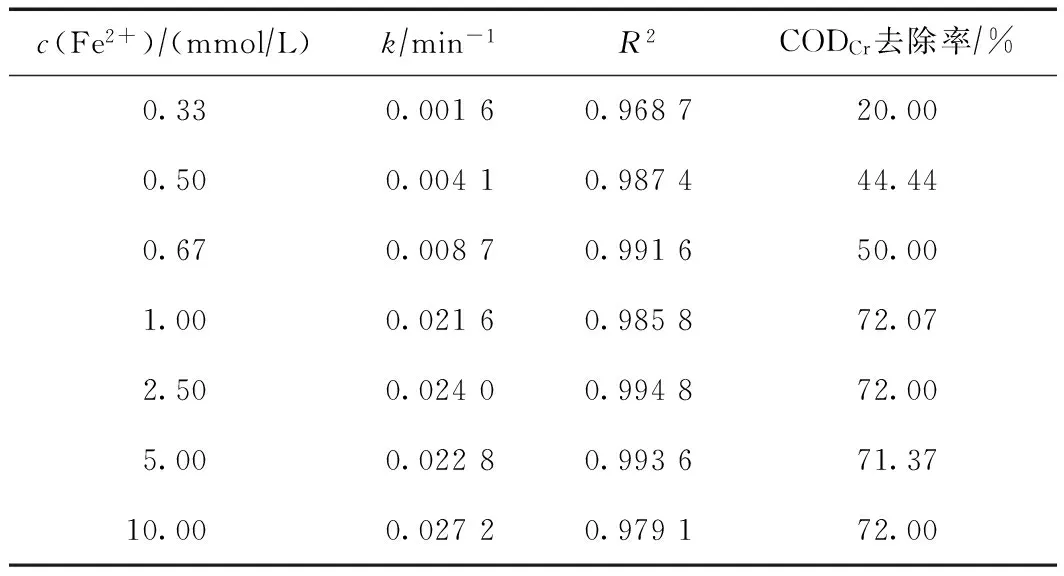
c(Fe2+)∕(mmol∕L)k∕min-1R2CODCr去除率∕%0.330.00160.968720.000.500.00410.987444.440.670.00870.991650.001.000.02160.985872.072.500.02400.994872.005.000.02280.993671.3710.000.02720.979172.00
由图3及表4可看出,不同初始c(Fe2+)条件下,2-N去除率随时间变化的趋势差异很大,随着初始c(Fe2+)由0.33 mmol/L增至10 mmol/L,k和CODCr去除率均呈先快速增大后基本不变的趋势,当c(Fe2+)>1 mmol/L时,继续提高c(Fe2+),k和CODCr去除率基本不再增大. 因为在Fenton试剂中,Fe2+作为催化剂有着至关重要的作用,随着c(Fe2+)的增加,可以激发H2O2释放出更多的·OH,从而提高Fenton试剂对2-N的降解效率[36]. 但当c(Fe2+)增加到一定值,体系中的H2O2已基本完全分解,多余的Fe2+甚至会与·OH发生反应(·OH + Fe2+→ Fe3++ OH-),反而使·OH浪费,不能有效分解有机污染物. 另外,若初始c(Fe2+)太高,会在反应后期产生较多铁泥,增加了Fenton降解2-N的负担. 因此,初始c(Fe2+)为1.0 mmol/L是较为合适的投加量.
2.4 初始ρ(2-N)的影响
在初始pH为3.0、c(H2O2)为10 mmol/L、c(Fe2+)为1 mmol/L、室温(20±1 ℃)条件下,不同初始ρ(2-N)对Fenton氧化降解2-N的影响结果如图4所示. 对不同初始ρ(2-N)时2-N的降解情况进行一级、伪一级和二级动力学拟合,二级动力学拟合的相关性最佳,根据k及反应最终CODCr去除率的比较,进一步分析初始ρ(2-N)对该反应的影响,如表5所示.
ρ(2-N)/(mg/L): 1—25; 2—50; 3—100; 4—150; 5—200; 6—250.图4 初始ρ(2-N)对2-N去除率的影响Fig.4 Effect of initial ρ(2-N) on 2-N removal rate

ρ(2-N)∕(mg∕L)k∕min-1R2CODCr去除率∕%250.01100.992675.00500.00820.995470.231000.00590.996169.581500.00420.996370.222000.00230.996268.222500.00200.995267.52
由图4及表5可以看出,随着初始ρ(2-N)由25 mg/L增至250 mg/L,k逐渐减小,呈良好的线性关系,最终的2-N和CODCr去除率相差不大. 随着初始ρ(2-N)的升高,初始氧化降解速率逐渐变慢,究其原因,可能是Fenton试剂的氧化降解速度非常快,当初始ρ(2-N)较低时,Fenton试剂可以充分发挥作用,将低浓度的2-N快速降解,但是当初始ρ(2-N)较高时,Fenton试剂在反应一开始只能将大部分2-N快速降解,随着反应时间的增加才能慢慢降解,因此,反应速率随着初始ρ(2-N)增加呈现递减规律,但最终的 2-N 和CODCr去除率没有明显差异.
2.5 温度的影响
在初始pH为3.0,初始ρ(2-N)为100 mg/L,c(H2O2)为10 mmol/L,c(Fe2+)为1 mmol/L条件下,不同的温度对Fenton氧化降解2-N的影响结果如图5所示. 对不同温度下的降解情况进行一级、伪一级和二级动力学拟合,二级动力学拟合的相关性最佳,根据k及反应最终CODCr去除率的比较,进一步分析反应温度对该反应的影响,如表6所示.

温度/℃: 1—10; 2—20; 3—30; 4—40; 5—50.图5 温度对2-N去除率的影响Fig.5 Effect of temperature on 2-N removal rate
温度∕℃k∕min-1R2CODCr去除率∕%100.00360.975652.01200.01400.978578.36300.04000.973379.66400.06110.981186.32500.34800.9866100.00
由图5可见,随着反应温度的升高,2-N的降解速率明显加快,反应温度为50 ℃时,反应5 min后2-N 的去除率已经达到98.95%. 在不同反应温度下,Fenton试剂降解2-N的过程均符合二级动力学模型. 且由表6可明确看出,随着温度的升高,k和CODCr去除率均有明显升高,究其原因,温度的升高可以提高·OH 的生成速率[20],使整体反应速率加快,使2-N的去除效率增大.
同时,根据阿伦纽斯方程(Arrhenius equation)可计算反应活化能,该方程表达了反应温度(T)和特定的反应速率(kobs)之间的关系[37],表示如下:
式中:A为指前因子(或振动因子);Ea为活化能,J/mol;R表示理想气体常数,8.314 J/(mol·K);T为绝对温度,K.
由于该研究中使用的温度范围较窄(10~50 ℃),2-N降解反应中的指前因子和经验阿伦纽斯表达式的活化能的变化可以忽略不计. 可将lnkobs与1/T进行线性拟合,如图6所示.
图6 Fenton氧化降解2-N过程中ln kobs与1/T的线性拟合Fig.6 Plot of ln kobs-(1/T) for the degradation of 2-N by Fenton oxidation process
由图6可见,lnkobs与1/T的线性关系良好(R2=0.992 0),由线性方程(y=-3.635 6x+8.210 2)可得:
根据阿伦纽斯方程,可得活化能Ea为30.23 kJ/mol,一般来说,普通的热反应,反应活化能在60~250 kJ/mol[38- 39]之间,所以,Fenton氧化2-N对活化能要求较低,相比同类其他化合物而言,Fenton氧化降解2-N较容易实现,因此,采用Fenton法处理2-N废水是适合并高效的.
2.6 Fenton氧化2-N的机理
在初始pH为3.0,c(H2O2)为10 mmol/L,c(Fe2+)为1 mmol/L,室温(20±1 ℃)条件下,设定初始ρ(2-N)为100 mg/L,来研究Fenton氧化2-N的降解途径. 分别在反应进行1、3、5、10、20、30 min时,通过GC-MS测定有机物的成分变化,中间转化物质质谱图如图7所示.
根据质谱鉴定结果(见图7),反应进行至3 min时的中间产物主要为2-硝基- 4-甲氧基苯酚〔见图7(a)〕. 因2-N上三种取代基中—NH2附近电子云密度最高,因此·OH首先攻击—NH2,—NH2被氧化为羟基(—OH),因此反应生成2-硝基- 4-甲氧基苯酚. 当反应进行至5 min时,新生成的物质可能为间甲氧基硝基苯〔见图7(b)〕,由于苯环上硝基附近电子云密度最低,硝基苯类物质十分稳定,因此2-硝基- 4-甲氧基苯酚转化为间甲氧基硝基苯. 反应进行至10 min时,鉴定结果主要为苯酚等物质〔见图7(c)〕,苯环上的硝基被·OH进攻后发生羟基取代反应,因而生成苯酚[40- 42]. 同时,可能还会有醌类物质生成,如图7(d)所示,主要因为羟基增加了苯环上的电子云密度,诱使·OH攻击苯环,使其发生脱氢反应,生成醌类[43- 44]. 由反应进行至20~30 min时,质谱鉴定结果为烷烃或羧酸等,如图7(e)(f)所示,也可能为其余短链杂质. 主要是因为生成的醌类物质不稳定,被·OH进一步攻击后,断裂开环[45]. 另外,通过预测的标准物质使用HPLC进行检测,也检测了一些小分子酸,如乙二酸、乙酸、甲酸等.
综上,在Fenton氧化降解2-N的过程中,Fenton体系所产生的·OH先攻击苯环上的—NH2,使其氧化生成2-硝基- 4-甲氧基苯酚,然后,进一步攻击苯环上的羟基,从而生成间甲氧基硝基苯,并进而转化为苯酚. 由于羟基增加了苯环上的电子云密度,诱使·OH攻击苯环,使其发生脱氢反应,因此生成苯醌类物质,进而断裂开环,生成一系列小分子酸等物质,最终降解为二氧化碳和水.
图7 2-N降解过程中转化物质质谱图Fig.7 Mass spectra of converted substances during the degradation of 2-N
3 结论
a) Fenton氧化降解2-N效果显著,各试验组分别在初始pH为3.0、初始c(H2O2)为10 mmolL、初始c(Fe2+)为1 mmolL、初始温度为50 ℃、ρ(2-N)为100 mgL时2-N的去除率相对最高,其降解过程均符合二级动力学模型;
b) 2-N去除率随温度升高而增大,基于在不同温度下的速率常数,推导出了2-N降解的阿伦纽斯(Arrhenius Equation)经验表达式,得到Fenton降解2-N 的活化能为30.23 kJmol.
c) Fenton氧化2-N的降解机理主要为,2-N首先被氧化生成2-硝基- 4-甲氧基苯酚,然后生成间甲氧基硝基苯和苯酚,继而生成苯醌类物质,进而断裂开环,生成乙二酸、乙酸、甲酸等小分子酸,最终降解为二氧化碳和水.
[1] RAVIKUMAR C,HUBERT J I.Electronic absorption and vibrational spectra and nonlinear optical properties of 4-methoxy- 2-nitroaniline[J].Physical Chemistry Chemical Physics,2010,12(32):9452- 9460.
[2] ROSLI M M,PATIL P S,FUN H K,etal.4-methoxy- 2-nitroaniline[J].Acta Crystallographica,2007,63(2):1039- 1040.
[3] OTURAN M A,PEIROTEN J,CHARTRIN P,etal.Complete destruction ofp-nitrophenol in aqueous medium by electro-Fenton method[J].Environmental Science & Technology,2000,34(16):3474- 3479.
[4] SAUPE A.High-rate biodegradation of 3- and 4-nitroaniline[J].Chemosphere,1999,39(13):2325- 2346.
[5] 郝艳霞,苏砚溪.溶剂法合成2-硝基- 3-甲氧基苯胺的研究[J].煤炭与化工,2003(2):25- 26. HAO Yanxia,SU Yanxi.Study on the synthesis of 2-nitro-p-methoxyaniliine by method of solvent[J].Coal and Chemical Industry,2003(2):25- 26.
[6] 司红强,刘秀杰,何鑫,等.2-硝基- 3-甲氧基苯胺的合成[J].天津理工大学学报,2009,25(2):19- 21. SI Hongqiang,LIU Xiujie,HE Xin,etal.Synthesis of 2-nitro- 4-methoxyaniline[J].Journal of Tianjin University of Technology,2009,25(2):19- 21.
[7] 刘德龙,窦艳,高云,等.奥美拉唑中间体2-硝基- 3-甲氧基苯胺的制备[J].江苏师范大学学报(自然科学版),2003,21(4):25- 27. LIU Delong,DOU Yan,GAO Yun,etal.The synthesis of the intermediate of omeprazole of N-(2-nitro- 4-methoxy) phenyIamine[J].Journal of Jiangsu Normal University(Natural Science Edithon),2003,21(4):25- 27.
[8] KHALAJI A D,NIKOOKAR M,DAS D.Co(Ⅲ),Ni(Ⅱ),and Cu(Ⅱ) complexes of bidentate N,O-donor schiff base ligand derived from 3-methoxy- 2-nitroaniline and salicylaldehyde[J].Journal of Thermal Analysis and Calorimetry,2014,115(1):409- 417.
[9] CONTRERAS R H,KOWALEWSKI D G D,FACELLI J C.The NMR analysis of the methoxy-group conformation in 4-methoxy- 2-nitroaniline[J].Journal of Molecular Structure,1982,81(1):147- 149.
[10] GU Bing,JI Wei,HUANG Xiaoqin,etal.Concentration-dependent two-photon absorption and subsequent excited-state absorption in 4-methoxy- 2-nitroaniline[J].Journal of Applied Physics,2009,106(3):1245.
[11] RAVIKUMAR C,HUBERT J I.Electronic absorption and vibrational spectra and nonlinear optical properties of 4-methoxy- 2-nitroaniline[J].Physical Chemistry Chemical Physics,2010,12(32):9452- 9460.
[12] PIGNATELLO J J,OLIVEROS E,MACKAY A.Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J].Critical Reviews in Environmental Science & Technology,2006,36(1):1- 84.
[13] TSUBOKURA Y,ASO S,KOGA T,etal.Combined repeated dose and reproductivedevelopmental toxicity screening test of 3-methoxy- 2-nitroaniline in rats[J].Drug and Chemical Toxicology,2015,38(4):361- 374.
[14] ANDREOZZI R,CAPRIO V,INSOLA A,etal.Advanced oxidation processes (AOP) for water purification and recovery[J].Catalysis Today,1999,53(1):51- 59.
[15] XU Xiangrong,LI Huabin,WANG Wenhua,etal.Degradation of dyes in aqueous solutions by the Fenton process[J].Chemosphere,2004,57(7):595- 600.
[16] NEYENS E,BAEYENS J.A review of classic Fenton′s peroxidation as an advanced oxidation technique[J].Journal of Hazardous Materials,2003,98(1):33- 50.
[17] BALLESTEROS MARTIN M M,SANCHEZ PEREZ J A,CASAS LOPEZ J L,etal.Degradation of a four-pesticide mixture by combined photo-Fenton and biological oxidation[J].Water Research,2009,43(3):653- 660.
[18] ZIMBRON J A,REARDON K F.Hydroxyl free radical reactivity toward aqueous chlorinated phenols[J].Water Research,2005,39(5):865- 869.
[19] DUESTERBERG C K,WAITE T D.Process optimization of Fenton oxidation using kinetic modeling[J].Environmental Science & Technology,2006,40(13):4189- 4195.
[20] ZAZO J A,CASAS J A,MOHEDANO A F,etal.Chemical pathway and kinetics of phenol oxidation by Fenton′s reagent[J].Environmental Science & Technology,2005,39(23):9295- 9302.
[21] ZHANG Qinqin,WANG Chuan,LEI Yangming.Fenton′s oxidation kinetics,pathway,and toxicity evaluation of diethyl phthalate in aqueous solution[J].Journal of Advanced Oxidation Technologies,2016,19(1):125- 133.
[22] MASOMBOON N,RATANATAMSKUL C,LU M C.Chemical oxidation of 2,6-dimethylaniline by electrochemically generated Fenton’s reagent[J].Journal of Hazardous Materials,2010,176(1):92- 98.
[23] SUN Jinhui,SUN Shengpeng,FAN Maohong,etal.A kinetic study on the degradation ofp-nitroaniline by Fenton oxidation process[J].Journal of Hazardous Materials,2007,148(1):172- 177.
[24] SUN Shengpeng,LI Chengjie,SUN Jianhui,etal.Decolorization of an azo dye Orange G in aqueous solution by Fenton oxidation process:effect of system parameters and kinetic study[J].Journal of Hazardous Materials,2009,161(2):1052- 1057.
[25] XU Hang,YU Tianlong,WANG Jianxu,etal.Online monitoring of Fenton-mediated reactive red 6B oxidation kinetics[J].Environmental Progress & Sustainable Energy,2015,34(4):1019- 1027.
[26] YOON I H,YOO G,HONG H J,etal.Kinetic study for phenol degradation by ZVI-assisted Fenton reaction and related iron corrosion investigated by X-ray absorption spectroscopy[J].Chemosphere,2016,145(2):409- 415.
[27] GARCIA-RODRIGUEZ O,BANUELOS J A,EL-GHENYMY A,etal.Use of a carbon felt-iron oxide air-diffusion cathode for the mineralization of Malachite Green dye by heterogeneous electro-Fenton and UVA photoelectro-Fenton processes[J].Journal of Electroanalytical Chemistry,2016,767(4):40- 48.
[28] OU Xiaoxia,WANG Chong,SU Yan,etal.Degradation of rhodamine B in aqueous solution by Fenton′s reagent[J].Advanced Materials Research,2011,233235(5):737- 740.
[29] TROVO A G,HASSAN A K,SILLANPAA M,etal.Degradation of acid blue 161 by Fenton and photo-Fenton processes[J].International Journal of Environmental Science & Technology,2016,13(1):147- 158.
[30] SCHWAAB M,LEMOS L P,PINTO J C.Optimum reference temperature for reparameterization of the Arrhenius Equation:Part 2.problems involving multiple reparameterizations[J].Chemical Engineering Science,2008,63(11):2895- 2906.
[31] YUN W K,HWANG K Y.Effects of reaction conditions on the oxidation efficiency in the Fenton process[J].Water Research,2000,34(10):2786- 2790.
[32] BENITEZ F J,ACERO J L,REAL F J,etal.The role of hydroxyl radicals for the decomposition ofp-hydroxy phenylacetic acid in aqueous solutions[J].Water Research,2001,35(5):1338- 1343.
[33] 吴彦瑜,覃芳慧,赖杨兰,等.Fenton试剂对垃圾渗滤液中腐殖酸的去除特性[J].环境科学研究,2010,23(1):94- 99. WU Yanyu,QIN Fanghui,LAI Yanglan,etal.Removal performance of humic substances in landfill leachate by Fenton reagent[J].Research of Environmental Sciences,2010,23(1):94- 99.
[34] SAINI R,KUMAR MONDAL M,KUMAR P.Fenton oxidation of pesticide methyl parathion in aqueous solution:kinetic study of the degradation[J].Environmental Progress & Sustainable Energy,2017,36(2):420- 427.
[35] KANG N,LEE D S,YOON J.Kinetic modeling of Fenton oxidation of phenol and monochlorophenols[J].Chemosphere,2002,47(9):915- 924.
[36] 张冬梅,刘蕾,褚衍洋.电-Fenton氧化降解2,4-二氯酚[J].环境科学研究,2012,25(9):1041- 1046. ZHANG Dongmei,LIU Lei,CHU Yanyang.Degradation of 2,4-dichlorophenol by electro-Fenton oxidation process[J].Research of Environmental Sciences,2012,25(9):1041- 1046.
[38] CHEN Jianxin,ZHU Lizhong.Heterogeneous UV-Fenton catalytic degradation of dyestuff in water with hydroxyl-Fe pillared bentonite[J].Catalysis Today,2007,126(3):463- 470.
[39] WANG Haoyi,HU Yunan,CAO Guiping,etal.Degradation of propylene glycol wastewater by Fenton′s reagent in a semi-continuous reactor[J].Chemical Engineering Journal,2011,170(1):75- 81.
[40] 赵曦蕾.Fenton法降解对硝基苯酚的机理研究[D].南京:南京理工大学,2014.
[41] FU Liting,ZHAO Zhenwen,MA Jiahai,etal.Cavity-confined acceleration of iron cycle for the Fenton-like reaction byβ-CD-benzoquinone host-guest complex under visible irradiation[J].Catalysis Communications,2015,65(5):96- 101.
[42] SALGADO PR,MELIN V,DURAN Y,etal.The reactivity and reaction pathway of Fenton reactions driven by substituted 1,2- dihydroxybenzenes[J].Environmental Science & Technology,2017,51(7):3687- 3693.
[43] LI Ying,ZHANG Pei,WU Mingzhu,etal.An effective oxidation of 2,3,6-trimethylphenol to 2,3,5-trimethylbenzoquinone using Fenton’s reagent under mild conditions[J].Chemical Engineering Journal,2009,146(2):270- 274.
[44] 贺俊梅,孔令娜,梁倩,等.苯醌类与苯醌亚胺类在日光Fenton体系中的光敏性[J].中国环境科学,2016,36(9):2638- 2644. HE Junmei,KONG Lingna,LIANG Qian,etal.Photosensitivity of benzoquinones and benzoquinoneimines in the sunlightFenton system[J].China Environmental Science,2016,36(9):2638- 2644.
[45] LIU Yucan,ZHANG Guangming,FANG Shunyan,etal.Degradation of aniline by heterogeneous Fenton’s reaction using a Ni-Fe oxalate complex catalyst[J].Journal of Environmental Management,2016,182(11):367- 373.
Characteristics and Kinetics of Oxidative Degradation of 2-Nitro- 4-Methoxyaniline by Fenton Oxidation Process
GUO Ying1, CHEN Honghan1*, ZHANG Huanzhen1, PANG Hao2, WANG Hui1, WANG Ning1, CHANG Simiao1
1.Beijing Key Laboratory of Water Resources and Environmental Engineering, China University of Geosciences (Beijing), Beijing 100083, China 2.Beijing Z.D.H.K. Environmental Science & Technology Co., Ltd., Beijing 100120, China
X703.1
1001- 6929(2017)10- 1613- 09
A
10.13198/j.issn.1001- 6929.2017.02.85
2017-01-14
2017-06-12
国家自然科学基金项目(51238001)
郭莹(1990-),女,河南洛阳人,guoying1990@qq.com.
*责任作者,陈鸿汉(1956-),男,四川乐山人,教授,博士,博导,主要从事地下水污染评价与防治技术研究,chenhh@cugb.edu.cn
郭莹,陈鸿汉,张焕祯,等.Fenton氧化降解2-硝基- 4-甲氧基苯胺的特性和动力学特征[J].环境科学研究,2017,30(10):1613- 1621.
GUO Ying,CHEN Honghan,ZHANG Huanzhen,etal.Characteristics and kinetics of oxidative degradation of 2-nitro- 4-methoxyaniline by Fenton oxidation process[J].Research of Environmental Sciences,2017,30(10):1613- 1621.

