不同月份和海拔黄山松各器官全氮和全磷含量比较及其相关性和异速关系分析
范瑞瑞, 杨福春, 孙 俊, 李 曼, 钟全林, 程栋梁,①
(福建师范大学: a. 地理科学学院, b. 湿润亚热带山地生态国家重点实验室培育基地, c. 福建省植物生理生态重点实验室, 福建 福州 350007)
不同月份和海拔黄山松各器官全氮和全磷含量比较及其相关性和异速关系分析
范瑞瑞a,b,c, 杨福春a,b,c, 孙 俊a,b,c, 李 曼a,b,c, 钟全林a,b, 程栋梁a,b,c,①
(福建师范大学: a. 地理科学学院, b. 湿润亚热带山地生态国家重点实验室培育基地, c. 福建省植物生理生态重点实验室, 福建 福州 350007)
以江西武夷山国家级自然保护区内海拔1 200、1 600和2 000 m的黄山松(PinustaiwanensisHayata)为研究对象,分别对6月份和9月份叶、茎和细根的全氮和全磷含量及其比值进行比较,并进行Pearson相关性分析和异速关系分析。结果表明:与6月份相比,9月份黄山松叶和细根的全氮含量以及细根的全磷含量均升高,而茎的全氮含量及叶的全磷含量却显著降低。从均值来看,全氮含量在叶中最高、在细根中最低,全磷含量在茎中最高、在细根中最低。随海拔升高,叶全氮含量逐渐升高,叶全磷含量及茎全氮和全磷含量呈“降低—升高”的趋势,而细根全氮含量呈“升高—降低”的趋势,细根全磷含量逐渐升高。Pearson相关性分析结果表明:细根全氮含量与叶全磷含量呈极显著负相关,与茎全氮和全磷含量呈显著负相关;茎全氮含量与叶全氮含量及茎和叶全磷含量,叶全氮含量与茎和叶全磷含量,细根全氮含量与其全磷含量,以及茎全磷含量与叶全磷含量均呈极显著正相关。氮磷异速关系分析结果表明:在6月份,叶和细根的氮磷异速指数随海拔升高而逐渐减小,而茎的氮磷异速指数则随海拔升高而逐渐增大;在9月份,叶的氮磷异速指数在海拔1 600 m最小,而茎和细根的氮磷异速指数则在海拔1 600 m最大。总体来看,不同月份和海拔黄山松各器官的氮磷异速关系均达到显著或极显著水平,并且,黄山松叶、茎和细根的氮磷异速指数均较高,分别为0.79、0.83和0.78。研究结果显示:不同月份和海拔黄山松各器官中氮和磷的分配差异明显。
黄山松; 全氮; 全磷; 月份; 海拔; 相关性分析; 异速关系
Abstract: TakingPinustaiwanensisHayata at altitudes of 1 200, 1 600, and 2 000 m in Wuyishan National Nature Reserve of Jiangxi Province as research object, total nitrogen and total phosphorus contents and their ratio in leaf, stem and fine root in June and September were compared, respectively, and Pearson correlation analysis and allometric relationship analysis were conducted. The results show that compared with June, in September, total nitrogen content in leaf and fine root, and total phosphorus content in fine root ofP.taiwanensisincrease, while total nitrogen content in stem and total phosphorus content in leaf decrease significantly. On the view of mean, total nitrogen content in leaf is the highest and the lowest in fine root, total phosphorus content in stem is the highest and the lowest in fine root. With increasing of altitude, total nitrogen content in leaf increases gradually, total phosphorus content in leaf and total nitrogen and total phosphorus contents in stem appear the trend of “decreasing-increasing”, while total nitrogen content in fine root appears the trend of “increasing-decreasing”, and total phosphorus content in fine root increases gradually. The result of Pearson correlation analysis shows that there is an extremely significantly negative correlation of total nitrogen content in fine root with total phosphorus content in leaf, and significantly negative correlations with total nitrogen and total phosphorus contents in stem. There are extremely significantly positive correlations of total nitrogen content in stem with total nitrogen content in leaf and total phosphorus content in stem and leaf, total nitrogen content in leaf with total phosphorus content in stem and leaf, total nitrogen content in fine root with its total phosphorus content, and total phosphorus content in stem with that in leaf. The results of analysis on allometric exponent between nitrogen and phosphorus show that in June, with increasing of altitude, allometric exponents between nitrogen and phosphorus in leaf and fine root decrease gradually, while that in stem increases gradually; in September, allometric exponent between nitrogen and phosphorus in leaf at altitude of 1 600 m is the smallest, while that in stem and fine root at altitude of 1 600 m is the largest. On the whole, allometric relationships between nitrogen and phosphorus in different organs ofP.taiwanensisin different months and altitudes all reach the significant or extremely significant level. Besides, allometric exponents between nitrogen and phosphorus in leaf, stem, and fine root ofP.taiwanensisare high with values of 0.79, 0.83 and 0.78, respectively. It is suggested that there are obvious differences in allocation of nitrogen and phosphorus in different organs ofP.taiwanensisin different months and altitudes.
Keywords:PinustaiwanensisHayata; total nitrogen; total phosphorus; month; altitude; correlation analysis; allometric relationship
异速关系(allometric relationship)是指生物体形态结构、生理功能以及结构与功能间的相互联系,能够揭示某种或某类生物的部分与整体或部分与部分间的差异或对比关系[1-7]。植物性状间的异速关系是生态系统和植物进化关系共同影响的结果[8-12],在不同植物生态系统和植物群落间具有显著差异,说明植物在不同环境中的生长策略存在差异[5,8-11]。
植物的养分分配对陆地生态系统的物质和能量循环具有重要影响[12-14],各养分元素在不同器官的合理分配是植物响应及适应环境变化的重要机制。然而,植物不同器官的功能有较大差异,叶和根是碳同化和养分吸收的主要器官,茎是连接叶和根的重要媒介[15]。相关研究结果表明:植物不同器官的养分含量能够影响各器官的功能和生长以及植物自身的生长,并最终影响植物的生活史策略[7,16-18]。氮和磷是植物生长的重要限制性营养元素[19],二者的异速关系在不同植物中存在较大差异。Niklas等[20-21]的研究结果表明:冬菟葵〔Eranthishyemalis(Linn.) Salisb.〕等17种植物叶片的氮磷异速关系遵循3/4次幂法则;Wright等[22]和Reich等[23]的研究结果表明:供试植物叶片的氮磷异速关系遵循2/3次幂法则,并且其氮磷异速关系不受植物分类学限制,对不同科和属植物均适用。作者的相关研究结果(另文发表)表明:杉木〔Cunninghamialanceolata(Lamb.) Hook.〕、马尾松(PinusmassonianaLamb.)、刨花润楠(MachiluspauhoiKanehira)和闽楠〔Phoebebournei(Hemsl.) Yang〕叶片在生长期的呼吸速率显著大于非生长期,并且,不同生长期植物各器官对氮和磷的需求量有显著差异。然而,植物茎和细根的氮磷异速关系是否也遵循3/4次幂法则或者2/3次幂法则尚不清楚,有待深入研究。不同海拔区域的环境因子呈现连续梯度变化,基于不同海拔研究植物叶、茎和细根的氮磷异速关系变化特征不仅有助于揭示植物对气候变化的响应,还有助于研究全球气候变化与陆地生态系统的关系。
黄山松(PinustaiwanensisHayata)系中国特有种,为亚热带中山地区代表群落的建群种,也是研究生物多样性与植被演替的理想树种,在高山植被恢复、固碳、涵养水源及应对全球气候变化等方面具有重要价值。本研究以黄山松为实验材料,对6月份和9月份江西武夷山国家级自然保护区海拔1 200、1 600和2 000 m的黄山松叶、茎和细根的全氮和全磷含量及其比值进行比较,对黄山松叶、茎和细根的全氮和全磷含量进行Pearson相关性分析,并对不同月份和海拔各器官的氮磷异速关系进行分析,以期明确黄山松主要器官中氮和磷的分配规律及其对不同海拔的响应特征,为深入探讨黄山松的进化策略及其对环境的适应策略提供参考依据。
1 研究区自然概况和研究方法
1.1 研究区自然概况
江西武夷山国家级自然保护区的具体地理坐标为东经117°39′30″~117°55′47″、北纬27°48′11″~28°00′35″,海拔350.0~2 160.8 m,属中亚热带季风气候,年均温13.2 ℃~14.8 ℃,极端低温-14.2 ℃,极端高温36.3 ℃,年均降水量2 583 mm,无霜期231 d。该保护区土壤具有典型的亚热带中山土壤特点,海拔400~600 m区域的土壤为山地黄红壤,海拔600~1 300 m区域的土壤为山地黄壤,海拔1 300~1 900 m区域的土壤为山地暗黄棕壤,海拔1 900 m以上区域的土壤为山地草甸土[24]。
1.2 研究方法
1.2.1 样地设置 黄山松主要分布在江西武夷山国家级自然保护区内海拔900~2 000 m区域,在海拔1 200、1 600和2 000 m区域各设置1个典型的黄山松样地。在每个样地内划分3个面积20 m×20 m的样方,各样方间隔不小于20 m;在每个样方内划分4个面积10 m×10 m的小样方。对各样方内所有胸径大于等于5 cm的乔木进行挂牌,记录其胸径和树高等信息,并测定各样方的密度和郁闭度以及土壤的全氮和全磷含量。不同海拔黄山松样地的基本情况见表1。
样地内的木本植物主要有黄山松、木荷(SchimasuperbaGardn. et Champ.)、柃木(EuryajaponicaThunb.)、格药柃(E.muricataDunn)、贵定桤叶树(ClethracavalerieiLévl.)、马银花〔Rhododendronovatum(Lindl.) Planch. ex Maxim.〕、毛棉杜鹃花(R.moulmainenseHook. f.)、云锦杜鹃(R.fortuneiLindl.)、杉木〔Cunninghamialanceolata(Lamb.)Hook.〕、南方铁杉〔Tsugachinensisvar.tchekiangensis(Flous) Cheng et L. K. Fu〕和豆梨(PyruscalleryanaDecne.)等种类。


海拔/mAltitude郁闭度/%Canopydensity密度/hm-2Density平均胸径/cmMeandiameteratbreastheight平均树高/mMeanheight各土层全氮含量/mg·g-1Totalnitrogencontentindifferentsoillayers各土层全磷含量/mg·g-1Totalphosphoruscontentindifferentsoillayers0-10cm10-20cm0-10cm10-20cm120090±13160±24023.99±0.7916.19±0.466.62±0.433.62±0.110.19±0.010.14±0.01160082±42460±38014.53±0.4010.49±0.165.67±0.434.39±0.280.27±0.030.25±0.08200049±3930±15013.17±0.664.76±0.145.76±0.174.71±0.290.43±0.020.41±0.05
1.2.2 样品采集和处理 分别于2014年6月15日和9月22日在每个样方内选择3株树龄相近的黄山松标准木,在每株样株树冠四周随机选取具有成熟叶的5个当年生末端小枝,将叶和茎分开,同一样方的所有叶和茎分别混合并装入信封中,带回实验室。
在以树干为原点、半径约0.5 m的树冠区三等分线垂直地面上挖取3个长、宽、高均为20 cm的土块,同一样方的所有土块混合并装入密封袋中,带回实验室。将土块放入孔径0.15 mm的网袋中,用流水反复淘洗,收集直径小于2 mm的细根。
将黄山松的叶、茎和细根于105 ℃杀青30 min,并在60 ℃条件下烘干至恒质量,磨碎后,过筛(孔径小于0.25 mm),备用。
1.2.3 全氮和全磷含量测定 采用Vario EL Ⅲ碳氮元素分析仪(德国Elemental Analyzer公司)测定全氮含量;经H2SO4-H2O2消煮后,采用San++连续流动分析仪(荷兰Skalar公司)测定全磷含量。每个指标重复测定3次,结果取平均值。根据全氮和全磷含量计算N∶P比,并计算各指标的变异系数(CV)。
1.3 数据分析
采用SPSS 19.0统计分析软件对6月份和9月份黄山松叶、茎和细根的全氮和全磷含量进行t-test分析;采用单因素方差分析(one-way ANOVA)对不同海拔黄山松叶、茎和细根的全氮和全磷含量进行分析;并采用Pearson相关性分析法对不同月份和海拔黄山松叶、茎和细根的全氮和全磷含量进行分析。
计算黄山松叶、茎和细根全氮和全磷含量的算术平均值,并进行以10为底的对数转换,以降低误差并符合正态分布。采用异速生长方程“y=bxa”对同一器官的全氮和全磷含量进行拟合分析。式中,y为全氮含量,x为全磷含量,b为异速常数,a为异速指数。a=1时,全氮含量与全磷含量呈等速关系;a≠1时,全氮含量与全磷磷含量呈异速关系。使用R软件的smatr包,采用标准化主轴估计(standardized major axis estimation,SMA)法估算氮磷的异速指数和异速常数。
2 结果和分析
2.1不同月份黄山松各器官全氮和全磷含量及其比值分析
江西武夷山国家级自然保护区内不同月份黄山松叶、茎和细根的全氮和全磷含量及其比值的比较结果见表2。由表2可以看出:与6月份相比,9月份黄山松叶的全氮含量略升高,其变异系数(CV)却降低;全磷含量显著(P<0.05)降低,其CV值却明显升高;N∶P比(全氮含量与全磷含量的比值)显著升高,其CV值却明显降低。与6月份相比,9月份茎的全氮含量和N∶P比均显著降低,其CV值却明显升高或降低;全磷含量相同,其CV值却升高。与6月份相比,9月份细根的全氮含量显著升高,全磷含量和N∶P比略升高,其CV值均降低。
由表2还可以看出:从均值来看,全氮含量在叶中最高、在细根中最低,全磷含量在茎中最高、在细根中最低,N∶P比在细根中最高、在茎中最低;全氮含量的CV值在细根中最高、在叶中最低,全磷含量的CV值在茎中最高、在叶中最低,N∶P比的CV值在叶中最高、在茎中最低。
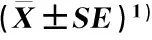

月份Month叶中全氮含量Totalnitrogencontentinleaf叶中全磷含量Totalphosphoruscontentinleaf叶中N∶P2)N∶P2)inleaf均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)614.51±0.35a12.581.19±0.02a10.5712.02±0.24b10.54914.98±0.33a11.561.00±0.02b14.9615.00±0.19a6.54均值Mean14.74±0.2412.061.10±0.0215.1913.51±0.2613.90月份Month茎中全氮含量Totalnitrogencontentinstem茎中全磷含量Totalphosphoruscontentinstem茎中N∶P2)N∶P2)instem均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)610.80±0.29a13.941.11±0.04a18.329.82±0.20a10.6499.51±0.29b15.811.11±0.04a19.228.63±0.11b6.54均值Mean10.15±0.2216.011.11±0.0318.599.23±0.1412.06月份Month细根中全氮含量Totalnitrogencontentinfineroot细根中全磷含量Totalphosphoruscontentinfineroot细根中N∶P2)N∶P2)infineroot均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)69.49±0.29b16.010.41±0.03a31.9724.10±0.84a18.04910.48±0.31a15.580.42±0.01a14.1224.81±0.38a8.01均值Mean9.98±0.2224.300.42±0.0116.4324.46±0.4613.77
1)同列中不同的小写字母表示相同器官同一指标在不同月份间差异显著(P<0.05) Different lowercases in the same column indicate the significant difference in the same index of the same organ among different months (P<0.05).
2)N∶P: 全氮含量与全磷含量的比值 Ratio of total nitrogen content to total phosphorus content.
3)CV: 变异系数 Coefficient of variance.
2.2不同海拔黄山松各器官全氮和全磷含量及其比值分析
江西武夷山国家级自然保护区内不同海拔黄山松叶、茎和细根的全氮和全磷含量及其比值的比较结果见表3。由表3可以看出:随海拔升高,黄山松叶的全氮含量显著(P<0.05)升高,其变异系数(CV)却逐渐降低;全磷含量呈“降低—升高”的趋势,并在海拔2 000 m显著高于海拔1 200和1 600 m,其CV值明显降低;N∶P比(全氮含量与全磷含量的比值)呈“升高—降低”的趋势,并在海拔1 600 m显著高于海拔1 200 m,其CV值明显降低。随海拔升高,茎的全氮和全磷含量均呈“降低—升高”的趋势,并在海拔1 600 m显著低于海拔1 200和2 000 m,其CV值分别呈“升高—降低”和逐渐降低的趋势;N∶P比呈“升高—降低”的趋势,其CV值呈“降低—升高”的趋势。随海拔升高,细根的全氮含量及其CV值均呈“升高—降低”的趋势,并在海拔1 600 m高于海拔1 200和2 000 m;全磷含量及其CV值呈逐渐升高的趋势,并在海拔2 000 m显著高于海拔1 200和1 600 m;N∶P比呈逐渐降低的趋势,并在海拔2 000 m显著低于海拔1 200和1 600 m,其CV值却呈逐渐升高的趋势。
由表3还可以看出:不同海拔叶的全氮含量均高于茎和细根,细根的全磷含量均低于叶和茎,并且,细根的N∶P比最高,茎的N∶P比最低。
2.3 黄山松各器官全氮和全磷含量的相关性分析
Pearson相关性分析结果(表4)表明:黄山松叶全氮含量与茎全氮和全磷含量及叶全磷含量呈极显著(P<0.01)正相关,相关系数分别为 0.557、0.509和0.601;茎全氮含量与叶全磷含量和茎全磷含量呈极显著正相关,相关系数分别为0.756和0.838;细根全氮含量与细根全磷含量以及叶全磷含量与茎全磷含量呈极显著正相关,相关系数分别为0.681和0.491。另外,细根全氮含量与叶全磷含量呈极显著负相关,相关系数为-0.456;与茎全氮和全磷含量呈显著(P<0.05)负相关,相关系数分别为-0.340和-0.284。
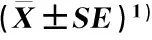
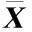

海拔/mAltitude叶中全氮含量Totalnitrogencontentinleaf叶中全磷含量Totalphosphoruscontentinleaf叶中N∶P2)N∶P2)inleaf均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)120013.50±0.44c13.951.06±0.05b20.3712.99±0.49b15.78160014.70±0.32b9.101.04±0.04b14.5614.35±0.42a12.33200016.03±0.25a6.611.19±0.01a3.7713.19±0.37ab7.67海拔/mAltitude茎中全氮含量Totalnitrogencontentinstem茎中全磷含量Totalphosphoruscontentinstem茎中N∶P2)N∶P2)instem均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)12009.83±0.31b13.281.10±0.05b17.729.13±0.32a15.0716008.99±0.31c14.770.95±0.04c15.799.45±0.19a8.53200011.64±0.22a8.131.29±0.03a9.309.09±0.19a8.87海拔/mAltitude细根中全氮含量Totalnitrogencontentinfineroot细根中全磷含量Totalphosphoruscontentinfineroot细根中N∶P2)N∶P2)infineroot均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)均值/mg·g-1 MeanCV/%3)12009.84±0.32a13.710.37±0.01b12.2226.67±0.34a5.46160010.11±0.49a20.590.41±0.02b21.1925.02±0.63a10.4420009.99±0.35a14.800.48±0.03a26.8921.68±0.83b16.13
1)同列中不同的小写字母表示相同器官同一指标在不同海拔间差异显著(P<0.05) Different lowercases in the same column indicate the significant difference in the same index of the same organ among different altitudes (P<0.05).
2)N∶P: 全氮含量与全磷含量的比值 Ratio of total nitrogen content to total phosphorus content.
3)CV: 变异系数 Coefficient of variance.
表4黄山松各器官全氮及全磷含量的Pearson相关性分析1)
Table4PearsoncorrelationanalysisontotalnitrogenandtotalphosphoruscontentsindifferentorgansofPinustaiwanensisHayata1)

指标In-dex相关系数 CorrelationcoefficientTNLTNSTNFRTPLTPSTPFRTNL1.000TNS0.557**1.000TNFR-0.261-0.340*1.000TPL0.601**0.756**-0.456**1.000TPS0.509**0.838**-0.284*0.491**1.000TPFR-0.0050.0730.681**-0.102-0.0501.000
1)TNL: 叶全氮含量 Total nitrogen content in leaf; TNS: 茎全氮含量 Total nitrogen content in stem; TNFR: 细根全氮含量 Total nitrogen content in fine root; TPL: 叶全磷含量 Total phosphorus content in leaf; TPS: 茎全磷含量 Total phosphorus content in stem; TPFR: 细根全磷含量 Total phosphorus content in fine root. *:P<0.05; ** :P<0.01.
2.4不同月份和海拔黄山松各器官的氮磷异速关系分析
不同月份和海拔黄山松各器官的氮磷异速关系分析结果见表5。由表5可以看出:在6月份,黄山松叶的氮磷异速指数随海拔升高而逐渐减小,异速常数却随海拔升高而逐渐增大,并且,叶的氮磷异速关系在海拔1 200和1 600 m达到极显著(P<0.01)水平;茎的氮磷异速指数随海拔升高而逐渐增大,异速常数随海拔升高略增大,并且,各海拔茎的氮磷异速关系均达到极显著水平;细根的氮磷异速指数和异速常数均随海拔升高而逐渐减小,并且,各海拔细根的氮磷异速关系均达到极显著水平。
表5不同月份和海拔黄山松各器官的氮磷异速关系分析1)
Table5AnalysisonallometricrelationshipbetweennitrogenandphosphorusindifferentorgansofPinustaiwanensisHayataindifferentmonthsandaltitudes1)

海拔/mAltitude6月份叶的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinleafinJune9月份叶的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinleafinSeptemberabR2abR212001.381.010.92**0.711.160.64*16001.051.100.73**0.701.190.76**2000-0.761.240.051.011.150.04海拔/mAltitude6月份茎的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinsteminJune9月份茎的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinsteminSeptemberabR2abR212000.570.990.65**0.590.940.57*16000.580.990.66**1.140.970.82**20000.931.000.76**0.710.960.61*海拔/mAltitude6月份细根的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinfinerootinJune9月份细根的氮磷异速关系AllometricrelationshipbetweennitrogenandphosphorusinfinerootinSeptemberabR2abR212001.111.480.82**1.911.790.70**16001.061.450.64**1.261.460.96**20000.591.150.98**1.441.560.80**
1)a: 异速指数 Allometric exponent;b: 异速常数 Allometric constant;R2: 相关系数 Correlation coefficient. *:P<0.05; ** :P<0.01.
由表5还可以看出:在9月份,黄山松叶的氮磷异速指数在海拔1 600 m最小,而异速常数却在海拔1 600 m最大,并且,叶的氮磷异速关系在海拔1 200和1 600 m分别达到显著(P<0.05)和极显著水平;茎的氮磷异速指数和异速常数均在海拔1 600 m最大,并且,各海拔茎的氮磷异速关系均达到显著或极显著水平;细根的氮磷异速指数和异速常数均在海拔1 600 m最小,并且,各海拔细根的氮磷异速关系均达到极显著水平。
将所有海拔和月份黄山松叶、茎和细根的氮磷异速关系进行综合分析。结果表明:黄山松叶的氮磷异速指数为0.79,异速常数为1.14;茎的氮磷异速指数为0.83,异速常数为0.97;细根的氮磷异速指数为0.78,异速常数为1.30。并且,各器官的氮磷异速关系均达到极显著水平。
3 讨论和结论
3.1 黄山松不同生长期全氮和全磷含量的变化分析
动态平衡理论认为生物体具有控制体内化学元素(如各种养分)相对稳定的能力,以确保体内的元素组成不会随环境改变而发生剧烈变化,并能够在相对狭窄的范围内维持恒定[25-26]。植物不同器官氮和磷含量的稳定性存在明显差异。一般认为,各器官中氮含量的稳定性高于磷含量,并且,二者在叶中的稳定性高于茎和根[27-29]。本研究中,黄山松叶和茎全氮含量的平均变异系数均小于全磷含量,并且,叶全氮和全磷含量的平均变异系数均小于茎和细根,说明黄山松体内的氮含量较磷含量更稳定,并且,氮和磷含量在叶中最稳定。相关研究表明:茎的组织密度较高,生长缓慢,其养分含量较低[30-31]。然而,黄山松茎的全氮和全磷含量均较高,这可能是因为本研究选择的是当年生小枝,其生命活力较旺盛[32],因此,养分含量较高。
植物不同器官的氮和磷含量与其自身功能结构和生长节律密切相关[25]。在生长初期,植物叶的生长速率较大,叶内需要积累大量的营养物质用于叶的形态建成,根系从土壤中吸收的养分无法满足叶的需要,导致叶的养分含量下降[33];在生长后期,叶的生长基本停止,植物为了提高自身的代谢强度,叶的养分含量略有升高[26]。在6月份(生长初期),黄山松叶的全氮含量略低于9月份(生长后期),而叶的全磷含量却显著高于9月份。相关研究结果表明:不同生活型植物对环境的适应方式存在差异,其资源利用效率也存在一定差异[34]。牛得草等[35]认为,植物叶的氮含量主要受植物种类或其与采样时间的综合影响,叶的磷含量主要受生长季节的影响;刘万德等[36]认为,植物叶的氮含量主要受植物所处生长阶段的影响,而叶的磷含量主要受植物种类和生长阶段的综合影响。综上所述,植物叶的全氮和全磷含量受多种因素的综合影响。
Kerkhoff等[16]的研究结果表明:不同海拔区域的气候、土壤和植物形态差异较大,能够强烈影响种子植物体内氮和磷在不同器官中的分配。黄山松茎的全氮和全磷含量在海拔1 600 m最低,并在海拔2 000 m最高;叶的全氮含量以及细根的全磷含量均随海拔升高而逐渐增大。在高海拔地区,受低温和干旱等环境条件的影响,植物种类减少、林分密度较低,植物个体的生存空间增大,能够维持较高的碳同化产物[37],这可能是高海拔区域黄山松叶、茎和细根的全氮和全磷含量较高的原因之一。
3.2 黄山松不同器官的氮磷异速关系分析
一般认为,植物叶中氮和磷含量的稳定性较茎和根更高[17],并且,植物的氮磷异速关系在不同代谢器官和结构器官中存在差异[16]。叶是植物进行光合作用的主要器官,不同植物种类叶的氮磷异速关系差异显著[38-39],其异速指数也存在显著差异。Niklas等[20-21]认为,植物叶的氮磷异速指数约为3/4;Wright等[5]、Reich等[23]及Han等[40]认为,植物叶的氮磷异速指数为2/3;Kerkhoff等[16]和Reich等[41]认为,植物叶的氮磷异速指数分别为0.72和0.70;Zhao等[15]和Kerkhoff等[16]认为,植物茎的氮磷异速指数分别为0.70和0.71。本研究中,黄山松叶和茎的氮磷异速指数分别为0.79和0.83,显著高于上述研究结果,这可能是因为:首先,本研究选用的是单一树种(黄山松)的当年生小枝,茎和叶的养分流动较活跃,在植株发育过程中,氮含量较低的非代谢活性部分(如心材)逐渐积累,致使植株整体氮含量逐渐减小[11];其次,本研究与其他研究涉及的植物生长地环境、气候及生长策略等均存在差异。
本研究中,6月份和9月份黄山松不同器官的氮磷异速指数存在明显差异,海拔对黄山松不同器官的氮磷异速关系也有显著影响,表明黄山松的氮磷异速关系在不同生长期对周围环境的响应存在差异。此外,不同生长型植物的氮磷异速关系对环境变化的响应也明显不同[42]。不同植物对养分需求的差异不仅受环境因子影响,也可能与植物自身的生长发育特征密切相关[43]。本研究中,6月份和9月份黄山松叶的氮磷异速指数在海拔2 000 m分别为-0.76和1.01,可见,二者的氮磷异速关系明显不同,这可能是因为在高海拔区域植物的生长条件较为苛刻,黄山松为适应生境改变了叶片固有的养分平衡机制。
3.3 结论
综上所述,不同月份和海拔黄山松各器官中氮和磷的分配差异明显。然而,不同器官中氮和磷的分配差异究竟是养分分配的保守性所致还是植物自身的适应性调整所致,至今尚无明确结论。探究不同养分在植物主要器官的分配以及植物不同养分分配方式对环境的响应,将是今后研究的重要方向。
[1] ENQUIST B J, BROWN J H, WEST G B. Allometric scaling of plant energetics and population density[J]. Nature, 1998, 395: 163-165.
[2] 马玉珠, 程栋梁, 钟全林, 等. 中国森林凋落物不同组分异速比例关系[J]. 植物生态学报, 2013, 37(12): 1071-1079.
[3] BROWN J H, GILLOOLY J F, ALLEN A P, et al. Toward a metabolic theory of ecology[J]. Ecology, 2004, 85(7): 1771-1789.
[4] PRICE C A, WEITZ J S, SAVAGE V M, et al. Testing the metabolic theory of ecology[J]. Ecology Letters, 2012, 15: 1465-1474.
[5] WRIGHT I J, REICH P B, WESTOBY M, et al. The worldwide leaf economics spectrum[J]. Nature, 2004, 428: 821-827.
[6] XIANG S, REICH P B, SUN S, et al. Contrasting leaf trait scaling relationships in tropical and temperate wet forest species[J]. Functional Ecology, 2013, 27: 522-534.
[7] YANG X, TANG Z, JI C, et al. Scaling of nitrogen and phosphorus across plant organs in shrubland biomes across Northern China[J]. Scientific Reports, 2014, 4: 5448.
[8] REICH P B, WALTERS M B, ELLSWORTH D S. From tropics to tundra: global convergence in plant functioning[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(25): 13730-13734.
[9] MCGRODDY M E, DAUFRESNE T, HEDIN L O. Scaling of C∶N∶P stoichiometry in forests worldwide: implications of terrestrial redfield-type ratios[J]. Ecology, 2004, 85(9): 2390-2401.
[10] KERKHOFF A J, ENQUIST B J, ELSER J J, et al. Plant allometry, stoichiometry and the temperature-dependence of primary productivity[J]. Global Ecology and Biogeography, 2005, 14(6): 585-598.
[11] ÅGREN G I. Stoichiometry and nutrition of plant growth in natural communities[J]. Annual Review of Ecology Evolution and Systematics, 2008, 39: 153-170.
[12] ÅGREN G I. The C∶N∶P stoichiometry of autotrophs: theory and observations[J]. Ecology Letters, 2004, 7: 185-191.
[13] ELSER J J, BRACKEN M E S, CLELAND E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems[J]. Ecology Letters, 2007, 10: 1135-1142.
[14] HEBERLING J M, FRIDLEY J D. Biogeographic constraints on the world-wide leaf economics spectrum[J]. Global Ecology and Biogeography, 2012, 21(12): 1137-1146.
[15] ZHAO N, YU G, HE N, et al. Invariant allometric scaling of nitrogen and phosphorus in leaves, stems, and fine roots of woody plants along an altitudinal gradient[J]. Journal of Plant Research, 2016, 129(4): 647-657.
[16] KERKHOFF A J, FAGAN W F, ELSER J J, et al. Phylogenetic and growth form variation in the scaling of nitrogen and phosphorus in the seed plants[J]. The American Naturalist, 2006, 168(4): E103-E122.
[17] MINDEN V, KLEYER M. Internal and external regulation of plant organ stoichiometry[J]. Plant Biology, 2014, 16(5): 897-907.
[18] WESTOBY M, FALSTER D S, MOLES A T, et al. Plant ecological strategies: some leading dimensions of variation between species[J]. Annual Review of Ecology and Systematics, 2002, 33 (1): 125-159.
[19] CHENG D L,WANG G X, LI T, et al. Relationships among the stem, aboveground and total biomass across Chinese forests[J]. Journal of Integrative Plant Biology, 2007, 49(11): 1573-1579.
[20] NIKLAS K J, COBB E D. N, P, and C stoichiometry ofEranthishyemalis(Ranunculaceae) and the allometry of plant growth[J]. American Journal of Botany, 2005, 92(8): 1256-1263.
[21] NIKLAS K J. A phyletic perspective on the allometry of plant biomass-partitioning patterns and functional equivalent organ-categories[J]. New Phytologist, 2006, 171(1): 27-40.
[22] WRIGHT I J, REICH P B, CORNLISSEN J H C, et al. Assessing the generality of global leaf trait relationships[J]. New Phytologist, 2005, 166(2): 485-496.
[23] REICH P B, OLEKSYN J, WRIGHT I J, et al. Evidence of a general 2/3-power law of scaling leaf nitrogen to phosphorus among major plant groups and biomes[J]. Proceedings of the Royal Society B: Biological Sciences, 2010, 277: 877-883.
[24] 刘信中, 方福生. 江西武夷山自然保护区科学考察集[M]. 北京: 中国林业出版社, 2001: 1-4.
[25] 严正兵, 金南瑛, 韩廷申, 等. 氮磷施肥对拟南芥叶片碳氮磷化学计量特征的影响[J]. 植物生态学报, 2013, 37(6): 551-557.
[26] 吴统贵, 吴 明, 刘 丽, 等. 杭州湾滨海湿地3种草本植物叶片N、P化学计量学的季节变化[J]. 植物生态学报, 2010, 34(1): 23-28.
[27] HAN W X, FANG J Y, REICH P B, et al. Biogeography and variability of eleven mineral elements in plant leaves across gradients of climate, soil and plant functional type in China[J].Ecology Letters, 2011, 14: 788-796.
[28] BURTON A J, PREGITZER K S, HENDRICK R L. Relationships between fine root dynamics and nitrogen availability in Michigan northern hardwood forests[J]. Oecologia, 2000, 125: 389-399.
[29] HOLDAWAY R J, RICHARDSON S J, DICKIE I A, et al. Species-and community-level patterns in fine root traits along a 120 000-year soil chronosequence in temperate rain forest[J]. Journal of Ecology, 2011, 99: 954-963.
[30] FORTUNEL C, FINE P V A, BARALOTO C. Leaf, stem and root tissue strategies across 758 Neotropical tree species[J]. Functional Ecology, 2012, 26: 1153-1161.
[31] LI A, GUO D, WANG Z, et al. Nitrogen and phosphorus allocation in leaves, twigs, and fine roots across 49 temperate, subtropical and tropical tree species: a hierarchical pattern[J]. Functional Ecology, 2010, 24: 224-232.
[32] 杨冬梅, 毛林灿, 彭国全. 常绿和落叶阔叶木本植物小枝内生物量分配关系研究: 异速生长分析[J]. 植物研究, 2011, 31(4): 472-477.
[33] 刘广全, 赵士洞, 王 浩, 等. 锐齿栎林个体光合器官生长与营养季节动态[J]. 生态学报, 2001, 21(6): 883-889.
[34] 张文彦, 樊江文, 钟华平, 等. 中国典型草原优势植物功能群氮磷化学计量学特征研究[J]. 草地学报, 2010, 18(4): 503-509.
[35] 牛得草, 李 茜, 江世高, 等. 阿拉善荒漠区6种主要灌木植物叶片C∶N∶P化学计量比的季节变化[J]. 植物生态学报, 2013, 37(4): 317-325.
[36] 刘万德, 苏建荣, 李帅锋, 等. 云南普洱季风常绿阔叶林优势物种不同生长阶段叶片碳、氮、磷化学计量特征[J]. 植物生态学报, 2015, 39(1): 52-62.
[37] 严思维, 陈爱民, 林勇明, 等. 干热河谷区不同林龄赤桉叶中养分含量和再吸收率的比较及其线性回归分析[J]. 植物资源与环境学报, 2017, 26(1): 39-46.
[38] SARDANS J, PEUELAS J. Tree growth changes with climate and forest type are associated with relative allocation of nutrients, especially phosphorus, to leaves and wood[J]. Global Ecology and Biogeography, 2013, 22(4): 494-507.
[39] WANG Z Q, HUANG H, DENG J M, et al. Scaling the respiratory metabolism to phosphorus relationship in plant seedlings[J]. Scientific Reports, 2015, 5: 16377.
[40] HAN W, FANG J, GUO D, et al. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China[J]. New Phytologist, 2005, 168(2): 377-385.
[41] REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001-11006.
[42] SWENSON N G, ENQUIST B J. Ecological and evolutionary determinants of a key plant functional trait: wood density and its community-wide variation across latitude and elevation[J]. American Journal of Botany, 2007, 94(3): 451-459.
[43] MORI S, YAMAJI K, ISHIDA A, et al. Mixed-power scaling of whole-plant respiration from seedlings to giant trees[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(4): 1447-1451.
(责任编辑: 佟金凤)
ComparisonontotalnitrogenandtotalphosphoruscontentsindifferentorgansofPinustaiwanensisindifferentmonthsandaltitudesandanalysesontheircorrelationandallometricrelationship
FAN Ruiruia,b,c, YANG Fuchuna,b,c, SUN Juna,b,c, LI Mana,b,c, ZHONG Quanlina,b, CHENG Donglianga,b,c,①
(Fujian Normal University: a.College of Geographical Sciences, b. State Key Laboratory Breeding Base of Humid Subtropical Mountain Ecology, c. Fujian Provincial Key Laboratory of Plant Ecophysiology, Fuzhou 350007, China),J.PlantResour. &Environ., 2017,26(3): 69-77
Q945.3; S791.24
A
1674-7895(2017)03-0069-09
10.3969/j.issn.1674-7895.2017.03.09
2017-05-15
国家自然科学基金资助项目(31722007; 31370589; 31170374); 福建省青年拔尖人才支持计划
范瑞瑞(1993—),女,河北张家口人,硕士研究生,主要从事植物生理生态方面的研究。
①通信作者E-mail: chengdl02@aliyun.com

