γ分泌酶抑制剂阻断Notch信号通路对肝癌细胞增殖的影响
孟继明,唐红娜,刘晓明,王朝阳,2,任学群,2,3
1. 河南大学淮河医院 普外科,河南 开封 475000; 2. 河南大学 循证医学中心,河南 开封 475000; 3. 河南大学淮河医院 转化医学中心,河南 开封 475000
γ分泌酶抑制剂阻断Notch信号通路对肝癌细胞增殖的影响
孟继明1,唐红娜1,刘晓明1,王朝阳1,2,任学群1,2,3
1. 河南大学淮河医院 普外科,河南 开封 475000; 2. 河南大学 循证医学中心,河南 开封 475000; 3. 河南大学淮河医院 转化医学中心,河南 开封 475000
〔目的〕 探索γ分泌酶抑制剂 MW167阻断Notch信号通路对肝癌细胞增殖的影响。〔方法〕 通过Western blotting 和RT-PCR方法检测Notch受体各亚型的表达。用不同浓度(5、10、20μmol/L)MW167处理肝癌细胞,48h后用Western blotting法检测Notch各蛋白的表达,采用RT-PCR法检测Notch信号通路下游基因HES1 mRNA表达,MTT法测定细胞增殖。〔结果〕 HepG2细胞中可检测到Notch1~4 蛋白和mRNA的表达。不管是与培养基对照还是DMSO对照相比,不同浓度MW167对Notch1~4蛋白的表达没有显著影响。与相应浓度的对照组相比,MW167处理组HES1 mRNA表达下降(P<0.05)。随着MW167处理浓度升高,HES1 mRNA表达抑制率逐渐升高(P<0.05)。MTT法检测结果显示,MW167处理的细胞,其吸光度高于对照组(P<0.05),且随着MW167浓度的升高,细胞增殖率相应升高。〔结论〕HepG2细胞中可检测到Notch1~4蛋白和mRNA的表达,MW167处理可降低HES1 mRNA表达,MW167处理可促进细胞的增殖。
γ分泌酶抑制剂;MW167;Notch信号通路;肝细胞肝癌
Abstract: 〔Objective〕To explore the influence of blocking Notch signaling pathway by γ-secretase inhibitor on proliferation of HepG2 cells. 〔Methods〕The expression of Notch 1~4 was determined with Western blotting and RT-PCR methods. HepG2 cells were treated by 5, 10 and 20μmol/LMW167. 48h after treatment, protein expression of Notch 1~4 was determined. HES1 mRNA expression was measured by RT-PCR technology. Cell proliferation was determined with MTT method.〔Results〕The genetic and protein expressions of Notch 1~4 were observed in HepG2 cells. MW167 showed no influences on the expression of these proteins. Compared with corresponding control, HES1 mRNA expression was decreased (P<0.05).〔Conclusion〕The inhibition rates were increased as the concentration increased. MW167 treatment could improve the cell proliferation of HepG2 cells.
Keywords: γ-secretase inhibitor; MW167; Notch pathway; hepatocellular carcinoma (HCC)
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,是严重威胁人类生命的重大疾病,是世界癌症相关死亡的第二大病因。目前,对肝癌相关信号传导通路的研究尚不明了,肝癌信号通路的深入研究对于肝癌的早期预防和治疗具有关键作用。Notch信号通路,是进化中高度保守的信号传导通路,在胚胎发育、细胞增殖凋亡和肿瘤形成等过程中发挥重要作用[1-2]。近年来研究[3-4]显示,Notch信号通路与肝癌的发生有密切关系。本文应用γ分泌酶抑制剂MW167阻断Notch信号通路,进而研究对肝癌细胞增殖的影响。
1 材料与方法
1.1 细胞株与药物
HepG2细胞株,购自中国科学院上海细胞生物所。γ分泌酶抑制剂MW167(Merck公司);胎牛血清(Hyclone公司);DMEM高糖培养基(Gibco公司);RT-PCR试剂盒(TaKaRa公司);引物(上海生工生物工程有限公司合成);TRIzol(Invitrogen公司);Notch1~4单克隆抗体(Cell signaling technology公司);GAPDH单克隆抗体(上海康成生物工程公司);HRP标记的羊抗大鼠二抗、羊抗兔二抗及羊抗小鼠二抗(上海威奥生物科技公司);细胞裂解液(碧云天生物公司);PVDF膜和ECL发光试剂盒(碧云天生物公司)。
1.2 细胞培养
将细胞密度为1×105/mL的HepG2细胞接种到含有体积分数为10%FBS的高糖型DMEM培养基中(5 mL),在37 ℃、体积分数为5% CO2、完全饱和湿度条件下培养。倒置显微镜下观察细胞生长状况。取对数生长期细胞进行后续实验。
1.3 Western blotting检测Notch各受体蛋白表达
收集HepG2细胞,提取总蛋白,进行SDS-PAGE电泳、转膜,分别接Notch1~4单克隆一抗进行孵育、洗膜,接相应二抗进行孵育。实验中,一抗按1∶1 000比例稀释,二抗按1∶2 000比例稀释。加ECL发光,凝胶成像仪(Bio-Rad)拍照。
1.4 RT-PCR检测Notch1~4的表达
取对数生长期HepG2细胞约1×106个,提取总RNA,分光光度计检测基因浓度与纯度。引物序列见表1。反转录条件:30 ℃,10 min;42 ℃,30 min;99 ℃,5 min。RT-PCR操作按说明书进行。Notch1、Notch3的退火温度设定为60 ℃,Notch2退火温度设定为56 ℃,Notch4退火温度设定为58 ℃。质量分数为2%的琼脂糖凝胶电泳对产物进行检验。凝胶成像系统对结果进行分析。
1.5 Western blotting 检测MW167对Notch1~4蛋白表达的影响
取对数生长期HepG2细胞接种6孔板,每个孔内15×104个。70%的细胞融合后,用无血清培养基,饥饿培养24 h,加含不同浓度MW167(5、10、20μmol/L)的无血清培养基进行培养,二甲基亚砜(DMSO)处理设定为对照组。48 h后提取蛋白,进行SDS-PAGE凝胶电泳,操作同1.3。Quantity-One软件分析条带吸光度。实验重复3次,取平均值。
1.6 RT-PCR检测MW167对Notch下游基因HES1表达的影响
取对数生长期HepG2细胞接种6孔板,每个孔内15×104个。70%的细胞融合后,用无血清培养基,饥饿培养24 h,加含不同浓度MW167(5、10、20 μmol/L)的无血清培养基进行培养。48 h后提取总RNA,然后进行RT-PCR操作。HES1引物序列(表1):5’-CCCTCCTCCTAAACTCCC-3’(上游引物)和5’-AATACAAAGGCGCAATCC-3’(下游引物)。扩增条件为94 ℃,30 s;58 ℃,30 s;72 ℃,1 min。28个循环。质量分数为2%的琼脂糖凝胶电泳对产物进行检测,凝胶成像系统分析结果。实验重复3次,取平均值进行分析。
1.7 MTT测定细胞增殖
取对数生长期HepG2细胞,细胞密度调整为1×104个/mL,接种于96孔板。每孔中加入200 μL细胞悬液。细胞贴壁后,换无血清培养基饥饿培养24 h,加含不同浓度MW167(5、10、20 μmol/L)的无血清培养基进行培养。每个浓度设对照组(DMSO处理),空白调零组(只加培养基),每组设3个复孔。在MW167处理培养48 h后,每孔分别加20 μL MTT溶液(5g/L),继续孵育4 h,每孔加入150 μL DMSO,震荡溶解甲瓒后,设置酶标仪波长为490 nm,测定吸光度。实验重复3次,取均值。
1.8 统计学分析
采用SPSS 18.0软件进行统计学分析。t检验进行各组间均值比较,多组间比较采用单因素方差分析,P<0.05表示有统计学差异。
2 结果
2.1 Notch受体蛋白各亚型在HepG2细胞的表达
Western blotting 实验显示,HepG2细胞中可检测到Notch受体蛋白各亚型的表达,见图1。RT-PCR实验证明,HepG2细胞中可检测到Notch1~4 mRNA的表达,见图2。

表1 引物序列

图1 HepG2细胞中Notch1~4蛋白的表达

1.Marker;2.GAPDH;3.Notch1;4.Noth2;5.Notch3;6.Notch4图2 RT-PCR法测定HepG2细胞Notch1~4 mRNA的表达量
2.2 γ分泌酶抑制剂MW167对Notch1~4 表达的影响
从图3可看出,不管是与培养基还是DMSO对照相比,不同浓度MW167对Notch1~4蛋白的表达没有显著影响。
2.3 MW167对Notch下游基因HES1表达的影响
MW167处理HepG2细胞后,RT-PCR法测定HES1 mRNA 的表达,与相应浓度的对照组相比,MW167处理组HES1 mRNA表达下降(P<0.05)。随着MW167处理浓度升高,HES1 mRNA表达抑制率逐渐升高(P<0.05)。见图4。
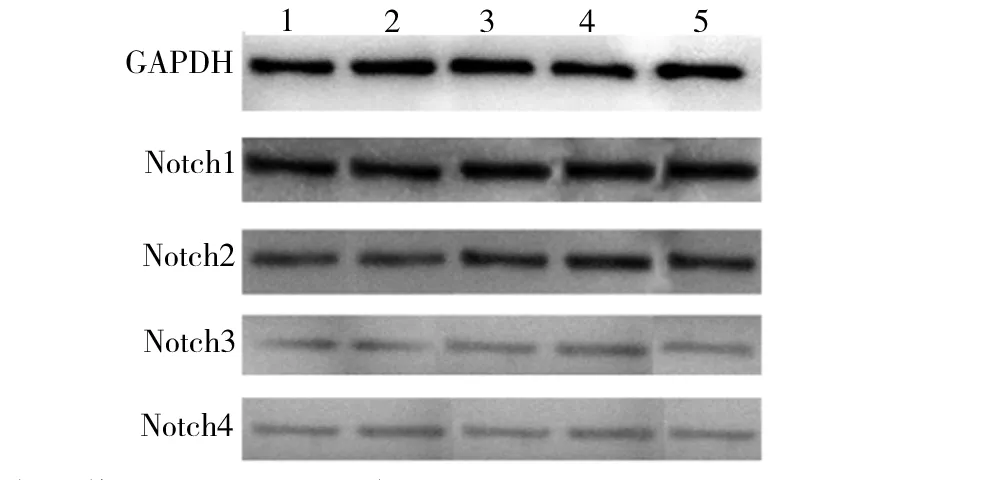
1.培养基对照;2.DMSO对照;3、4、5分别为5、10、20 μmol/L MW167加药组图3 不同浓度MW167作用下HepG2细胞中Notch1~4蛋白的表达

1、3、5分别为5、10、20 μmol/L M167处理;2、4、6分别为相应处理浓度的对照组图4 不同浓度MW167对Notch下游基因HES1表达的影响
2.4 MW167对HepG2细胞增殖的影响
MTT法检测结果显示,MW167处理的细胞,其吸光度高于对照组(P<0.05),且随着MW167浓度的升高,细胞增殖率相应升高,见表2。
3 讨论
自1917年Morgan发现Notch基因以来,对Notch功能与结构的研究不断深入。从组织自我更新,胚胎发育到肿瘤的发生,Notch都发挥重要作用。在对肿瘤的研究[5]中发现,血液系统肿瘤及大部分器官的实体肿瘤,Notch基因的作用得到了认同。

表2 不同浓度MW167对HepG2细胞增殖的影响
注:*表示与对照组相比,存在显著差异(P<0.05);#表示与5μmol/L相比,存在显著差异(P<0.05)。
Notch信号通路,通过相邻细胞间的相互作用,对细胞分化潜能可进行精确调控。相邻细胞通过Notch受体与配体的结合,传递Notch信号,从而扩大细胞间分子差异,对细胞命运起决定作用,最终影响器官的形成和形态发生。Notch信号,是相邻细胞之间的通讯,对细胞发育进行调控的重要通路。多种恶性肿瘤中,都可发现Notch信号通路调节异常。通过小RNA或γ分泌酶抑制剂技术阻断Notch1的活化,可抑制肿瘤细胞的生长。多项研究[6-8]表明,在非小细胞肺癌组织中存在Notch1蛋白高表达,并认为Notch1的高表达与非小细胞肺癌的发生及预后密切相关。
Notch信号通路可作用于肝内外胆管形态发育、肝内血管生成和肝细胞发育、再生等过程,同时可促进肝癌的发生和演变[9]。Notch1表达量在肝癌组织中明显高于正常和癌旁组织,且其与肿瘤的静脉侵犯、淋巴结转移及肿瘤分化密切相关。同时,研究[10-11]显示,肝癌组织中Notch 3 和Notch 4表达量上调,而肝炎组织和正常肝组织中未检测到其表达。本实验通过γ分泌酶抑制剂MW167处理正常培养的HepG2细胞,结果显示,MW167可部分阻断Notch信号通路,并可促进HepG2细胞的增殖。由此可知,Notch在肝癌中发挥抑癌作用。这与先前研究结果一致。还有专家研究[12]表明, Notch信号在体外和体内均能抑制肿瘤的生长,并且可能与肝癌细胞凋亡和周期停滞相关。
综上所述,本实验结果表明,HepG2细胞中可检测到Notch1~4蛋白和mRNA的表达,MW167处理可降低HES1 mRNA表达,MW167处理可促进细胞的增殖。
[1] Aleinik A N, Kondakova I V. The Notch signaling system and oncogenesis [J]. Vopr Onkol, 2012,58 (5):593-597.
[2] Dang T P. Notch, apoptosis and cancer [J]. Adv Exp Med Biol, 2012, 727: 199-209.
[3] Geisler F, Strazzabosco M. Emerging roles of Notch signaling in liver disease [J]. Hepatology, 2015,61(1):382-392.
[4] Sun L, Sun G, Yu Y, et al. Is Notch Signaling a Specific Target in Hepatocellular Carcinoma[J]. Anticancer Agents Med Chem, 2015,15(7):809-815.
[5] Koch U, Radtke F. Notch and cancer: a double-edged sword [J]. Cell Mol Life Sci, 2007,64(21):2746-762.
[6] 周敏, 马佳韵, 郭雪君. Notchl 受体蛋白在成人肺癌中的表达[J]. 临床医学研究, 2010,27(3):398-401.
[7] Westhoff B, Colaluca I N, D'Ario G, et al. Alterations of the Notch pathway in lung cancer [J]. Proc Natl Acad Sci USA, 2009,106(52):22293-22298.
[8] 姜昕,周建华,邓征浩,等.非小细胞肺癌中Notch1、HIF-1、VEGF蛋白及Notch1 mRNA的表达及意义[J].临床与实验病理学杂志,2008,24(3):276-279.
[9] Geisler F, Strazzabosco M. Emerging roles of Notch signaling in liver disease [J]. Hepatology, 2015,61:382-392.
[10] Zhang Q, Lu C, Fang T, et al. Notch3 functions as a regulator of cell self-renewal by interacting with the beta-catenin pathway in hepatocellular carcinoma [J]. Oncotarget, 2015,6(6):3669-3679.
[11] Gao J, Song Z, Chen Y, et al.Deregulated expression of Notch receptors in human hepatocellular carcinoma [J]. Dig Liver Dis, 2008,40(2):114-121.
[12] Qi R, An H, Yu Y, et al. Notch1 signaling inhibits growth of human hepatocellular carcinoma through induction of cell cycle at rest and apoptosis [J]. Cancer Res, 2003,63(23):8323-8329.
[责任编辑时红]
TheinfluenceofblockingNotchsignalingpathwaybyγ-secretaseinhibitoronproliferationofHepG2cells
MENG Jiming1, TANG Hongna1, LIU Xiaoming1, WANG Chaoyang1,2, REN Xuequn
1. Department of Surgery, Huaihe Hospital of Henan University, Henan Kaifeng 475000, China; 2. Center for Evidence-Based Medicine, Henan University, Henan Kaifeng 475000, China; 3. Center for Translational Medicine, Huaihe Hospital of Henan University, Henan Kaifeng 475000, China.
R73-3
A
1672-7606(2017)03-0187-04
2016-11-17
孟继明(1971- ),男,河南睢县人,主任医师,硕士生导师,研究方向:普外科疾病的诊断与治疗。

