泰诺福韦特戊酸酯抗鸭乙型肝炎病毒的实验研究
王成丽戴国俊陶建平邢 华谢恺舟
(1.江苏农牧科技职业技术学院,江苏泰州 225300;2.扬州大学动物科学与技术学院,江苏扬州 225009)
泰诺福韦特戊酸酯抗鸭乙型肝炎病毒的实验研究
王成丽1戴国俊2陶建平2邢 华2谢恺舟2
(1.江苏农牧科技职业技术学院,江苏泰州 225300;2.扬州大学动物科学与技术学院,江苏扬州 225009)
为了研究泰诺福韦特戊酸酯(PMPA)治疗鸭乙型肝炎的疗效。试验以无乙型肝炎病毒(DHBV)的雏鸭为阴性对照组,将人工感染DHBV的雏鸭随机分成5组,其中2组分别为阳性和阳性药物药物拉米夫对照组,其余3组为不同剂量的PMPA治疗组。用PCR方法检测血清中的鸭乙型肝炎病毒,ELISA法检测血清中DHBV的OD值以及甲胎蛋白浓度。研究成功构建了DHBV阳性模型,用药后第2和第3周,PMPA中剂量治疗组OD值极显著低于阳性对照组(P<0.01),且用药后第2周中剂量组OD值下降,但仍显著高于阳性药物拉米夫定组(P<0.05);经PMPA治疗后,阳性鸭DHBV个体全部转为阴性,但停药后均有不同程度的反弹。结果表明泰诺福韦特戊酸酯对DHBV具有一定的抑制作用和疗效。
泰诺福韦特戊酸酯 鸭乙型肝炎病毒 治疗效果
乙型肝炎是危害人类健康主要疾病之一,全世界约有3亿人感染乙肝病毒(HBV),而中国就约有1.2亿人[1],所以乙型肝炎患者及带毒者数量庞大,其患者还面临发展为肝硬化和肝癌的危险。乙型肝炎病毒的复制是慢性乙型肝炎病情反复难以治愈的重要原因[2]。到目前为止,乙型肝炎的治疗还没有特效药物。预防和治疗乙型肝炎的主要手段仍是使用疫苗免疫或化学药物。我国用于治疗人类乙型肝炎的药物大多依靠进口,目前尚无疗效显著的具有自主知识产权的原创药在临床上应用。要解决我国千百万慢性肝炎病人的治疗问题,迫切需要创制更好的新药。寻找更有效的治疗途径是医学研究的重要课题[3-5]。泰诺福韦特戊酸酯是一种无环核苷衍生物磷酸盐类似物样的药物,它属于核苷类似物。核苷类似物有逆转录酶功能,具有促进肝细胞的再生和加快更新速度的作用,能够终止乙型肝炎病毒DNA链的延伸,从而达到抑制其繁殖的目的。为了研究泰诺福韦特戊酸酯在治疗乙型肝炎的作用。本实验通过泰诺福韦特戊酸酯在鸭乙型肝炎模型动物[6]体内给药试验,研究其抗鸭乙型肝炎病毒的效果,为该药物的药效学评价和临床应用提供依据。
1 材料和方法
1.1 试验材料
1.1.1 DHBV阳性模型动物(鸭)的制备 采集DHBV为阳性的成年高邮麻鸭的血样,经离心后,取上层血清为毒种,添加100 IU/ml青霉素冷冻保存备用。1日龄DHBV阴性樱桃谷肉鸭雏鸭48只,按樱桃谷肉鸭常规饲养方式饲养。其中40只分别于1日龄和10日龄经足静脉注射DHBV阳性血清(接种DHBV种毒),阴性对照组鸭8只注射等量生理盐水,注射量为0.2ml/次/只。
1.1.2 试验药物 泰诺福韦特戊酸酯,苏州博瑞生物医药技术有限公司提供,批号:BP0018;阳性对照药物:拉米夫定(LAM),葛兰史克制药有限公司生产,批号:0412009。
1.1.3 主要检测试剂及检测方法 DHBV基因组 PCR检测试剂,由上海生物工程公司生产;血清甲胎蛋白(AFP)检测ELISA试剂盒,由农业部青岛动物检验检疫所提供;MBST(0.01M,pH7.4)、OPD底物溶液和H2SO4(2M),PBST溶液由本实验室自配。
1.2 动物分组与给药方法
1.2.1 动物分组 试验分6组,每组8只。阴性对照组为灌服pH 2.5的柠檬酸水的DHBV阴性鸭;阳性对照组为灌服pH2.5的柠檬酸水的DHBV阳性鸭;阳性药物组为灌服浓度10mg/ml的LAM DHBV阳性鸭;PMPA低剂量、中剂量和高剂量组分别为灌服浓度3.75mg/ml、7.5mg/ml和15mg/ml的PMPA DHBV阳性鸭。
1.2.2 药物配置 先用90%的酒精作为溶剂溶解PMPA,总溶液量为每天用量的10%,待充分溶解后加入pH为2.5的柠檬酸钠,配成终浓度15mg/ml的PMPA溶液,即高剂量组浓度,再以pH为2.5的柠檬酸钠按1:2和1:4稀释成终浓度分别为7.5mg/ml和3.75mg/ml的中、低剂量组。终浓度为10mg/ml的拉米夫定也用PH为2.5的柠檬酸溶液配制。所有药物均每天现配现用。
1.2.3 给药时间、剂量与药物抑制效果评价指标测定时间 一月龄时开始给药,连续给药3周,给药期间,每天上午测定各个体体重,试验组各个体按每天、灌服药物剂量均为2ml(2ml/kg·d)。并分别于用药前,用药后1周、2周、3周(停药)和停药后1周称重,采集血样,分离血清,检测实验药物对DHBV的抑制效果相关评价指标。
1.3 DHBV
药物抑制效果评价指标及测定方法
1.3.1 体重 每次体重测定均是早上8:00空腹称重。
1.3.2 PCR检测方法 根据阳性鸭DHBV的序列设计引物,上游引物(C1)为5'-ATG CCC CAA CCA TTG AAG CA-3',下游引物(C2)为5'-CGG CCT GCT AAT TGA TTT AG-3'。扩增产物长度为711bp。PCR反应体系:10×buffer 2.5μl,C1 0.3μl,C2 0.3μl,dNTP 2.5μl,TeqE 0.3μl,模板1.0μl,加无菌双蒸水至25μl。PCR反应条件:94℃ 5 min,94℃ 1 min,56℃ 1 min,72℃ 1 min,共34个循环,72℃ 7 min,4℃ pause。以1%琼脂糖凝胶电泳检测PCR扩增产物,用DNA marker鉴定片段大小,同时设阳性对照和阴性血清对照。阳性条带在711bp处。
1.3.3 甲胎蛋白ELISA检测方法 按试剂盒操作说明,将待测样品用0.01M PBS(pH7.4)作1:100稀释。取出冻存的酶标板至室温,用PBST洗一次,拍干。加入1:100稀释的待测样品,100μl/孔。每板设阳性对照一孔(加入已配好的阳性对照100μl)。每板设阴性对照2孔(选用健康鸡血清,用0.01M PBS作1:100稀释后,每孔加样100μl)。37℃水浴作用2h,PBST洗板3次。用0.01M PBS(pH7.4)按1:2000稀释酶标抗体,100 μl/孔。37℃水浴作用2h,PBST洗板3次。加入OPD底物溶液(100μl/孔)37℃避光显色10min,2M H2SO4(100μl)终止反应,测定OD490值。判断。阳性对照显色,阴性对照血清不显色。分别计算N值(两孔阴性对照的平均OD490值)和P值(待测血清样品的OD490值),P/N≥2.1判为阳性,反之判为阴性。
2 结果
2.1 泰诺福韦特戊酸酯对DHBV鸭不同周龄体重的影响
泰诺福韦特戊酸酯对DHBV鸭不同用药阶段(周龄)体重的影响结果见表1。由表中数据可见,各组体重都呈现稳定上升趋势,阴性对照组增重最快,阳性对照组和阳性药物组(拉米夫定组)增重平缓,阴性对照组、阳性对照组和各治疗组间差异不显著,阳性药物组与PMPA各组间差异也不明显,经统计分析不同阶段各组间增重差异均不显著(P>0.05),所以体重不是用于评定药物抑制效果的最佳指标。
表1 不同处理组各阶段体重测定结果
2.2 泰诺福韦特戊酸酯对DHBV抑制效果的ELISA检测结果
由表2各组实验动物不同阶段血清中DHBV用ELISA法检测的OD值可见,用药前无论阳性组、阳性药物组和PMPA治疗组间比较差异均不显著(P>0.05),而这些组与阴性对照组差异极显著(P<0.01)。用药后的不同时间测定点,阴性对照组的OD值也均极显著低于其他各组(P<0.01)。用药后第1周,除阴性组外其他各组间比较差异也不显著(P>0.05)。用药后第2和第3周,PMPA中剂量治疗组均极显著低于阳性对照组(P<0.01),且用药后第2周中剂量组OD值下降,但仍显著高于阳性药物拉米夫定组(P<0.05),直到第3周时中剂量组OD值下降到和阳性药物组比较差异不显著(P>0.05)。由停药后1周各组比较可见,只有阳性药物组的OD值显著低于阳性组(P<0.05),而PMPA各治疗组与阳性组比较差异不显著(P>0.05),说明停药后药物作用消失,OD值上升。由表还可以发现,药物治疗组在用药的第1周OD值均有不同幅度的下降,但阳性药物组和PMPA药物高剂量组OD值下降速度最快,从用药后的第2周开始逐渐升高,其中阳性药物组升高幅度小于PMPA各治疗组。
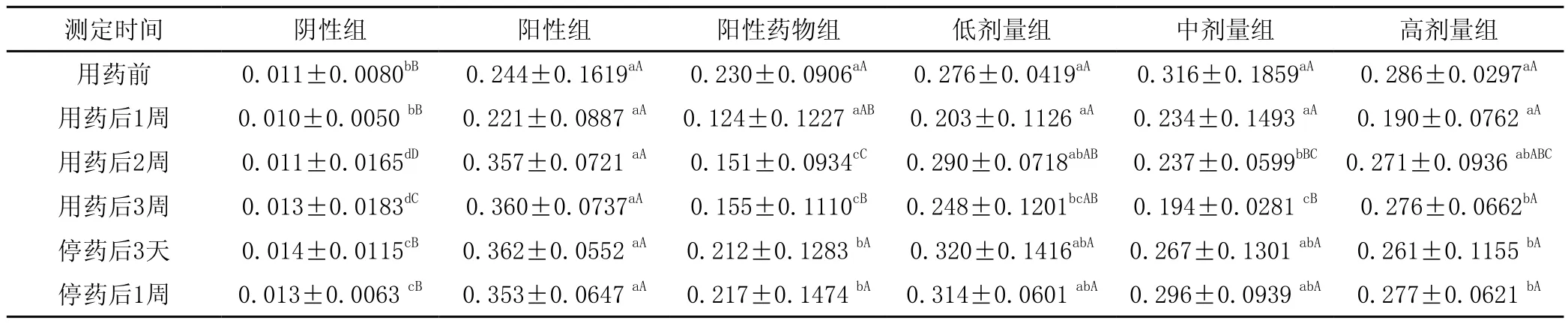
表2 各组动物实验各阶段血清样品DHBV的ELISA检测结果(OD值)
2.3 泰诺福韦特戊酸酯对DHBV抑制效果的PCR检测结果
实验动物血清的PCR扩增产物检测结果见图2.3。各组实验动物试验各阶段,血清中DHBV用PCR方法检测出的阳性数见表3。
由表3可见,阴性对照组用药前后各阶段阳性率均为0.00%,阳性对照组阳性率均为100%,没有变化。而阳性药物组和PMPA药物低、中和高剂量组的阳性率在用药后的第1和第2周均下降为0.00%,但阳性药物组在用药后第3周有2个个体转为阳性,而待测药物各剂量组均在停药后第3d开始有部分个体转为阳性,且低剂量组和高剂量组在停药1周后反弹较为明显。就转阳率而言,PMPA比拉米夫定阳性药物对照组的效果好。

2.4 泰诺福韦特戊酸酯对血清中甲胎蛋白(AFP)的影响检测结果
由表4结果可见,用药前,除阴性组AFP浓度极显著地高于其他各组外(P<0.01),而阳性组、阳性药物组和PMPA各治疗组的AFP浓度差异不显著(P>0.05)。阴性和阳性对照组的AFP浓度,随着用药后时间的推移,总体上略呈下降趋势,但下降速度不及阳性和PMPA药物组,其中PMPA高剂量组的AFP下降的速度最快,说明用药量会直接影响AFP的浓度。由表还可见,停药后1周各用药组(含阳性药物组)间比较差异不显著(P>0.05)。但极显著高于阴性对照组,低于阳性组(P<0.01)。
3 讨论
3.1 鸭和人慢性乙型肝炎的相关性以及模型动物选择与药物治疗
慢性乙型肝炎是消化系统常见的一类传染性疾病,患者多通过血液、性传播等方式感染乙型肝炎病毒,进而引起肝的变性、坏死[7]。由于目前乙型肝炎病毒仅能在黑猩猩等数量较少而价格昂贵的灵长类动物体内繁殖,难以建立和应用人类HBV动物模型[8]。周翊钟等(1980)在饲养2年以上鸭的血清中发现与鸭肝炎和肝癌相关的病毒[9]。同年Summers等[10]曾在来自中国启东的33份鸭血清中发现11份有类似人HBV的病毒。Mason等在美国的北京鸭血清中发现有内源性DNA多聚酶活性的DNA病毒,且大量病毒DNA存在于肝脏,其生物学特性与HBV相似[11],命名为鸭乙型肝炎病毒,为乙肝病毒感染的研究提供了理想的动物模型[12]。

表3 各组动物实验多阶段血清样品DHBV的PCR检测结果
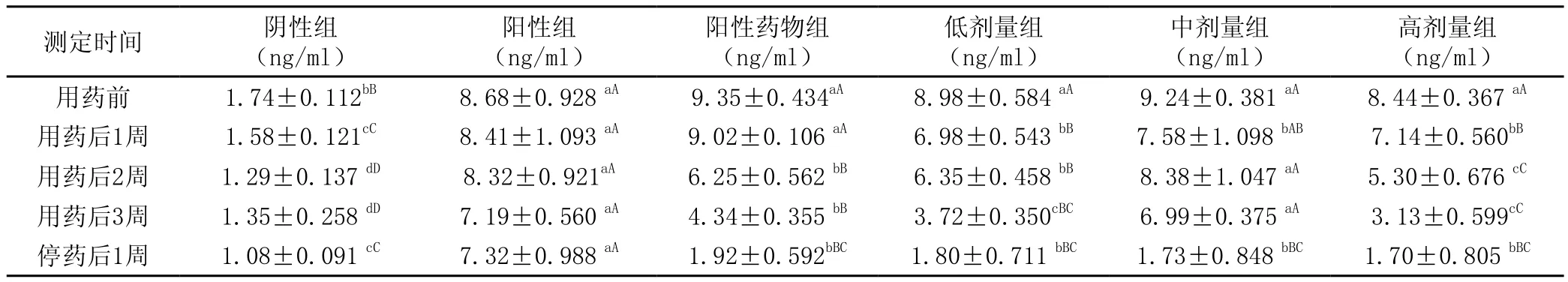
表4 各组动物各阶段AFP浓度测定结果
建立鸭乙型肝炎动物模型需要选择合适的鸭种,Mason等(1980)研究选择DHBV自然感染率较低的樱桃谷鸭作为鸭乙肝动物模型的鸭种,用同样剂量对1日龄樱桃谷鸭和北京鸭实验感染,樱桃谷鸭两周后有12/13只出现病毒血症,而北京鸭血清DHBV阳转时间不一,并认为樱桃谷鸭更适合作为肝炎动物模型[13]。Cooper[14]等应用原代鸭肝细胞观察感染早期 DHBV 进入细胞的步骤。Kundgen等[15]发现在垂直感染的鸭卵内,8日龄鸭胚可检测到成熟的 DHBV共价闭合环状DNA(cccDNA)。唐霓等[16]用不同日龄鸭接种 DHBV 建立急性和慢性感染,发现慢性感染的形成与幼鸭免疫系统发育尚未完善有关,不同鸭龄的肝细胞对 DHBV易感性不同。
本试验在雏鸭1日龄时就进行DHBV的感染,10日龄再感染1次,制作为模型动物。尽管雏鸭对DHBV非常易感,但选择适当保存的较高DHBV滴度的鸭血清作为毒种对成功感染尤为重要。而且,不同来源的DHBV阳性血清的感染力也存在一定的差异,因此毒种要求来源专一,最好是同一批次的阳性血清。雏鸭实验感染途径很多,以DHBV阳性鸭血清静脉、腹腔、肌肉、皮下和肝内注射13日龄雏鸭均可使之感染。但以静脉感染和腹腔感染最为常用,其中静脉感染多取鸭颈静脉,1~3日龄雏鸭因其免疫系统尚未完善,容易形成免疫耐受,病毒血症可持续3个月以上。
目前国内治疗乙型肝炎的药物主要可分为三类:抗病毒药、改善肝功能药以及免疫调节药。抗病毒药主要有干扰素和核苷类似物。该类药物治疗效果较好,但价格昂贵且停药后易复发。改善肝功能药又称保肝药或抗肝细胞损伤药,如联苯双酯、肝细胞生长因子、甘草酸,水飞蓟素及某些中草药制剂等。改善肝功能药对降酶、改善症状有一定效果,且费用较低,副反应少,但停止使用后,大多数病人病情亦会复发,且对肝炎病毒阳性指标转阴疗效较差。免疫调节药有胸腺素、白细胞介素-2、转移因子等。这类药物治疗慢性肝炎的病例不多,疗效尚待肯定,药费较昂贵,且有副反应[13]。由此可见,目前尚无满意的治疗慢性肝炎药物,要解决我国千百万慢性肝炎病人的治疗问题,迫切需要创制更好的新药。肝炎由病毒引起,要彻底治愈肝炎,关键还是寻找有效的抗肝炎病毒药。本实验用对乙型肝炎病毒有明显抑制作用的核苷酸类似物拉米夫定作为阳性药物对照,通过与泰诺福韦特戊酸酯不同剂量组对DHBV的抑制作用的比较,研究该药物的治疗效果。
3.2 DHBV感染程度的检测指标和评价
AFP是胎儿发育过程中,由卵黄囊和胎儿肝产生,妊娠13周时,胎儿血液中含量达最高峰,约3×106μg/L,周岁后婴儿血液中AFP浓度接近成人,一般健康成人AFP浓度低于20μg/L[17]。原发性肝癌的患者,其恶变的肝细胞有恢复合成AFP的能力,而致血液中AFP浓度升高,且常>400μg/L[18]。AFP在非肿瘤性肝病时也可出现升高,其机制尚不十分清楚,可能是细胞炎性病变坏死后,继而又增生而导致异常分泌的结果[13]。在鸭动物模型的血清中从检测的AFP可以看出在用药后呈明显下降。
PCR阳性数和OD值的大小在一定程度上说明了药物的治疗效果。研究表明待测药物低、中剂量组在用药开始时各项监测指标下降不明显,在用药两周后依然能使OD值比用药前有所下降,至停药后才有所上升;而高剂量组用药一周后OD值极显著下降,但第二周就开始反弹,甚至达到用药前水平。这说明本药物对DHBV有一定的抑制作用,每日给予一定剂量的药物能抑制病毒的复制,从而达到控制及治疗乙肝的目的,但过高剂量服用该药物虽然在短期内有显著的疗效,但长期疗效不如低、中剂量组,且低剂量组对病毒的抑制效果不如中剂量组。由此可见,该药物的长期抗病毒效果与其服用的剂量大小有一定的关系。研究还表明,药物使用与否对鸭的生长没有显著的影响。各剂量组与拉米夫定组同时间点的病毒抑制率比较无显著差异,说明该药与拉米夫定有相近的体内抗鸭肝炎病毒作用。在停药后所有的剂量组各指标均有所反弹,这可能与其抑制病毒复制的机理有关,药物能抑制病毒DNA逆转录酶的活性,使病毒的DNA链的延伸被阻断,但不能完全将病毒从体内清除,因而停药后病毒复制仍可恢复,故OD值和PCR阳性数都在停药后有所上升,这也是许多核苷类药物的缺陷,可在以后的用药过程中采取联合用药或终生用药的方法将其克服,但该药长期服用的毒理作用尚待进一步研究。
[1]常晓依,兰喜,白银梅,等.乙型肝炎病毒的研究进展[J].中国农学通报,2010,26(18):6-11.
[2]赵辉.阿德福韦酯联合苦参素治疗慢性乙型肝炎临床疗效观察[J].齐齐哈尔大学医学院学报,2011,32(8):1260.
[3]姚光弼,王宝恩,崔振宇.拉米夫定治疗慢性乙型肝炎2年临床试验的总结[J].肝脏,2002,7(2):12-28.
[4]Young-S L,Dong J S. Current Antiviral Therapy for Chronic Hepatitis B [J]. J Korean Med Sci.,2004,(19):489-494.
[5]谢天恩,胡志红.普通病毒学[M].科学出版社,2002:125-148.
[6]王超,李传峰,陈中艳,等.鸭病毒性肝炎病毒RNA聚合酶在真核细胞中的表达及亚细胞定位[J].中国兽医科学,2012,42(01):35-38.
[7]Arrese E Basaras M,Blanco S,et al. Monititoring of therapy in patients with chronic hepatitis B virus [J]. Eur J Gastroenterol Hepatol,2010,22(6):736-740.
[8]杨艳宏,陈祥明,陈智,等.拉米夫定治疗鸭乙肝停药后肝脏病理研究[J].浙江预防医学,2003,15(11):34-38.
[9]陶科,秦立新.病毒性肝炎甲胎蛋白检测的临床意义[J].中国实验诊断学,2002,6(3):150-151.
[10]周翊钟,寇平原,邵龙琪.一种可能与鸭肝炎和肝癌相关的病毒[J].上海医学,1980,3(11):1-3.
[11]Summers J,Smolec J M,Snyder R. A virus similar to hepatitis B virus associated with hepatitits and hepatoma in woodchucks [J]. Proc Natl Acad Sci USA,1978,(75):4533-4537.
[12]谈博,张奉学,操红缨,等.鸭乙型肝炎病毒感染模型及其方法学研究进展[J].热带医学杂志,2005,5(1):111-117.
[13]Mason WS,Seal G and Summers J. Virus of Pekin ducks with structural and biological relatedness to human hepatitis B virus [J].J Virol,1980,36(3):829-836.
[14]Cooper A,Paran N,Shaul Y. The earliest steps in hepatitis B virus infection [J]. Biochim Biophys Acta,2003,1614(1):891.
[15]Kundgen LR,Thomasc C,Kock J,et al. Inhibition of duck hepatitis B virus replication by intrahepatic expression of an antiviral resistance gene [J].J Mol Med,2002,80(3):187-195.
[16]唐霓,黄爱龙,郭树华,等.DHBV 感染鸭特异免疫应答比较[J].中华肝脏病杂志,2001,(93):166-168.
[17]李鹏,翟云,刘晖,等.血清AFP、GPC3、VEGF、IGF-Ⅱ单独及联合检测对原发性肝细胞癌的诊断价值[J].世界华人消化杂志,2010,18(25):2702-2706
[18]Villeneu JP,Condreay LD,Willems B,et al. Lamivudine treatment for decompensated cirrhosis resulting from chronic hepatitis B [J].Hepatology,2000,31(1):207-210.
江苏高校品牌专业建设工程项目(PPZY2015C230)
王成丽(1978-),女,江苏泰州人,硕士。
邢 华

