福建黄兔INHBA基因5’端cDNA克隆及序列分析
桑雷 孙世坤 陈冬金 陈岩峰 谢喜平 (福建省农业科学院畜牧兽医研究所 350013)
福建黄兔INHBA基因5’端cDNA克隆及序列分析
桑雷 孙世坤 陈冬金 陈岩峰 谢喜平 (福建省农业科学院畜牧兽医研究所 350013)
为扩增福建黄兔INHBA基因5'端,根据GenBank上已公布的家兔序列KC831577,设计了2条巢式引物,利用5'RACE技术克隆福建黄兔INHBA基因5'端序列,获得1个682bp片段,对该片段克隆测序,获得包括5'UTR、第1外显子及部分第1内含子的片段。利用在线软件预测在-229~-180bp处存在可能的启动子,同时还发现9个潜在转录因子结合位点,其中包含对转录有重要调控作用的TATA-box位点。
福建黄兔;片段;克隆;INHBA;5'RACE;启动子;序列分析
抑制素属于TGF-β (transforming growth factor-bata,转化生长因子-β)超家族成员之一,由α、β两个亚基组成的二聚体糖蛋白激素,此类激素通过负反馈调节FSH(follicle stimulating hormone,卵泡雌激素)合成与分泌,从而影响卵泡发育和精子发生[1,2]。抑制素β亚基有βA和βB两种形式,其中α亚基和βA组成抑制素A,此外βA与自身通过二硫键连接组成活化素A(Activin A,ACTA)以及与βB亚基组成活化素B(Activin B,ACTB)[3]。在母畜中,抑制素βA是影响山羊、绵羊产羔数的重要基因[4,5]。在公畜中,抑制素βA是影响荷斯坦公牛射精量及精子密度的重要因素[6]。目前对福建黄兔INHBA基因研究甚少,尤其cDNA 5’UTR(untranslated region,非翻译区)序列未见有报导,本研究目的是解析福建黄兔INHBA基因启动子序列及结构特征,为进一步研究福建黄兔INHBA基因调控与繁殖性状的关联分析提供依据。
1 材料与方法
1.1 动物及组织
性成熟的福建黄兔母兔由福建连江玉华山生态试验场购买。黄兔母兔屠宰后立刻取卵巢组织,放入液氮罐中,备用。
1.2 总RNA提取
使用RNAiso Plus(Takara)提取黄兔卵巢组织中的总RNA,然后用不含RNA酶的Recombiant DNase I(Taraka)去除基因组DNA,随后溶于DEPC水,中保存于-20℃备用。
1.3 引物设计及合成
本试验以已获得的INHBA cDNA部分序列 (KC831577)设计引物扩增5’端序列[7],由上海生工合成,引物的部分序列见表1。
1.4 5'RACE前处理及反转录
使用Takara 5’Full RACE Kit with TAP对5μg的总DNA进行CIAP、TAP处理,并与5’RACE Adaptor连接后,反转录合成cDNA。cDNA反转录体系:连接好的RNA 6μl,随机 引 物( 50μM) 0.5μl, dNTPs Mixture(各 10mM)1μl,RNase Inhibitor (40U/μl) 0.25μl, 5×M-MLV buffer 2μl, Reverse Transcriptase M-MLV (200U/μl) 0.25μl。 RT 反应条件为:30℃下10min,42℃下60min,70℃下15min,反应结束后将cDNA产物保存于-20℃备用。
1.5 PCR扩增
取上述反转录反应液稀释5倍取2μl,10μM上、下游引物 (INHBA 1, Outer primer) 各 2μl, 2×GC buffer 25μl, 5U/μl LA TaqⓇ(Takara) 0.5μl, 用水补足至 50μl体系。 反应条件为: 94℃下 3min; 94℃下 30s, 60℃下 30s, 72℃下 2min,30个循环;72℃下10min。取上述PCR产物1μl作为模板,上、 下游引物 (INHNA 2, Inner primer) 各取 2μl, dNTP(各 2.5mM) 8μl, 2×GC buffer25μl, 5U/μl LA TaqⓇ(Takara)0.5μl,用水补足至50μl体系。反应条件为:94℃下3min;94℃下 30s, 60℃下 30s, 72℃下 2min, 30个循环; 72℃下10min。取5μl进行1%琼脂糖凝胶电泳检测。
1.6 克隆测序
将胶回收试剂盒切胶回收的PCR产物 (约700bp)与pMD18-T载体连接后转染至DH5α细胞中,涂平板37℃培养12h,挑选阳性克隆用PCR法鉴定重组质粒。随后将鉴定过质粒送至宝生物工程 (大连)有限公司进行测序。
2 结果与分析
2.1 兔INHBA基因5'UTR区扩增
经过1%琼脂糖凝胶电泳,结果显示,3’RACE产物为大约700bp的条带 (图1),与预期的产物大小一致。将扩增产物送至宝生物工程 (大连)有限公司进行测序,最后得到1个682bp片段。从获得序列分析结果来看,所获得序列包含1个5’UTR(280bp),第1外显子 (288bp)以及部分第1内含子 (14bp)(见图2)。
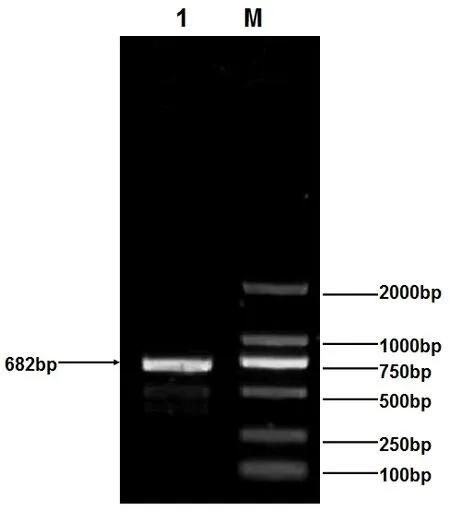
图1 黄兔INHBA 5’端扩增产物琼脂糖电泳

图2 福建黄兔INHBA基因5’UTR区序列分析
2.2 兔INHBA基因的生物信息学分析
将测序得到的兔INHBA基因5’UTR区序列用BDGP∶NeuralNetwork PromoterPrediction ( http∶//www.fruitfly.org/seq_tools/promoter.html)进行启动子位点预测,发现在-229~-180bp处存在可能的启动子位点,得分为0.92,具体位置见图2。
将测序得到的兔INHBA基因5’UTR序列用BIMAS网站的 Promoter Scan (https∶//www-bimas.cit.nih.gov/molbio/) 预测转录结合位点,发现9个潜在的转录因子结合位点 (表2),其中-273bp处存在 3种TFFIID结合位点,分别为TATA-box.2、 Ad2MLP US.5、 TATA-box-CS, 其中 TATA-box.2为真核生物共有的转录结合位点,Ad2MLP US.5、TATA-box-CS为哺乳动物特有的TFIID结合位点,-208bp、-206bp存在激活蛋白AP-2(activator protein-2)结合位点,此外还存在 glucagon-G3A (-230bp)、 UCE.2 (-227bp)、JCV_repeated_sequence(-58bp)转录结合位点。

表1 PCR引物扩增序列
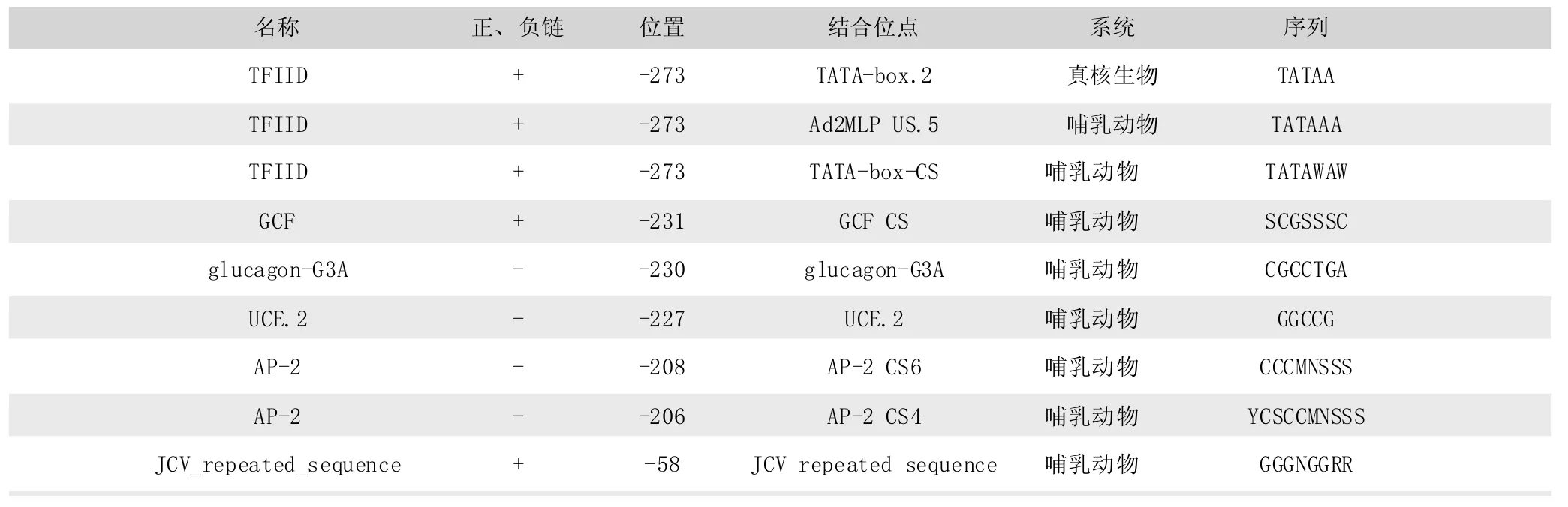
表2 转录结合因子
3 讨论
TFIID(Transcription factor IID,转录因子IID)由TBP(TATA-box binding protein,TATA结合蛋白)和多种TBP协同因子 (TBP-associated factors,TAFs)组成,是真核生物中唯一具有位点特异的DNA结合能力的因子。TFIID能识别TATA位点并与之结合,形成TFIID-启动子复合物,指导其他转录因子与RNA聚合酶II形成转录起始复合物 (transcriptional preinitiation complex),引发RNA的合成过程[8]。UCE(upstream control element,上游控制元件),与核心启动子(core promoter) 一起被 UBF (upstream binding factor, 上游结合因子)结合,再与SL1(selectivity factor 1,选择性因子1)一起促进转录[9]。GCF(GC binding factor,GC结合因子)是一种转录抑制因子,通过与上游启动子中富含GC序列的区域特异结合,进而抑制基因的转录[10]。AP-2(activator protein-2,激活蛋白-2)是一种DNA结合蛋白,参与调控多种基因转录及细胞增殖、分化、凋亡[11]。Csh1、PRP-I及PAG1等基因上游有AP-2结合位点,相关研究发现Csh1、PRP-I及PAG1与胎盘子叶和胚胎发育相关,敲除小鼠胚胎细胞AP-2基因会导致合体滋养层细胞丧失增殖能力[12,13]。研究发现人滋养层细胞的hCG、hCSH1和hGRH等基因上游区域存在AP-2结合位点,这些基因的特异表达受AP-2家族的调控[14,15]。INHBA基因上GCF和AP-2位点是否与表达调控相关,有待进一步的验证。
4 小结
本研究利用5’RACE技术获得INHBA基因5’端1个682bp片段,通过克隆测序获得了其5’UTR序列。通过在线分析软件预测福建黄兔INHBA基因转录因子结合位置及启动子序列,为进一步研究福建黄兔INHBA在生殖轴中的表达机制奠定了理论基础。
[1]程萍,张昌军.抑制素B与生殖[J].生殖医学杂志,2007,16(3):205-208.
[2]刘贺山,袁陶燕,吴兵兵,等.抑制素基因免疫在提高动物繁殖力中的应用[J].浙江畜牧兽医,2011(1):12-14.
[3]张成云,曾宪垠.抑制素免疫在家畜繁殖中的应用[J].畜牧兽医杂志,2008,27(2):35-37.
[4]彭志兰,储明星,陈宏权,等.抑制素βA基因多态性及其与济宁山羊高繁殖力关系[J].农业生物技术学报,2007,15(5):901-902.
[5]陈宝麒,赵宗胜,贾斌,等.新疆肉用绵羊抑制素βA基因多态性与产羔数关联分析[J].石河子大学学报,2013,31(2):159-163.
[6]Sang L,Du Q,Yang W,et al.Polymorphisms in follicle stimulation hormone receptor,inhibin alpha,inhibin bata A,and prolactin genes,and their association with sperm quality in Chinese Holstein bulls[J].Anim Reprod Sci,2011,126(3-4):151-156.
[7]桑雷,孙世坤,陈冬金,等.福建黄兔卵泡抑制素βA亚基cDNA的克隆与序列分析[J].家畜生态学报,2013,34(9):17-20.
[8]王军,贾弘缇.真核转录因子TFIID研究进展[J].生物化学与生物物理进展,1993,20(5):329-333.
[9]俞峻,王均,贾弘.TBP与TBP相关因子[J].生物化学与生物物理进展,1995,22(5):408-414.
[10]马平,晁耐霞,潘复泽,等.GC结合因子2在肝细胞癌中的表达和意义[J].广西医科大学学报,2013,30(4):493-495.
[11]张翔,苏波.转录因AP-2与肿瘤的研究进展[J].国际病理科学与临床杂志,2012,32(1):40-44.
[12]Werling U,Schorle H.Transcription factor gene AP-2 gamma essential for early murine development[J].Molecular Cell Biology,2002,35:442-450.
[13]Auman H,Nottoli T,Lakiza O,et al.Transcription factor AP-2 gamma is essential in the extraembryonic lineages for early postimplantation development[J].Placenta,2007,5:16-35.
[14]Richdardson B,Cheng Y,Langland R,et al.Differential expression of AP-2 gamma and Ap-2 alpha during human trophoblast differentiation[J].Life Science,2001,69:2157-2165.
[15]Cheng Y,Aronow B,Hossain S,et al.Critical role for transcription factor AP-2 alpha in human trophoblast differentiation[J].Physiology Genomics,2004,18:99-107.
项目资金:福建省公益类研究院所专项 “闽西南黑兔FABP4基因的克隆、多态性及与生长、肉质性状的关联分析”(2015R1023-13);福建省农业科学院科技创新团队PI项目 “家兔优良品种资源创新育种研究”(2016PI-11);福建农业科学院杰出青年人才基金 “闽西南黑兔FABP4基因的克隆、多态性及与生长、肉质性状的关联分析”(2014JQ-1)。
桑雷 (1981-),男,汉族,博士,助理研究员,从事草食动物遗传育种与繁殖工作。

