养鸭场血清1型鸭疫里默氏杆菌分离与鉴定
蒋 姝 王康锐 杨清林 马财万 黄承洪
(重庆科技学院, 重庆 401331)
养鸭场血清1型鸭疫里默氏杆菌分离与鉴定
蒋 姝 王康锐 杨清林 马财万 黄承洪
(重庆科技学院, 重庆 401331)
鸭疫里默氏杆菌是引起鸭传染性浆膜炎的病原,目前国内外已经报道有超过21种血清型。该菌感染谱广,不但可以感染鸭,还可以感染鹅、天鹅、鸡、野鸭、猪等动物。对某鸭场25 — 30日龄鸭罹患传染性浆膜炎进行了病原分离,经形态观察、血清学实验及聚合酶链式反应,证实了该养鸭场感染的RA为血清1型;SEM观察RA呈“草履虫”形态;PCR扩增得到1 046 bp大小条带;药物敏感实验表明其对头孢唑啉、环丙沙星、丁氨卡那、利福平高度敏感,相继采用头孢唑啉和利福平治疗后迅速控制了疫情发展。
鸭疫里默氏杆菌; 血清1型; 传染性浆膜炎; 分离鉴定
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)能引起多种动物(包括鸭、鹅、鸡、火鸡、野鸭、猪等)发病[1-3],还有研究表明健康鸭也会带菌[4]。RA对水禽的危害最大,主要侵害2 — 8周龄雏鸭和幼鹅,是危害养禽业的主要病原之一。其危害除直接引起水禽出现急性或慢性败血症、纤维素性心包炎、肝周炎、气囊炎外,还引起禽肉品质下降,饲料报酬降低,生长周期延长等间接危害。RA的血清型众多,目前有超过21种血清型[5-8],经研究不同的血清型制作的灭活疫苗之间缺乏交叉保护。对某养鸭场爆发的鸭浆膜炎进行了细菌分离和鉴定,证明受到RA血清1型感染。
1 试验材料和方法
1.1试验材料
病(濒死)鸭由某鸭场送检,具有典型的神经症状和剖检病变(见图1a);鸭抗RA1型血清由西南大学李继祥教授课题组制备和提供;巧克力营养琼脂平板、鲜血营养琼脂平板、普通营养琼脂平板、LB增强营养液体培养基的制备参照文献[9]进行;大肠杆菌为试验室分离并保存;麦康凯营养琼脂,药敏试纸试剂盒购于杭州天和微生物试剂有限公司,按使用说明配制。PCR试剂盒购自生工生物工程(上海)股份有限公司。
1.2试验方法
1.2.1 病原分离
无菌操作条件将病死鸭脑组织、心包液、腹水等接种于巧克力营养琼脂平板,置烛缸中在37 ℃条件下培养18~24 h;可疑菌落用巧克力营养琼脂平板及LB增强营养液体培养基扩大培养。
1.2.2 细菌形态观察
待长出单个菌落并纯化后,进行革兰氏染色,光镜或电镜观察,以及生化特性鉴定,同时进行动物回归试验。
1.2.3 血清学鉴定
分别采用玻片凝集试验和琼脂糖双扩散试验鉴定。凝集抗原的制备:纯培养的细菌用甲醛生理盐水(FPSS,0.1%)清洗并悬浮成菌悬液;3 000 r/min离心,用FBSS洗涤至上清液透明。琼扩抗原的制备:纯培养细菌用甲醛磷酸盐缓冲液(FPBS,0.1%)清洗并悬浮成菌悬液;测定吸光度,并调节吸光度(OD600)至0.8;沸水中煮1 h,冷却后5 000 r/min离心30 min,取上清液备用。试验操作参见文献[10]。
1.2.4 聚合酶链式扩增(PCR)
依据GenBank登录的RA协同溶血素cam基因序列[11]设计一对特异性引物(5′GGCGGATCCAT GAAACAATCTATTATC3′CGCAAGCTTTTACTTTAC ATTTAACTC5′)进行PCR扩增。PCR 25 μL反应体系:灭菌ddH2O,14.75 μL;10×buffer,2.5 μL;25 mM MgCl2,2.5 μL;2.5 mM dNTP,2.0 μL;20 uM上游引物,0.5 μL;20 uM下游引物,0.5 μL;基因组DNA模板,2 μL;Taq DNA Polymerase,0.25 μL。PCR反应条件:95 ℃预变性2 min;30个循环:95 ℃变性1 min,44 ℃复性1 min,72 ℃延伸1 min;72 ℃延伸5 min。PCR产物以1×TAE作缓冲溶液,用1.0%琼脂糖凝胶进行电泳;EB染色,凝胶成像系统拍照。基因组提取过程见文献[12]。
1.2.5 药敏试验
用杭州天和微生物试剂有限公司出品的药敏纸片进行药敏试验。
2 试验结果
2.1菌落及细菌形态观察
病料接种于巧克力营养琼脂平板,烛缸中培养18~24 h后长出表面光滑、近圆形、中央微突起、直径为1.0~2.0 mm的菌落,长时放置菌落变大。细菌在麦康凯营养琼脂及普通营养琼脂平板上都不能生长。革兰氏染色为阴性的大小0.3~2.0 μm的小杆菌(见图2a)。扫描电镜观察近似“草履虫”形(见图2b),或者“脚”形,同时观察到在母体细菌上有正在凸起的小泡(见图2c)。韦强等人首次报道了这种赘生物的存在,并对其大小、成分进行了初步分析,具体生理作用及其存在机制还不十分清楚。动物回归试验能复制出与临床表现一致的病例。

图1 具有典型鸭传染性浆膜炎症状病鸭
细菌株能利用葡萄糖,不能发酵碳水化合物;尿素酶阳性;能液化明胶;硫化氢及硝酸盐试验阴性;触酶、过氧化氢酶、精氨酸酶、赖氨酸酶阳性。

图2 病原形态观察
分别采用玻片凝集和琼扩试验对细菌进行血清型鉴定。凝集抗原和标准阳性血清之间出现明显的凝集团块判定为阳性反应,沉淀抗原和标准阳性血清之间出现明显的沉淀线判定为阳性反应。经血清型鉴定,该鸭场感染的RA为血清1型。
2.4 PCR鉴定
以鸭疫里默氏杆菌分离株基因组DNA为模板,以大肠杆菌为对照,以特异性引物,对分离的RA进行PCR扩增,得到1 046 bp左右的DNA分子片段,与预期的大小基本一致(见图3),而对照未能扩增出目的片断。
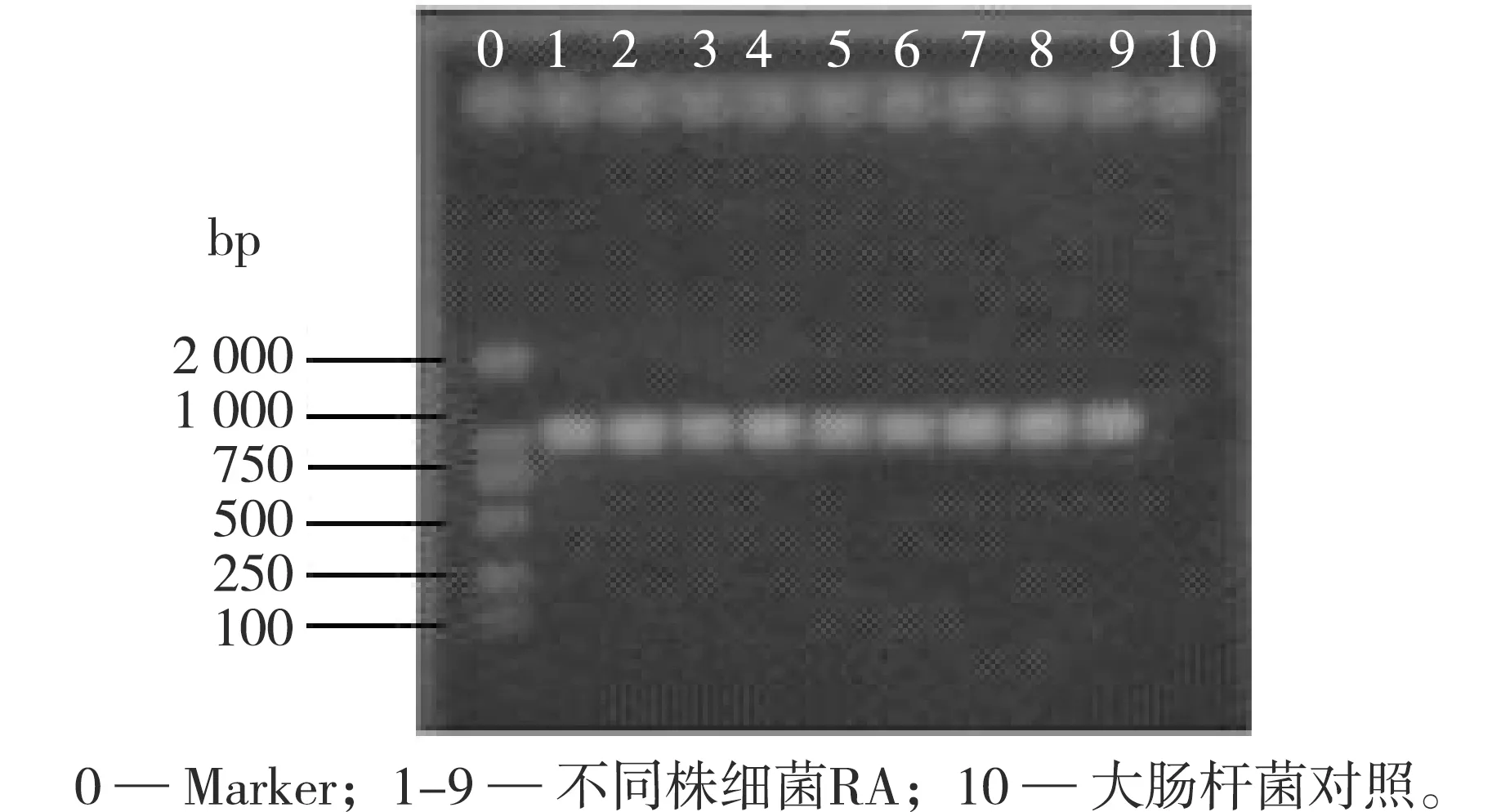
图3 PCR扩增产物
鸭疫里默氏杆菌对头孢唑啉、环丙沙星、丁氨卡那、利福平高度敏感,而对链霉素、氨苄青霉素、氧氟沙星等中度敏感,但对青霉素、卡那霉素、四环素等完全耐药。采用头孢唑啉注射,结合投喂复合维生素后,病情基本得到控制。但已经出现症状的鸭生长缓慢,造成饲料浪费,只能分拣淘汰。
3 结 语
农村水禽的养殖严重依赖水源,而且通常是鸭、鹅混养[13],在我国川东地区尤其如此。已有研究表明RA对鸭的感染在不同的时间段存在动态变化[14]。且该病原的血清型众多,不同血清型之间缺乏交叉保护,不同血清型之间的药物敏感性不尽相同[15-16]。因此,给该病的预防与治疗造成很大的困难。本实验感染鸭分离RA,证明为血清1型,基于药敏实验结果进行抗生素治疗取得了良好的治疗效果,为该养殖场挽救了濒死鸭,减少了损失,提高了养殖效益。
[1] PIERCE R L, VORHIES M W. Pasteurella Anatipestifer Infection in Geese[J]. Avian Diseases, 1973, 17(4):868-870.
[2] HELFER D H, HELMBOLDT C F. Pasteurella Anatipestifer Infection in Turkeys[J]. Avian Diseases, 1977, 21(21):712-715.
[3] HINZ K H, RYLL M, KOHLER B, et al. Phenotypic Characteristics of Riemerella Anatipestifer and Similar Micro-organisms From Various Hosts.[J]. Avian Pathology, 1998, 27(1):33-42.
[4] RYLL M, CHRISTENSEN H, BISGAARD M, et al. Studies on the Prevalence of Riemerella Anatipestifer in the Upper Respiratory Tract of Clinically Healthy Ducklings and Characterization of Untypable Strains[J]. Journal of Veterinary Medicine, 2001, 48(7):537-546.
[5] BISGAARD M. Antigenic Studies on Pasteurella Anatipestifer, Species Incertae Sedis, Using Slide and Tube Agglutination[J]. Avian Pathology, 1982, 11(3):341-342.
[6] 张大丙,郭玉璞.1株难以定型的鸭疫里默氏菌分离株[J].中国兽医学报,2005,25(2):148-151.
[7] SANDHU T, HARRY E G. Serotypes of Pasteurella Anatipestifer Isolated From Commercial White Pekin Ducks in the United States[J]. Avian Diseases, 1981, 25(2):497-498.
[8] SANDHU T S, MARY L. Serotypes of ‘Pasteurella’ Anatipestifer Isolates From Poultry in Different Countries[J]. Avian Pathology, 1991, 20(2):233-239.
[9] 李继祥,徐刚,王孝友,等.重庆地区鸭传染性浆膜炎病原分离鉴定[J].中国预防兽医学报,2000,22(6):402-422.
[10] BROGDEN K A, RHOADES K R, RIMLER R B. Serologic Types and Physiologic Characteristics of 46 Avian Pasteurella Anatipestifer Cultures[J]. Avian Diseases, 1982, 26(4):891-896.
[11] KAREN C. Identification and Characterization of CAMP Cohemolysin as a Potential Virulence Factor of Riemerella Anatipestifer[J]. Journal of Bacteriology, 2002, 184(7):1932-1933.
[12] SAMBROCK J, RUSSEL D. Molecular Cloning: A Laboratory Manual, 3rd ed[J]. Immunology, 2001, 49(1):895-909.
[13] MORISHITA T Y. Common Diseases in Backyard Ducks and Geese[J]. Seminars in Avian & Exotic Pet Medicine, 2004, 13(4):191-196.
[14] HUANG C H, LI J X, HUANG W, et al. Dynamic Epidemiological Investigation of Riemerella Anatipestifer Isolated From Ducklings in Chongqing and Sichuan[J]. Chinese Journal of Preventive Veterinary Medicine, 2007,29(1):67-70.
[15] CHANG C F, LIN W H, YEH T M, et al. Antimicrobial Susceptibility of Riemerella Anatipestifer Isolated From Ducks and the Efficacy of Ceftiofur Treatment[J]. Journal of Veterinary Diagnostic Investigation, 2003, 15(1):26-29.
[16] TURBAHN A, DE J S C, GREUEL E, et al. Dose Response Study of Enrofloxacin Against Riemerella Anatipestifer Septicaemia in Muscovy and Pekin Ducklings[J]. Avian Pathology, 1997, 26(4):791.
Abstract:Riemerella anatipestifer (RA) is the causative of duck infectious serositis. Currently, there are more than 21 serotypes reported at home and abroad. RA has broad infectious spectrum, which can cause disease to goose, swan, chicken, wild ducks, even pigs in additional to domestic ducks. This research mainly focuses on pathgen isolation, morphology observation, serum test and PCR amplification for RA identification about 25-30 days sick ducklings. Results show ducks are infected by type 1 RA. SEM images shape typical “paramecium” appearance. PCR obtains a 1046bp band. Drug-resistance ascertain RA is sensitive to cefazolin, ciprofloxacin, amikacin and rifampicin. Infection is successfully controlled after prompt application of cefazolin and rifampicin.
Keywords:Riemerella anatipestifer; Serum Type 1; infectious serositis; identification
IsolationandIdentificationofRiemerellaAnatipestiferType1fromDuckery
JIANG Shu WANG Kangrui YANG Qinglin MA Caiwan HUANG Chenghong
(Chongqing University of Science and Technology, Chongqing 401331, China)
S852.61
B
1673-1980(2017)05-0112-03
2017-04-25
重庆市科委社会民生科技创新专项“木聚糖酶发酵法生产技术研究及应用”(CSTC2016SHMSZX0600);重庆科技学院教授/博士科研启动基金项目“基于卟啉化壳聚糖/碳纳米管复合物膜构建仿生电子鼻核心元件用于汽油品质检测研究”(CK2014B14)
蒋姝(1993 — ),女,重庆科技学院在读硕士研究生,研究方向为生物化工安全。

