山木通扦插繁殖及生根机制
赵 爽,刘志高,冯 彬,季梦成
(浙江农林大学 风景园林与建筑学院,浙江 临安311300)
山木通扦插繁殖及生根机制
赵 爽,刘志高,冯 彬,季梦成
(浙江农林大学 风景园林与建筑学院,浙江 临安311300)
以山木通Clematis finetiana 1年生枝条为材料,针对植物生长调节物质种类和质量浓度、浸泡时间、扦插基质等4个因素,采用L9(34)正交试验设计扦插试验,研究山木通扦插繁殖技术及生根过程中相关氧化酶[氧化物酶(POD),吲哚乙酸氧化酶(IAAO),多酚氧化酶(PPO)]活性,可溶性糖、可溶性蛋白、淀粉质量分数的动态变化。结果表明:山木通属于皮部生根类型,不同外源植物生长调节物质及质量浓度、浸泡时间和扦插基质4个因素对山木通插穗生根的影响均达到极显著水平(P<0.01),以河沙扦插基质,100 mg·L-1吲哚丁酸(IBA)浸泡2 h处理的山木通扦插的生根质量最佳,生根率达21.67%。生根过程中,可溶性糖质量分数在不定根诱导期和根系生长期下降,根系表达期和生长后期糖质量分数有所回升;淀粉质量分数持续下降;可溶性蛋白质量分数在扦插后逐渐下降,插穗大量生根期达到谷值,然后又逐渐上升。插穗内POD,PPO,IAAO活性的变化均呈现 “上升—下降”的趋势,在不定根表达初期达到峰值。经IBA处理的插穗营养物质质量分数变化幅度较对照组显著,且酶活性到达峰值时间较对照组早10 d,说明外源生长调节物质能够提高营养物质的利用率和氧化酶活性。图3表4参20
园艺学;山木通;扦插繁殖;营养物质;氧化酶
Abstract:To study cutting propagation techniques with one-year-old cuttings of Clematis finetiana and to investigate the dynamic changes in activity of related oxidative enzymes [peroxidase (POD),indoleacetic acid oxidase (IAAO),and polyphenol oxidase (PPO)] as well as the content of soluble sugar,soluble protein,and starch,an L9(34) orthogonal experiment was conducted with four treatments of exogenous hormones,hormone concentration,soaking time,and cutting matrix.Results indicated that rooting of C.finetiana was derived from the cortex.The effects of different exogenous hormones,hormone concentration,soaking time,and cutting matrix on rooting were notable by variance analysis.The best rooting formula was as follows:a matrix of river sand processed with Indole-3-butyric acid (1H-Indole-3-butanoic acid (IBA) 100 mg·L-1for 2 h producing a rooting rate of 22.7%.In the rooting process,the content of soluble sugar increased during the induction and root growth periods,but decreased during the expression period and the late growth stage.Soluble protein content decreased gradually after cutting reaching a low point when most cuttings rooted.Starch content declined throughout the process.Also,the POD,IAAO,and PPO activities all increased first and then decreased reaching a peak in the early stages of expression.Additionally,greater nutrient content for the test group was found than the control,and peak oxidase activities of test groups arrived 10 d earlier than the control.This demonstrated that exogenous hormones could improve the nutrient utilization and oxidase activities of cuttings.[Ch,3 fig.4 tab.20 ref.]
Key words:horticulture;Clematis finetiana;cutting propagation;nutrients;oxidases
毛茛科Ranunculaceae铁线莲属Clematis植物是一类具有观赏和药用价值的植物,攀援性强,花型多变,花色丰富,花期长,也是优良的垂直绿化材料[1]。由于铁线莲属植物多数存在结实少,种子萌发率低或萌发时间长等问题,不宜采用有性繁殖,园林栽培应用受到限制。铁线莲属植物的无性繁殖研究已成为园林领域的研究热点,为扩大铁线莲属植物在园林中的应用,许多学者也陆续开展了相关研究[2-3]。铁线莲扦插繁殖研究以栽培品种为主,对铁线莲属野生种的研究甚少,与栽培品种相比,野生种适应性好,利用前景广阔。山木通Clematis finetiana为铁线莲属多年生藤本植物,花期4-5月,花色洁白,小而繁茂,栽培适应性佳,但其自然结实率和种子繁殖系数均偏低[4]。同时,山木通野生群体中存在花色、花型自然变异的单株,是优良的观赏种质资源,唯有通过无性繁殖才能实现品种化。目前,对山木通的研究主要集中在化学成分及药用价值方面[5-6],有关繁殖技术研究的报道较少。本研究以山木通1年生枝条作为试材,探究适宜的扦插条件组合,并对其扦插生根机制进行系统研究,以期为山木通的繁殖及在园林中的应用提供理论支持。
1 材料与方法
1.1 试验材料
试验插条选自浙江农林大学铁线莲种质资源圃,选取母株长势旺盛,腋芽饱满,无病害的1年生枝条中上部作为插穗。剪取插条长为5~6 cm,含芽1对·插条-1,保留1~2片叶子,上切口距芽1 cm,下切口距芽约4~5 cm。采集插条后浸泡在清水中,避免失水,随后根据试验要求进行扦插处理。
1.2 最佳扦插生根方案的选择
采用4因素3水平的L9(34)正交试验,研究植物生长调节物质种类和质量浓度、处理时间和扦插基质对山木通扦插生根的影响。通过多重比较分析,筛选出最适宜山木扦插生根的组合。具体因素和水平见表1,插穗20个·处理-1,重复3次。扦插试验于2015年5月22日在浙江农林大学温室内进行,白天25~29℃,晚间23~25℃,白天用75%遮阳网遮阳。扦插后每天早晚各喷水1次以保持基质和枝条湿润,喷水约10 min·次-1,插穗生根后适当减少喷水次数和时间。

表1 山木通扦插正交试验表Table1 Orthogonal test of Clematis finetiana cutting
1.3 扦插生根机理研究
1.3.1 样品采集 于2016年5月19日在浙江农林大学温室内进行扦插生根机制试验,设置对照与处理2组试验,插穗200个·组-1,以清水作为对照。自扦插之日起隔10 d取样1次,共6次,取样部位为插穗基部2~3 cm茎段,同年7月8日结束取样。采样后用冰桶迅速带回实验室,清水冲洗并置于-79℃低温冰箱内保存备用。
1.3.2 插穗生根的形态解剖学研究 剪取0.5~1.0 cm长茎段,用体积分数为70%的甲醛-乙醇-醋酸混合固定液(FAA)固定,常规石蜡切片法制片,番红-固绿对染,Axio lmager A2正置荧光显微镜观察拍照。
1.3.3 扦插生根过程中生理指标的测定 剪取插穗基部2~3 cm茎段0.2 g,3次重复。可溶性糖和淀粉的测定采用蒽酮比色法[7],可溶性蛋白测定采用考马斯亮蓝G-250染色法[7],过氧化物酶(POD)活性的测定采用愈创木酚法[7],多酚氧化酶(PPO)活性测定采用邻苯二酚比色法[8],吲哚乙酸氧化酶(IAAO)活性测定采用二氯酚比色法[9]。
1.4 数据处理方法
采用Microsoft Excel和SPSS 19.0统计软件进行数据分析,用Origin作图软件进行绘图。
2 结果与分析
2.1 最佳扦插生根方案的选择
山木通扦插各处理生根情况见表2。从生根率来看,处理3、处理8与其他组处理差异极显著,处理3与处理8之间也存在极显著差异(P<0.01),以处理8生根率效果最好;平均根长以处理1,处理2和处理3为最好,与其他处理差异极显著(P<0.01),处理8次之;处理8平均根数与其他处理组差异极显著(P<0.01),根数量最多,处理9次之。综合3项生根指标,处理8扦插生根效果最好,生根率达21.67%,平均根长为2.63 cm,平均生根数量达10条。方差分析(表3)表明,不同植物生长调节物质种类、植物生长调节物质浓度、外源植物生长调节物质的处理时间及扦插基质对山木通扦插生根率具有极显著影响(P<0.01)。
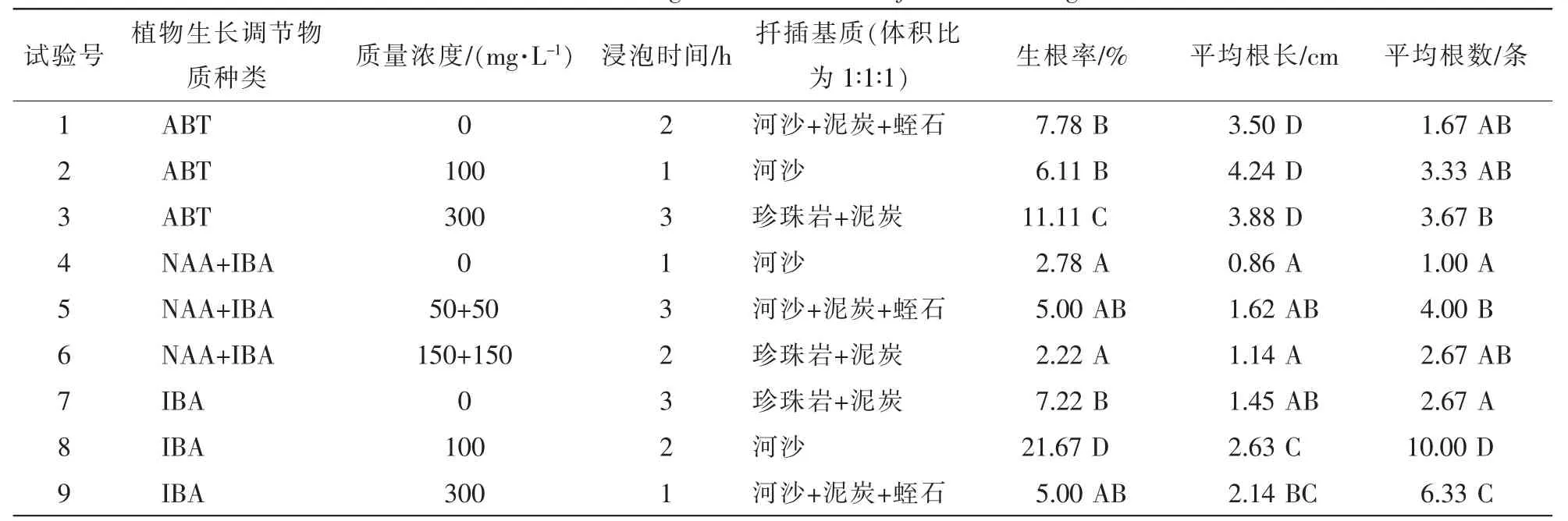
表2 山木通扦插生根情况Table 2 Rooting results of Clematis finetiana cutting

表3 山木通扦插正交试验各因素对生根率影响的方差分析Table 3 Variance analysis for 5 factors of Clematis finetiana cutting on orthogonal test
表4多重比较分析表明:在不同质量浓度IBA与ABT处理生根率无显著差异,但与NAA+IBA形成极显著差异 (P<0.01),生根率仅为IBA处理的29.5%;植物生长调节物质质量浓度以100 mg·L-1效果最好,与300,0 mg·L-1形成极显著差异,生根率较后2种处理高4.82%~5.00%;插穗浸泡时间以2 h为宜,扦插基质以为河沙最佳,与其他2种基质形成极显著差异(P<0.01),约为2种基质的2倍,说明山木通扦插以透水性好、质地疏松的基质为宜。因此,山木通最佳扦插生根方案为处理8,即扦插基质为河沙,100 mg·L-1IBA处理2 h,生根率可达21.67%。
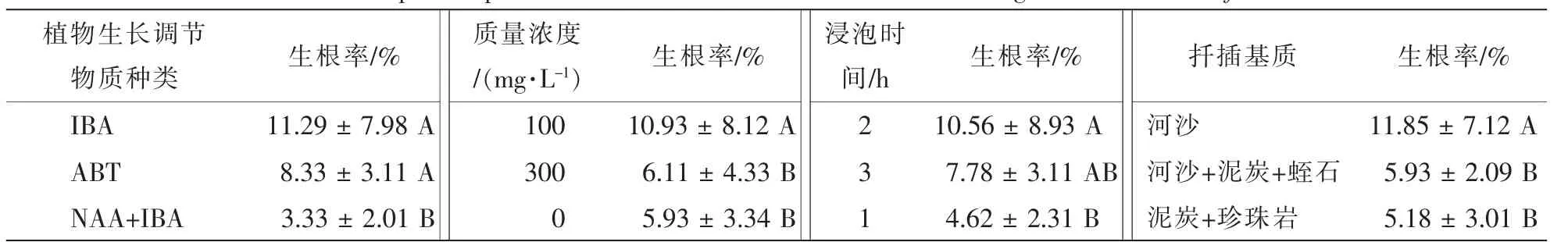
表4 不同因素和水平对山木通生根率影响Table 4 Multiple comparisons for different factors and levels on rooting rates of Clematis finetiana
2.2 山木通扦插生根过程中插穗生理生化指标的变化
2.2.1 可溶性糖质量分数与生根的关系 山木通扦插生根过程中,处理8(100 mg·L-1IBA处理2 h,扦插基质为河沙)与对照插穗可溶性糖质量分数变化规律一致,均呈现 “下降—上升—下降—上升”趋势,但处理8插穗变化幅度较对照组显著(图1A)。处理8和对照前10 d可溶性糖质量分数缓慢下降,10~20 d 显著下降并达到谷值, 分别为 33.48 mg·L-1,59.90 mg·L-1。 10~20 d 处于不定根诱导期,插穗内代谢旺盛,营养物质被大量消耗;对照组可溶性糖质量分数约为处理组的2倍,说明IBA处理能够促进插穗对可溶性糖的利用。20~30 d可溶性糖质量分数稍有回升,可能是由于可溶性糖的急剧降低,促使插穗内淀粉酶活性增强,淀粉加速水解,增加了可溶性质量分数;随着淀粉质量分数的持续降低,转化为可溶性糖的量减少,此时根系突破皮层进入伸长生长阶段需消耗大量养分,导致可溶性糖质量分数再次下降。40 d后插穗逐步具备产生营养物质的能力,可溶性糖质量分数又回升。
2.2.2 淀粉质量分数与生根的关系 图1B显示,处理8与对照的淀粉质量分数持续下降,前期下降较快,后期缓慢,但处理8插穗内淀粉质量分数下降速度大于对照,说明IBA处理能够促进插穗淀粉降解。扦插前期,不定根发育和愈伤组织的形成需消耗大量的可溶性糖,淀粉下降速度快,随着淀粉的大量消耗,下降速度减缓。
2.2.3 可溶性蛋白质量分数与生根的关系 处理8与对照可溶性蛋白质量分数呈现 “下降—上升”的趋势(图1C)。前30 d处理8可溶性蛋白质量分数低于对照组,40 d后,处理8高于对照,且对照降到谷值的时间较处理8晚10 d,处理8与对照达到谷值时的可溶性蛋白质量分数分别为12.33,15.00 mg·g-1。综合山木通扦插生根外部形态观察可知,前30 d为插穗不定根诱导与表达期,同时伴随着愈伤组织的形成,需消耗大量的营养物质,可溶性蛋白质量分数大幅下降。不定根形成后,由于水分、营养的供应及光合作用的进行,可溶性蛋白质量分数逐渐上升,对照组可溶性蛋白质量分数的变化滞后于处理组,说明IBA处理促进了不定根的提前表达。
2.2.4 过氧化物酶(POD)活性与生根的关系 由图1D可见:处理8与对照插穗POD活性均在扦插前期升高,处理8在20 d达到峰值,对照在30 d达到峰值,之后开始下降。扦插前期,POD活性高有助于消除植物体内多余的氧化氢及酚类物质,降低IAA质量浓度,利于根源基的诱导。随着根系伸出和愈伤的形成,POD活性显著下降,IAA质量浓度升高,有利于根系突破皮层。与对照相比,处理8插穗POD活性达到峰值时间早于对照,且活性高于对照,说明IBA处理提高了POD的活性,对生根有一定的促进作用。
2.2.5 吲哚乙酸氧化酶(IAAO)与生根的关系 在扦插生根过程中,处理8与对照IAAO酶活性呈先上升后下降的趋势,处理8到达峰值时间较对照组早10 d,且峰值较对照高说明处理组生根较对照早(图1E)。在不定根表达期,插穗IAAO活性虽有下降,但下降幅度较小,仍维持在较高水平,这可能是抑制山木通插穗生根的原因之一。生长期IAAO活性降低幅度大,此时根系已突破皮层,利于根系的发育与生长。
2.2.6 多酚氧化酶(PPO)与生根的关系 由图1F可见:山木通扦插生根过程中,PPO活性与POD和IAAO活性的变化规律基本相同,处理8与对照的PPO活性变化均呈现 “上升—下降”的趋势,在不定根形成期达到峰值。处理8插穗PPO活性在20 d达到峰值,对照在30 d达到峰值,且处理8活性高于对照,说明外源植物生长调节物质处理提高了PPO的活性,对插穗生根起到促进作用。在愈伤组织与根源基形成时期,PPO活性升高,有利于催化酚类物质与IAA结合,形成 “IAA-酚酸复合物”,促进不定根的发生。20 d后根系伸出体外,PPO活性下降,IAA质量浓度升高,有助于根系伸长生长。
2.3 扦插生根过程中的解剖学研究
2.3.1 扦插生根过程中的外部形态观察 扦插后20 d,处理组大多数插穗基部切口处凸起,少数皮部出现白色小凸起;扦插后30 d,处理组多数插穗已生根,约3~5条,均着生在插穗基部2~3 cm处(图2A),对照组生根数量较少,且根系较短(图2B)。插穗的大量生根期,即生根表达期,伴随着愈伤组织的大量形成(图2C,2D),且形成愈伤组织的插穗未有根系长出。与对照生根插穗相比,处理8插穗根系数量多,根系长,生根质量明显优于对照(图2E,2F)。50 d时处理组插穗已有叶片长出(图2G)。
2.3.2 扦插生根过程的解剖学观察 扦插后20 d对插穗基部膨大处横切面进行观察,发现膨大的插穗基部有根源基细胞的出现(图3A),根源基细胞较其他细胞染色较深。随着根源基细胞的不断发育分裂,将周围细胞挤向外端(图3B),并进行伸长生长,迫使插条皮部开裂,不定根伸出体外(图3C,3D)。扦插后30 d,对愈伤组织进行横切面观察,发现山木通插穗虽能形成愈伤组织(图3E),但在愈伤组织中未发现根原始体。
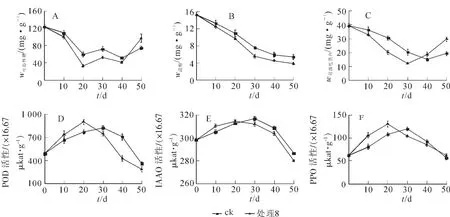
图1 山木通扦插生根过程中生理指标的变化Figure 1 Changes of physiological index during rooting cuttings of Clematis finetiana
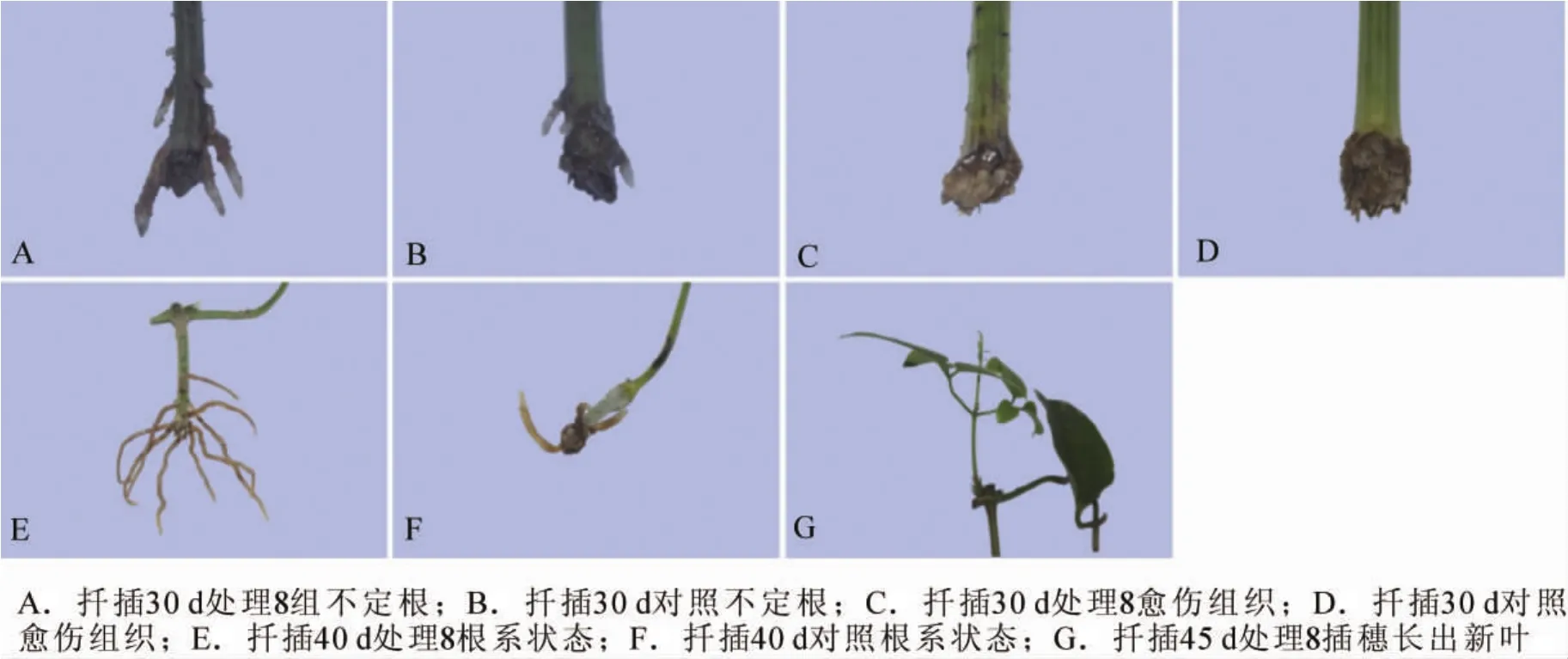
图2 山木通扦插生根过程的形态观察Figure 2 Morphological observation of C.finetiana’s rooting process
3 讨论
本研究结果表明:外源植物生长调节物质及其质量浓度、处理时间、扦插基质等4个因素对山木通扦插生根率的影响达到极显著差异(P<0.01),100 mg·L-1IBA浸泡2 h后扦插于河沙中为山木通扦插生根的最佳处理组合,生根效果最好,生根率可达22.67%。外源植物生长调节物质以IBA生根质量最好,ABT次之,NAA+IBA最差。这可能是由于IBA被植物吸收后不易转移,存留在插穗基部促进生根。植物生长调节物质质量浓度和插穗浸泡时间对生根的影响是相互的,当质量浓度大于100 mg·L-1时,山木通的生根质量随质量浓度的增加而降低,当质量浓度低于100 mg·L-1时,其生根品质随质量浓度的升高而增加;处理时间长于2 h时,高质量浓度植物生长调节物质抑制生长,山木通生根质量下降,短于2h时,低质量浓度植物生长调节物质浸泡不充分,生根质量欠佳。基质在扦插过程中除对植物起到支持和固定作用外,还为植物提高一个稳定的生根环境[10]。本研究中,河沙进行山木通扦插生根质量最佳,河沙+泥炭+蛭石次之,泥炭+珍珠岩生根质量最差,这可能与基质的通气性、透水性有关。目前,对铁线莲属植物扦插繁殖技术也有一定的研究,如对粗齿铁线莲Clematis grandi-dentata扦插研究表明:400 mg·L-1NAA处理插穗10 min,生根效果最佳[11]; 6-BA较NAA能更好地促进圆锥铁线莲Clematis terniflora生根,以50 mg·L-16-BA效果最好[12]。本试验植物生长调节物质种类与质量浓度仅有3个水平,对不同植物生长调节物质下更多质量浓度对山木通扦插生根质量的影响还有待进一步研究。
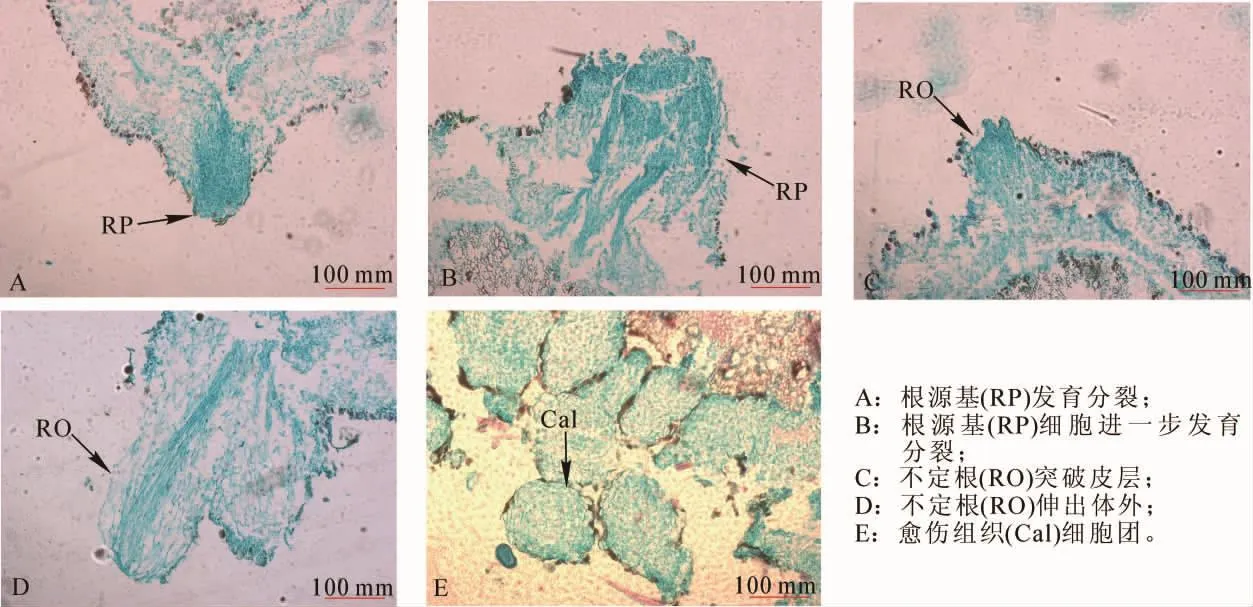
图3 山木通扦插生根过程的解剖学特征Figure 3 Anatomical features of Clematis finetiana rooting process
营养物质是插穗生根的必要条件之一,也是插穗维持机体平衡的重要能源,早有研究发现母株的营养水平对插穗生根及产生新梢具有显著影响。本试验研究表明:山木通插穗可溶性糖质量分数虽有波动,但整体变化趋势与可溶性蛋白质量分数一致,均在生根诱导和形成期下降明显,消耗的糖类和蛋白质一方面用于维持插穗的生活力和物质转化的能量,一方面用于根源基的发生。不定根形成后插穗吸收营养物质的能力增强,伴随着新叶的长出,插穗自身能够合成营养物质,糖和蛋白质质量分数回升。此结论与梁文斌等[13]对短梗大参Macropanax rosthornii生根理化性质分析的结果一致。插穗中淀粉质量分数则呈持续下降趋势,淀粉只有水解为糖类才能被植物体吸收,是插穗内可溶性糖的补充来源。经100 mg·L-1IBA处理的山木通插穗可溶性糖、淀粉及可溶性蛋白质量分数变化幅度均较对照组大,说明IBA处理有利于插穗中可溶性糖和蛋白质质量分数的积累,提高营养物质利用率,对山木通扦插生根有一定的促进作用,这与柚木Tectona grandis嫩枝扦插研究中IBA处理插穗的可溶性糖质量分数显著增加[14]相符合。另外,本研究中发现山木通扦插生根过程中伴随愈伤组织的形成,且形成愈伤组织的插穗未有根系长出,同时皮部生根也会受到影响,这可能是因为愈伤组织形成与不定根发生之间存在竞争关系,养分的供应难以支撑两者的同时发生,因此,形成愈伤的插穗皮部生根不会发生或很少发生,进而导致山木通插穗生根率低。且有研究表明,插穗愈伤组织的形成及发育对不定根的产生有抑制作用。
POD,PPO和IAAO酶通过调节插穗体内生长素IAA的含量参与山木通扦插生根过程,但作用机制各不相同,三者通过相互作用影响插穗生根。POD作用的某些产物可能是不定根发生所必须的辅助因子,促进不定根的形成[15]。在山木通扦插生根过程中,POD活性在不定根诱导期上升,生根期逐渐下降,这是因为高活性的POD氧化较多的内源IAA,利于根源基的诱导,低活性的POD减少IAA的分解,促进不定根的形成。这与宋丽红等[15]的研究结论相一致。PPO能够催化酚类物质和IAA形成 “酚酸复合物”,同时增强插穗呼吸作用,使插穗生理状态活跃,促进不定根的发生[16]。在本研究中,PPO在生根诱导期活性升高,大量生根期即生根表达期达到峰值,与前人的研究结论一致[17]。生根后期活性下降,IAA质量浓度增加,利于根系的伸长生长。IBA处理使插穗中PPO活性较对照组高,生根效果也较对照组好,这一结果与刘玉民等[18]对马尾松Pinus massoniana扦插所得的结论基本一致。离体生根过程中,高活性的IAAO使内源IAA水平降低是生根诱导期的特点之一,质量浓度低的IAA利于不定根的诱导,IAAO活性升高,高质量浓度的IAA利于根系的萌发与生长,IAAO活性下降。这与本研究中不定根诱导期和表达期插穗表现出高的IAAO活性,不定根生长期插穗IAAO活性下降的结论基本一致。另外,本研究发现山木通插穗内IAAO活性变化不显著,与其他生根率较高的插穗相比[19-20],山木通插穗内IAAO在不定根诱导期上升幅度较小,酶活状态不活跃可能是导致山木通插穗生根率低的另一原因。由于实验本身的局限性,山木通插穗生根特性与酶活性变化的关系还有待进一步研究。
[1] 章银科,周建国,高瞻.浙江铁线莲属植物资源及其开发应用前景[J].亚热带植物科学,2007,36(4):51-54.ZHANG Yinke,ZHOU Jianguo,GAO Zhan.Resources of Clematis in Zhejiang Province and its utilization prospect[J].Subtrop Plant Sci,2007,36(4):51 - 54.
[2] 张启香,胡恒康,方炎明.铁线莲 “Multi-Blue”体细胞胚诱导和植株再生[J].南京林业大学学报(自然科学版), 2010, 34(6):18 - 22.ZHANG Qixiang,HU Hengkang,FANG Yanming.Embryogenesis and plant regeneration of Clematis ‘Multi-Blue’[J].J Nanjing For Univ Nat Sci Ed,2010,34(6):18 - 22.
[3] 张启香,仲磊,方炎明,等.外源激素对铁线莲扦插生根的效应研究[J].北方园艺,2007(1):103-104.ZHANG Qixiang,ZHONG Lei,FANG Yanming.The effects of exogenous hormones on Clematis rooting [J].Northern Hortic,2007(1):103 - 104.
[4] 刘志高,季梦成,杨彦鹏,等.3种铁线莲属植物种子萌发特性研究[J].种子,2015,34(6):30-33.LIU Zhigao,JI Mengcheng,YANG Yanpeng,et al.Study on germination characteristics of three species from Clematis[J].Seed,2015,34(6):30 - 33.
[5] 巩玉静,董彩霞,周洋,等.山木通的化学成分研究[J].中国野生植物资源,2011,30(2):39-41.GONG Yujing,DONG Caixia,ZHOU Yang,et al.Studies on chemical constituents of Clematis finetiana [J].Chin Wild Plant Resour,2011,30(2):39 - 41.
[6] 邱晓春,靳凤云,黄婕,等.山木通挥发油化学成分分析[J].中草药,2009,40(12):1888-1889.QIU Xiaochun,JIN Fengyun,HUANG Jie,et al.Studies on chemical constituents of essential oil of Clematis finetiana[J].Chin Tradit Herb Drugs,2009,40(12):1888 - 1889.
[7] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:111-112.
[8] 李焕秀,王乔春,李春秀.梨芽和茎尖多酚氧化酶活性和总酚含量的初步研究[J].四川农业大学学报,1994, 2(2):218 - 222.LI Huanxiu,WANG Qiaochun,LI Chunxiu.Preliminary studies of polyphenol oxidase activities and phenolic contents in the ear bueds and stem terminals [J].J Sichuan Agric Univ,1994,2(2):218 - 222.
[9] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:123-124,188-189.
[10] 吴文勇,方品武.蓝莓嫩枝扦插繁殖技术的优化试验[J].种子,2009,28(8):88-90.WU Wenyong,FANG Pinwu.Studies on optimization softwood cutting propagation technology of blueberry [J].Seed,2009,28(8):88 - 90.
[11] 杨璧嘉,吴玉兰,保智娟,等.粗齿铁线莲扦插繁殖条件初探[J].湖北农业科学,2014,53(7):1579-1582.YANG Bijia,WU Yulan,BAO Zhijuan,et al.Cutting propagation of Clematis grandidentata [J].Hubei Agric Sci,2014,53(7):1579 - 1582.
[12] 严靖.圆锥铁线莲的繁殖生物学研究[D].南京:南京林业大学,2013.YAN Jing.Studies on the Reproductive Biology of Clematis terniflora [D].Nanjing:Nanjing Forestry University,2013.
[13] 梁文斌,聂东伶,吴思政,等.短梗大参扦插生根特性及相关生理生化分析[J].湖南农业大学学报(自然科学版), 2014, 40(5): 519 - 524.LIANG Wenbin,NIE Dongling,WU Sizheng,et al.Cutting rooting characters of Macropanax rosthornii and its physiological and biochemical analysis [J].J Hunan Agric Univ Nat Sci,2014,40(5):519 - 524.
[14] 曾炳山,黄永芳,杨懋勋,等.柚木嫩枝扦插生根过程中营养物质的研究[J].中南林业科技大学学报,2013, 33(2): 1 - 4.ZENG Bingshan,HUANG Yongfang,YANG Maoxun,et al.Study on nutrient contents of Tectona grandis Linn.shoot in the course of soft-wood cutting propagation [J].J Cent South Univ For Technol,2013:33(2):1 - 4.
[15] 宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究, 2005, 23(4): 347 - 350.SONG Lihong,CAO Banghua.Studies on activities on indoleacetic acid oxidase,polyphenol oxidase and peroxidase in cuttings of Broussonetia papyrifera during rooting process [J].J Wuhan Bot Res,2005,23(4):347 - 350.
[16] 徐丽萍,上官新晨,喻方圆.秤锤树嫩枝扦插过程中几种酶活性变化研究[J].江西农业大学学报,2009,31(2): 274 - 277.XU Liping,SHANGGUAN Xinchen,YU Fangyuan.A study on changes of same enzymes in the soft-stem cuttings of Sinojackia xyocarpa [J].Acta Agric Univ Jiangxi,2009,31(2):274 - 277.
[17] 马英姿,宋荣,宋庆安,等.凹叶厚朴扦插繁殖的生根机理研究[J].中国农学通报,2012,28(33):112-117.MA Yingzi,SONG Rong,SONG Qin’an,et al.Study on cutting propagation and rooting mechanism of Magnolia officinalis subsp.biloba [J].Chin Agric Sci Bull,2012,28(33):112 - 117.
[18] 刘玉民,刘亚敏,马明,等.马尾松扦插生根过程相关生理生化分析[J].林业科学,2010,46(9):28-33.LIU Yumin,LIU Yamin,MA Ming,et al.Analysis of relevant physiological and biochemical characteristics of Pinus massoniana during cuttings rooting [J].Sci Silv Sin,2010,46(9):28 - 33.
[19] 闫绍鹏,武晓东,王秋玉,等.欧美山杨杂种嫩枝微扦插生根相关氧化酶活性变化及繁殖技术[J].东北林业大学学报, 2011, 39(11): 5-11.YAN Shaopeng,WU Xiaodong,WANG Qiuyu,et al.Changes in relevant oxidase activities during the rooting of cuttings of Populus tremula × P.tremuloides and cutting propagation technique [J].J Northeast For Univ,2011,39(11):5 - 11.
[20] 勒栋梁,董凤祥,李宝,等.杂交榛不同枝段绿枝扦插生根特性及相关氧化酶活性变化[J].林业科学研究,2009, 22(4): 526 - 532.LE Dongliang,DONG Fengxiang,LI Bao,et al.The characteeristics of rooting and change of oxidases in different portions of softwood cuttings of hybird hazelnut[J].For Res,2009,22(4):526 - 532.
Cutting propagation technology and rooting of Clematis finetiana
ZHAO Shuang,LIU Zhigao,FENG Bin,JI Mengcheng
(College of Landscape Architecture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
S723.1;S615
A
2095-0756(2017)05-0955-08
2016-10-10;
2016-12-07
浙江省农业(林木)新品种选育重大科技专项(2016C02056-13-4)
赵爽,从事野生园林植物资源分类与应用研究。E-mail:185937456@qq.com。通信作者:季梦成,教授,从事植物分类与观赏应用研究。E-mail:mchji@zafu.edu.cn

