醛糖还原酶抑制剂对早期糖尿病肾病患者肾血流动力学参数的影响
刘春泥,袁玉红,石秀娟,饶小胖
(山东省青岛市城阳区人民医院①药剂科,②内分泌科,山东 青岛 266109)
醛糖还原酶抑制剂对早期糖尿病肾病患者肾血流动力学参数的影响
刘春泥1,袁玉红1,石秀娟1,饶小胖2
(山东省青岛市城阳区人民医院①药剂科,②内分泌科,山东 青岛 266109)
目的:探讨早期糖尿病肾病(DN)患者应用醛糖还原酶抑制剂依帕司他(ARI)治疗后肾血流动力学参数的变化。方法:选择120例早期DN患者,分为对照组68例和治疗组52例,治疗组应用ARI治疗,对照组未应用ARI治疗,均治疗3个月。治疗前后应用彩色多普勒超声测定肾血流参数,测定生化指标,并比较2组治疗前后的临床指标及肾动脉血流动力学参数。结果:2组年龄、病程、空腹血糖、舒张压、收缩压、血清尿酸、低密度脂蛋白、三酰甘油、总胆固醇、高密度脂蛋白、腰围和体质量指数比较,差异均无统计学意义(均P>0.05)。治疗3个月后,治疗组肾动脉和肾段动脉舒张期末血流速度(EDV)均明显高于治疗前及对照组(均P<0.01);治疗组肾大叶间动脉收缩期峰值血流速度及EDV均明显高于治疗前及对照组(均P<0.01),血流RI显著低于治疗前及对照组(均P<0.01)。结论:ARI可改善早期DN的肾动脉血流,增加肾动脉灌注,改善肾小球微循环。
醛糖还原酶抑制剂;依帕司他;糖尿病肾病;血流动力学
近年来,大量研究[1-8]表明,多元醇通路的激活参与了糖尿病微血管病变的发生及发展;醛糖还原酶是多元醇通路的限速酶,醛糖还原酶基因多态性与糖尿病微血管病变的发生有关。目前,醛糖还原酶抑制剂(aldose reductase inhibitors,ARI)在糖尿病肾病(diabetic nephropathy,DN),尤其早期 DN 领域的治疗报道较少,国内未见相关报道,国外有少部分研究,但结果不一致。动物实验表明,依帕司他(ARI)可引起肾脏血流动力学及病理学改变[9]。也有文献[10]报道,ARI治疗DN可能基于糖尿病神经病变的改善,本研究采用ARI治疗早期DN,观察其疗效。
1 资料与方法
1.1 一般资料 收集2015年我院收治的120例早期DN患者,男45例,女75例,年龄20~75岁,分为对照组68例和治疗组52例,均治疗3个月,治疗组应用ARI治疗,对照组未应用ARI。2组均无高血压和血脂异常,无吸烟和饮酒史,无明确肝、肾、肺功能不全病史及危重疾病,调查时无急性感染性疾病,如泌尿系统感染、呼吸系统感染、消化道感染等,无服用影响糖代谢或胰岛素代谢的药物。
1.2 诊断标准 糖尿病诊断标准参照1999年WHO标准:空腹血糖(FBG)≥7.0 mmol/L和(或)负荷后2 h血糖(2 h PG)≥11.1 mmol/L[11]。 早期 DN 通过计算尿微量白蛋白(UAlb)/尿肌酐(UCr)比值(urinary al bumin/urinary creatine rate,UACR)进行诊断。 参照国际公认的Mogenson诊断与分期标准,结合《肾脏病学(第四版)》标准分期如下[12]:①正常白蛋白尿(NAU)(UACR<30 mg/g);微量白蛋白尿(MAU)(30mg/g≤UACR<300mg/g);临床蛋白尿(CP)(UACR≥300 mg/g)。②排除引起UAlb排泄率增加的因素,如心力衰竭、泌尿系统感染、自身免疫性疾病、肾毒性药物史、肾炎及其他慢性疾病。
1.3 临床指标测定 所有患者均记录糖尿病病程、年龄、性别,测量身高、体质量、腰围(WC)、收缩压(SBP)、舒张压(DBP)。 抽空腹血,测定FBG、总胆固醇(TC)、三酰甘油(TG)、尿酸(UA)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。 留取晨尿测定 UAlb和UCr,UAlb采用免疫散射比浊法测定。
1.4 超声检查 采用Philips IU22型超声诊断仪检测肾血流参数,包括肾动脉、肾段动脉及肾大叶间动脉,分别检测上述动脉的收缩期峰值血流速度(PSV)、舒张末期血流速度(EDV)及 RI,测量 3 次取平均值。
1.5 统计学方法 使用SPSS 17.0统计软件,计量资料以±s表示,组间比较采用t检验,TG为非正态分布,取自然对数值使正态化后进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 2组一般临床指标比较(表1) 2组年龄、病程比较差异无统计学意义(P>0.05);治疗前后2组体质量指数(body mass index,BMI)、WC、SBP、DBP、FBG、TG、TC、HDL、LDL 比较差异均无统计学意义(均P>0.05)。
表1 2组治疗前后临床指标的比较(±s)
注:BMI,体质量指数;WC,腰围;SBP,收缩压;DBP,舒张压;FBG,空腹血糖;TG,三酰甘油;TC,总胆固醇;UA,尿酸;HDL,高密度脂蛋白;LDL,低密度脂蛋白。1 mmHg=0.133 kPa。
时间 组别 例数 病程(年) 年龄(岁) BMI(kg/m2) WC(cm) SBP(mmHg) DBP(mmHg)治疗前 对照组 68 8.35±4.86 53.82±11.9 23.52±4.87 82.04±5.93 120.50±18.42 69.58±11.12治疗组 52 8.45±5.46 54.02±11.9 23.64±5.12 81.51±5.52 118.90±21.16 69.36±11.64治疗后 对照组 68 8.35±4.86 53.82±11.9 23.92±4.75 82.10±5.51 120.76±18.32 69.82±10.96治疗组 48 8.45±5.46 54.02±11.9 24.00±5.43 81.62±5.34 119.02±20.98 69.94±11.37时间 组别 例数 FBG(mmol/L) TG(mmol/L) TC(mmol/L) UA(mmol/L) HDL(mmol/L) LDL(mmol/L)治疗前 对照组 68 5.96±1.82 1.25±0.81 5.05±1.22 265.05±68.26 1.49±0.33 2.76±1.05治疗组 52 6.02±1.78 1.26±0.59 4.98±1.16 254.98±54.19 1.45±0.38 2.69±1.08治疗后 对照组 68 5.85±1.79 1.22±0.78 4.97±1.30 265.01±68.24 1.42±0.25 2.78±1.06治疗组 48 6.01±1.79 1.21±0.55 4.86±1.30 254.26±53.95 1.41±0.23 2.71±1.07
2.2 2组治疗前后肾血流动力学参数比较(表2) 2组治疗前各肾动脉PSV、EDV及RI差异均无统计学意义(均P>0.05)。治疗3个月后,治疗组肾动脉和肾段动脉EDV均明显高于治疗前和对照组(均P<0.01),PSV 及 RI差异均无统计学意义(均 P>0.05);治疗组肾大叶间动脉PSV及EDV均明显高于治疗前和对照组(均P<0.01),RI则显著低于治疗前和对照组(均 P<0.01)。
3 讨论
DN是糖尿病最常见的严重微血管并发症之一,在糖尿病人群中发生率为20%~40%[13],临床表现为早期微量白蛋白尿,逐渐进展至持续临床蛋白尿、高血压及进行性肾功能损伤[14]。 既往研究[15]显示,DN的发生与纤维化、氧化应激反应、炎症反应、多种激酶通路和肾素-血管紧张素-醛固酮系统等多种通路有关。长期的慢性血糖升高会导致肾小球肥大、肾脏血管损伤、毛细血管扩张,发展成微血管损伤后又造成肾脏内血流分布和肾脏内微动脉血流动力学参数改变。本研究选择肾动脉、肾段动脉、大叶间动脉进行检测,结果显示,治疗组肾动脉和肾段动脉EDV均明显高于治疗前及对照组;治疗组肾大叶间动脉PSV及EDV均明显高于治疗前及对照组,RI则低于治疗前及对照组。PSV、EDV降低,以及RI升高能反映肾内微循环受阻、肾小球内压升高,进一步反映了肾血管内血流动力学状态。本研究结果显示应用ARI治疗后,DN患者的肾脏血流供应得到一定改善。
综上所述,ARI可改善早期DN的肾动脉血流,为临床治疗提供新途径,但广泛的临床应用还有待进一步研究,且本研究样本量相对较少,需进一步扩大样本量。
表2 2组治疗前后各肾动脉血流动力学参数比较(±s)
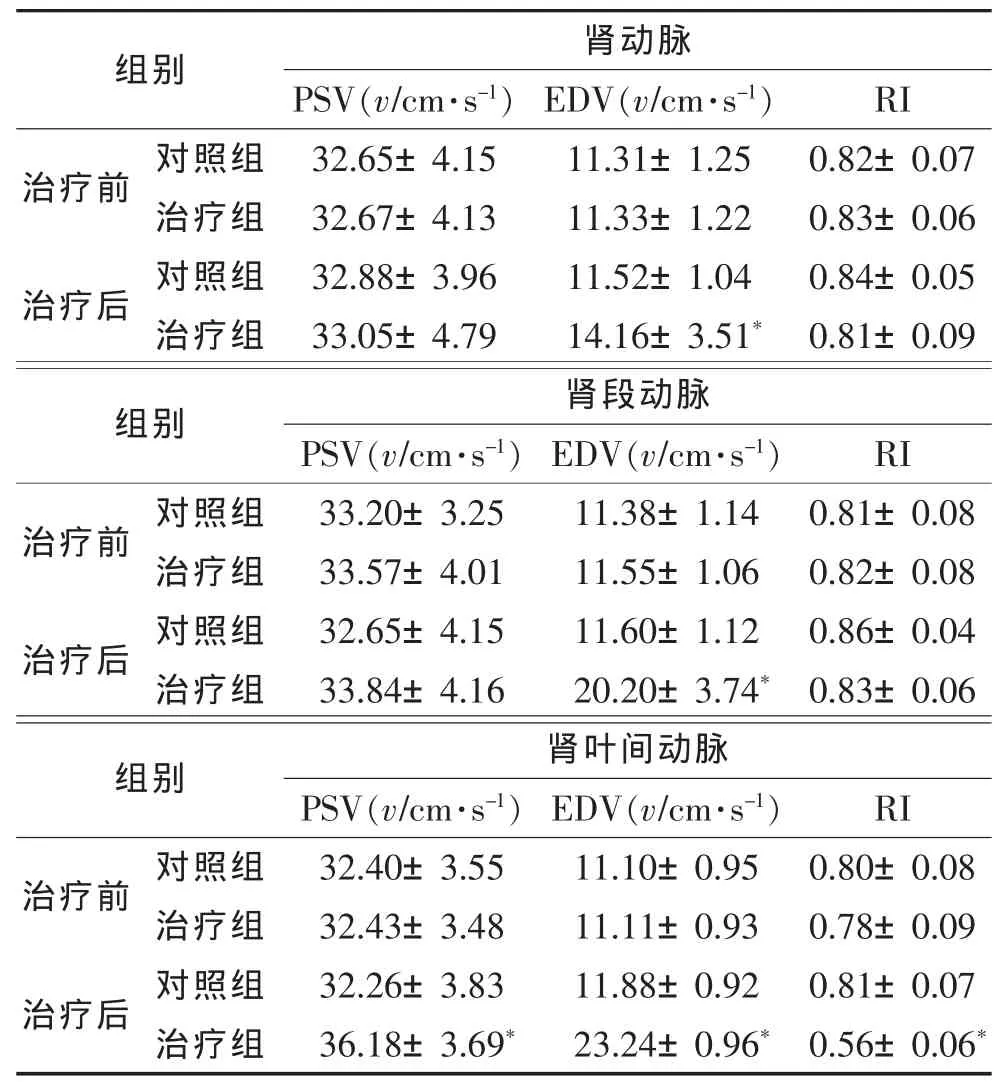
表2 2组治疗前后各肾动脉血流动力学参数比较(±s)
注:PSV,收缩期峰值血流速度;EDV,舒张末期血流速度;与本组治疗前和对照组比较,*P<0.01。
组别治疗前 对照组治疗组治疗后 对照组治疗组肾动脉PSV(v/cm·s-1) EDV(v/cm·s-1)32.65±4.15 11.31±1.25 32.67±4.13 11.33±1.22 32.88±3.96 11.52±1.04 33.05±4.79 14.16±3.51*RI 0.82±0.07 0.83±0.06 0.84±0.05 0.81±0.09组别 PSV(v/cm·s-1) EDV(v/cm·s-1)治疗前 对照组 33.20±3.25 11.38±1.14治疗组 33.57±4.01 11.55±1.06治疗后 对照组 32.65±4.15 11.60±1.12治疗组 33.84±4.16 20.20±3.74*肾段动脉RI 0.81±0.08 0.82±0.08 0.86±0.04 0.83±0.06组别 肾叶间动脉治疗前 对照组治疗组治疗后 对照组治疗组PSV(v/cm·s-1) EDV(v/cm·s-1)32.40±3.55 11.10±0.95 32.43±3.48 11.11±0.93 32.26±3.83 11.88±0.92 36.18±3.69* 23.24±0.96*RI 0.80±0.08 0.78±0.09 0.81±0.07 0.56±0.06*
[1] Dagher Z,Park YS,Asnaghi V,et al.Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy[J].Diabetes,2004,53:2404-2411.
[2] Olmos P,Futers S,Acosta AM,et al. (AC)23[Z-2]polymorphism of the aldose reductase gene and fast progression of retinopathy in Chilean type 2 diabetics[J].Diabetes Res Clin Prac,2000,47:169-176.
[3] Galvez AS,Ulloa JA,Chiong M,et al.Aldose reductase induced by hyperosmotic stress mediates cardiomyocyte apoptosis:differential effects of sorbitol and mannitol[J].J Biol Chem,2003,278:38484-38494.
[4] Cheung AK,Fung MK,Lo AC,et al.Aldose reductase deficiency prevents diabetes-induced blood-retinal barrier breakdown,apoptosis,and glial reactivation in the retina of db/db mice[J].Diabetes,2005,54:3119-3125.
[5] Obrosova IG,Li F,Abatan OI,et al.Role of poly (ADP-ribose)polymerase activation in diabetic neuropathy[J].Diabetes,2004,53:711-720.
[6] Joussen AM,Poulak IV,Le ML,et al.A central role for inflammation in the pathogenesis of diabetic retinopathy[J].FASEB J,2004,18:1450-1452.
[7] Chung SS,Chung SK.Genetic analysis of aldose reductase in diabetic complications[J].Curr Med Chem,2003,10:1375-1387.
[8] Maladkar M,Rajadhyaksha G,Venkataswamy N,et al.Efficacy,safety,and tolerability of epalrestat compared to methylcobalamine in patients with diabetic neuropathy[J].Int J Diabetes Dev Ctries,2009,29:28-34.
[9] Pedersen MM,Christiansen TS,Mogensen CE.Reduction of glomerular hyperfiltration in normoalbuminuric IDDM patients by 6 mo of aldose reductase inhibit ion[J].Diabetes,1991,40:527-531.
[10] Hotta N,Kawamori R,Fukuda M,et al.Long-term clinical effects of epalrestat,an aldose reductase inhibitor,on progression of diabetic neuropathy and other microvascular complications:multivariate epidemiological analysis based on patient background factors and severity of diabetic neuropathy[J].Diabet Med,2012,29:1529-1533.
[11] World Health Organisation.Definition,diagbnosis and classification of diabetes mellitus and its complication.Report of a WHO consultation.Part 1:diagbnosis and classification of diabetes mellitus[S].Geneva:World Health Organisation,1999.
[12] 陆再英. 内科学[M]. 北京:人民卫生出版社,2007:775-778.
[13] Alberti KG,Zimmet PZ.Report of a WHO consulation:definition,diagnosis and classification of diabetes Mellitus and its complication[J].Diabet Med,1999,16:442-443.
[14] Arora MK,Singh UK.Molecular mechanisms in the pathogenesis of diabetes nephropathy:an update[J].Vascul Pharmacal,2013,58:259-271.
[15] Nakagaki O,Miyoshi H,Sawada T,et al.Epalrestat improves diabetic wound healing via increasedexpression of never growth factor[J].Exp Clin Endocrinol Diabete,2013,121:84-89.
Effect of aldose reductase inhibitor on renal blood flow parameters of early diabetic nephropathy
LIU Chunni,YUAN Yuhong,SHI Xiujuan,RAO Xiaopang.Department of Endocrinology,People’s Hospital in Chengyang District,Qingdao,266109,China.
Objective:To investigate the effect of early diabetic nephropathy treated with aldose reductase inhibitors/epalrestat,and observe the change of renal blood flow parameters.Methods:120 early diabetic nephropathy patients were randomly assigned to control group and treatment group,68 and 52 cases.All patients were treated for 3 months.The control group was not treated with ARI,and the treatment group was treated with ARI,and the parameters of renal blood vessels before and after treatment were measured by color high resolution ultrasound system.SPSS 16.0 software was used for statistical treatment.Results:Age,course of disease,FBG,DBP,SBP,SUA,LDL,TG,TC,HDL,WC and BMI were similar before and after the treatment,There was no significant difference (P> 0.05).After 3 months of treatment,the treatment group of renal artery and renal artery end diastolic velocity (EDV) were significantly higher than the control group (P<0.01),treatment group with lobar artery peak systolic velocity (PSV) and EDV levels were significantly higher than the control group (P<0.01).The blood flow resistance index (RI) was significantly lower than that of the control group (P<0.01).Conclusion:Aldose reductase inhibitor/epalrestat can improve the blood flow of renal artery of early DN,increase renal artery perfusion,improve glomerular microcirculation,effectively delay the progression of renal disease.
Aldose reductase inhibitors;Epalrestat;Diabetic nephropathies;Hemodynamic
2017-01-03)

10.3969/j.issn.1672-0512.2017.05.009
青岛市优秀医学人才计划项目(2015040)。
饶小胖,E-mail:123raoxiaopang@163.com。

