海水浸泡与日晒对皮肤功能影响的研究
翁巧玲,桑军军,吴 洁,曾德华,陈向齐,陈胜平
• 论 著 •
海水浸泡与日晒对皮肤功能影响的研究
翁巧玲,桑军军,吴 洁,曾德华,陈向齐,陈胜平
目的 观察大鼠模拟海训战士经海水浸泡及日光照射后的皮肤变化,探讨海水和日光对皮肤的影响。方法 海水浸泡及部分联合模拟日光(长波紫外线+ 中波紫外线)照射SD大鼠,每周5次,共4周,观察照射部位皮肤的外观、含水量、组织病理改变,分析比较皮肤含水量、角质形成细胞层数。结果 大鼠最小红斑量(MED)平均值1 443.6 mJ/cm2;海水浸泡或紫外线照射均可引起皮肤含水量下降、角质屏障功能受损,并且联合干预后变化更明显。组织病理改变示海水浸泡或紫外线照射均可引起角质形成细胞增殖,但联合干预后变化无加剧。结论 在海水浸泡后光照会加重光损伤和光老化,提示战士海训时要注意加强防护。
光老化;海水浸泡;日光;光损伤
[J Pract Dermatol, 2017, 10(4):193-196]
部队濒海训练是针对渡海登陆作战的一项军事训练项目。濒海训练时官兵所接受的紫外线照射强度很大,受海水浸泡时间长,导致官兵在濒海训练时的皮肤病患病率明显高于训练前。为了研究海水浸泡后光照对皮肤的影响,本研究以大鼠为模型,观察海水浸泡及光照后皮肤的损伤情况,以期为战士训练时皮肤保护提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠40只,大鼠全身皮肤无病变,体重400 g左右,均购于福建医科大学动物中心[动物中心许可证号SYXK( 闽) 2012-0001,实验动物质量合格证NO0002401],饲养于南京军区福州总医院比较医学科屏障环境[SYXK( 闽) 2013-0004]。
1.1.2 主要试剂及仪器 SUV日光紫外线模拟器[中波紫外线(UVB)发射光谱280~320 nm,长波紫外线(UVA) 发射光谱 320~400 nm,UVA+UVB发射光谱290~400 nm,上海希格玛高技术有限公司] ;红海珊瑚盐7 kg/22 kg(以色列红海有限公司);规格1 200 ml圆柱状储物罐(永辉超市股份有限公司);雅舒美皮肤水分检测仪(千千一线电子科技有限公司);盐酸氯胺酮注射液2 ml:0.1 g(福建古田药业有限公司,批号1505222);BX51 奥林巴斯显微镜(日本 HITACHI 公司);苏木精 -伊红(HE)染色试剂;S8060 Sirius Red、TR-2011弹性纤维染色液(福州市鼓楼区康华生物技术有限公司)。
1.2 方法
1.2.1 动物分组 将40只健康SD大鼠随机分为5组,每组 8只,最小红斑量(MED)组;空白组(A组);海水浸泡6 h/d(B组);光照1 MED(C组);海水浸泡6 h/d+光照1 MED(D组)。均用医用剪刀剪除大鼠颈部、背部、臀部区域内毛发,以后每次海水浸泡前用剃须刀剃除该部位的毛发。
1.2.2 MED计算 利用SUV日光紫外线模拟器UVA+UVB输出装置,其具有8个孔,输出口单孔面积≥80 mm2,排列方式如图1。第1~8孔输出辐照强度值依次以60%~80%逐级递减,多次测量其贴壁辐照强度取平均值,
第1~8孔辐照强度值分别为62.29 mW/cm2、43.61 mW/cm2、29.21 mW/cm2、22.12 mW/cm2、17.08 mW/cm2、12.14 mW/cm2、8.02 mW/cm2、5.25 mW/cm2。随后将 SD 大鼠背部皮肤置于SUV日光紫外线模拟器UVA+UVB输出装置光源正下方,保证输出口8个孔均匀无缝紧贴皮肤,照射同时注意保护大鼠眼睛免于光照,定时器调为180 s,从第1~8孔辐照剂量值分别为11 212.2 mJ/cm2、7 849.8 mJ/cm2、5 257.8 mJ/cm2、3 981.6 mJ/cm2、 3 074.4 mJ/cm2、2 185.2 mJ/cm2、1 443.6 mJ/cm2、945 mJ/cm2。随后第24、48、72 h观察皮肤改变。
1.2.3 海水浸泡 根据红海珊瑚盐说明书,1 L蒸馏水配33.4 g红海珊瑚盐作为浸泡海水,浸泡时每只大鼠放一个储蓄罐,确保大鼠背部皮肤始终浸泡于海水中,并可采取自由体位,间断给予饮水。每周海水浸泡5 d,6 h/d,连续4周,并观察其皮肤外观改变。
1.2.4 海水浸泡联合模拟日光照射 先将SUV日光紫外线模拟器输出装置改为大透镜,用避光锡纸遮盖大部分光源,只取其中央直径2 cm光源。海水浸泡后将SD 大鼠放置于距离光源(UVA + UVB)30 cm 处的水平面上照射,每天照射前观察动物背部皮肤有无改变并记录。根据大鼠最小红斑量及光源能量功率,得出C、D组照射时间34.2 s。每周海水浸泡+日光照射5 d,连续4周,并观察其皮肤外观改变。
1.2.5 含水量测定 A~D组每次海水浸泡前、后,用雅舒美皮肤水分检测仪测量所有大鼠背部皮肤含水量。
1.2.6 取材与组织病理 经实验4周后,处死动物迅速取背部光老化处皮肤组织块(0.1~0.2 g),置于甲醛中浸泡。行HE常规染色、弹性纤维染色(Gomori醛复红染色),观察大鼠皮肤组织病理改变。
1.3 统计学方法
使用SPSS 18.0软件进行分析,所有测定指标均采用所得数值均数±标准差,统计方法使用单因素方差分析和LSD-t检验,P<0.05认为有统计学意义。
2 结果
2.1 MED的计算
MED是指在一定的光源、距离下,特定的个体、部位接受光照后24 h产生肉眼刚可观察到的红斑所需的剂量。大部分大鼠第7号孔为MED照射剂量(图1),计算出大鼠MED平均值为1 443.6 mJ/cm2。
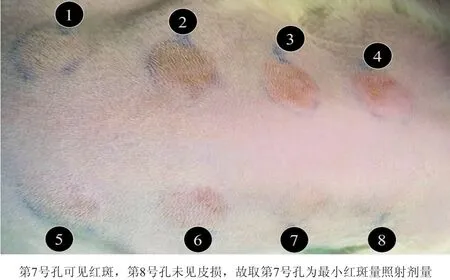
图1 大鼠腹部最小红斑量测定
2.2 肉眼观察
肉眼可见A组皮肤色泽正常,弹性好;B组皮肤潮红,毛细血管扩张;C组光照处可见红斑及少许鳞屑,表面粗糙;D组光照处可见局部斑块和糜烂,皮肤松弛,弹性差(图2)。
2.3 含水量比较
A~D组皮肤含水量的比较见表1。 A~D组角质层屏障功能受损主要体现在含水量值,B、C、D组与 A组含水量比较,差异均有统计学意义(P<0.05),表示海水浸泡或(和)紫外线照射均可引起角质层屏障功能受损;B、C组与 D组含水量比较,差异均有统计学意义(P<0.05),表示海水浸泡联合紫外线照射引起角质层屏障功能受损均比单独海水浸泡或者紫外线照射明显。

表1 不同组别大鼠表皮含水量变化比较 (x¯±s,%)
2.4 组织病理学改变
A组HE染色示皮肤表皮正常,约1~3层细胞厚度,真皮胶原纤维组织细腻,无炎性细胞浸润,弹性纤维染色可见弹性纤维细长,无断裂;B组HE染色示表皮增厚伴板层状角化过度、颗粒层增厚;C组HE染色示表皮角化过度,表皮棘细胞间水肿,表皮内水疱形成,真皮浅层胶原纤维组织增粗、断裂,急慢性炎性细胞浸润伴红细胞外溢;D组HE染色示表皮明显增厚,约6~7层细胞厚度,见致密型角化过度、角化不全,局灶Munro微脓疡,表皮细胞间水肿伴基底层显著空泡化变性,局灶小水疱形成;真皮浅层水肿,淋巴单核及中性粒细胞浸润,显著红细胞外溢。真皮浅层胶原纤维组织增粗伴嗜碱性变性;弹性纤维可见弹性纤维断裂、增粗,局灶聚集成团(图3a-3d)。

图2 大鼠皮肤肉眼观察

图3 各组小鼠皮肤组织病理(a-d:HE染色×200;e-g:弹性纤维染色×200)
A组弹性纤维染色示弹性纤维细长,无断裂;B组弹性纤维染色示部分弹性纤维断裂、增粗;C组弹性纤维染色示弹性纤维断裂、增粗,小部分聚集成团;D组弹性纤维染色示弹性纤维断裂、增粗,局灶聚集成团(图3 e-3h)。
A~D组大鼠HE染色角质形成细胞层数分别为(3.8±0.6)层、(5.2±1.2)层、(6.4±1.3)层、(6.0±0.8)层。角质形成细胞层数间接体现了皮肤厚度,B、 C 、D组与 A组角质形成细胞层数比较,差异均有统计学意义(P<0.05),显示海水浸泡或(和)紫外线照射均可引起角质形成细胞增殖;B、C组与 D组角质形成细胞层数比较,差异均无统计学意义(P>0.05),显示海水浸泡联合紫外线照射引起角质形成细胞增殖与单独海水浸泡或紫外线照射无差别。
3 讨论
皮肤是机体抵御外界侵害的第一道防线,同时皮肤作为直接与外界环境接触的最大器官,容易受到有害因素的影响,而导致形态和功能的改变。角质层是防止体内水分丢失的主要屏障结构,呈弱酸性,经过碱性海水浸泡后,可引起角质层超微结构的改变,且随着浸泡时间的延长,变化愈明显[1]。潘敏鸿等[2]研究表明,长时间海水浸泡可导致表皮角质细胞的凋亡和增殖,可引起表皮角质层脂质超微结构的改变,从而导致表皮屏障的损伤;赵晓明等[3]研究表明,经海水浸泡后皮肤炎症因子水平升高,局部炎症加剧。本实验A与B组含水量以及角质形成细胞层数的对比表明,海水浸泡后其含水量明显下降、角质形成细胞代偿性增殖,角质屏障功能受损,从而使紫外线对皮肤损伤加剧。
日光中的紫外线是造成光老化的重要原因[4-6]。紫外线照射对真皮纤维具有两种破坏作用,一种为分解纤维细胞,另外一种抑制纤维细胞合成。纤维细胞是皮肤真皮中最主要的细胞类型,其各种生物学特性改变是皮肤光老化、光损伤形成的最重要基础[7-9]。本实验提出紫外线照射联合海水浸泡后弹性纤维的形态发生异常改变,出现断裂、增粗,局灶聚集成团等,这与Kvaskoff[10]和Seite等[11]实验研究结果相一致,被称之为日光性弹性纤维变性,此种变化不仅会出现在光老化皮肤中,还会出现在一些由紫外线照射引起的皮肤癌前病变和恶性肿瘤中,如日光性角化病(AK)、皮肤黑素瘤[10]、鳞状细胞癌[12]。故说明日光性弹性纤维变性是光老化皮肤的一个组织学特征。研究表明,紫外线辐射,特别是 UVB的辐射是诱发系统性红斑狼疮(SLE)患者角质形成细胞凋亡的主要因素[13],并且能增加皮肌炎和狼疮患者的光敏性皮损[14]。其中74%的鳞状细胞癌都是出现在长期曝晒部位[15]。另外紫外线辐射还可诱发AK,其为体内早期阶段侵袭性鳞状细胞癌的原位癌[16]。另外有学者提出日光照射约在4周时,真皮出现不可修复的损伤,最终导致光损伤特征性的皮肤皱纹表现,肉眼可见红斑、鳞屑、表面粗糙、皮肤松弛、弹性差等表现,与本实验一致。
虽然关于海水或光照对皮肤的影响已有研究,但关于海水浸泡联合日晒对皮肤屏障和免疫功能影响的研究少见报道。本研究模拟战士海训的实际情况,在海水浸泡的基础上模拟光照处理,探究两者叠加对皮肤的影响。在外观上,海水浸泡后光照较单独光照或海水浸泡出现的光损伤严重,组织病理上出现表皮细胞间水肿伴基底层显著空泡化变性,局灶小水疱形成;真皮浅层水肿,淋巴单核及中性粒细胞浸润,显著红细胞外溢,较单纯海水浸泡或光照,损伤更明显,皮肤屏障功能破坏更加严重,从而易发生多形性日光疹、日光性荨麻疹、光化性痒疹、光刺激性接触性皮炎。濒海训练时官兵所接受的紫外线照射强度大,受海水浸泡时间长,日光曝晒加之海水浸泡,可出现光损伤及光老化,表现为红斑,水疱或皮肤粗糙松弛,出现皱纹和色斑,甚至良性或恶性肿瘤[4]。战士们长期处于日光曝晒加之海水浸泡的环境中可诱发结缔组织病(红斑狼疮、皮肌炎)以及皮肤肿瘤(日光性角化病、鳞状细胞癌),造成非战斗力减员。对光引起的皮肤损伤的防护,包括一般防护、遮光剂、药物3种。结合战士们实际情况,建议可适当减少紫外线辐射最强时(10: 00~14: 00)训练时间,并且减少持续海水浸泡时间,可间歇性进行。另外,因为外源性光敏感物接触皮肤或吸收后经血液到达皮肤后,紫外线照射下使皮肤中某些正常成分发生变化,形成新抗原,引起局部的光损害[17,18]。故需避免使用光敏性的食物及药物,如菠菜、灰菜、紫云英等,药物如四环素族类、喹诺酮类、磺胺及苯噻嗪类等。对有光敏感的战士,可适当使用B族维生素和β胡萝卜素等,此外羟氯喹药物具有很好的抗炎和抗光敏作用。
[1] Tobias SW, Matthew CB, Dubose DA, et al. Comparison of oxygenated perfuorocarbon and humidifed oxygen for rewarming hypothermic miniswine [J]. Mil Med, 2001, 166(10):853-861.
[2] 潘敏鸿, 姜少军, 吴波, 等. 海水浸泡对表皮细胞凋亡和增殖的影响 [J]. 医学研究生学报, 2007, 20(9):916-919.
[3] 赵晓明, 王远征, 郝光辉, 等. 海水浸泡对模拟海训皮肤擦伤大鼠炎症因子的影响 [J]. 临床军医杂志, 2013, 41(3):219-221.
[4] Rabe JH, Mamelak AJ, McElgunn PJ, et al. Photoaging: mechanisms and repair [J]. J Am Acad Dermatol, 2006, 55(1):1-19.
[5] Kang S, Fisher GJ, Voorhees JJ. Photoaging: pathogenesis, prevention,and treatment [J]. Clin Geriatr Med, 2001, 17(4):643-659, v-vi.
[6] 陈劲奕, 秦琴, 雷霞. Nrf2/ARE在抗光老化中的作用及机制研究进展 [J]. 实用皮肤病学杂志, 2016, 9 (5):319-321.
[7] Fisher GJ, Wang ZQ, Datta SC, et al. Pathophysiology of premature skin aging induced by ultraviolet light [J]. N Engl J Med, 1997,337(20):1419-1428.
[8] Kang S, Fisher GJ, Voorhees JJ. Photoaging and topical tretinoin:therapy, pathogenesis, and prevention [J]. Arch Dermatol, 1997,133(10):1280-1284.
[9] 李雪莉, 黄玉成, 李振鲁. 1319nmND:YAG激光治疗皮肤光老化的动物实验研究 [J]. 实用皮肤病学杂志, 2012, 5 (1):12-15.
[10] Kvaskoff M, Pandeya N, Green AC, et al. Solar elastosis and cutaneous melanoma: a site-specifc analysis [J]. Int J Cancer, 2015,136(12):2900-2911.
[11] Seite S, Zucchi H, Septier D, et al. Elastin changes during chronological and photo-ageing: the important role of lysozyme [J]. J Eur Acad Dermatol Venereol, 2006, 20(8):980-987.
[12] da STA, Coelho G, Lorenzetti BA, et al. Expression of apoptotic, cell proliferation regulatory, and structural proteins in actinic keratosis and their association with dermal elastosis [J]. J Cutan Pathol, 2007,34(4):315-323.
[13] Reefman E, Kuiper H, Jonkman MF, et al. Skin sensitivity to UVB irradiation in systemic lupus erythematosus is not related to the level of apoptosis induction in keratinocytes [J]. Rheumatology (Oxford),2006, 45(5):538-544.
[14] Dourmishev L, Meffert H, Piazena H. Dermatomyositis: comparative studies of cutaneous photosensitivity in lupus erythematosus and normal subjects [J]. Photodermatol Photoimmunol Photomed, 2004,20(5):230-234.
[15] Trakatelli M, Ulrich C, del MV, et al. Epidemiology of nonmelanoma skin cancer (NMSC) in Europe: accurate and comparable data are needed for effective public health monitoring and interventions [J].Br J Dermatol, 2007, 156(3):1-7.
[16] Hauschild A, Popp G, Stockfleth E, et al. Effective photodynamic therapy of actinic keratoses on the head and face with a novel, selfadhesive 5-aminolaevulinic acid patch [J]. Exp Dermatol, 2009,18(2):116-121.
[17] Booth AV, Mengden S, Soter NA, et al. Chronic actinic dermatitis [J].Dermatol Online J, 2008, 14(5):25.
[18] 夏志宽, 王文岭, 杨蓉娅. 慢性光化性皮炎18例诊治分析 [J]. 实用皮肤病学杂志, 2013, 6(1):15-16.
The study on the effect of seawater immersion and sunlight exposure on the skin of rats
WENG Qiao-ling,SANG Jun-jun,WU Jie,et al
Fuzhou General Hospital of PLA & Dongfang Hostpital Affiliated to Xiamen University, Fuzhou 350001, China
Objective To observe the changes of the skin of rats after seawater immersion and sunlight exposure, and to investigate the effect of seawater and sunlight on the skin. Methods The SD rats were immersed by seawater and exposed to simulated light (UVA +UVB), 5 times per week for 4 continuous weeks. The changes of skin appearance, moisture content and pathology were observed. Results The minimal erythema dose (MED) of the rats was 1 443.6 mJ/cm2. Either seawater immersion or sunlight caused the decrease of moisture content of skin and dysfunction of the skin barrier, and the changes were more obvious after combined intervention. Histopathological fndings revealed elastic fber fracture, thickening and focal aggregation in the group of sequential seawater immersion or sunlight. The proliferation of keratinocytes was induced by seawater immersion or sunlight exposure, but the prognosis didn’t become worse when the interventions were combined. Conclusion Exposure to sunlight after seawater immersion may exacerbate the photoaging and photodamage, which remind that the soldiers should strengthen the protection during sea training.
Photoaging;Seawater immersion;Light;Photodamage
R739.5
A
1674-1293(2017)04-0193-04

翁巧玲
2016-11-21
2017-03-07)
(本文编辑 耿建丽)
10.11786/sypfbxzz.1674-1293.20170401
南京军区军队医药卫生科研基金(MS124)
350001 福州,解放军福州总医院/厦门大学附属东方医院(翁巧玲,桑军军,吴洁,曾德华,陈向齐,陈胜平)
翁巧玲,住院医师,研究方向:紫外线相关皮肤疾病、皮肤病理,E-mail: 982664536@qq.com
陈胜平,E-mail: chen-shengping@126.com

