泌尿系统畸形胎儿染色体核型及CMA产前诊断
商梅娇 周祎*
(1.厦门大学附属第一医院 产科,福建 厦门 361003;2.中山大学附属第一医院 妇产科胎儿中心,广东 广州 510080)
泌尿系统畸形胎儿染色体核型及CMA产前诊断
商梅娇1周祎2*
(1.厦门大学附属第一医院 产科,福建 厦门 361003;2.中山大学附属第一医院 妇产科胎儿中心,广东 广州 510080)
目的探讨常规G显带染色体核型分析及染色体微阵列分析(chromosomal microarray analysis,CMA)技术在先天性泌尿系统畸形胎儿产前诊断中的应用价值及发病相关性,探讨泌尿系统畸形可能的致病机制。方法回顾性研究134例产前超声检查发现胎儿泌尿系统畸形并行常规G显带染色体核型分析的病例,其中30例按照Affymetrix CytoScan HD 芯片平台的操作手册对胎儿及部分父母的DNA进行消化、连接、PCR、片段化、标记、杂交、洗染并全基因组扫描,采用配套的CHAS软件进行结果分析。结果①134例泌尿系统畸形病例,128例胎儿染色体正常;2例异常,分别为46,XY,del(21)(qter-p11:)和46,XY,der(22)t(Y,22)(q11;q13.3),4例染色体多态性,染色体异常率为1.50%(2/134)。②30例CMA结果均成功获得分析,19例结果正常,检出11例CNVs,CNVs检出率为36.7%(11/30);30例行CMA检测病例仅1例常规染色体核型分析异常(CMA亦检出病理性CNVs),余29例均正常,泌尿系统畸形但染色体核型正常胎儿CNVs检出率为34.5%(10/29)。③11例CNVs,20%(6/30)考虑为良性CNVs,16.7%(5/30)为病理性CNVs。6例良性CNVs胎儿,其中5例行父母亲外周血CMA检测,发现均为来源父系或母系的遗传。5例病理性CNVs胎儿,有3例行父母外周血CMA检测,发现均为新发CNVs。29例泌尿系统畸形但染色体核型正常胎儿的病理性CNVs检出率为13.8%(4/29)。④根据产前超声表现将30例泌尿系统畸形病例分为孤立性泌尿系统畸形(24例)和泌尿系统畸形合并其他畸形(6例),孤立性泌尿系统畸形胎儿的CNVs检出率为37.5%(9/24),其中病理性CNVs为20.8%(5/24),合并其他畸形胎儿的CNVs检出率为33.3%(2/6),无病理性CNVs。两组病理性CNVs检出率差异无统计学意义。⑤本研究检出1例新发的17q12缺失综合征病例,与肾囊肿和糖尿病综合征(renal cysts and diabetes syndrome,RCAD)重叠,内含与肾脏发育密切相关的HNF1β基因。结论泌尿系统畸形胎儿常规染色体核型异常发生率为1.50%。通过CMA技术发现泌尿系统畸形但常规染色体核型正常胎儿CNVs检出率为34.5%,其中16.7%为病理性CNVs,CMA可明显提高遗传性疾病的诊断率。本研究发现孤立性泌尿系统畸形和多发系统畸形胎儿的病理性CNVs检出率差异无统计学意义。17q12缺失综合征可能是导致先天性泌尿系统畸形的原因之一,其发病与HNF1β基因单剂量不足相关。
胎儿泌尿系统畸形;染色体核型;染色体微阵列分析;产前诊断;遗传咨询
目前引起胎儿泌尿系统畸形的病因仍不清楚,染色体或基因异常是胎儿泌尿系畸形的主要原因之一。在泌尿系统畸形胎儿中,异常核型发生率约为5%~12%[1, 2]。从而得知虽然一部分患者可检出染色体核型异常,但仍有大部分患者超声提示泌尿系统畸形,且出生后预后不好,但是染色体核型却正常,出现表型与染色体核型不一致的情况。2012年发表在《美国人类遗传学杂志》的大样本多中心研究表明,多发畸形病例(包括泌尿系统畸形)22.5%检出基因CNVs,孤立性泌尿系统畸形病例检出率为14.5%,而在正常对照组人群中CNVs的检出率仅为0.2%[3]。
染色体微阵列分析(chromosomal microarray analysis,CMA)是一项新兴基因芯片技术,可诊断微缺失或微重复,即拷贝数变异(copy number variants,CNVs)。因此,我们对泌尿系统畸形胎儿进行CMA分析,筛查可能致病CNVs,探讨泌尿系统畸形与CNV之间的关系,寻找可能致病基因,从而更好地指导临床咨询。
1 资料与方法
1.1 研究对象 所有各孕期超声发现泌尿系统畸形的胎儿,包括肾积水、后尿道瓣膜、多囊肾发育不良、异位肾、重复肾、马蹄肾等,合并或不合并其他系统畸形。
1.2 研究方法 回顾性研究2013年4月至2014年2月在中山大学附属第一医院胎儿中心因产前超声检查发现胎儿泌尿系统畸形并行常规G显带染色体核型分析的134例病例,其中30例按照Affymetrix CytoScan HD 芯片平台的操作手册对胎儿及部分父母的DNA进行消化、连接、PCR、片段化、标记、杂交、洗染并全基因组扫描,采用配套的CHAS软件进行结果分析。
2 结果
2.1 染色体结果 本研究超声发现134例泌尿系统畸形病例,128例胎儿染色体正常,2例异常,分别为46,XY,del(21)(qter-p11:)(未查CMA)和46,XY,der(22)t(Y,22)(q11;q13.3)[CMA结果提示arrYq11.221q11.23(18212359-28799937)×2,22q13.2q13.33(43866279-51197838)×1],4例染色体多态性,分别为46,XY,13pstk+、46,X,Yqh+、46,X,inv(Y)(p11;q11)及46,XX,15p+,染色体异常率为1.50%(2/134)。
2.2 CMA结果 因胎儿泌尿系统畸形行CMA检测共30例,结果均成功获得分析,19例结果正常,11例阳性CNVs,CNVs检出率为36.7%(11/30)。11例阳性CNVs,20%(6/30)考虑为良性CNVs(表1、图1);16.7%(5/30)为病理性CNVs(表2、图2)。根据产前超声表现分为孤立性泌尿系统畸形(24例),和泌尿系统畸形合并其他畸形(6例),其CNVs检出情况见表3。两组病理性CNVs检出率差异无统计学意义。
这30例病例均同时行脐血常规染色体核型分析,1例染色体核型异常,为染色体不平衡易位,CMA同时检测出异常,余病例染色体核型均正常。19例CMA结果正常的病例,染色体核型结果亦均正常,在11例CMA结果异常病例,仅1例不平衡易位在常规染色体核型分析中体现,余病例在常规染色体核型分析中均未检测出。29例染色体核型正常病例中,通过CMA技术检出10例CNVs异常,在染色体核型正常病例中CNVs异常检出率为34.5%,其中病理性CNVs检出率为13.8%。
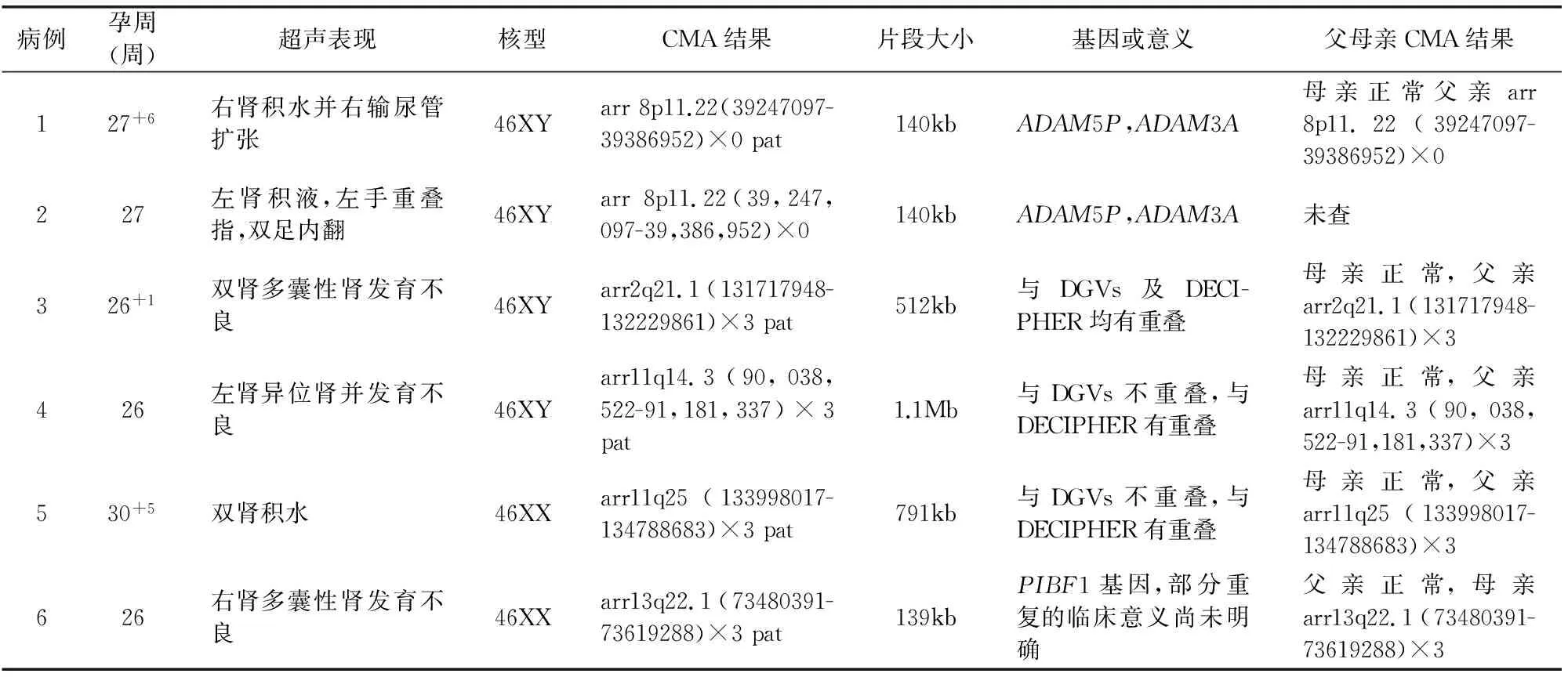
表1 6例良性CNVs的病例特点
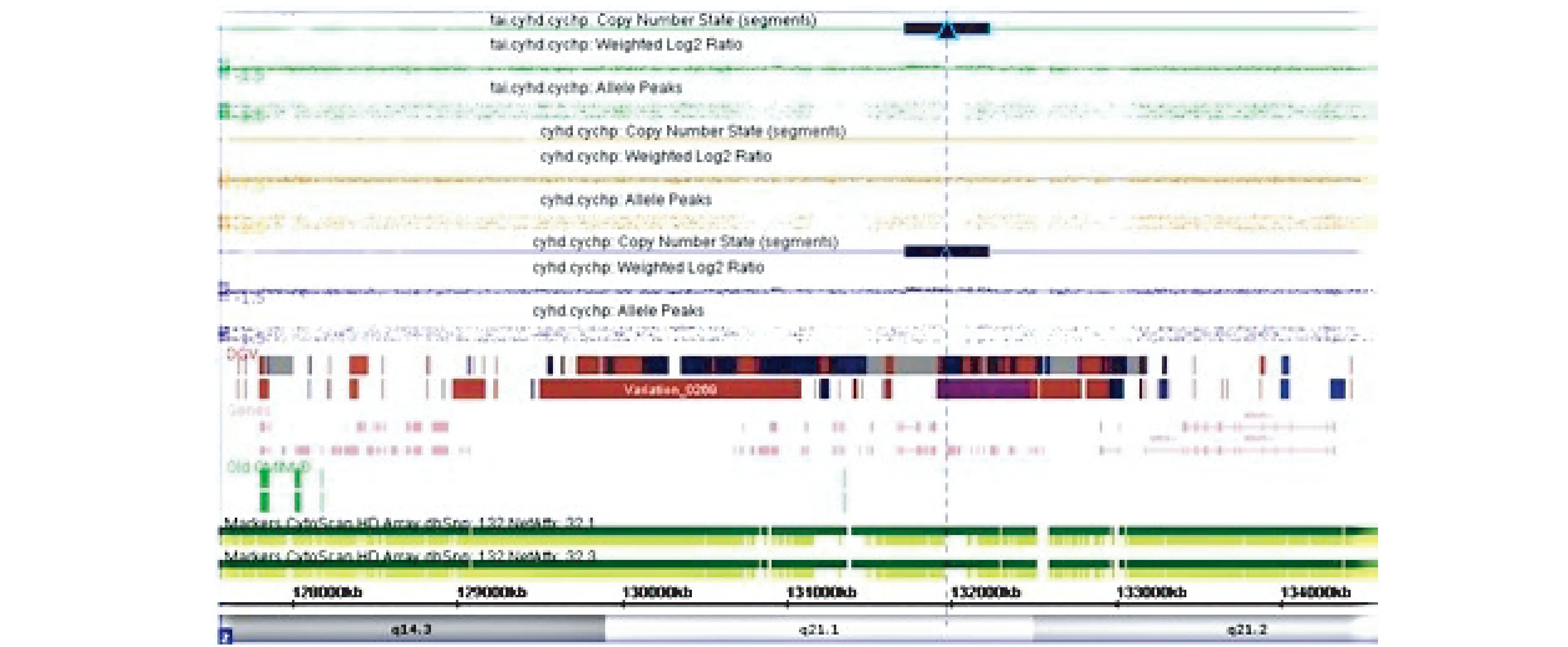
图1 良性CNVs病例3从上而下分别代表胎儿、母亲、父亲的CNVs,最下面显示重复的染色体位置,蓝色代表重复片段,胎儿重复片段同父亲,考虑父亲遗传
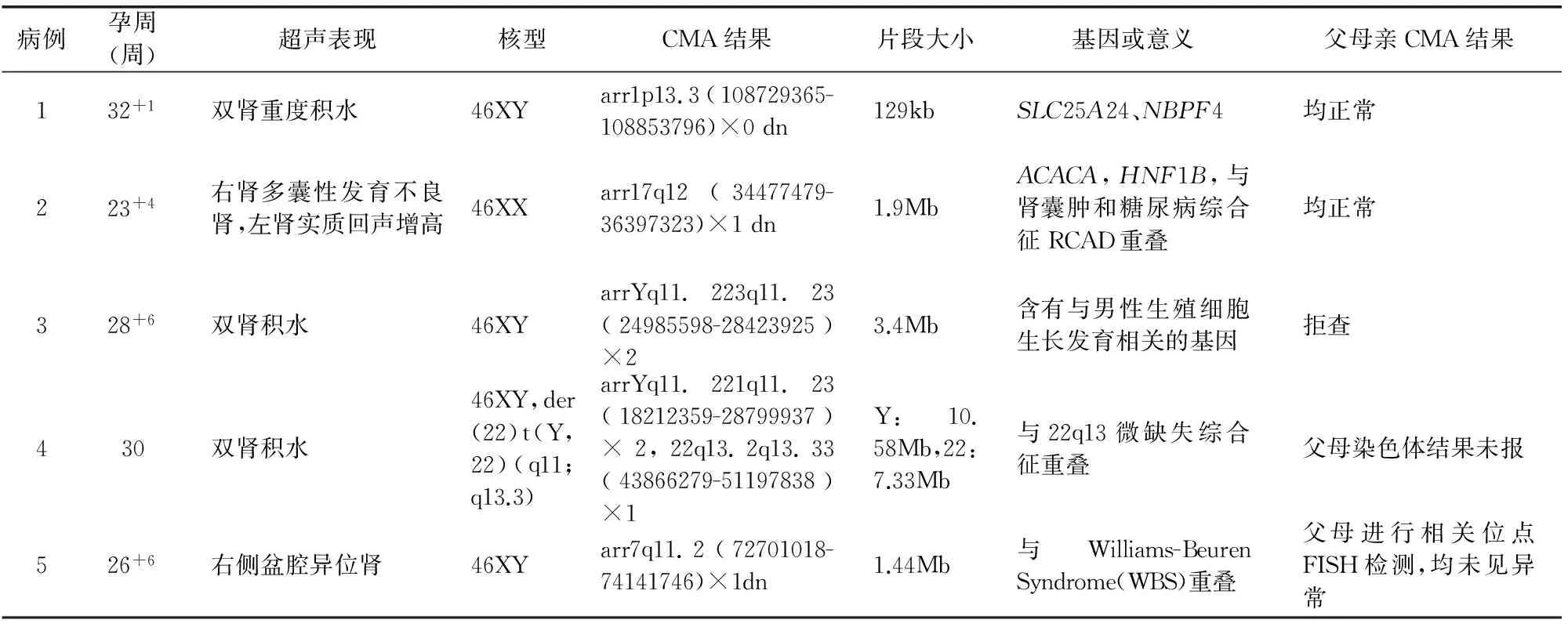
表2 5例病理性CNVs的病例特点
注:*:染色体核型:46XY,der(22)t(Y,22)(q11;q13.3);CMA结果:arrYq11.221q11.23(18212359-28799937)×2,22q13.2q13.33(43866279-51197838)×1
本研究检出1例新发的17q12缺失综合征病例,与肾囊肿和糖尿病综合征(renal cysts and diabetes syndrome,RCAD)重叠,内含与肾脏发育密切相关的HNF1β基因。
3 讨论
3.1 泌尿系统畸形与染色体核型异常的关系 在泌尿系统畸形胎儿中,异常核型发生率约为5%~12%[4, 5]。在单侧多囊性肾发育不良胎儿中,3%出现染色体异常[6]。本研究泌尿系统畸形胎儿染色体异常发生率为1.5%,低于文献报道,考虑病例选择存在偏倚。综上所述,建议对泌尿系畸形胎儿行染色体核型检查,部分如双肾多囊肾可行基因诊断。
但是在临床上我们经常会遇到临床表型和染色体核型不一致的情况,虽然泌尿系统畸形胎儿产前诊断行胎儿染色体核型分析可检出小部分异常结果,多数胎儿染色体为正常。
3.2 CMA与常规染色体G显带的比较 CMA技术的发展大大提高了小片段基因微缺失或微重复的诊断,而这些是传统常规染色体核型分析无法诊断的,提高了遗传疾病的诊断率。使用CMA检测优于传统常规染色体培养的优点还可分析没有生命力的组织,比如流产绒毛、宫内死胎样本[7],使得因染色体遗传问题而引起的流产、死胎的检出率明显提高。文献报道,在先天性结构畸形、神经认知发育异常疾病的遗传诊断中,在染色体核型分析的基础上,CMA可额外诊断出12%~15%的遗传性疾病,因此学者甚至提出将CMA检查作为这类患儿的首选检查[8-10]。
在本研究中,共检测30例病例,仅有1例常规染色体核型分析结果异常,为染色体不平衡易位,CMA同时检测出异常。而在这29例染色体核型正常胎儿中,通过CMA分析检出34.5%(10/29)的CNVs,其中13.8%(4/29)病理性CNVs。可见CMA检查可明显提高遗传性疾病的诊断率。
将CMA检查应用于产前诊断,目前已有小规模的研究报道,主要针对染色体异常可能性较大的胎儿,比如超声发现胎儿结构畸形的胎儿[10-12]。发表在《新英格兰杂志》的一项较大规模的CMA应用于产前诊断研究发现,在染色体核型正常的分组病例中进一步行CMA检测,CNVs检出率为36.6%,超声提示生长或结构异常的胎儿病理性CNVs检出率为6.0%,而在仅因高龄但超声未发现异常且染色体核型正常的胎儿病理性CNVs检出率仅为1.7%,与仅因唐氏筛查高风险胎儿中检出率仅为1.6%相近[13]。本研究通过CMA额外检出34.5%(10/29)的CNVs,CNVs检出率与文献报道相仿。Lee CN等[14]直接检测194例超声异常胎儿CNVs,病理性CNVs检出率为17%,先天性心脏畸形胎儿异常CNVs检出率为14%,颅内畸形胎儿为18.2%,骨骼畸形胎儿为8.7%。也有文献报道多发畸形胎儿病理性CNVs检出率为10%[15]。小样本病例研究检测30例患有各种CAKUT合并至少一项肾外畸形的小儿CNVs,并经过FISH确诊,异常检出率为10%[16]。一项系统性综述文献经过精密的筛选纳入18项研究,综合分析染色体核型正常超声异常胎儿的产前CMA检测,发现孤立性系统畸形异常CNVs的检出率为5.6%,多发畸形检出率为9.1%,总的检出率为6.8%,孤立性中枢神经系统畸形为6.2%,单纯性心脏畸形为4.2%,孤立性泌尿生殖系统畸形胎儿检出率为5.9%[17]。
本研究中,24例为孤立性泌尿系统畸形,CNVs的检出率为37.5%(9/24),病理性CNVs的检出率为16.7%(4/24),6例为泌尿系统畸形合并其他畸形,CNVs的检出率为33.3%(2/6),未检出病理性CNVs。病理性及良性变异的总检出率两者相仿,似乎孤立性泌尿系统畸形的病理性CNVs检出率高于多发畸形病例,但是两者的差异是没有统计学差异,为了进一步探讨孤立性畸形和多发畸形之间的CNVs的检出率是否有差异需要更大样本量的研究。
然而,CMA检测有其局限性,CMA不能检测出染色体倒位及染色体平衡易位、点突变、基因组嵌合、四倍体及六倍体,对于不平衡易位的基因组仅能标识出基因组不平衡的区域,不提供产生该变异或基因组重排的相关机制的信息。本研究数据中未检出染色体平衡易位病例,仅检出1例染色体不平衡易位病例,该病例同时在CMA检查中检测出异常结果。该病例CMA检测结果为arrYq11.221q11.23(18212359-28799937)×2,22q13.2q13.33(43866279-51197838)×1,Y染色体重复大小约为10.58Mb,1条22号染色体缺失大小约为7.33Mb,检索文献及相关数据库,缺失区域与22q13微缺失综合征(22q13 deletion syndrome,Phelan-Mcdermid syndrome)重叠,Y染色体缺失、及22号染色体重复区域内含多个OMIM数据库列出的致病基因,涉及免疫、心血管、神经系统以及泌尿系统疾病,临床表现可能有神经发育迟滞、智力低下等。但是从CMA结果我们不知道该缺失区域和重复区域是如何重排的。于是结合其常规染色体染色体核型结果46,XY,der(22)t(Y,22)(q11;q13.3),我们可知染色体数目为46条,胎儿性别为男性,其中一条染色体为22号衍生染色体,为Y染色体q11片段和22号染色体q13.3片段的不平衡易位,断裂点为Y染色体q11和22号染色体的q13.3。由此可见,在产前诊断中,虽然CMA检测在某些方面有其优越性,但是将常规染色体核型和CMA结果结合起来分析是有必要的。
3.3 17q12微缺失的分析 17q12缺失综合征主要表现为肾脏多囊性改变及青年人成年发病型糖尿病(maturity onset diabetes of the young,MODY5),也有报道与妇女生殖系统苗勒管发育畸形有关[18]。17q12缺失的大小可为1.06~2.46Mb[19]。该缺失片段与肾囊肿和糖尿病综合征(renal cysts and diabetes syndrome,RCAD)重叠,因HNF1β基因突变或缺失引起,是一种常染色体显性疾病,主要表现为肾发育不良及早发型糖尿病,肾脏疾病表现多种多样,可表现为肾囊肿、肾小球肾病、肾发育不良、双肾小、独肾或马蹄肾等。HNF1β在肾脏发育中发挥重要的作用,主要在上皮分化中发挥作用,在输尿管芽发育形成的髓质和皮质集合管中检出高表达。Bellanne-Chantelot等[20]学者曾报道8个家族共13位患者因HNF1β基因突变导致肾囊肿和糖尿病综合征,这些患者均有各类肾脏畸形包括肾发育不全、肾发育不良以及肾囊肿等。Edghill等[21]研究160例不明原因肾脏疾病患者,检出14%(23/160)患者携带HNF1β基因突变,83%患者肾脏主要表现为肾囊肿。Bellanne-Chantelot[22]从40例非家系的MODY患者中检出28例HNF1β基因的分子改变,包括18例基因突变和10例基因的缺失[22]。Mefford[23]曾发现1例多囊肾发育不良胎儿伴有17q12染色体1.8Mb的缺失,缺失片段内包括HNF1β基因,在另外8例肾脏发育不良或MODY患者中也检出类似的缺失。Nagamani[24]报道4例17q12微缺失患者的临床表现,其中2例表现为仍有保留肾功能的肾囊肿,1例为完全无功能的右肾多囊性发育不良,还有1例为肾发育不良并肾衰并行肾脏移植。本研究中检出的该病例,系因超声发现“胎儿右肾多囊性发育不良,左肾实质回声增高”行产前诊断,胎儿染色体核型正常,CMA结果提示arr17q12(34477479-36397323)×1,缺失片段大小达1.9Mb,内含HNF1β基因,父母双方行CMA分析结果均正常,考虑胎儿CNVs异常为新发病变。该患者于近足月时再次行胎儿超声检查提示右肾多囊性肾发育不良,左肾实质回声增强、肾皮质多囊样改变,考虑多囊肾发育不良早期改变,较早前超声相比,病情明显加重,且出现胎儿长骨短和侧脑室临界增宽的其他超声表现。可见HNF1β基因缺失与胎儿双肾发育不良密切相关,在产前明确诊断,对于指导临床预后及指导下一次妊娠具有非常重要的作用。
综上所述,通过CMA技术可以提高泌尿系统畸形胎儿遗传性疾病的诊断率,建议行染色体核型分析的同时行CMA检测。17q12缺失综合征可能是导致先天性泌尿系统畸形的原因之一,其发病与HNF1β基因单剂量不足相关。
[1] Nicolaides KH, Cheng HH, Abbas A, et al.Fetal renal defects:associated malformations and chromosomal defects[J].Fetal Diagn Ther,1992,7(1):1-11.
[2] Callan NA, Blakemore K, Park J, et al.Fetal genitourinary tract anomalies:evaluation, operative correction, and follow-up[J].Obstet Gynecol,1990,75(1):67-74.
[3] Sanna-Cherchi S, Kiryluk K, Burgess KE, et al.Copy-number disorders are a common cause of congenital kidney malformations[J].Am J Hum Genet,2012,91(6):987-997.
[4] Nicolaides KH, Cheng HH, Abbas A, et al.Fetal renal defects:associated malformations and chromosomal defects[J].Fetal Diagn Ther,1992,7(1):1-11.
[5] Callan NA, Blakemore K, Park J, et al.Fetal genitourinary tract anomalies:evaluation, operative correction, and follow-up[J].Obstet Gynecol,1990,75(1):67-74.
[6] Aubertin G, Cripps S, Coleman G, et al.Prenatal diagnosis of apparently isolated unilateral multicystic kidney:implications for counselling and management[J].Prenat Diagn,2002,22(5):388-394.
[7] Reddy UM, Page GP, Saade GR, et al.Karyotype versus microarray testing for genetic abnormalities after stillbirth[J].N Engl J Med,2012,367(23):2185-2193.
[8] Miller DT, Adam MP, Aradhya S, et al.Consensus statement:chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J].Am J Hum Genet,2010,86(5):749-764.
[9] Manning M, Hudgins L.Array-based technology and recommendations for utilization in medical genetics practice for detection of chromosomal abnormalities[J].Genet Med,2010,12(11):742-745.
[10] Maya I, Davidov B, Gershovitz L, et al.Diagnostic utility of array-based comparative genomic hybridization (aCGH) in a prenatal setting[J].Prenat Diagn,2010,30(12-13):1131-1137.
[11] Hillman SC, Pretlove S, Coomarasamy A, et al.Additional information from array comparative genomic hybridization technology over conventional karyotyping in prenatal diagnosis:a systematic review and meta-analysis[J].Ultrasound Obstet Gynecol,2011,37(1):6-14.
[12] Srebniak M, Boter M, Oudesluijs G, et al.Application of SNP array for rapid prenatal diagnosis:implementation, genetic counselling and diagnostic flow[J].Eur J Hum Genet,2011,19(12):1230-1237.
[13] Wapner RJ, Martin CL, Levy B, et al.Chromosomal microarray versus karyotyping for prenatal diagnosis[J].N Engl J Med,2012,367(23):2175-2184.
[14] Lee CN, Lin SY, Lin CH, et al.Clinical utility of array comparative genomic hybridisation for prenatal diagnosis:a cohort study of 3171 pregnancies[J].BJOG,2012,119(5):614-625.
[15] Valduga M, Philippe C, Bach SP, et al.A retrospective study by oligonucleotide array-CGH analysis in 50 fetuses with multiple malformations[J].Prenat Diagn,2010,30(4):333-341.
[16] Weber S, Landwehr C, Renkert M, et al.Mapping candidate regions and genes for congenital anomalies of the kidneys and urinary tract (CAKUT) by array-based comparative genomic hybridization[J].Nephrol Dial Transplant,2011,26(1):136-143.
[17] De Wit MC, Srebniak MI, Govaerts LC, et al.Additional value of prenatal genomic array testing in fetuses with isolated structural ultrasound abnormalities and a normal karyotype:a systematic review of the literature[J].Ultrasound Obstet Gynecol,2014,43(2):139-146.
[18] Nik-Zainal S, Strick R, Storer M, et al.High incidence of recurrent copy number variants in patients with isolated and syndromic Mullerianaplasia[J].J Med Genet,2011,48(3):197-204.
[19] Nagamani SC, Erez A, Shen J, et al.Clinical spectrum associated with recurrent genomic rearrangements in chromosome17q12[J].Eur J Hum Genet,2010,18(3):278-284.
[20] Bellanne-Chantelot C, Chauveau D, Gautier JF, et al.Clinical spectrum associated with hepatocyte nuclear factor-1beta mutations[J].Ann Intern Med,2004,140(7):510-517.
[21] Edghill EL, Bingham C, Ellard S, et al.Mutations in hepatocyte nuclear factor-1beta and their related phenotypes[J].J Med Genet,2006,43(1):84-90.
[22] Bellanne-Chantelot C, Clauin S, Chauveau D, et al.Large genomic rearrangements in the hepatocyte nuclear factor-1 beta (TCF2) gene are the most frequent cause of maturity-onset diabetes of the young type 5[J].Diabetes,2005,54(11):3126-3132.
[23] Mefford HC, Clauin S, Sharp A J, et al.Recurrent reciprocal genomic rearrangements of 17q12 are associated with renal disease, diabetes, and epilepsy[J].Am J Hum Genet,2007,81(5):1057-1069.
[24] Nagamani SC, Erez A, Shen J, et al.Clinical spectrum associated with recurrent genomic rearrangements in chromosome17q12[J].Eur J Hum Genet,2010,18(3):278-284.
ObjectiveTo study the clinical value of G banding karyotype analysis and CMA in prenatal diagnosis of congenital abnormalities of the urinary system.MethodA retrospective study of 134 cases of fetal urinary tract abnormalities by prenatal ultrasonography and performed by G banding karyotype analysis.Results①134 cases of urinary system abnormalities, 128 cases of normal fetal chromosome; 2 cases were abnormal, were 46, XY, del (21) (qter-p11), 46, XY, der (22) t (Y, 22) (Q11; q13.3), 4 cases of chromosome polymorphism and abnormal rate of chromosome is 1.50% (2/134).②Results of 30 cases of CMA were successfully analyzed.In 19 cases, the results were normal.11 cases of CNVs were detected, and the detection rate of CNVs was 36.7% (11/30).③Of 11 patients with CNVs, 20% (6/30) considered benign CNVs, and 16.7% (5/30) were pathological CNVs.④According to the prenatal ultrasonic results, 30 cases of urinary abnormalities were divided into solitary urinary abnormalities (24 cases) and urinary abnormalities associated with other abnormalities (6 cases).⑤This study detected 1 cases of newly diagnosed 17q12 deletion syndrome, which overlapped with RCAD, and containedHNF1βgene closely related to renal development.ConclusionsThe incidence of chromosomal abnormalities in the abnormal fetus of urinary system was 1.50%.The urinary system abnormalities were detected by CMA, but the normal karyotype of fetal CNVs was 34.5%, 16.7% of which were pathological CNVs, and CMA could significantly improve the diagnostic rate of hereditary diseases.
fetus urinary system abnormalities;karyotype;CMA; prenatal diagnosis; genetic counseling
R714.53
A
2017-05-11)
编辑:宋文颖
10.13470/j.cnki.cjpd.2017.02.002
*通讯作者:周祎,E-mail:zhouyifm@126.com

