微藻贴壁培养对沼液废水的处理效果
程鹏飞,王 艳,杨期勇,刘德富,刘天中
(1.武汉大学 水利水电学院,湖北 武汉 430072; 2.九江学院 鄱阳湖生态经济研究中心,江西 九江 332005; 3.九江学院 电子商务学院,江西九江 332005; 4.湖北工业大学 土木建筑与环境学院,湖北 武汉 430072; 5.中国科学院 青岛生物能源与过程研究所,山东 青岛 266101)
微藻贴壁培养对沼液废水的处理效果
程鹏飞1,2,王 艳3,杨期勇2,刘德富4,*,刘天中5
(1.武汉大学 水利水电学院,湖北 武汉 430072; 2.九江学院 鄱阳湖生态经济研究中心,江西 九江 332005; 3.九江学院 电子商务学院,江西九江 332005; 4.湖北工业大学 土木建筑与环境学院,湖北 武汉 430072; 5.中国科学院 青岛生物能源与过程研究所,山东 青岛 266101)
以产油藻类栅藻、小球藻为研究对象,通过贴壁方式考查微藻处理养猪沼液废水的效果。结果表明,栅藻、小球藻均能在沼液中较好生长,其生物产率分别是6.26、6.08 g·m-2·d-1,与在正常培养基上(BG11)相当。栅藻、小球藻在沼液中培养,藻细胞油脂积累分别占细胞干重的34.6%和31.4%,与正常培养基相差不大。栅藻、小球藻均能较好净化废水中主要污染指标氨氮(NH3-N)、总磷(TP)及化学需氧量(COD),栅藻的去除率分别是96.59%、74.52%和72.47%,小球藻去除率分别是94.90%、73.55%和71.40%。本研究将产油微藻培养和养猪沼液废水处理相结合,研究结果可为藻类生物燃料生产及沼液废水资源化利用等提供理论基础。
微藻;贴壁培养;沼液
当前,生猪养殖废水主要采用厌氧发酵产沼气处理技术,该方法在废水净化效果与经济效益方面均有一定优势,但处理后的沼液仍含有丰富的氮、磷等大量元素及各种微量元素[1-2],成分复杂,较难处理。传统的“猪-沼-果”“猪-沼-鱼”等沼液利用模式能够有效提高土壤肥力,改善果蔬与鱼苗的生长品质;但是这些沼液的规模化利用方式面临消纳土地不足及农户不接受等问题,加大了养殖污水处理难度,造成资源的浪费和环境的污染[3-4]。因此,沼液废水的处理迫切需要能够资源化利用的集成技术。
猪粪沼液废水中含有大量藻类生长所需的氮、磷以及其他营养物质,将养猪沼液废水净化与微藻的培养相结合,既可以达到排放标准,降低沼液处理成本,又可以节约微藻的培养成本,同时还可利用微藻生物质中的高附加值产物[5-6]。但是,传统的液体悬浮培养(如跑道池等)处理沼液因占地面积大、处理效率不高、条件不易控制、采收成本较高等问题一直未能被大面积推广应用。Chiu等[7]将小球藻(ChlorellavulgarisYSW-04)在传统的光反应器(PBRs)中进行悬浮培养,以净化沼液废水,结果藻细胞生长受到抑制,生物产率较低,而且培养后的藻细胞需离心分离才能最终净化水质,效果欠佳。
贴壁培养是一种依据光稀释与固定化的原理,将藻细胞与培养基相分离,并固定在一定的生物膜材料上,极少量的培养基液体通过附着多孔材料的背面或内部滴入,使藻细胞处于半干湿润状态,并在一定光照强度与营养盐浓度下进行生长的培养方式(图1)[8]。利用贴壁方式培养微藻处理沼液废水,因反应装置的特殊性,培养结束后可省去藻细胞离心的高能耗过程,降低成本。在众多微藻中,栅藻(Scendesmusdimorphus)、小球藻等在培养过程中可积累较多油脂,且对污水耐受能力强,是较为理想的净化污水的藻种资源[9]。本研究拟采用贴壁方式培养栅藻、小球藻,考查藻细胞在沼液废水中生长、油脂积累情况,及对NH3-N、TP、COD的去除效率,以期探索出一种利用栅藻、小球藻贴壁培养处理养猪沼液废水的方法,为沼液污染控制及现代畜禽产业发展提供“绿色生态”途径。
1 材料与方法
1.1 藻种与培养基
试验所用栅藻、小球藻藻种由湖北工业大学实验室保藏。2种微藻液体种子培养过程所用培养基为BG11培养基[10]
1.2 沼液废水
试验前期,采集武汉地区多家养猪场沼液废水,并进行指标测定,综合沼液指标、废水稳定性与连续性及场地的便利性等因素,选用武汉某畜禽企业某地区经厌氧发酵后的养猪沼液废水作为处理对象。取水时间为2016-07-16 T 10∶00。废水经自然沉降2 d后,取上清液,测定其初始氨氮(NH3-N)、总磷(TP)、化学需氧量(COD)分别为302.1、31.0、563 mg·L-1。
1.3 反应器与培养方法
试验所用反应器为玻璃柱式反应器,内直径0.05 m, 柱高0.55 m,反应体积0.9 L。反应器内部布置直径5 mm的玻璃通气管,混合有1.5% CO2(V/V)的压缩空气(0.1 MPa)通过通气管从反应器底部曝气,搅动藻液并补充碳源。前期研究显示,光照强度100 μmol photons·m-2s-1下藻细胞生长较好。为了考查试验条件下微藻生长的最高效率,2株藻类培养过程中均采用连续光照,培养柱表面光强100 μmol photons·m-2s-1,培养温度(25±1)℃。
贴壁培养反应装置如图1所示,将长0.4 m、宽0.2 m、厚3 mm的玻璃板置于0.5 m×0.3 m×0.05 m的玻璃腔中,玻璃板的一面附有滤纸,并接受正上方的光照。将2株藻种分别接种于醋酸纤维素膜上,贴于附着在玻璃板的滤纸上,将附有藻种的玻璃板放入玻璃腔室内。为保障玻璃腔室内的环境稳定,用保鲜膜封住玻璃腔的一面,2 L培养基液体通过循环泵滴加(循环使用)。为了使培养液更均匀地渗入藻细胞内,将玻璃培养腔放置一定角度,荧光灯置于培养腔正上方提供光源。用沼液废水进行贴壁培养时,不通CO2,以空气鼓泡代替;用BG11培养基进行贴壁培养时,正常通CO2,其他培养条件相同。

图1 微藻贴壁培养装置示意图Fig.1 Structure of the attached cultivation device for microalgae
1.4 分析方法
1.4.1 藻细胞生物量测定
将0.45 μm、直径50 mm的醋酸纤维滤膜煮沸3次后,在105 ℃烘箱中烘至恒重(m1),将待测藻样用去离子水冲至烧杯中,并倒入抽滤装置中抽至已称重的滤膜上(面积10 cm2),将附着藻的滤膜放入105 ℃烘箱中烘至恒重(m2),用分析天平称量可得藻样生物量(m)(g·m-2)。
m=(m2-m1)×1 000。
(1)
1.4.2 藻细胞油脂含量测定
藻细胞总脂含量的测定采用改进的氯仿-甲醇法[11]。收集藻细胞,用一定量蒸馏水冲洗离心后冷冻干燥。称取50 mg(重量W1)藻粉于研钵中,加入200 mg已烘干的石英砂,研碎后加入5 mL甲醇、2.5 mL氯仿,高速振荡5 min。摇床培养12 h,离心,取上清7.5 mL至新管1。向固相中再加入5 mL甲醇、2.5 mL氯仿,高速振荡5 min,摇床培养2 h,离心,取上清7.5 mL至新管1,加入5 mL氯仿和9 mL质量浓度1%的NaCl,保证最终体系为甲醇∶氯仿∶1% NaCl=2∶2∶1.8(体积比),振荡混匀。将新管1于8 000 r·min-1离心10 min,去上清,下层液转移入20 mL干净玻璃管(已称重W2)。61 ℃水浴下氮吹,氯仿被吹干后,于105 ℃烘3 h,冷却后,称重(W3)。
总脂含量(%)=(W3-W2)/W1×100。
(2)
1.4.3 NH3-N、TP及COD测定
取贴壁培养循环装置中沼液废水,每2 d取样1次,分别测定NH3-N、TP及COD。氨氮采用纳氏试剂分光光度法(HJ 535—2009)测定;总磷采用钼酸铵分光光度法(GB 11893—89)测定;COD采用重铬酸钾氧化处理法(GB 11914—89)测定。
1.5 数据分析
试验数据采用SPSS 10.0进行单因素方差分析 (one-way ANOVA),对有显著(P<0.05)差异的处理采用LSD法进行多重比较。
2 结果与分析
2.1 对栅藻、小球藻生长的影响
将对数期栅藻、小球藻种子液接种于贴壁反应器中,每2 d取样1次,培养8 d后考查栅藻、小球藻在沼液废水中的生长情况,并与BG11培养基条件下(正常培养)的生长情况进行比较(图2)。栅藻在养猪沼液废水原水中能较好生长,尤其在培养前2 d,生长较快,生物量明显高于正常培养。培养8 d后,沼液废水中栅藻生物量与正常培养无明显差异。小球藻在沼液废水中的生物产率为6.08 g·m-2·d-1,高于正常培养下的生物产率(5.45 g·m-2·d-1)。
2.2 对栅藻、小球藻贴壁培养油脂积累的影响
将栅藻、小球藻分别在沼液废水和BG11培养基条件下贴壁培养,收集培养8 d后的藻细胞,分别考查油脂积累情况(图3)。沼液废水条件下栅藻的油脂含量略低于BG11培养基条件下,分别是34.6%、35.2%。由于栅藻细胞在2种培养条件下生物产率相近,因而其油脂产率也相近,分别为2.17和2.19 g·m-2·d-1。小球藻在沼液废水条件下的油脂含量为31.4%,高于其在BG11培养基条件下的含量(29.6%)。相应地,小球藻贴壁培养在沼液废水和BG11培养基条件下的油脂产率分别是1.91和1.69 g·m-2·d-1。

图2 沼液废水与正常培养基栅藻、小球藻贴壁生长状况Fig.2 Growth of Scendesmus dimorphus and Chlorella pyrenoidosa with attached culture in swine wastewater and BG11 medium

图3 沼液废水与BG11培养基条件下栅藻(A)与小球藻(B)贴壁培养油脂积累情况Fig.3 Lipid accumulation of Scendesmus dimorphus (A) and Chlorella pyrenoidosa(B) with attached culture in swine wastewater and BG11 medium
2.3对沼液废水中NH3-N、TP及COD的去除情况
由图4可知,栅藻贴壁培养条件下,废水中NH3-N浓度在最初2 d内下降较快,培养8 d后,由最初的302.1 mg·L-1降至10.3 mg·L-1;废水中总P浓度在前4 d下降最快,培养8 d后,由初始浓度31.0 mg·L-1降至7.9 mg·L-1;培养8 d后,废水中COD由初始563 mg·L-1降至155 mg·L-1。栅藻贴壁培养处理养猪沼液废水8 d,废水中NH3-N、TP及COD去除率分别是96.59%、74.52%和72.47%。
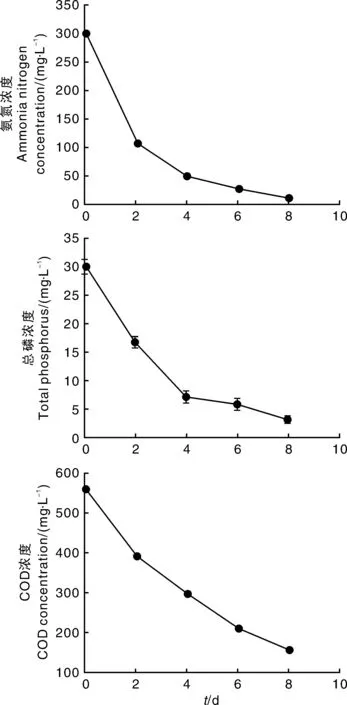
图4 贴壁培养栅藻对NH3-N、TP及COD的去除情况Fig.4 Removal of NH3-N, TP and COD of wastewater with biofilm attached cultivation of Scendesmus dimorphus
由图5可知,小球藻贴壁培养沼液中NH3-N浓度由最初的302.1 mg·L-1降到15.4 mg·L-1,总P浓度由起始的31.0 mg·L-1降至8.2 mg·L-1,COD浓度由563 mg·L-1下降至161 mg·L-1。小球藻贴壁培养对NH3-N、TP及COD的去除率分别是94.90%、73.55%和71.40%。
3 结论与讨论

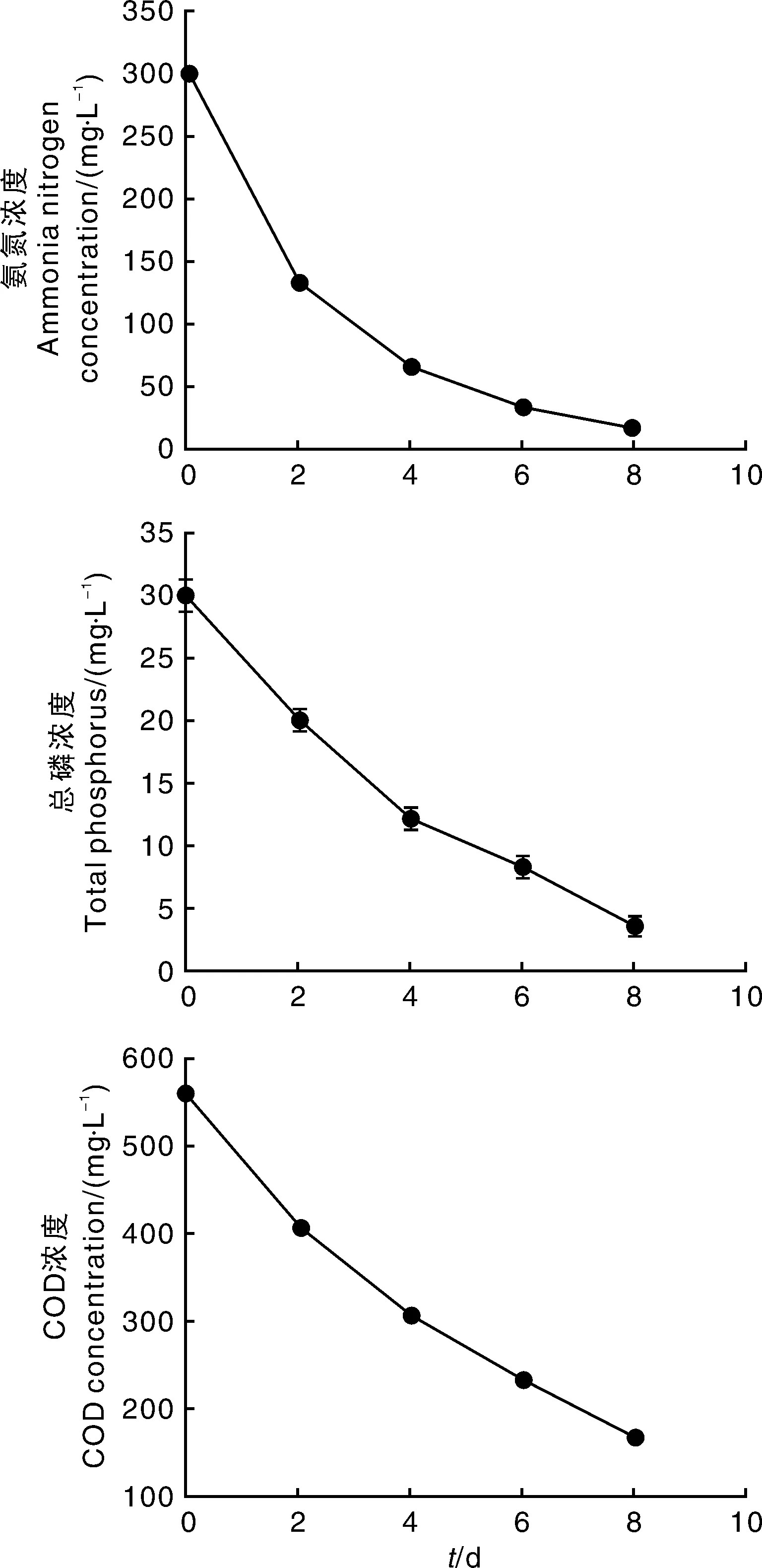
图5 贴壁培养小球藻对NH3-N、TP及COD的去除情况Fig.5 Removal of NH3-N, TP and COD of wastewater with biofilm attached cultivation of Chlorella pyrenoidosa
微藻因其独特的组成及结构而成为获得生物柴油和生物质油的优良原料来源。相比其他动植物,利用藻类生产油脂生物燃料,增值迅速,含油量高,占地面积小,更具发展潜力。但如何降低微藻油脂燃料的生产成本仍然是国内外商业化开发面临的主要问题。本研究表明,栅藻、小球藻在沼液废水中贴壁培养产生的油脂含量与在BG11培养基上培养的相差不大,沼液废水是栅藻、小球藻贴壁培养较好的替代介质。利用产油微藻贴壁培养处理养猪沼液废水并耦合油脂生产,既可以降低培养成本,又能提高藻类生物燃料工业化生产的经济性。
总体来看,本研究表明产油微藻——栅藻、小球藻贴壁培养处理沼液废水具有可行性。将微藻应用于养猪沼液废水处理,同时可生产油脂生物燃料,不仅能有效地降低水体富营养化水平,而且具有低成本、低能耗、低污染、高效率、高收益和高溶氧量等优势,可以创造更多的经济效益和生态效益。研究结果可为实现藻类生物燃料生产与废水处理系统从“处理工艺”向“生产工艺”的转化奠定基础。
[1] 刘荣厚, 郝元元, 叶子良,等. 沼气发酵工艺参数对沼气及沼液成分影响的实验研究[J]. 农业工程学报, 2006(增刊1):93-96. LIU R H,HAO Y Y,YE Z L,et al. Experimental research on technical parameters of anaerobic fermentation for biogas production[J].TransactionsoftheCSAE, 2006(Suppl. 1): 93-96. (in Chinese with English abstract)
[2] 靳红梅, 常志州, 叶小梅,等. 江苏省大型沼气工程沼液理化特性分析[J]. 农业工程学报, 2011, 27(1):291-296. JIN H M,CHANG Z Z,YE X M,et al. Physical and chemical characteristics of anaerobically digested slurry from large-scale biogas project in Jiangsu Province[J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2011,27(1):291-296. (in Chinese with English abstract)
[3] 张国治, 吴少斌, 王焕玲,等. 大中型沼气工程沼渣沼液利用意愿现状调研及问题分析[J]. 中国沼气, 2010, 28(1):21-24. ZHANG G Z,WU S B,WANG H L,et al. Survey and analysis on state quo of public intention for utilizing digestate from large and medium size biogas plants[J].ChinaBiogas,2010,28(1):21-24. (in Chinese with English abstract)
[4] ZHU L D, HILTUNEN E. Application of livestock waste compost to cultivate microalgae for bioproducts production: a feasible framework[J].Renewable&SustainableEnergyReviews, 2016, 54: 1285-1290.
[5] KALE D K, ANTHAPPAN P D. Sustainable treatment of wastewater using effective microorganisms[J].JournalofPure&AppliedMicrobiology, 2012, 6(1):333-338.
[6] 张强, 邹华, 余云龙,等. 小球藻处理养殖废水的初步研究[J]. 上海环境科学, 2011,30(6):249-253. ZHANG Q, ZOU H, YU Y L, et al. An approach to the treatment of livestock farming wastewater byChlorellavulgaris[J].ShanghaiEnvironmentalSciences, 2011, 30(6):249-253. (in Chinese with English abstract)
[7] CHIU S Y, KAO C Y, CHEN T Y, et al. Cultivation of microalgal Chlorella, for biomass and lipid production using wastewater as nutrient resource[J].BioresourceTechnology, 2015, 184: 179-189.
[8] LIU T, WANG J, QIANG H, et al. Attached cultivation technology of microalgae for efficient biomass feedstock production[J].BioresourceTechnology, 2013, 127(1):216-222.
[9] MATA T M, MARTINS A A, CAETANO N S. Microalgae for biodiesel production and other applications: A review[J].Renewable&SustainableEnergyReviews, 2010, 14(1):217-232.
[10] RIPPKA R, DERUELLES J, WATERBURY J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria[J].Microbiology, 1979, 111(1): 1-61.
[11] BLIGH E G, DYER W J. A rapid method of total lipid extraction and purification[J].CanadianJournalofBiochemistryandPhysiology, 1959, 37(8): 911-917.
[12] HALL D O, ACIÉN FERNNDEZ F G, GUERRERO E C, et al. Outdoor helical tubular photobioreactors for microalgal production: Modeling of fluid‐dynamics and mass transfer and assessment of biomass productivity[J].BiotechnologyandBioengineering, 2003, 82(1): 62-73.
(责任编辑高 峻)
Purificationeffectforswinewastewaterwithattachedcultureofmicroalgae
CHENG Pengfei1,2, WANG Yan3, YANG Qiyong2, LIU Defu4,*, LIU Tianzhong5
(1.SchoolofWaterResourcesandHydropowerEngineering,WuhanUniversity,Wuhan430072,China; 2.PoyangLakeEco-EconomyResearchCenterofJiujiangUniversity,Jiujiang332005,China; 3.E-BusinessInstituteofJiujiangUniversity,Jiujiang332005,China; 4.SchoolofArchitecturalandEnvironment,HubeiUniversityofTechnology,Wuhan430072,China; 5.QingdaoInstituteofBioenergyandBioprocessTechnology,ChineseAcademyofSciences,Qingdao266101,China)
The purification effect of swine wastewater treated byScendesmusdimorphusandChlorellapyrenoidosawith attached culture was investigated in this study. It was shown that the 2 strains could grow well in swine wastewater and the biomass ofScendesmusdimorphusandChlorellapyrenoidosareached 6.26 and 6.08 g·m-2·d-1, respectively. Meanwhile, the lipid content in the 2 strains was 34.6% and 31.4%, respectively, which was comparable with those cultivated in BG11 medium. Notably, attached culture ofScendesmusdimorphusandChlorellapyrenoidosacould treat swine wastewater efficiently. The removal efficiency of ammonia nitrogen (NH3-N), total phosphorus (TP) and COD was 96.59%, 74.52% and 72.47%, respectively, byScendesmusdimorphusand 94.90%, 73.55% and 71.40%, respectively, byChlorellapyrenoidosa. Based on the results, a process combining algae-based wastewater treatment with attached cultivation and biodiesel production was proposed to treat swine wastewater.
microalgae; attached culture; swine wastewater
X703
:A
:1004-1524(2017)09-1564-06
程鹏飞,王艳,杨期勇,等. 微藻贴壁培养对沼液废水的处理效果[J]. 浙江农业学报,2017,29(9): 1564-1569.
10.3969/j.issn.1004-1524.2017.09.20
2017-02-06
国家自然科学基金项目(31560724);中国博士后科学基金资助项目(2016M600616)
程鹏飞(1984—),男,江西婺源人,博士,副教授,主要研究方向为环境生物技术。E-mail: 511944088@qq.com
*通信作者,刘德富,E-mail: dfliu@189.cn

