干旱胁迫对2种柑橘幼苗生长形态、渗透调节物质含量和抗氧化酶活性的影响
冯芳芳,魏清江,苏受婷,宁少君,廖小娜,辜青青
(江西农业大学 农学院,江西 南昌330045)
干旱胁迫对2种柑橘幼苗生长形态、渗透调节物质含量和抗氧化酶活性的影响
冯芳芳,魏清江,苏受婷,宁少君,廖小娜,辜青青*
(江西农业大学 农学院,江西 南昌330045)
采用盆栽控水的方法,比较干旱胁迫对2种抗旱性不同的柑橘——三湖红橘和三湖化红生长形态、渗透调节物质含量和抗氧化酶活性的影响。结果表明:干旱胁迫可以降低2种柑橘的株高,增加根冠比,同时降低三湖化红主根长,增加三湖红橘主根长;此外,干旱胁迫导致2种柑橘幼苗叶片和根系的脯氨酸含量显著增加,三湖红橘叶片脯氨酸含量增幅更大;除三湖红橘叶片的可溶性糖含量降低外,干旱胁迫后2种柑橘的可溶性糖和可溶性蛋白含量均升高。酶活性分析表明,干旱胁迫后2种柑橘叶片中SOD和CAT活性均下降,而根中2种酶活性均上升;三湖红橘叶片POD活性先升高后降低,根中POD活性显著升高;三湖化红叶片POD活性一直显著高于对照,根中POD活性则显著降低。综上,三湖红橘的抗旱性强于三湖化红可能与其在干旱胁迫条件下主根长度增加,根冠比增大从而提高根系水分吸收能力有关。此外,干旱胁迫后渗透物质尤其是叶片脯氨酸的积累和POD活性的升高,也有助于其应对干旱胁迫带来的伤害。
柑橘幼苗;干旱胁迫;生长形态;渗透调节物质;抗氧化酶
柑橘是中国南方的一种重要果树,大多柑橘产区处于山地,灌溉条件差,土壤保水力不强[1]。随着夏季晴热天气的到来,树体由于水分缺失而产生的枯萎、落叶、果实变小,甚至落果和死树的现象逐渐显现。土壤缺水是柑橘出现旱害的主要原因,也是制约柑橘业发展的主要环境因素。因干旱胁迫引起的柑橘产量和品质的下降,已成为柑橘生产上亟待解决的问题之一[2]。使用抗旱砧木是提高柑橘整体耐旱性的有效途径,耐旱砧木资源的研究和利用在柑橘干旱胁迫研究中占有重要地位[3]。
干旱胁迫下植物会产生一系列形态和生理生化上的变化,以适应体内水分的亏缺。在形态上,植株可以通过增加主根生长速度以及关闭叶片气孔等方式适应干旱胁迫[4]。同时,渗透调节也是植物适应干旱胁迫的重要生理机制。研究表明,干旱胁迫能够促进植物体内合成糖醇类、氨基酸及其衍生物如脯氨酸、甘氨酸、甜菜碱和多胺等低分子量的有机溶质,且耐旱性较强的品种较抗性弱的品种上升幅度大[5-6]。例如,干旱胁迫下香橙生长受到的抑制较小,这与其叶片脯氨酸含量大幅积累有关[7]。抗旱的印度酸橘根系能够积累大量脯氨酸,而卡里佐枳橙则没有明显变化[8]。干旱胁迫导致桃树叶片和根系中的山梨醇、棉子糖和脯氨酸含量发生变化,这些物质与干旱胁迫条件下植株的水分利用率有关[9]。植物抗旱的另一重要生理机制是活性氧清除机制。当植物处于干旱逆境时,细胞内活性氧自由基产生和清除之间的平衡受到破坏,在细胞缺乏保护机制时,它们可能对细胞结构和功能产生不同伤害[10]。在长期的进化过程中,植物形成活性氧的清除系统,其中以超氧物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)为代表的酶类在活性氧清除过程中起重要作用[11]。目前,抗氧化酶的研究多集中在植物叶片,植物根系等组织中相关酶活性的变化与其抗旱性关系的研究相对较少。
前人研究发现,江西地方特色资源—三湖红橘(CitrustangerinaHort. ex Tanaka)的抗旱性较强[12],具有广泛用作砧木的潜能,但对其抗旱生理机制的研究尚未开展。三湖化红(C.tangerinaHort. ex Tanaka ×C.aurantiumL.)是橘和橙的天然杂交种,对溃疡病有较强的抗性,但树势强旺、抗旱性差[12]。为此,我们以这2种抗旱性不同的柑橘品种为对象,分析干旱胁迫不同时间后植株的生长形态、渗透调节物质含量和抗氧化酶活性的变化,旨在阐明两者抗旱性差异的生理基础,为柑橘耐旱性评价和抗旱砧木选育提供依据。
1 材料与方法
1.1 试验材料
试验于江西农业大学园艺教学实验基地的温室大棚内进行,采用盆栽的方法。将2个月左右的柑橘实生幼苗移入直径30 cm、高40 cm的塑料盆中,盆中土壤为营养土和沙土(体积比2∶1),每盆种植5株。适应生长1个月后浇透水,开始干旱胁迫,以正常灌溉处理为对照,分别于干旱胁迫后10、20和30 d取样,同时测定土壤含水量。处理期间,对照植株的土壤含水量维持在27%~40%,干旱胁迫植株的土壤含水量从约40%逐渐下降至约10%。每个处理至少取10株,植株用冰盒带回实验室,测量植株的株高和主根长。部分植株杀青后烘干,称量干质量并计算根冠比。余下植株分为叶片和根2个部分,用液氮速冻后于-80 ℃保存,用于生理指标测定。
1.2 测定方法
脯氨酸含量的测定使用茚三酮比色法;可溶性蛋白含量的测定使用考马斯亮蓝G-250染色法;可溶性糖含量的测定使用蒽酮比色法;超氧化物歧化酶(SOD)活性的测定使用总超氧化物歧化酶(T-SOD)测试盒(南京建成生物工程研究所);过氧化物酶(POD)活性的测定参考李合生[13]的方法;过氧化氢酶(CAT)活性的测定参考曹建康等[14]的方法。
1.3 数据处理
试验数据使用DPS(data protection system)软件进行差异显著性分析和相关性分析。用Excel软件作图。
2 结果与分析
2.1 干旱胁迫对柑橘幼苗株高的影响
干旱胁迫对2种柑橘幼苗株高的影响有所不同(图1)。干旱胁迫10 d对2个品种的株高无显著影响。干旱胁迫20 d时,三湖红橘的株高与对照无显著差异,而三湖化红则显著低于对照。干旱胁迫30 d时,2个品种的株高显著下降,三湖化红株高下降幅度大于三湖红橘,表明干旱胁迫对三湖化红生长的抑制作用更大。
2.2 干旱胁迫对柑橘幼苗主根长的影响
干旱胁迫期间,三湖红橘的主根长在干旱胁迫10 d时低于对照,干旱胁迫20和30 d时均显著高于对照。与此相反,干旱胁迫导致三湖化红的主根长度下降,并且在干旱胁迫20和30 d时均显著低于对照(图2)。说明干旱胁迫促进了三湖红橘主根的生长,但对三湖化红主根生长有抑制作用。

相同处理时间柱状图无相同小写字母表示处理间差异达显著水平(P<0.05)。下同Values without the same lower letters at the same treatment time were significantly different at the 5% level. The same as below图1 干旱胁迫条件下2种柑橘幼苗株高的变化Fig.1 Changes of plant height of two citrus seedlings under drought stress
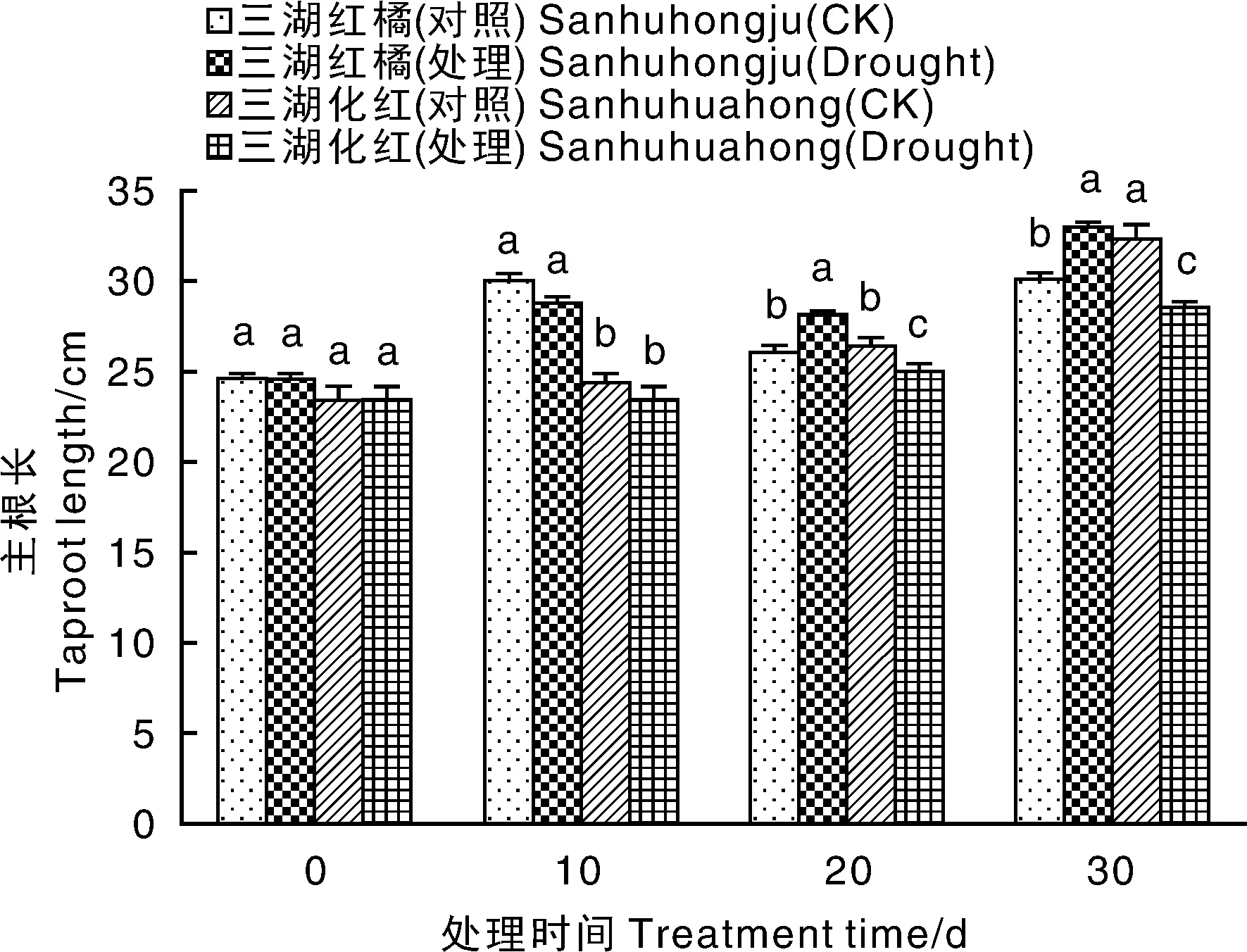
图2 干旱胁迫条件下2种柑橘幼苗主根长的变化Fig.2 Changes of taproot length of two citrus seedlings under drought stress
2.3 干旱胁迫对柑橘幼苗根冠比的影响
干旱胁迫前期,2种柑橘幼苗根冠比与对照差异不明显(图3)。干旱胁迫30 d时,两者根冠比均显著上升,其中三湖红橘的根冠比为0.69,三湖化红为0.62。与对照相比,三湖红橘的上升幅度大于三湖化红。
2.4 干旱胁迫对柑橘幼苗脯氨酸含量的影响
干旱胁迫导致柑橘幼苗叶片脯氨酸含量升高。干旱胁迫10 d时,2种柑橘叶片脯氨酸含量与对照均无明显差异,处理20 d后其含量显著上升。与对照相比,三湖红橘叶片脯氨酸含量增加幅度高于三湖化红(图4-A)。2个柑橘品种根中脯氨酸含量变化相似,均在干旱胁迫10 d时显著低于对照,干旱胁迫20 d后其含量开始上升,并显著高于对照(图4-B)。
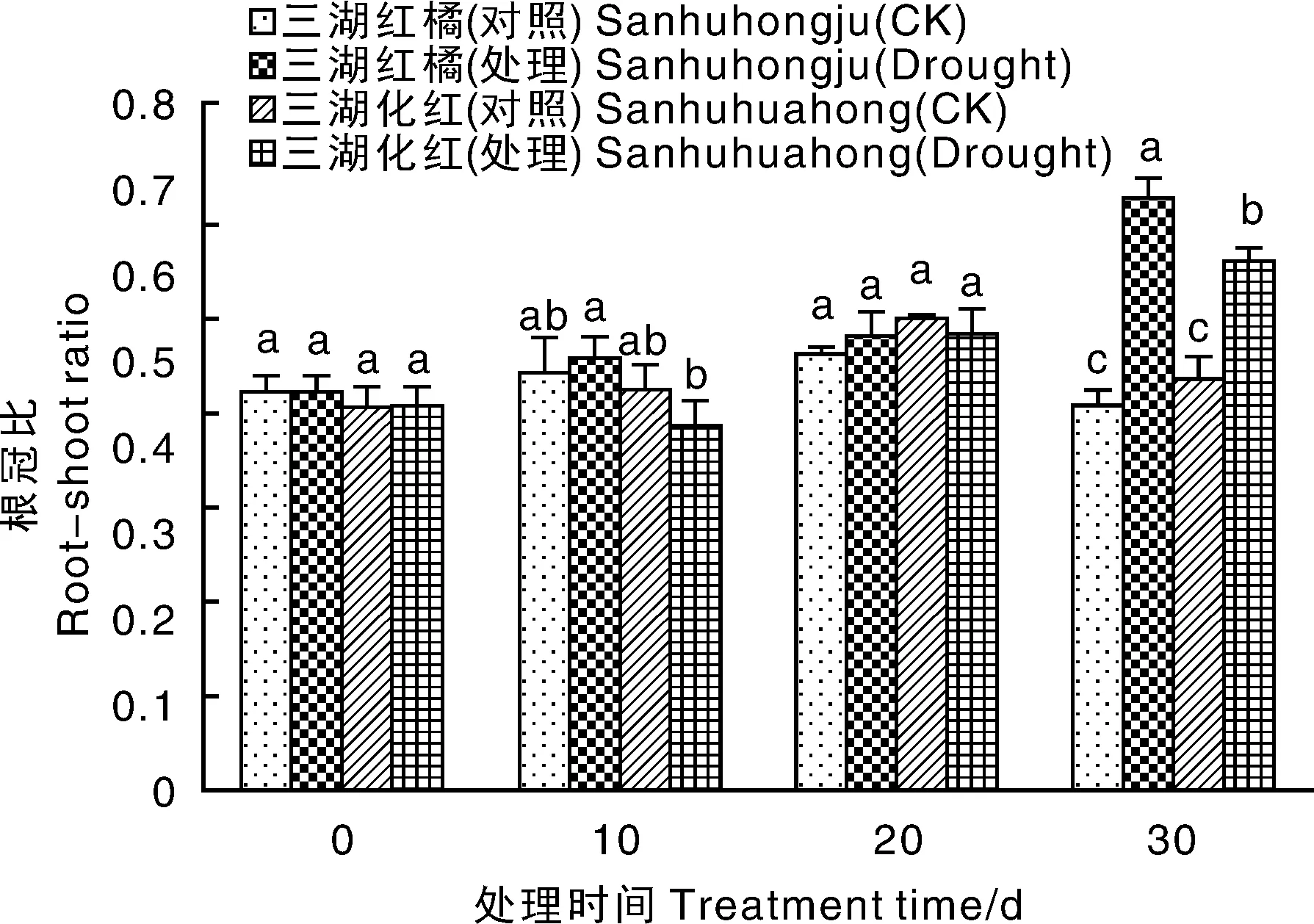
图3 干旱胁迫条件下2种柑橘幼苗根冠比的变化Fig.3 Changes of root-shoot ratio of two citrus seedlings under drought stress

图4 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中脯氨酸含量的变化Fig.4 Changes of proline contents in leaves (A) and roots (B) of two citrus seedlings under drought stress
2.5干旱胁迫对柑橘幼苗可溶性蛋白含量的影响
干旱胁迫前期,2个柑橘品种叶片可溶性蛋白含量无明显变化,干旱胁迫20 d时,其含量均高于对照。干旱胁迫30 d时,2个柑橘品种叶片可溶性蛋白含量均显著升高,且三湖化红的增加幅度高于三湖红橘(图5-A)。2个柑橘品种根中可溶性蛋白含量随干旱胁迫时间延长而呈上升趋势,其中三湖红橘在干旱胁迫10和20 d时显著高于对照,三湖化红在干旱胁迫20和30 d时显著高于对照(图5-B)。
2.6 干旱胁迫对柑橘幼苗可溶性糖含量的影响
如图6-A所示,干旱胁迫条件下,三湖红橘叶片中可溶性糖含量下降,并在干旱胁迫10和30 d时显著低于对照。与此相反,干旱胁迫10 d后,三湖化红叶片中可溶性糖含量上升,直至干旱胁迫30 d时其含量均显著高于对照。干旱胁迫导致2个柑橘品种根中可溶性糖含量显著上升,三湖化红根中可溶性糖含量往往高于三湖红橘,其增加幅度也高于后者(图6-B)。
2.7干旱胁迫对柑橘幼苗抗氧化酶活性的影响
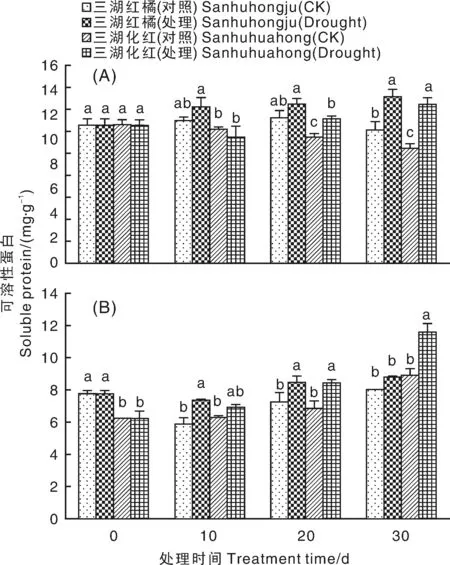
图5 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中可溶性蛋白含量的变化Fig.5 Changes of soluble protein contents in leaves (A) and roots (B) of two citrus seedlings under drought stress
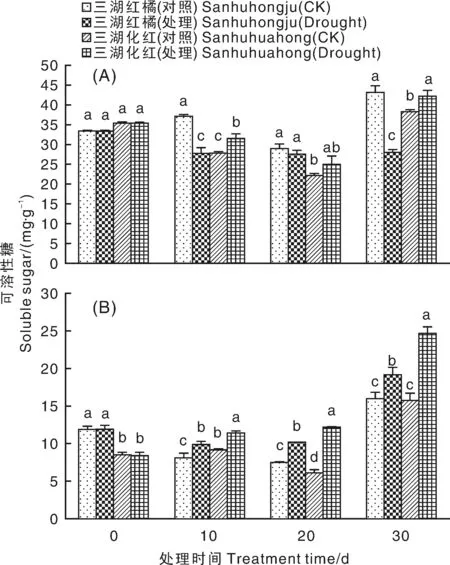
图6 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中可溶性糖含量的变化Fig.6 Changes of soluble sugar contents in leaves (A) and roots (B) of two citrus seedlings under drought stress
如图7-A所示,干旱胁迫导致2个品种叶片SOD活性降低,且在干旱胁迫10 d后其活性均显著低于对照。与叶片不同,2个品种根中SOD活性随着干旱胁迫时间延长呈上升趋势,且在干旱胁迫10 d开始显著高于对照。但是,在相同处理时间,三湖红橘根中SOD活性往往高于三湖化红(图7-B)。
干旱胁迫对2种柑橘叶片中POD活性的影响不同。干旱胁迫前期,三湖红橘叶片POD活性显著升高,干旱胁迫后期酶活性则下降,且在干旱胁迫20和30 d时均显著低于对照。三湖化红叶片POD活性随着干旱胁迫时间延长呈上升趋势,且在干旱胁迫期间均显著高于对照(图8-A)。干旱胁迫条件下,2种柑橘根中POD活性的变化相反,其中,三湖红橘在干旱胁迫10 d后开始显著高于对照,而三湖化红则在干旱胁迫10 d后开始显著低于对照。(图8-B)。
干旱胁迫处理导致三湖红橘叶片的CAT活性下降,并且在干旱胁迫10、20 d时显著低于对照。三湖化红叶片CAT活性在干旱胁迫处理前期无明显变化,干旱胁迫30 d时酶活性显著低于对照(图9-A)。在根中,干旱胁迫对三湖红橘CAT活性影响不明显,但导致三湖化红的 CAT活性显著升高(图9-B)。
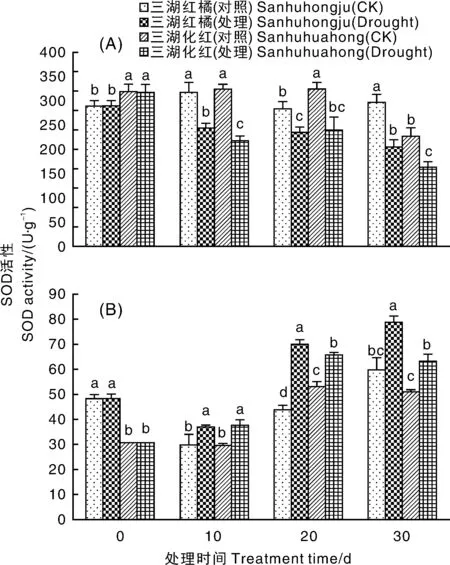
图7 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中SOD活性的变化Fig.7 Changes of SOD activities in leaves (A) and roots (B) of two citrus seedlings under drought stress
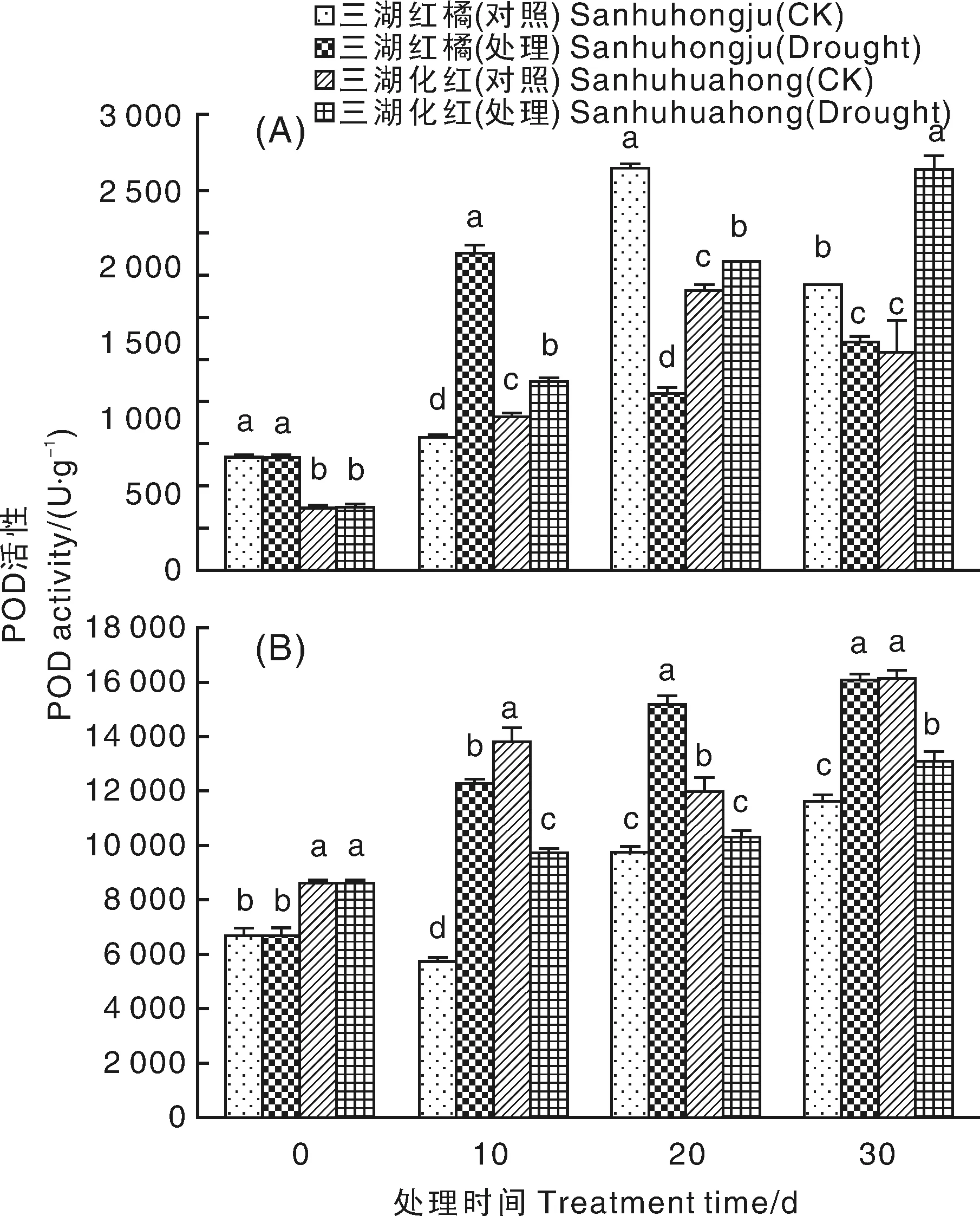
图8 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中POD活性的变化Fig.8 Changes of POD activities in leaves (A) and roots (B) of two citrus seedlings under drought stress
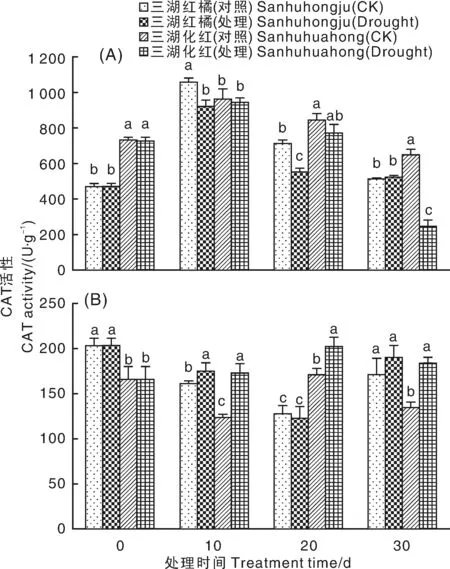
图9 干旱胁迫条件下2种柑橘幼苗叶片(A)和根(B)中CAT活性的变化Fig.9 Changes of CAT activities in leaves (A) and roots (B) of two citrus seedlings under drought stress
2.8柑橘幼苗生长指标与其他测定指标的相关分析
相关分析结果(表1)显示,柑橘幼苗的株高与主根长呈极显著正相关(0.834),根冠比与所测定其他指标均无显著相关性。植株脯氨酸含量(叶片和根系)与根系可溶性糖含量、可溶性蛋白含量均呈极显著正相关。此外,株高和主根长与POD活性呈显著正相关,两者与根SOD活性也呈显著正相关,但与叶片SOD活性呈显著负相关(表1)。进一步分析表明,渗透调节物质含量和抗氧化酶活性之间也存在相关性。例如,植株脯氨酸、可溶性蛋白和根系可溶性糖含量与根系SOD活性呈极显著或显著正相关关系,但与叶片SOD活性均呈极显著负相关关系(表1)。
3 结论与讨论
持续的干旱胁迫抑制植株的生长,干旱胁迫程度不同,植株表现也存在较大差别。抗旱性强的品种可以通过构建发达的根系,增加根的吸水面积,提高根冠比,减少叶片面积等方面来提高植株的抗旱能力[3,15]。本研究发现,2个柑橘幼苗的生长形态受干旱胁迫影响,但三湖红橘株高受抑制程度较低,表现出较强的抗旱能力。此外,干旱胁迫条件下三湖红橘主根长和根冠比均升高,这可能有利于其增加根部吸收面积,提高对根系水分的吸收能力从而适应干旱胁迫环境。相关性分析表明,主根长与株高呈极显著正相关(表1)。在一定干旱胁迫程度下,植物可以通过改变体内各内源激素的浓度和比例调控其生长发育,从而提高抗逆性[16]。因此,三湖红橘干旱胁迫后根系伸长,可能与根源化学信号调节有关,这也是影响其干旱胁迫适应性的重要因素。
在干旱胁迫条件下,植物能够通过渗透调节物质的合成来降低细胞渗透势以维持膨压,防止细胞内大量脱水,从而提高植物吸水和保水能力,增强抗旱性[5]。前人研究表明,抗旱性强的小麦品种的渗透调节能力大于抗旱性弱的品种,渗透调节物质的相对贡献率为:K+>可溶性糖>其他游离氨基酸>Ca2+>Mg2+>脯氨酸[17]。本研究表明,干旱胁迫后脯氨酸在2种幼苗叶片尤其是三湖红橘叶片中迅速积累。脯氨酸含量与植株株高和根长无明显相关性,但与根系可溶性糖和可溶性蛋白含量均呈极显著正相关(表1)。这些结果说明脯氨酸是柑橘重要的渗透调节物质,还可能对其他渗透物质的合成产生影响。抗旱性强的三湖红橘脯氨酸合成能力也强。相对而言,植株干旱胁迫后叶片可溶性糖和可溶性蛋白积累相对缓慢,甚至三湖红橘叶片中可溶性糖含量下降。其原因可能是渗透物质的合成需要消耗能量,因此,在一般逆境条件下植株中有些渗透物质的含量反而降低,从而避免能量的过度消耗[18]。同时,该结果也说明不同植物或同种植物不同时期的渗透调节能力不同,参与渗透调节的物质也存在差异[19]。此外,干旱胁迫后2种柑橘幼苗根系中3种渗透调节物质含量均增加,但是与植株株高和根长均无明显相关性。尽管如此,根中渗透物质的积累能够直接增加细胞膨压,从而提高其从外界获取水分的能力[5]。这也暗示相对叶片而言,在根系中合成渗透物质是其更为经济有效的抗旱方式。
干旱胁迫诱导植物体内的保护酶系统参与活性氧的清除,主要包括SOD、POD和CAT,其中SOD能将O2-转化成为H2O2,然后在CAT和POD等酶共同作用下消除H2O2的影响[20]。但这3种酶在干旱胁迫期间的变化和具体作用因干旱胁迫程度、生长条件和植物品种不同而有所差异。柑橘中的研究表明,温州蜜柑愈伤组织的POD和CAT酶活性在胁迫下达到最大值,并且POD酶活性的变化趋势随着胁迫程度的增加减小[21]。马文涛等[22]认为,抗旱性强的柑橘品种具有较强的抗氧化能力,其叶片SOD、POD和CAT活性较高。但是也有研究发现,柑橘植株在干旱胁迫时SOD、POD和CAT活性表现出先升后降的趋势[23-24]。本研究结果显示,干旱胁迫不同时间,2种柑橘叶片SOD和CAT活性均下降,但是2种酶在根系中的活性往往升高,表明柑橘叶片和根系具有不同的活性氧清除能力。值得注意的是,POD活性在抗旱性不同的2种柑橘中的变化趋势存在差异,尤其是在根系中。这暗示POD在耐旱性不同柑橘植株抗旱中的作用不同。相关分析也显示,与SOD和CAT相比,叶片和根系中POD活性与植株的株高和主根长都呈显著正相关(表1)。因此,与三湖化红相比,三湖红橘POD活性的升高可能有利于提高其应对干旱胁迫的能力。
综上所述,三湖红橘耐旱性强于三湖化红,这与其干旱胁迫下的形态变化和生理生化调节有关。在形态上,三湖红橘生长量较小但主根发达,干旱胁迫后根系能够有效伸长,根冠比增加,从而有助于提高对水分的吸收和利用能力。在生理生化方面,在干旱胁迫后,三湖红橘叶片和根系的脯氨酸等渗透调节物质和POD等抗氧化酶协调作用,能够在维持其细胞渗透压的同时清除体内活性氧,从而缓解干旱胁迫对植株的不利影响。
[1] XIE S X, CAO S Y, LIU Q, et al. Effect of water deficit stress on isotope15N uptake and nitrogen metabolism of Newhall orange and Yamasitaka mandarin seedling[J].JournalofLifeSciences, 2013, 7(11): 1170-1178.
[2] 樊卫国, 李庆宏, 吴素芳.长期干旱环境对柑橘生长及养分吸收和相关生理的影响[J]. 中国生态农业学报, 2012, 20(11): 1484-1493. FAN W G, LI Q H, WU S F. Effect of perennial drought environments onCitrustangerineHort. cv. Chuanju growth, nutrient absorption and physiology[J].ChineseJournalofEco-Agriculture, 2012, 20(11): 1484-1493. (in Chinese with English abstract)
[3] 黄翼. 水分胁迫下7种柑橘砧木品种的抗逆性评价[D]. 重庆: 西南大学, 2012. HUANG Y. Tolerance evaluation for seven citrus rootstock cultivars under water stress [D]. Chongqing: Southwest University, 2012. (in Chinese with English abstract)
[4] MANAVALAN L P, GUTTIKONDA S K, TRAN L S, et al. Physiological and molecular approaches to improve drought resistance in soybean[J].PlantCellPhysiology, 2009, 50(7): 1260-1276.
[5] SEKI M, UMEZAWA T, URANO K, et al. Regulatory metabolic networks in drought stress responses[J].CurrentOpinioninPlantBiology, 2007, 10(3): 296-302.
[6] WU Q S, XIA R X, ZOU Y N, et al. Osmotic solute responses of mycorrhizal citrus (Poncirustrifoliata) seedlings to drought stress[J].ActaPhysiologiaePlantarum, 2007, 29(6): 543-549
[7] 聂华堂, 陈竹生, 计玉. 水分胁迫下柑橘的生理变化与抗旱性的关系[J]. 中国农业科学, 1991, 24(4): 14-18. NIE H T, CHEN Z S, JI Y. Effects of water stress on physiology and drought resistance of citrus[J].ScientiaAgriculturalSinica, 1991, 24(4): 14-18. (in Chinese with English abstract)
[8] ARGAMASILLA R, GMEZ-CADENAS A, ARBONA V. Metabolic and regulatory responses in citrus rootstocks in response to adverse environmental conditions[J].JournalofPlantGrowthRegulation, 2014, 33(2): 169-180.
[9] JIMÉNEZ S, DRIDI J, GUTIÉRREZ D, et al. Physiological, biochemical and molecular responses in fourPrunusrootstocks submitted to drought stress[J].TreePhysiology, 2013, 33(10): 1061-1075.
[10] 白团辉, 马锋旺, 李翠英, 等. 苹果砧木幼苗对根际低氧胁迫的生理响应及耐性分析[J]. 中国农业科学, 2008, 41(12): 4140-4148. BAI T H, MA F W, LI C Y, et al. Physiological responses and analysis of tolerance of apple rootstocks to root-zone hypoxia stress[J].ScientiaAgriculturaSinica, 2008, 41(12): 4140-4148. (in Chinese with English abstract)
[11] DHINDSA A, MUTOUE W. Drought tolerance in two mosses: Correlated with enzymatic defense against lipid peroxidation[J].JournalofExperimentalBotany, 1981, 32(1): 79-91.
[12] 杨义伶. 柑橘砧木抗旱性评价及相关生理指标与基因表达差异分析[D]. 南昌: 江西农业大学, 2012. YANG Y L. Evaluation of drought tolerance for citrus rootstocks and discrepancy analysis on related physiological indexes and gene expression [D]. Nanchang: Jiangxi Agricultural University, 2012. (in Chinese with English abstract)
[13] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[14] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[15] 刘志玲, 程丹. 植物抗旱生理研究进展与育种[J]. 中国农学通报, 2011, 27(24): 249-252. LIU Z L, CHENG D. Plant drought-resistant physiology research progress and breeding[J].ChineseAgriculturalScienceBulletin, 2011, 27(24): 249-252. (in Chinese with English abstract)
[16] 李冀南, 李朴芳, 孔海燕, 等. 干旱胁迫下植物根源化学信号研究进展[J]. 生态学报, 2011, 31(9): 2610-2620. LI J N, LI P F, KONG H Y, et al. Current progress in eco-physiology of root-sourced chemical signal in plant under drought stress[J].ActaEcologicaSinica, 2011, 31(9): 2610-2620. (in Chinese with English abstract)
[17] 李德全, 郭清福, 张以勤, 等. 冬小麦抗旱生理特性的研究[J]. 作物学报, 1993, 19(2): 125-132. LI D Q, GUO Q F, ZHANG Y Q, et al. Studies on the physiological characteristics of drought resistance in winter wheat[J].TheCropJournal, 1993, 19(2): 125-132. (in Chinese with English abstract)
[18] SAHI C, SINGH A, BLUMWALD E A. Beyond osmolytes and transporters: novel plant salt-stress tolerance-related genes from transcriptional profiling data[J].PhysiologiaPlantarum, 2006, 127(1): 1-9.
[19] ZAHER-ARA T, BOROOMAND N, SADAT-HOSSEINI M. Physiological and morphological response to drought stress in seedlings of ten citrus[J].Trees, 2016, 30(3): 985-993.
[20] 梅映学, 魏玮, 张诗婉, 等. 干旱锻炼对盐胁迫下水稻幼苗根系抗氧化酶活性的影响[J]. 浙江农业学报, 2016, 28(8):1304-1308. MEI Y X, WEI W, ZHANG S W, et al. Effect of PEG pretreatment on antioxidant enzymes activity under salt stress in root of rice seedling [J].ActaAgriculturaeZhejiangensise, 2016, 28(8): 1304-1308. (in Chinese with English abstract)
[21] 蔡小东, 崔航. PEG6000模拟干旱胁迫对柑橘愈伤组织抗氧化酶活性的影响[J]. 长江大学学报(自然科学版), 2003, 10(23): 14-17. CAI X D, CUI H. Effects of PEG6000 induced drought stress on activity of antioxidant enzymes in citrus callus culture[J].JournalofYangzeUniversity(NaturalScienceEdition), 2003, 10(23): 14-17. (in Chinese with English abstract)
[22] 马文涛, 樊卫国. 贵州野生柑橘的抗旱性及其活性氧代谢对干旱胁迫的响应[J]. 果树学报, 2014, 31(3): 394-400. MA W T, FAN W G. Drought resistance and response of active oxygen metabolism of wild citrus seedlings of Guizhou under drought stress[J].JournalofFruitScience, 2014, 31(3): 394-400. (in Chinese with English abstract)
[23] 邓胜兴, 曾明, 熊伟, 等. 干旱胁迫对柑橘叶片保护酶系统的影响[J]. 西南大学学报(自然科学版), 2009, 31(2): 61-64. DENG S X, ZENG M, XIONG W, et al. Effects of drought stress on the antioxidative enzyme system in citrus eaves[J].JournalofSouthwestUniversity(NaturalScienceEdition), 2009, 31(2), 61-64. (in Chinese with English abstract)
[24] 刘晓纳, 徐媛媛, 朱世平, 等. 不同柑橘砧木的耐旱性评价[J]. 果树学报, 2016, 33(10): 1230-1240. LIU X N, XU Y Y, ZHU S P, et al. Evaluation of drought tolerance in different citrus rootstocks [J].JournalofFruitScience, 2016, 33(10): 1230-1240. (in Chinese with English abstract)
(责任编辑侯春晓)
Effectofdroughtongrowthmorphology,osmolytecontentandantioxidantenzymeactivityoftwocitrusseedlings
FENG Fangfang, WEI Qingjiang, SU Shouting, NING Shaojun, LIAO Xiaona, GU Qingqing*
(CollegeofAgronomy,JiangxiAgriculturalUniversity,Nanchang330045,China)
Pot experiments were conducted to compare the effects of drought on growth morphology, osmolyte content, and antioxidant enzyme activity of two citrus seedlings Sanhuhongju and Sanhuhuahong. Results showed that, plant heights were decreased, while root-shoot ratios were increased in both seedlings under drought. The taproot length was decreased in Sanhuhuahong while it was increased in Sanhuhongju under drought. Moreover, proline content was significantly increased in leaves and roots of the two citrus seedlings, and greater increase was found in leaves of Sanhuhongju than that of Sanhuhuahong. Except for soluble sugar in leaves of Sanhuhongju, contents of soluble sugar and soluble protein were increased in the treated seedlings. Enzyme analysis revealed that the activities of superoxide dismutase (SOD) and catalase (CAT) were decreased in leaves whereas increased in roots of both seedlings. The leaf peroxydase (POD) activity was firstly increased and then decreased in Sanhuhongju, and it was always increased in Sanhuhuahong. In roots, the POD activity was significantly increased in Sanhuhongju and was significantly decreased in Sanhuhuahong under drought. Overall, the higher drought tolerance shown by Sanhuhongju might be related to the longer taproot and higher root-top ratios, which could improve the water uptake ability of root. Additionally, the accumulation of osmolytes especially the proline and the increase of POD activities in roots might also help the Sanhuhongju to cope with drought stress.
citrus seedling; drought stress; growth morphology; osmolyte; antioxidant enzyme
S666.2
:A
:1004-1524(2017)09-1515-09
冯芳芳,魏清江,苏受婷, 等. 干旱胁迫对2种柑橘幼苗生长形态、渗透调节物质含量和抗氧化酶活性的影响[J]. 浙江农业学报, 2017, 29(9): 1515-1523.
10.3969/j.issn.1004-1524.2017.09.13
2017-03-23
国家自然科学基金项目(31460496);江西省青年科学基金项目(20161BAB214175)
冯芳芳(1989—),女,河南濮阳人,硕士研究生,从事果树逆境生物学研究。E-mail:1454140420@qq.com
*通信作者,辜青青,E-mail: qingqinggu2006@126.com

