PPAR-γ和PTEN蛋白在膀胱移行细胞癌中的表达及意义
张洲洲,浦金贤,俞弘颀,赵雪志,陈齐峰
(1.南京医科大学附属苏州市立医院北区泌尿外科,苏州 215008;2.苏州大学附属第一人民医院泌尿外科)
·论著·
PPAR-γ和PTEN蛋白在膀胱移行细胞癌中的表达及意义
张洲洲1,浦金贤2,俞弘颀1,赵雪志1,陈齐峰1
(1.南京医科大学附属苏州市立医院北区泌尿外科,苏州 215008;2.苏州大学附属第一人民医院泌尿外科)
目的测定膀胱移行细胞癌中PPAR-γ和PTEN蛋白的表达及与其病理分级、临床分期及预后相关性。方法免疫组织化学法检测PPAR-γ和PTEN于膀胱移行细胞癌标本及正常膀胱组织中的表达程度,病理分析仪测定蛋白表达程度。结果①在正常膀胱组织中PPAR-γ蛋白的表达(20%)明显低于膀胱癌(68%),而正常膀胱组织PTEN蛋白的表达(100%)明显高于膀胱癌(52%),两者阳性率差异有统计学意义(P<0.05)。② 膀胱移行细胞癌组织中PPAR-γ表达与临床分期、病理分期、淋巴结转移呈正相关性,PTEN蛋白表达呈负相关性。③ PPAR-γ蛋白和PTEN蛋白在膀胱移行细胞癌中表达呈负相关关系(r=-0.604,P<0.05)。结论PPAR-γ和PTEN可能参与了膀胱肿瘤的发生发展过程,对膀胱癌诊断、临床分期及预后有一定价值。
膀胱肿瘤;基因,肿瘤抑制;PPARγ;PTEN
近年来,临床上对于过氧化物酶体增殖物的激活受体与第10号的染色体的同源消失性的磷酸酶—张力蛋白基因的研究受到医学人员的重视和关注。PPAR-γ作为Ⅱ型核激素受体超家族成员之一,根据临床研究数据显示,在如胃肠道肿瘤,前列腺恶性肿瘤以及子宫内膜癌等疾病的发展中,存在明显的突变、缺失抑或异常的表达等,且与肿瘤恶性程度也呈现为紧密相关关系[1-3],另外,PPAR-γ和它的配体也已经被证明,可以对多种类型的肿瘤细胞进行抑制性的繁殖、分化诱导以及介导凋亡[4-8]。本实验通过免疫组织化学等方法检测在膀胱恶性肿瘤中PPAR-γ和PTEN的表达及相关性,从而为今后可能的靶向治疗提供靶点及理论依据。
1 材料与方法
1.1 标本的收集方法 纳入研究对象为2010年1月至2015年1月在苏州市立医院北区进行手术治疗的94例膀胱癌患者。60例患者行经尿道膀胱肿瘤电切(TURBT)术,34例患者行膀胱部分切除术,病理结果均为移行细胞癌。依据WHO的临床国际准则,进行病理分级,其中59例为低级别尿路上皮癌,35例为高级别尿路上皮癌,年龄33~92岁,其中男性39例,女性21例,平均(71±11)岁。按照2002年国际的抗癌协会联盟(UICC)有关TNM的临床分期进行分类,浅表型肿瘤(Ta—T1期肿瘤)的患者有61例,浸润型肿瘤(T2—T4期肿瘤)的患者有33例。对照组选取膀胱镜检查活检结果为正常膀胱组织患者20例,其中,13例男性,7例女性,年龄53~85岁,平均(65±10.5)岁。两组年龄、性别等一般资料比较,具有可比性。
1.2 试剂与仪器 使用常规SP免疫组织化学试剂,兔抗人PPAR-γ单克隆抗体、兔抗人PTEN单克隆抗体(武汉博士德生物工程有限公司),德国莱卡病理图像分析仪。
1.3 实验方法及结果判定
1.3.1 免疫组织化学检验 所有标本经过含量为10%的甲醛液固定1 d,并应用石蜡包埋。包埋的蜡块进行5 μm切片处理,切片的数量有4张,使用已知的阳性片给予阳性对照,使用PBS缓冲液给予阴性对照。使用免疫组织化学染色S-P 法对PPAR-γ以及PTEN进行检测。
1.3.2 病理结果判定 采用德国莱卡公司生产的病理分析图像仪对取得的结果进行记录和分析。采用空白对照法对阴性进行参照。阳性结果的判断为细胞浆和胞核为棕黄色抑或为黄色。采用随机数字表法选取数量5个高倍视野内(4×100),如果阳性细胞的比例占据计数细胞中的比值大于等于10%,则可以定义为阳性表达,反之则判定为阴性。使用双盲法给予结果判断,使用德国莱卡的病理分析仪对切片给予灰度测定,灰度值与免疫组织化学的染色结果成反比。使用平均灰度值对阳性的表达水平进行描述。
1.4 统计学处理 采用SPSS13.0软件处理数据,计数资料比较,采用χ2检验;使用计量资料对于组间的PPAR-γ和PTEN的表达差异性给予对比,使用Pearson相关性分析对PPAR-γ和PTEN的相关系数给予计算。P<0.05为差异有统计学意义。
2 结果
2.1 PPAR-γ及PTEN在正常膀胱组织及膀胱肿瘤组织中的表达 膀胱移行细胞癌组织中PPAR-γ蛋白阳性表达率(68%)高于正常膀胱组织(20%),P<0.001,见表1。膀胱肿瘤组织中PTEN蛋白的阳性表达率(52.1%)低于正常膀胱组织(100%),两者组织中PPAR-γ蛋白和PTEN蛋白表达的平均灰度值的差异有统计学意义(P<0.001)。见表2。表浅型膀胱移行细胞癌PPAR-γ蛋白表达灰度值高于浸润型膀胱移行细胞癌(P<0.001);低级别膀胱移行细胞癌中PPAR-γ蛋白表达灰度值高于高级别肿瘤(P=0.002);无淋巴结转移的膀胱移行细胞癌PPAR-γ蛋白表达量灰度值高于有淋巴结转移的肿瘤(P<0.001)。膀胱移行细胞癌中PPAR-γ蛋白表达灰度值与肿瘤是否浸润肌层、病理分期及是否存在淋巴结转移呈明显的负相关关系。而肿瘤的PPAR-γ蛋白表达在性别、年龄(>65岁组和≤65岁)、肿瘤大小(直径≤3 cm组和>3 cm组)各组中差异无统计学意义。
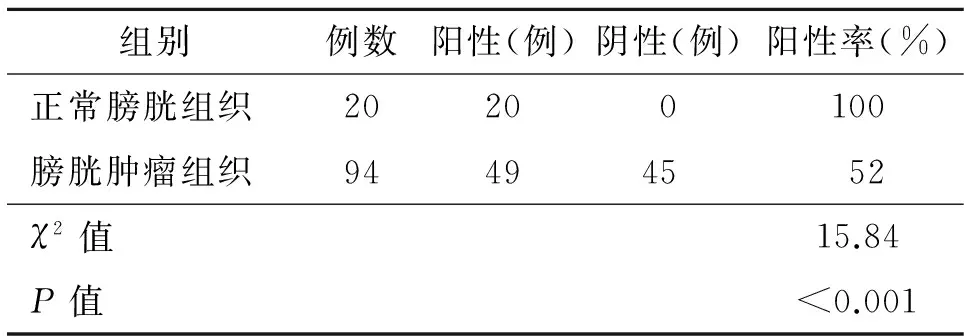
表2 在正常膀胱组织及膀胱移行细胞癌中PTEN阳性率
而在浸润型、高级别、有淋巴结转移的膀胱移行细胞癌PTEN蛋白表达灰度值均高于表浅型、低级别、无淋巴结转移膀胱肿瘤组织,两者差异有统计学意义(P<0.001)。PTEN蛋白在膀胱移行细胞癌表达灰度值与肿瘤是否浸润肌层、病理分期及淋巴结转移呈正相关关系。见表3。
2.2 Peason相关性分析 PPAR-γ及PTEN在膀胱移行癌组织中表达,显示PPAR-γ及PTEN呈明显负相关(r=-0.604,P<0.05),见图1。
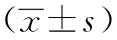
表3 PPAR-γ及PTEN在膀胱肿瘤组织中
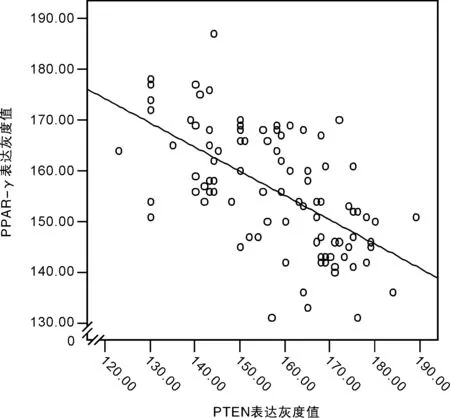
图1 PPAR-γ及PTEN在膀胱癌组织中表达的相关性
3 讨论
PPARs对细胞增殖控制和分化的过程中起着十分关键的效果[9-10]。经过国内外的临床数据证实,在细胞分化、胰岛素敏感度发展、2型糖尿病发展以及动脉粥样硬化和肿瘤生物学过程中,PPAR-γ皆有所参与[11]。当前对PPAR-γ和肿瘤之间的关系已经受到医学专家的广泛关注,由于PPAR-γ可对患者体内的新陈代谢情况以及炎性反应给予适宜的调控,当PPAR-γ被TZDs所激活之后,其可对患者体内的相关细胞分化、细胞增殖以及细胞凋亡等给予适宜的调控[12]。
PTEN的总称为人第10号染色体缺失的磷酸酶,为我国目前临床上发现的第一个有磷酸酶活性的抑制癌症因子的基因。在人类所患有的多种肿瘤类别中,PTEN的缺失和突变频率呈现上升趋势,这可能是一种新型的信号传导途径,和人类所患癌症有着紧密的关联。这一系列的复合物质已经被证实为对肿瘤的生长有促进效果。PTEN抑癌机制主要为:①对细胞周期抑制从而对生长流程进行调节控制。PTEN具磷酸酶的活性,促使PIP3表现为脱磷酸化的情况,进而对PI3K/AKT信号的传导途径给予一定程度抑制,降低细胞内的AKT磷酸化水平,并有效降低细胞的周期蛋白D1,加强细胞对凋亡的敏感性;②对肿瘤血管的生成进行抑制[13]。在PI3K/AKT信号传导通路中,PTEN具有调节作用,进而对VEGF/VEGF受体的信号途径产生影响,对MMPs进行下调,并调节VEGF的分泌,对肿瘤的血管生成进行调控,以此抑制肿瘤的浸润和转移。③恶性肿瘤中由于PTEN出现缺失和突变,对细胞生长的调节控制作用减弱,造成肿瘤生长[14]。临床研究显示,在胃肠道肿瘤、肾上腺癌、前列腺肿瘤以及子宫内膜癌等疾病中,PTEN均有异常表达,且与肿瘤恶性程度有一定相关性[15]。
本次研究结果显示,膀胱移行上皮肿瘤PPAR-γ以及PTEN的表达为负相关趋势,r=0.604,P<0.05,这一结果说明,PPAR-γ和PTEN在膀胱肿瘤的发展中存在一定的相关关系。相关研究表明,当对PPAR-γ进行激活后,其抑制癌症的基因(PTEN)以及c-myc和P27等,上调下游目的基因表达,起到抑制肿瘤转移和生物学浸润作用[16]。临床数据证实,当激活PPAR-γ后,其PTEN的表达上调,从而对PIP3激活PPI3K/AKT信号传导途径进行抑制。促进细胞凋亡,对细胞周期阻碍,并阻隔细胞周期停滞于G1期阶段,在抑制肿瘤生长、浸润和转移等方面也发挥十分重要的作用[17]。PPAR-γ和PTEN皆属于抑制癌症的基因,但是在膀胱癌中,PTEN的表达呈现为显著下降的趋势,而PPAR-γ持续上升,这一原因主要是由于:仅在发生PPAR-γ的磷酸化或与其他蛋白相互结合时,PPAR-γ异常表达才有可能具备一定的生物活性,进而可能为PPAR-γ的激动剂提供一定的治疗靶点。
一旦PTEN因子物质出现了缺损、突发性病变或者活性减弱时,则随之PTEN/PI3K/AKT细胞信号的传导通路也会受到影响,出现紊乱的情况。当PI3K或者是PKB等致癌物质不断发展过程中,PTEN对这些致癌物质的抑制效果不断减弱,导致这些致癌物质出现了活化异常上升的情况。而当致癌物质反应时,导致PPAR-γ的表达出现异常提高。导致这一因素出现的主要原因和激活剂产生抗肿瘤所提供靶点有所关联。同时在膀胱癌疾病的不断进展中,虽然PPAR-γ蛋白表达逐渐升高,然而PPAR-γ内在活性并未升高,可能一定程度出现下降。从而不能通过信号传导通路调控PTEN,故PTEN并未因此激活而表达水平有所下降,所以膀胱肿瘤患者体内的PPAR-γ为上升,PTEN为降低。
综上所述,PPAR-γ和PTEN可能参与了膀胱肿瘤的发生发展过程。通过PPAR-γ对PTEN/PI3K/AKT通路介导,以此对PTEN的表达产生影响,这为今后临床靶向治疗提供新的思路。
[1] SMALLRIDGE RC,COPLAND JA,BROSE MS,et al.Efatutazone,an oral PPAR-γ agonist,in combination with paclitaxel in anaplastic thyroid cancer:results of a multicenter phase 1 trial[J].J Clin Endocrinol Metab,2013,98(6):2392-2400.
[2] MATSUDA S,KITAGISHI Y.Peroxisome proliferator-activated receptor and vitamin d receptor signaling pathways in cancer cells[J].Cancers (Basel),2013,5(4):1261-1270.
[3] KAKEHASHI A,HAGIWARA A,IMAI N,et al.Mode of action of ethyl tertiary-butyl ether hepatotumorigenicity in the rat:evidence for a role of oxidative stress via activation of CAR,PXR and PPAR signaling pathways[J].Toxicol Appl Pharmacol,2013,273(2):390-400.
[4] MANDARD S,PATSOURIS D.Nuclear control of the inflammatory response in mammals by peroxisome proliferator-activated receptors[J].PPAR Res,2013(36):613864.
[5] SAWAYAMA H,ISHIMOTO T,WATANABE M,et al.Small molecule agonists of PPAR-γ exert therapeutic effects in esophageal cancer[J].Cancer Res,2010,74(2):575-585.
[6] NAGUIB A,COOKE JC,HAPPERFIELD L,et al.Alterations in PTEN and PIK3CA in colorectal cancers in the EPIC Norfolk study:associations with clinicopathological and dietary factors[J].BMC Cancer,2011,11(1):1-11.
[7] WANG X,SUN Y,WONG J,et al.PPARγ maintains ERBB2-positive breast cancer stem cells[J].Oncogene,2013,32(49):5512-5521.
[8] PARK JH,HAN SW,OH DY,et al.Analysis of KRAS,BRAF,PTEN,IGF1R,EGFR intron 1 CA status in both primary tumors and paired metastases in determining benefit from cetuximab therapy in colon cancer[J].Cancer Chemoth Pharm,2011,68(4):1045-1055.
[9] LUBET RA,FISCHER SM,STEELE VE,et al.Rosiglitazone,a PPAR gamma agonist:potentpromoter of hydroxybutyl(butyl) nitrosamine-induced urinary bladder cancers[J].Int J Cancer,2008,123(10):2254-2259.
[10] BABJUK M,OOSTERLINCK W,SYLVESTER R,et al.EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder,the 2011 update[J].Eur Urol,2011,59(6):997-1008.
[11] YU J,SHEN B,CHU ES,et al.Inhibitory role of peroxisome proliferator-activated receptor gamma in hepatocarcinogenesis in mice and in vitro[J].Hepatology,2010,51(6):2008-2019.
[12] TAN X,DAGHER H,HUTTON CA,et a1.Effects of PPAR gamma ligands on TGF-beta1-induced epithelial-mesenchymal transition in alveolar epithelial cells[J].Respir Res,2010,11(1):21.
[13] PRINGLE DR,VASKO VV,MANCHANDA PK,et al.Follicular thyroid cancers demonstrate dual activation of PKA and mTOR as modeled by thyroid specific deletion of Prkar1a and Pten in mice[J].J Clin Endocrinol Metab,2012,99(5):E804-E812.
[14] SUN C,ZHAO J,JIN Y,et al.PTEN regulation of the proliferation and differentiation of auditory progenitors through the PTEN/PI3K/Akt-signaling pathway in mice[J].Neuroreport,2011,25(3):177-183.
[15] DILLON LM,MILLER TW.Therapeutic targeting of cancers with loss of PTEN function[J].Curr Drug Targets,2012,15(1):65-79.
[16] 张萌,彭利,乔治斌,等.罗格列酮通过PI3K/PTEN/Akt通路抑制人肝癌HepG2细胞增殖[J].细胞与分子免疫学杂志,2014,30(2):147-150.
[17] LANGLE Y,LODILLINSKY C,BELGOROSKY D,et al.Role of peroxisome proliferator activated receptor-gamma in bacillus Calmette-Guérin bladder cancer therapy[J].J Urol,2012,188(6):2384-2390.
TheexpressionandsignificanceofPPAR-γandPTENinbladdertransitionalcellcarcinoma
Zhangzhouzhou*,PuJinxian,YuHongqi,ZhaoXuezhi,ChenQifeng
(*DepartmentofUrinarySurgery,theAffiliatedSuzhouHospitalofNanjingMedicalUniversity,Suzhou215008,China)
ObjectiveTo exolore the expression of ppar-gamma and PTEN in cell carcinoma of the bladder and the its correlation with pathologic grade,clinical stage and prognosis.MethodsThe expression of ppar-gamma and PTEN in bladder transitional cell carcinoma specimens and normal bladder tissues was detected by immunohistochemistry,and the expression level of protein was detected by pathological analyzer.Results① The expression of PPAR- gamma protein(20%) in normal bladder tissues was significantly lower than that of bladder cancer(68%),while the expression of PTEN protein in normal bladder tissues (100%)was significantly higher than that in bladder cancer(52%).The positive rate of the two markers had significant difference (P<0.01)。② The expression of PPAR- gamma was positively correlated with clinical stage,pathological stage and lymph node metastasis in bladder transitional cell carcinoma,and negatively correlated with PTEN protein expression.③There was a negative correlation between PPAR- gamma protein and PTEN protein in bladder transitional cell carcinoma (r=-0.604,P<0.05).ConclusionPpar-gamma and PTEN may be involved the occurrence and development of bladder cancer and maybe has some value in clinical diagnosis,staging and prognosis judgment of bladder cancer.
Urinary bladder neoplasms; Genes,tumor suppressor;PPAR gamma;PTEN
R737.14
A
10.3969/J.issn.1672-6790.2017.05.020
2017-06-10)
江苏省苏州市“科教兴卫”青年科技项目(KJXW2014023)
张洲洲,主治医师,Email:5747096@qq.com

