葛根配方颗粒对小鼠前列腺增生的影响
黄 霆 王安喜 朱晓雨 程义东 徐玉峰
(南京中医药大学第三附属医院泌尿外科,南京,210001)
葛根配方颗粒对小鼠前列腺增生的影响
黄 霆 王安喜 朱晓雨 程义东 徐玉峰
(南京中医药大学第三附属医院泌尿外科,南京,210001)
目的:探讨葛根配方颗粒抑制小鼠前列腺增生的作用机制。方法:将60只4周龄的雄性昆明种小鼠随机分为6组:葛根颗粒10,20,30 mg/kg组、对照组(保列治组)1 mg/kg、造模组及正常组。将除正常组外的小鼠手术去势7 d后,给予丙酸睾酮5 mg(/kg·d)皮下注射,同时分别给予不同剂量的葛根配方颗粒、保列治灌胃3周。后摘取各组小鼠前列腺,称重并计算前列腺指数(PI),免疫组化检测前列腺组织FGF2,Ki67,TGF-β1蛋白的表达,免疫酶联吸附试验(ELISA)检测5-还原酶活性,TUNEL试剂盒检测细胞凋亡情况。结果:与造模组比较,各给药组小鼠前列腺质量、PI均显著减小(P<0.05),FGF2,Ki67,TGF-β1抗原表达、5-还原酶活性均显著降低(P<0.05),细胞凋亡指数显著增高(P<0.05);而各项指标在葛根20,30 mg/kg组与对照组比较差异无统计学意义(P>0.05)。结论:葛根配方颗粒对小鼠前列腺增生有明显抑制作用,其可能的机制是抑制FGF2,Ki67,TGF-β1抗原表达,降低5-还原酶活性,增加细胞凋亡,从而机制鼠前列腺增生。
葛根配方颗粒;前列腺增生;昆明种小鼠;保列治
良性前列腺增生症(Benign Prostatic Hypertrophy,BPH)是常见的中老年男性进行性疾病[1]。随着社会的老年化,BPH的患病率明显增高[2]。但就良性前列腺增生的病因而言,国内外学者尚未明确。公认的两大因素是年龄的增大以及雄激素失衡。目前主要的治疗手段包括手术治疗和药物治疗。手术主要包括传统的开放手术和微创手术。微创手术中的经尿道前列腺电切术(TURP)、经尿道前列腺等离子双极电切术(TUPK)已经成为国内外泌尿外科医师治疗前列腺增生术式的金标准。药物治疗则主要有-肾上腺受体阻滞剂,5-还原酶抑制剂、抑制胆固醇类药、花粉制剂等。但这些药物长期使用存在一定的不良反应,寻找一种有效无毒、药食两用的中药防治BPH意义重大。本研究以去势小鼠加丙酸睾酮皮下注射诱发小鼠BPH模型,观察葛根颗粒对BPH小鼠前列腺湿重、指数、5-还原酶活性、FGF2,Ki67,TGF-β1蛋白及前列腺细胞TUNEL凋亡指数的影响。
1材料与方法
1.1 材料
1.1.1 实验动物 4周龄昆明种雄性小鼠,体重(22±2)g,SPF级,购自上海杰思捷实验动物有限公司,实验动物许可证号SCXK(沪)2014-0006。
1.1.2 药物 葛根配方颗粒(江阴天江药业有限公司生产,批号1602103,1512046),每袋装1 g相当于饮片10 g,充分溶解至20 mL沸水中,待冷却后制成溶剂;保列治(杭州默沙东制药有限公司生产,批号L003889),在研钵内充分研磨后溶解至10 mL蒸馏水中制成溶剂;丙酸睾酮注射剂(上海通用药业股份有限公司,批号131218);科研用分析纯水合氯醛(上海展云化工有限公司生产,批号20151102),调配成10%的水合氯醛注射液。
1.1.3 试剂与仪器 Anti-TGF beta1抗体(批号601338204)、Anti-BFGF抗体(批号603933001)、Anti-Ki67抗体(批号603605803),均购自美国ABCAM公司。二抗,兔kit(批号603447703)、NovoLinkTM polymer dilution(批号6005303),均购自珠海泉晖公司。5α-还原酶活性ELISA试剂盒:购自Angle Gene ELISA检测试剂盒。TUNEL染色试剂盒(50T):In situ cell death detection kit,POD 11684817910(罗氏Roche公司生产)。
低温高速离心机(Centrifuge 581 OR):德国Eppendorf公司;可调式微量移液器:德国Eppendorf公司;高压消毒锅:上海申安医疗器械厂;超净工作台:上海博讯实业有限公司;酶标仪:赛默飞世尔科技(中国)有限公司;烧杯,电子天平,研钵,灌胃针,无酶EP管。
1.2 方法
1.2.1 分组与模型制备 依据参考文献[3-5]进行动物模型制备,将小鼠随机分为葛根10,20,30 mg/kg组、对照组(保列治组)、造模组及正常组。对照组及葛根组给药剂量按照文献折算成小鼠用量。除正常组外,其余各组肌内注射丙酸睾丸酮5.0 mg/(kg·d)。
1.2.2 给药方法 葛根颗粒低、中、高剂量组分别给予10 mg/kg,20 mg/kg,30 mg/kg灌胃,保列治对照组给予1 mg/kg灌胃,连续21 d,每周复测体重调整灌胃剂量。
1.2.3 检测指标与方法 最后1次给药24 h后将各组动物称重后处死,取前列腺称湿重。
前列腺指数测定:将取材后的前列腺标本予电子天平称重,计算前列腺湿重指数PI=前列腺湿重/小鼠体重。
根据ELISA试剂盒说明书检测5α-还原酶活性。1)样品制备:将组织加入适量生理盐水进行匀浆液,1 000×g离心10 min,取上清液备用。2)标准品的稀释:准备5只标号的小试管分别加入标准品稀释液100 μL,然后取原浓度标准品150 μL加入一支已编好号的试管中,充分混匀;再在该试管中取200 μL加入第2支试管中,充分混匀;后依次取出100 μL加入到下一支试管中并充分混匀。在酶标包被板上设标准品孔,依次加入稀释后的标准品50 μL。3)加样:在酶标包被板上待测样品孔中先加样品40 μL,然后再加生物素标记的抗体10 μL。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。4)温育:用封板膜封板后置37 ℃恒温箱中温育30 min。5)配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。6)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次后拍干。7)加酶:每孔加入酶标试剂50 μL。8)温育:操作同4。9)洗涤:操作同6。10)显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min。11)终止:每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。12)测定:用酶标仪在450 nm波长状态下测量各孔的吸光度(A值)。
通过TUNEL染色试剂盒说明书观察细胞凋亡情况。1)切片常规脱蜡入水。2)将一烧杯盛200 mL的0.01 mol/L、pH6.0的柠檬酸缓冲液,加热至90~95 ℃,迅速放入切片,使用680 W(80%功率)、微波照射1 min,加入双蒸水(20~25 ℃)80 mL作迅速冷却,将玻片移至PBS(20~25 ℃)。3)PBS洗5 min×3次。4)加20%正常牛血清室温30 min。5)将TUNEL反应混合液加在切片上,37 ℃温育90 min。6)PBS洗5 min×3次。7)3%H2O2甲醇液室温阻断10 min。8)37 ℃温育90 min。9)加POD转化剂,37 ℃温育30 min。10)PBS洗5 min×3次。11)DAB/H2O2显色。12)苏木素淡染,常规脱水,透明,中性树胶封固。细胞核呈棕色颗粒者为阳性细胞,结合形态特征,可确立凋亡细胞。阴性对照片无棕色颗粒。将部分前列腺标本行常规苏木精-伊红(HE)染色,在光镜下观察小鼠前列腺腺体增生情况。每例标本均进行HE染色,光镜下观察细胞形态变化。HE染色步骤:10%甲醛溶液固定、石蜡包埋、4 μm连续切片,HE染色,光镜下观察前列腺结构,照相。
按照购自ABCAM公司的抗体的说明书,并分别做出TGF,Ki67,BFGF免疫组化切片。采用免疫组化超敏二步法法。取上述标本4 μm厚连续切片,经二甲苯脱蜡、梯度乙醇脱水后行免疫组化染色。切片脱蜡至水,PBS洗3次×5 min;柠檬酸抗原修复10 min,自然冷却;PBS浸泡5 min,3次;3% H2O2封闭内源性过氧化物酶,室温20 min;PBS浸泡5 min,3次;滴加山羊血清50 μL/片,室温内源性生物素封闭20 min;甩除勿洗,滴加一抗(Ki-67,bFGF,TGF-β1,1∶100)50 μL/片,4 ℃过夜;PBS浸泡5 min,3次;滴加二抗50 μL/片,37 ℃ 30 min;PBS浸泡5 min,3次;滴加辣根过氧化物酶标记卵霉链白素50 μL/片,37 ℃30 min;PBS浸泡5 min,3次;抗原修复采用高温高压修复法,蒸汽冒出持续2 min后自然冷却,其后按试剂盒说明书进行DAB显色、苏木精复染、中性树脂封片、显微镜下观察。TGF-β1阳性表达位于前列腺间质细胞的平滑肌细胞质、上皮细胞质内,呈淡黄色至棕褐色颗粒;FGF2阳性表达位于前列腺间质及上皮细胞质内,呈棕黄色颗粒;Ki-67阳性表达位于前列腺细胞核,呈棕色颗粒。
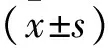
2结果
2.1 葛根配方颗粒对小鼠前列腺湿重、指数的影响 造模组与正常组小鼠比较,前列腺湿重及PI均显著增加,差异有统计学意义(P<0.05);葛根组20,30 mg/kg及对照组与造模组比较,小鼠前列腺湿重、PI显著降低,差异有统计学意义(P<0.05);葛根组10 mg/kg与造模组比较、葛根组30 mg/kg与葛根组20 mg/kg比较、对照组与葛根组20 mg/kg比较各指标间差异无统计学意义(P>0.05)。见表1。

表1 葛根配方颗粒对小鼠前列腺湿重、 指数的影响
注:与正常组比较,*P<0.05;与造模组比较,△P<0.05
2.2 葛根配方颗粒对小鼠前列腺组织FGF2,Ki67,TGF-β1蛋白表达的影响 对各组(除正常组)小鼠前列腺组织免疫组化检测发现,造模组FGF2,Ki67,TGF-β1蛋白阳性率明显高于其他各组,差异有统计学意义(P<0.05);对照组、葛根组20,30 mg/kg的FGF2,Ki67,TGF-β1蛋白阳性率显著低于葛根组10 mg/kg,差异有统计学意义(P<0.05);对照组、葛根组30 mg/kg的FGF2,Ki67,TGF-β1蛋白阳性率与葛根组20 mg/kg差异无统计学意义(P>0.05)。见表2。

表2 葛根配方颗粒对小鼠前列腺组织FGF2,Ki67, TGF-β1蛋白表达的影响
注:与造模组比较,*P<0.05;与葛根组(10 mg/kg)比较,△P<0.05
2.3 葛根配方颗粒对小鼠前列腺组织5α-还原酶活性及细胞凋亡的影响 造模组小鼠前列腺组织5α-还原酶活性明显高于正常组,而细胞凋亡指数明显低于正常组,差异有统计学意义(P<0.05);对照组、葛根组20、30 mg/K小鼠前列腺组织5α-还原酶活性明显低于造模组,而细胞凋亡指数明显高于造模组,差异有统计学意义(P<0.05);对照组、葛根组30 mg/K与葛根组20 mg/K比较,5α-还原酶活性及细胞凋亡指数差异无统计学意义(P>0.05)。见表3。6组TUNEL染色结果见图1。

表3 葛根配方颗粒对小鼠前列腺组织5α-还原酶活性及细胞凋亡的影响
注:与正常组比较,*P<0.05;与造模组比较,△P<0.05;与对照组比较,▲P<0.05

图1 6组小鼠前列腺TUNEL染色结果
3讨论
前列腺增生在老年男性属常见病、多发病,据报道,我国BPH发病率为7.9% ~28%[6]。本病因可导致下尿路梗阻、尿潴留、尿路感染甚至损伤肾功能[7]而越来越受到关注。到目前为止,良性前列腺增生症的病因及发病机制尚未明确,国内外学者通过大量研究提出多种学说:上皮-间质细胞相互作用学说、细胞凋亡学说、内分泌激素作用学说、生长因子学说等[8]。葛根又名“亚洲人参”,其药用价值极高。葛根甘、平,多食可行小便,具有活血通络、升阳活血、活血助补的功效[9]。有研究表明,葛根异黄酮可明显降低大鼠前列腺湿重、体积及PI,可缓解大鼠前列腺增生的症状,形态学上表现为上皮变薄,腺腔内分泌物减少,间质减少等[10]。大豆苷元是一种植物雌激素,其结构与雌二醇相似。曾靖[11]等研究表明:3′-大豆苷元磺酸钠对丙酸睾丸酮所致小鼠前列腺增生具有拮抗作用;其机制可能与降低小鼠血清T,E2,T/E2及其抑制雌激素受体的表达有关。本研究通过研究葛根配方颗粒对BPH小鼠前列腺湿重、指数、5-还原酶活性,FGF2,Ki67,TGF-β1蛋白及前列腺细胞凋亡指数的影响,从而初步探讨葛根配方颗粒抑制小鼠前列腺增生的作用机理。
碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,bFGF)在正常前列腺组织中少量表达,但在BPH中表达却明显升高[12]。Ki-67能客观地反映细胞的增殖程度,因此,Ki-67高表达是细胞增殖过度的重要标志[13]。Royuela等[14]指出,在正常情况下,TGF-β1只在前列腺基底上皮细胞及结缔组织基质中表达,而在BPH组织中既表达于基底上皮细胞,也表达于分泌柱状上皮细胞。Luo[15]等研究也发现,TGF-β1在BPH组织中表达增高。医学界大多数学者认为DHT是导致BPH的直接原因[16-17]。而5α-还原酶的作用之一是将睾酮(T)转变为双氢睾酮(Dihydrotestosterone,DHT),因此5α-还原酶亦可作为BPH的间接致病因素。
目前,保列治(非那雄胺)在治疗BPH方面有着显著的临床疗效[16-17],本研究将保列治治疗小鼠BPH作为对照组,观察葛根颗粒治疗小鼠BPH的疗效情况。根据结果提示,保列治1 mg/kg、葛根20、30 mg/kg处理小鼠后,其前列腺湿重、指数、FGF2,Ki67,TGF-β1阳性率、5α-还原酶活性明显下降,细胞凋亡指数明显升高,可见葛根配方颗粒对小鼠BPH有抑制作用。而葛根20、30 mg/kg与保列治1 mg/kg在处理小鼠BPH后各参数无明显差异,说明一定量的葛根颗粒可达到与保列治相近的疗效。本研究不足之处是,1)小鼠模型数量较少;2)未能明确起效的具体葛根药量。这些需要在后续的研究中进一步改进。
本研究通过检测BPH小鼠前列腺FGF2,Ki67,TGF-β1阳性率、5α-还原酶活性,细胞凋亡指数,发现经葛根颗粒处理后,5α-还原酶活性,FGF2,Ki67,TGF-β1表达下降,细胞凋亡指数增高。有研究证明,DHT可增加FGF2生成,从而促进前列腺间质增生[18],而DHT主要由5α-还原酶促进生成。因此我们推断,葛根颗粒可通过降低5α-还原酶活性,从而下调FGF2,Ki67,TGF-β1等蛋白表达,进而增加细胞凋亡。
综上所述,葛根配方颗粒可降低BPH小鼠前列腺5-还原酶活性,抑制FGF2,Ki67,TGF-β1等蛋白表达,增加细胞凋亡,从而阻遏小鼠前列腺增生。
[1]Morán E,Budía A,Broseta E,et al.Phytotherapy in urology.Current scientific evidence of its application in benign prostatic hyperplasia and prostate adenocarcinoma[J].Actas Urol Esp,2013,37(2):114-119.
[2]谢子平,谭艳,谢胜,等.依立雄胺治疗前列腺增生临床疗效的Meta分析[J].中国性科学,2015,24(12):35-43.
[3]徐叔云,卞濂如,陈修.药理实验方法学[M].2版.北京:人民卫生出版社,2005:1553.
[4]钱华,高智慧,王衍彬,等.大荨麻根提取物对前列腺增生小鼠的治疗作用[J].中国药学杂志,2008,43(2):108-110.
[5]苗明三,张玉林,纪晓宁,等.水蔓菁总黄酮对前列腺增生小鼠模型的影响[J].中药药理与临床,2009,25(2):63-64.
[6]张祥华,张骞,李学松,等.良性前列腺增生合并组织学前列腺炎的检出率——两种不同诊断标准的比较研究[J].中华临床医师杂志:连续型电子期刊,2007,1(7):29-31.
[7]Lee KL,Peehl DM.Molecular and cellular pathogenesis of benign prostatic hyperplasia[J].J Urol,2004,172(5 Pt 1):1784-1791.
[8]綦海燕.前列腺疾病基础研究与诊疗新进展[M].北京:人民卫生出版社,2009.
[9]唐迎雪.论葛根活血之功用[J].中国中药杂志,2002,27(4):310-311.
[10]程斯倩,赵丽晶,于馨洋,等.葛根异黄酮对大鼠前列腺增生的影响[J].吉林医药学院学报,2014,35(1):17-20.
[11]曾靖,胡蓉,江丽霞,等.3′-大豆苷元磺酸钠对性激素及前列腺组织中雌激素受体的表达的影响[J].中国实验方剂学杂志,2013,19(10):170-173.
[12]Ittman M,Mansukhani A.Expression of fibroblast growth factors(FGFs)and FGF receptors in human prostate[J].J Urol,1997,157(1):351-356.
[13]林海利,郑周达,陈森期,等.ki67、p504s、p63联合检测在前列腺癌中的临床意义研究[J].医学综述,2008,14(11):封2,封3.
[14]Royuela M,De Miguel MP,Bethencourt FR,et al.Transforming growth factor beta 1 and its receptor types I and II.Comparison in human normal prostate,benign prostatic hyperplasia,and prostatic carcinoma[J].Growth Factors,1998,16(2):101-110.
[15]Luo J,Dunn T,Ewing C,et al.Gene expression signature of benign prostatic hyperplasia revealed by cDNA microarray analysis[J].Prostate,2002,51(3):189-200.
[16]吴晓阳,徐俊芳.保列治(非那雄胺)对良性前列腺增生(BPH)患者体内双氢睾酮(DHT)的影响[J].世界最新医学信息文摘:连续型电子期刊,2016,16(6):57-58.
[17]柳建军,曹军,许志坚,等.非那雄胺对前列腺增生症术中及术后出血的治疗作用[J].中华泌尿外科杂志,2001,22(8):490-492.
[18]孙自学,陈建设,王德军,等.前列安对良性前列腺增生症大鼠模型前列腺组织碱性成纤维生长因子的影响[J].中国实验方剂学杂志,2010,16(15):101-104.
(2016-10-10收稿 责任编辑:杨觉雄)
GegenpeifangGranulesinBenignProstaticHyperplasiaofMice
Huang Ting,Wang Anxi,Zhu Xiaoyu,Cheng Yidong,Xu Yufeng
(TheThirdAffiliatedHospitalofNanjingUniversityofTraditionalChineseMedicine,Nanjing210001,China)
Objective:To explore the mechanism of Gegenpeifang Granules in benign prostatic hyperplasia of mice.Methods:Sixty male mice from Kunming,all four weeks of age,were randomly divided into 6 groups,including Gegenpeifang Granules 10,20,30 mg/Kg groups,a control group (finasteride) 1 mg/Kg,a model group and a normal group.Except a normal group,mice of other groups were given testosterone propionate 5 mg / kg / d by subcutaneous injection at 7 days after surgical castration.Different dose of Gegenpeifang Granules and finasteride were given by gavage for 3 three weeks.After that,mice were broken neck to death and their prostates were weighed and prostate index (PI) was calculated,detecting the expression of FGF2,Ki67,TGF-β1by immunohisochemical method and 5a-reductase activity by ELISA,the apoptosis index by TUNEL kit.Results:Comparing with the model group,other groups had a signify-cantly reduce of prostatic volume,prostatic index,FGF2,Ki67,TGF-β1,5 a-reductase(P<0.05),while had a higher apoptosis index(P<0.05).There had no statistical difference between kudzu root20、30 mg/Kg groups and finasteride group(P>0.05).Conclusion:The Gegenpeifang Granules may shrink prostatic volume of mice by reducing the activity of 5a-reductase,inhibiting the expression of FGF2,Ki67,TGF-β1,promoting cell apoptosis,and thus straining prostatic volume of mice.
Gegenpeifang granules;Prostatic hyperplasia;Kunming mice;Finasteride
R242;R229
:Adoi:10.3969/j.issn.1673-7202.2017.09.042
南京市医学科技发展重点项目课题(ZKX14047)
黄霆(1977.01—),男,硕士学位,副主任医师,主要从事中西医结合泌尿外科研究,E-mail:tingyan128@sina.com
王安喜(1965.01—),男,博士学位,主任医师,主要从事中西医结合泌尿外科研究,E-mail:Szdrwang@126.com

